
Les époxydes (contraction de épi-, à côté, et de oxyde pour les produits d'oxydation par l'oxygène) sont des substances chimiques comportant un oxygène ponté sur une liaison carbone-carbone unique. On parle également d'oxacycloalcanes (nomenclature systématique) plus souvent abrégé en oxiranes. L'époxyde le plus simple est l'oxyde d'éthylène qui est le noyau de base de tous les autres époxydes.
Production
Dans la nature
Dans la nature, une petite quantité d'époxyde est produite dans l'atmosphère à partir de l'isoprène qui est un hydrocarbure gazeux principalement produit par les végétaux en réponse notamment à certains stress (UV solaires qui ont augmenté avec le trou de la couche d'ozone et lors des pics de chaleur ou sécheresses qui augmentent aussi avec le dérèglement climatique). La production d'époxyde s'est avérée plus importante qu'attendu avant les travaux qui ont quantifié cette production, publiés en 2009[1]. Les modèles[2] prévoient que la production d'isoprène par les végétaux pourrait doubler durant le XXIe siècle [3], il est donc possible que la production « naturelle » d'époxyde dans l'air puisse aussi encore augmenter durant le XXIe siècle.
Production anthropique
Les voies de synthèse industrielle les plus courantes passent par l'oxydation des alcènes.
La première solution consiste à utiliser le dioxygène de l'air comme oxydant, et à le faire réagir avec l'alcène sur un catalyseur : l'argent. C'est la méthode utilisée pour la production industrielle.
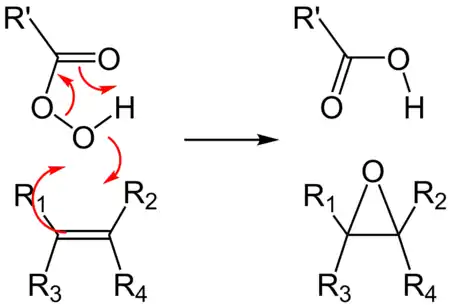
La seconde voie de synthèse utilise les acides peroxycarboxyliques — ou peracides, de la forme R-(C=O)-O-OH, que l'on fait réagir directement sur l'alcène pour obtenir l'époxyde, ainsi que l'acide carboxylique correspondant au peracide de départ. En général, on utilise l'acide métachloroperbenzoïque (m-CPBA). Un autre réactif de choix pour les époxydations est le diméthyldioxirane (DMDO).
On peut enfin utiliser une voie plus détournée qui utilise des composés, tels l'acide hypobromeux, pour effectuer une dissubstitution de l'alcène, puis une substitution nucléophile interne, après passage en milieu basique : l'oxygène attaque le carbone adjacent et éjecte le brome.
La production annuelle mondiale de résines époxyde avoisine 830 000 tonnes.
Polymères à base d'époxyde
Appelés polyépoxydes, polymères époxyde (ou époxydes et même « époxy » par abus de langage), ils sont fabriqués par polymérisation de monomères époxyde avec un agent de réticulation appelé durcisseur, qui peut être un anhydride d'acide, un phénol ou le plus souvent une amine : ce sont des polymères tridimensionnels. La désignation normalisée des polymères époxyde est EP selon la normes ISO 1043-1[4].
Le représentant le plus connu des polymères époxyde est la colle Araldite.
Leur première synthèse date des années 1940.
Notes et références
- ↑ Paulot, F., Crounse, J. D., Kjaergaard, H. G., Kürten, A., Clair, J. M. S., Seinfeld, J. H. et Wennberg, P. O., Unexpected epoxide formation in the gas-phase photooxidation of isoprene, Science, 2009, 325(5941), 730-733.
- ↑ Exemple : MEGAN, acronyme de Model of Emissions of Gases and Aerosols from Nature.
- ↑ (en) Alex Guenther, Thomas Karl, Peter Harley, Christine Wiedinmyer, Paul I. Palmer et Chris Geron, « Estimates of Global Terrestrial Isoprene Emissions Using MEGAN (Model of Emissions of Gases and Aerosols from Nature) », Atmos. Chem. Phys., European Geosciences Union (EGU), vol. 6, , p. 3181-3210 (résumé, lire en ligne).
- ↑ ISO 1043-1:2011(fr) Plastiques — Symboles et termes abrégés — Partie 1: Polymères de base et leurs caractéristiques spéciales
Voir aussi
Bibliographie
- Jules Houtmeyers, Belgochlor, livre blanc du chlore. BelgoChlor c/o Fedichem éd., 2004, Bruxelles, 232 p.
Articles connexes
- Polyépoxyde
- Résines époxyde (maladie professionnelle)
- Époxyde hydrolase