Un microscope confocal, appelé plus rarement microscope monofocal, est un microscope optique qui a la propriété de réaliser des images de très faible profondeur de champ (environ 400 nm) appelées « sections optiques ». En positionnant le plan focal de l’objectif à différents niveaux de profondeur dans l’échantillon, il est possible de réaliser des séries d’images à partir desquelles on peut obtenir une représentation tridimensionnelle de l’objet. L'objet n'est donc pas directement observé par l'utilisateur ; celui-ci voit une image recomposée par ordinateur.
Le microscope confocal fonctionne en lumière réfléchie ou en fluorescence. La plupart du temps, on utilise un laser comme source de lumière. On parle alors de microscope confocal à balayage laser — MCBL (en anglais CLSM pour confocal laser scanning microscope).
Le principe du microscope confocal a été décrit par Marvin Minsky en 1953[1], mais ce n’est que dans la fin des années 1980 que des modèles commerciaux sont apparus, rendant cette technique accessible à de nombreux laboratoires. La microscopie confocale est très utilisée aujourd'hui en biologie ainsi qu’en sciences des matériaux.
Principe et avantages
Limites du microscope optique classique
En microscopie optique à champ large, pour qu'une image soit nette, il faut que l'objet soit dans le plan focal du système optique. Lorsqu'un objet est épais, présente un relief important, ou bien lorsqu'il est incliné par rapport à l'objectif, seule une partie de l'objet est nette dans l’image (voir l'article sur la profondeur de champ).
De plus, plus le grossissement est élevé, plus cette profondeur est faible, ce qui empêche d'avoir une image nette sur la totalité d'un objet un peu étendu. Ceci est particulièrement ennuyeux pour les objets allongés comme les nerfs ; ils sont donc flous sur une partie de leur trajet quelle que soit l'habileté du préparateur. C'est également un problème pour les surfaces rugueuses ou gauches, comme des faciès de rupture.
En fait, la microscopie à champ large pose un problème pour tous les objets dont le volume à observer n'est pas une tranche mince perpendiculaire à l'axe optique :
- en réflexion, pour les surfaces qui ne sont pas planes et perpendiculaires à l'axe optique ;
- en fluorescence, pour tous les objets épais.
En effet, la lumière émise par le plan focal, donc nette, est perdue dans la fluorescence émise par les plans adjacents au plan focal, qui par définition sont flous.
Principe du microscope confocal
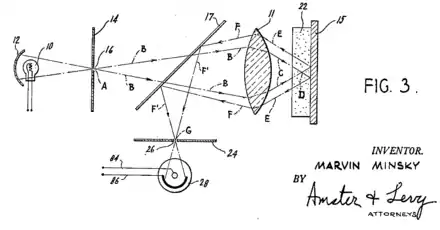
Pour résoudre ce problème, on éclaire la surface non plus par un faisceau de lumière blanche, produite par une lampe (10), mais par un faisceau laser, concentré par une lentille (identique avec l'objectif optique (11) dans le cas du schéma de principe de Marvin Minsky, ci-dessus en 1957), qui balaie la surface en positionnant un sténopé (24) —pinhole en anglais— devant le détecteur (28), dans un plan focal conjugué au plan focal de l’objectif (plans confocaux). De cette manière, seuls les photons provenant du plan focal passent le sténopé (24) et participent à la formation de l’image, d'où le nom « confocal » (synonyme de monofocal).
La lumière provenant des plans adjacents (floue) est arrêtée par les bords du trou. Il est ainsi possible d'obtenir une coupe optique nette correspondant uniquement au plan focal. En faisant varier ce plan on obtient une succession de coupes donnant des informations nettes et précises dans les trois dimensions de l'objet observé.
La microscopie confocale permet des études sur du matériel fixé, mais permet également d'étudier des phénomènes dynamiques, sur des cellules ou des tissus vivants, en particulier grâce aux molécules de la famille GFP (Green Fluorescent Protein). Par ailleurs les évolutions permanentes de la technique permettent aujourd'hui de se pencher sur des processus d'interaction moléculaire (Technique du FRET), ou de dynamique moléculaire (FRAP, FLIP).
Résolution
La résolution d’un microscope confocal peut être déterminée expérimentalement[2] ou théoriquement à l’aide de la fonction d'étalement du point (Point Spread Function ou PSF en anglais). En microscopie optique conventionnelle l’échantillon est illuminé en champ large et imagé par l’objectif de microscope de sorte que la PSF du système entier est donnée uniquement par la PSF de détection de l’objectif de microscope utilisé. En microscopie confocale, par contre, la lumière (souvent d’une source lumineuse cohérente comme un laser) est focalisée sur l’échantillon et dans ce cas la PSF totale est donc le produit de la PSF d’illumination et de la détection[3]. Ceci mène à une résolution latérale légèrement meilleure (180-160 nm) à celle attendue pour un microscope optique conventionnel (200 nm). La résolution en Z (profondeur) est de l’ordre de 600 nm en microscopie confocale.
Description du dispositif
Source de lumière
La plupart du temps, la source d'excitation utilisée n'est plus une lampe à arc, mais un (ou plusieurs) faisceau(x) laser. L'intérêt des lasers est de fournir une lumière monochromatique plus spécifique et facile à contrôler (en termes de filtrage). De plus la finesse du pinceau laser permet d'améliorer considérablement la résolution en XY (dans le plan) du fait d'une moindre diffusion.
Les lasers utilisés le plus fréquemment sont les suivants :
- argon-ion (longueurs d'onde : 457 nm, 488 nm, 514 nm) ;
- hélium-néon (longueurs d'onde : 543 nm, 633 nm).
Si l'on utilise une source de lumière blanche à la place d'un laser, il est également possible d'obtenir des images en couleur avec un microscope confocal. Il est toutefois plus difficile de focaliser la lumière blanche avec une forte intensité sur l'objet, ce qui augmente le temps d'acquisition. Les microscopes confocaux en lumière blanche utilisent en général plusieurs rayons de manière simultanée, ce qui permet d'observer plusieurs endroits de l'échantillon à la fois. Grâce à des dispositifs comme un disque de Nipkow, il est possible de réaliser des images en temps réel.
Système de balayage
Le balayage du champ observé par le laser se fait à l’aide de deux miroirs orthogonaux. Il s'agit de miroirs galvanométriques très rapides (entre 200 Hz et 2 kHz selon les modèles) effectuant le balayage en X, suivi d'un miroir permettant le balayage en Y.
Le positionnement de l’image dans la profondeur de l’échantillon est généralement obtenu en déplaçant en Z l’objectif à l’aide d’un quartz piezoélectrique par pas successifs de 200-300 nm.
Détecteurs
Les détecteurs utilisés sont des tubes photomultiplicateurs (PMT) ou une caméra CCD haute sensibilité. L’intensité lumineuse est mesurée et numérisée en fonction de la position du laser dans l’échantillon : on obtient directement des images numériques.
L'utilisation de photo-multiplicateurs (PMT) comme capteurs, à la place de l'œil ou de l'appareil photo, est rendue nécessaire par le très faible signal émis pour chaque position du faisceau. Pour chacune de ces positions, le PMT va produire un signal électrique proportionnel au niveau de lumière collecté. Ce signal électrique est ensuite numérisé pour constituer une matrice de pixels. En travaillant en 8 bits on obtient ainsi une image en 256 niveaux de gris, qui sont ensuite « colorés » artificiellement afin de différencier dans une superposition les fluorescences émises par plusieurs fluorochromes. Les images obtenues ont un champ variant de 64 x 64 à 2 048 x 2 048. Plus la résolution est élevée, plus le temps d'acquisition est long, ce qui peut devenir une limite pour l'acquisition de phénomènes biologiques rapides sur du matériel vivant. Enfin, le fichier généré est plus volumineux (problème de stockage mémoire).
Traitement de l'image
Le résultat d'une observation en microscopie confocale peut être considéré comme une tomographie à l'échelle cellulaire. Une fois la tomographie obtenue, elle peut être traitée de différentes façons :
- en réunissant les différentes images, on reconstitue une vue en deux dimensions de l'ensemble de la préparation parfaitement nette en tout point ;
- en créant une image stéréoscopique donnant une vue en trois dimensions de la préparation ;
- comme tous les éléments d'une même image se trouvent à la même profondeur de la préparation, on peut déterminer les connexions entre les différents éléments observables.
Ces usages ne sont toutefois pas limitatifs et dépendent des besoins et de l'imagination des scientifiques.
Autres techniques apparentées
Microscope confocal à Disque Rotatif (ou Disque de Nipkov)
Ce type de microscope à Disque de Nipkov est utilisé principalement en lumière blanche, où la scrutation en simultanée de plusieurs endroits est intéressante du fait de la durée nécessaire à l'observation de chaque point.
L'avantage de la lumière blanche réside dans l'obtention d'images en couleur.
Microscope confocal spectral (ou chromatique)

La microscopie confocale chromatique repose sur le même principe que la microscopie confocale classique où on utilise une optique volontairement chromatique. L'appareil peut être vu schématiquement comme un empilement de microscopes confocaux classiques, un par longueur d’onde (autrement dit par couleur). Une analyse spectrale de la lumière repassant par diaphragme (ou filtre spatial) permet alors de connaître la position de l’objet dans l’étendue de mesure du capteur.
Elle permet de mesurer la rugosité d’un échantillon, de faire une acquisition de profil, de topographie et, si le matériau est transparent, d’en mesurer l’épaisseur avec une précision de quelques microns.
Les principaux domaines d’application sont la mesure d’épaisseur de verre, la micro-électronique pour la mesure d’épaisseur de wafer ou la mesure de hauteur des protubérances (bumps).
Résolution
La microscopie confocale chromatique permet d’effectuer des mesures avec une résolution axiale de quelques nanomètres et une résolution latérale inférieure au micron. Les étendues de mesures accessibles par cette technique vont de quelques dizaines de microns à quelques dizaines de millimètres.
L’acceptance angulaire des microscopes confocaux est équivalente à celle des microscopes classiques et peut aller jusqu’à 45° sur des matériaux réfléchissants (comme un miroir) et 85° sur des matériaux diffusants (comme du plâtre).
Le principe de mesure permet de ne pas avoir d’effet d’ombre.
Généralement la microscopie confocale chromatique offre une flexibilité de mesure telle qu’elle peut être adaptée à tout type de mesure nécessitant une forte résolution pour une étendue de mesure de quelques dizaines de millimètres.
Périmètre
La microscopie confocale peut être utilisée de façon complémentaire avec d’autres techniques de mesure comme l’interférométrie lumière blanche ou l’interférométrie faible cohérence.
Les principaux avantages de la microscopie confocale sont sa souplesse dans la configuration de la mesure, sa précision et sa rapidité. Elle est très bien adaptée pour faire une mesure de profil de grande dimension (plusieurs centaines de millimètres) ou de topographie (quelques millimètres carrés à quelques dizaines de millimètres carrés).
Elle cède le pas à l’interférométrie lumière blanche pour des champs d’observation de quelques centaines de microns, lorsque l’acquisition de l’image doit être faite très rapidement. Dans ces configurations de mesure, elle est un peu moins bien adaptée malgré ses résultats de grande qualité.
Pareillement, si l’application nécessite une étendue de mesure de grande dimension (supérieure à 40 millimètres), l’interférométrie faible cohérence peut être préférée à la microscopie confocale. En effet, dans ce domaine d’étendue de mesure l’interférométrie faible cohérence permet d’aller jusqu’à 600 mm (voire plusieurs mètres) avec une précision de 100 nm à peine.
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Konfokalmikroskop » (voir la liste des auteurs).
- ↑ Brevet US 3013467 (en) « Microscopy apparatus », Marvin Minsky, 1967.
- ↑ (en) Nasse M. J., Woehl J. C., Huant S., « High-resolution mapping of the three-dimensional point spread function in the near-focus region of a confocal microscope », Appl. Phys. Lett., vol. 90, no 031106, , p. 031106-1-3 (DOI 10.1063/1.2431764).
- ↑ (en) Pawley JB (editor), Handbook of Biological Confocal Microscopy, Berlin, Springer, , 3e éd., 988 p. (ISBN 978-0-387-25921-5, LCCN 2005926334, lire en ligne).
Voir aussi
Articles connexes
- Instrument d'optique
- Microscope optique
Liens externes
- (en) Une introduction à la microscopie confocale
- (en) Microscope confocal à balayage laser
- (en) Un microscope confocal virtuel
- animations et explications sur les différents types de microscopes, dont le microscope à fluorescence et confocal (Université Paris Sud)
- Cours vidéo sur les microscopes confocaux pour la mesure d'état de surface