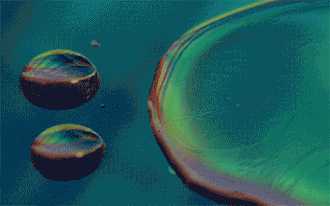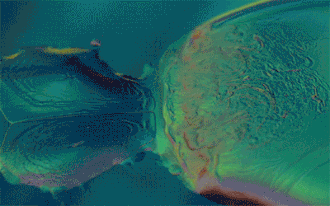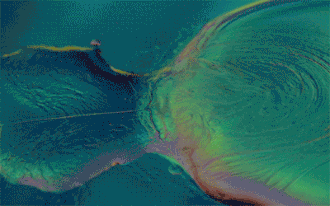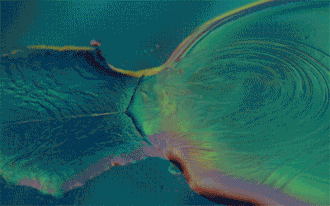
La miscibilité désigne usuellement la capacité de divers liquides à former un mélange homogène (une solution liquide). En minéralogie, la miscibilité désigne la capacité de deux ou plusieurs pôles purs (des minéraux de composition simple) de former des cristaux homogènes de composition intermédiaire (une solution solide). La différence essentielle avec la miscibilité des liquides est qu'on ne peut pas obtenir une solution solide par un mélange mécanique des corps purs, mais seulement par une réaction chimique ou par une cristallisation (à partir d'un liquide ou d'un gaz).
L'immiscibilité est la propriété contraire, celle de deux liquides ou de deux solides qui ne peuvent pas former un mélange homogène. En théorie l'immiscibilité n'est jamais complète (chacun des deux partenaires peut dissoudre une petite fraction de l'autre) mais elle peut l'être presque (quand les fractions dissoutes ne peuvent être qu'extrêmement petites).
Deux liquides ou deux solides peuvent être miscibles en toutes proportions à certaines températures et n'être plus que partiellement miscibles ou presque complètement immiscibles à d'autres températures (généralement plus basses que les précédentes).
Liquides
Si le mélange obtenu est homogène, les liquides sont qualifiés de miscibles.
Inversement, les liquides sont dits non-miscibles s'ils ne peuvent pas se mélanger et forment un mélange hétérogène : on observe alors plusieurs phases. Le liquide de densité plus faible sera alors placé au-dessus de l'autre.
C'est le cas par exemple de l'eau et de l'huile.
Deux composés peu miscibles ou non-miscibles mais de masses volumiques semblables risquent de former à leur frontière une émulsion. Cela peut être forcé par des agents émulsifiants ou diminué par une faible pression atmosphérique. Deux liquides présentant un tel mélange peuvent tout de même être séparés à l'aide de décantations successives dans une ampoule à décanter.
Composés organiques
Il n'y a aucune règle vérifiant la miscibilité entre deux liquides.
Dans les composés organiques, la longueur de la chaîne carbonée hydrophobe détermine souvent la miscibilité relative vis-à-vis des membres de la même famille. Par exemple, dans les alcools, l'éthanol qui possède deux atomes de carbone est miscible avec l'eau alors que l'octanol qui en possède huit ne l'est pas.
La miscibilité peut survenir pour plusieurs raisons. Les composés organiques oxygénés sont tous miscibles, par la présence du groupement hydroxyle comme chez les alcools qui peut former des liaisons hydrogène avec les molécules d'eau.
Dans les aldéhydes et cétones la liaison hydrogène peut former une liaison avec une seule paire d'électrons sur l'atome d'oxygène (groupement carboxyle).
Enfin, la miscibilité étant liée à la faculté de réaliser des liaisons, elle dépend aussi de la géométrie des molécules.
Minéraux
Des phases solides peuvent également former une solution solide et présenter un caractère de miscibilité totale ou partielle, étudiée au travers de diagrammes de phase.
À la différence des liquides, on n'obtient pas une solution solide par mélange mécanique de deux corps purs, mais par cristallisation directe à partir d'une solution liquide, ou par réaction minéralogique. Une solution solide peut aussi être obtenue par diffusion chimique, près de l'interface de deux corps purs solides ou de deux solutions solides de compositions différentes ; mais ce mode de formation reste presque toujours très limité spatialement, en raison de la lenteur de la diffusion à l'état solide, même à température élevée.
Voir aussi
Articles connexes
- Coefficient de partage
- Solution solide