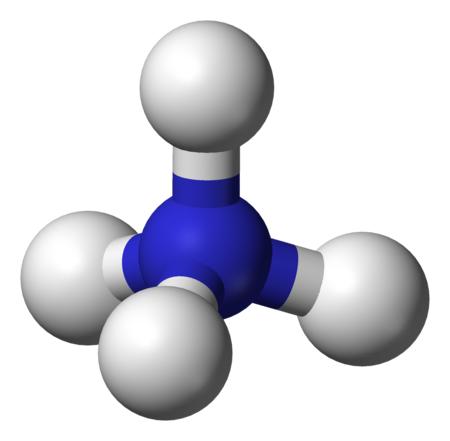
الأمونيوم وهو شاردة موجبة (كاتيون) للتجمع الذري +NH4 .[1][2][3]كتلته المولية مقدارها 18.04 غ/مول، وينتج من عملية إضافة بروتون (برتنة) للأمونياك. يتميز الأمونيوم بأنه قلوي له ثابت تشرد حمضي (pKa) مقداره 9.25 .
كيمياء الأمونيوم
في شاردة الأمونيوم ترتبط ذرة النيتروجين المشحونة إيجاباً بأربع روابط مشتركة مع الهيدروجين. تتصرف شاردة الأمونيوم كحمض برونشتد لوري ضعيف، أي أن شاردة الأمونيوم قادرة على منح بروتون إلى قاعدة أقوى وذلك بالتخلي عن أي من ذرات الهيدروجين التي لديها، فتتحول بالتالي إلى الأمونيا. مما يعني أن شاردة الأمونيوم هي حمض مترافق مع القاعدة التي هي الأمونيا.
التوازن بين الأمونيا والأمونيوم:
تعتمد مقدرة الأمونيا في المحلول في تشكيل شاردة الأمونيوم على pH الوسط. أغلب مركبات الأمونيوم تكون في المحاليل، إلا أنه يمكن أن تتكون أيضاً في الحالة الغازية؛ فعلى سبيل المثال عندما يحصل تماس بين بخار الأمونيا مع بخار كلور الهيدروجين تنشأ سحابة بيضاء من كلوريد الأمونيوم، والتي تترسب أخيراً على شكل صلب على سطح المحلول.
اقرأ أيضا
مراجع
- "معلومات عن أمونيوم على موقع fdasis.nlm.nih.gov". fdasis.nlm.nih.gov. مؤرشف من الأصل في 25 يوليو 2019.
- "معلومات عن أمونيوم على موقع rcsb.org". rcsb.org. مؤرشف من الأصل في 27 ديسمبر 2019.
- "معلومات عن أمونيوم على موقع thes.bncf.firenze.sbn.it". thes.bncf.firenze.sbn.it. مؤرشف من الأصل في 25 يوليو 2019.