يشكل الكبريت أكثر من 30 متآصلاً من الأشكال المختلفة، وذلك بشكل أكبر من أي عنصر كيميائي آخر.[1] أكثر هذه المتآصلات انتشاراً هو ثماني الكبريت الحلقي S8، ولكن توجد حلقات أخرى عديدة من هذا العنصر،[1] مثل الحلقة السباعية S7، والتي تتميز بلونها الأصفر الأغمق من S8. بينت التجارب باستخدام تقنية استشراب السائل رفيع الإنجاز (HPLC) أن الكبريت العنصري في الحالة السائلة يكون في حالة توازن بين مزيج يتكون بشكل رئيسي من S8 مع وجود نسبة من S7، وكميات صغيرة من S6.[2] جرى التمكن من تحضير حلقات أكبر من الكبريت، بما في ذلك S12 وS18.[3][4] يمكن الحصول على شكل لابلوري من الكبريت (يسمى أيضاً الشكل البلاستيكي) بإجراء عملية تبريد سريعة لمصهور الكبريت، مثل سكبه الفجائي في الماء البارد. بينت الدراسة بالأشعة السينية أن الشكل اللابلوري لديه هيكل لولبي يحوي ثمان ذرات لدى كل لفة.[1]
ثماني الكبريت الحلقي
تترتب الذرات في ثماني الكبريت S8 على هيئة حلقة لها شكل التاج، ويبلغ طول الرابطة S-S مقدار 203.7 بيكومتر (بم)، أما زاوية الرابطة S-S-S فتبلغ 107.8°، في حيت تبلغ الزاوية ثنائية السطح مقدار 98°؛[5] وتكون الزمرة النقطية من النمط D4d، ويبلغ عزم ثنائي القطب 0 ديباي.[6] يوجد ثماني الكبريت في الطبيعة في الشروط الديناميكية الحرارية القياسية على الشكل ألفا α، وتكون البنية فيه وفق نظام بلوري معيني قائم. تتبع البلورات وفق ذلك الزمرة الفراغية Fddd، وتكون أبعاد الشبكة البلورية a = 1044 بم، وb = 1284 بم وc = 2437 بم؛ مع وجود 16 وحدة صيغة S8 لكل وحدة خلية.
عند الدرجة 95.2 °س، وهي دون نقطة انصهاره، يغير ثماني الكبريت الحلقي من بنيته البلورية من الشكل ألفا α إلى الشكل بيتّا β؛[5] لكن ترتيب الذرات في حلقة S8 الثمانية لا تتأثر بهذا التغير الطوري، ولكنه بالمقابل يؤثر على التآثرات بين الجزيئية. يتبلور الكبريت على الشكل بيتّا وفق نظام بلوري أحادي الميل، وتكون فيه أبعاد الشبكة البلورية وفق ما يلي: a = 1085 بم وb = 1093 بم و c = 1095 بم؛ وزاوية الميلان بمقدار 96.2°؛ مع وجود 6 وحدة صيغة S8 لكل وحدة خلية؛ ولذلك يكون الشكل بيتا أقل كثافة من الشكل ألفا. ينصهر الشكل بيتا عند الدرجة 119.6 °س، وهي تدعى نقطة الانصهار المثالية للكبريت، وذلك في مقابل 115 °س التي تمثل نقطة الانصهار الطبيعية للكبريت.[7] عند التبريد يتحول الكبريت عائداً إلى الشكل ألفا.[5] يوجد شكل بلوري ثالث ونادر من ثماني الكبريت، وهوالشكل غاما، الذي يعرف أيضاً باسم روسيتسكيت، وتتبع فيه البلورات نظام أحادي الميل أيضاً.[1]
سباعي الكبريت الحلقي
وهو أقل متآصلات الكبريت ثباتية؛[1] حيث يقع طول الرابطة S-S فيه ضمن مجال غير عادي بين 199.3 و 218.1 بيكومتر. توجد منه أربعة أشكال بلورية معروفة (ألفا α- وبيتا β- وغاما γ- ودلتا δ-)؛[5] ويتم الكشف عنه غالباً إما في الحالة المصهورة أو في محاليل الكبريت في المذيبات اللاعضوية.
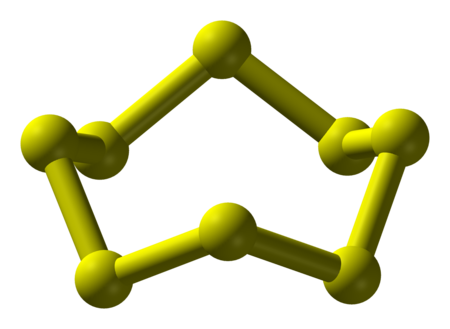
سداسي الكبريت الحلقي
هو متآصل للكبريت تترتب فيه الذرات بشكل حلقي على هيئة الكرسي، ويكون طول الرابطة S–S مقدار 2.057 بم؛ وزاوية الرابطة S–S–S مقدار 102.2 °.[8] يوجد سداسي الكبريت الحلقي على شكل بلورات حمراء برتقالية، وهي تتبع النظام البلوري السداسي؛ وحضر أول مرة سنة 1891 من الكيميائي إنغلز بمفاعلة ثيوكبريتات الصوديوم مع حمض الهيدروكلوريك؛[9] لذلك يعرف باسم «كبريت إنغلز». عند الشروط القياسية يتحول سداسي الكبريت إلى ثماني الكبريت الأكثر استقراراً.[5]
أشكال مختلفة للكبريت
هناك أشكال حلقية مختلفة للكبريت تتفاوت في أحجامها، ولكنها غير مستقرة على العموم؛ وأصغر الحلقات المكتشفة هي حلقة خماسية للكبريت، ولكنه لم يتم التمكن من عزلها، إنما جرى الكشف عنها فقط في حالة البخار.[1] أما الحلقات الأكبر المكونة من 9 ذرات وما فوق (Sn حيث n = 9 – 15, 18, 20) فيمكن تحضيرها ضمن شروط خاصة،[7] ويعد الشكل الاثناعشري هو الشكل الأكثر استقراراً فيما بينها، ويمكن تخيل بنيته على شكل ثلاثة مستويات متوازية، تقع فيها ثلاث ذرات كبريت في الأعلى وست في المنتصف وثلاث في الأسفل.[5]
عند درجات حرارة مرتفعة يمكن الحصول على سلاسل بوليمرية من الكبريت، وهي شديدة التنوع من حيث طول السلسلة وشكلها والشروط الحرارية التي تتشكل فيها.[10] هناك خمسة متآصلات مميزة للكبريت يمكن الحصول عليها عند ضغوط مرتفعة؛[1] أما في الحالة الغازية فيمكن أن تتشكل جزيئات صغيرة S2 – 4، تتراوح بين الكبريت الثنائي والثلاثي والرباعي، وهي تتشكل عند درجات أعلى من 550 °س.[5]
طالع أيضاً
مراجع
- Steudel, Ralf; Eckert, Bodo (2003). Solid Sulfur Allotropes Sulfur Allotropes. 230. صفحات 1–80. doi:10.1007/b12110. .
- Tebbe, Fred N.; Wasserman, E.; Peet, William G.; Vatvars, Arturs; Hayman, Alan C. (1982). "Composition of Elemental Sulfur in Solution: Equilibrium of S6, S7, and S8 at Ambient Temperatures". Journal of the American Chemical Society. 104 (18): 4971–4972. doi:10.1021/ja00382a050.
- Meyer, Beat (1964). "Solid Allotropes of Sulfur". Chemical Reviews. 64 (4): 429–451. doi:10.1021/cr60230a004.
- Meyer, Beat (1976). "Elemental sulfur". Chemical Reviews. 76 (3): 367–388. doi:10.1021/cr60301a003.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (الطبعة الثانية). Butterworth-Heinemann. صفحات 645–665. .
- Rettig, S. J.; Trotter, J. (15 December 1987). "Refinement of the structure of orthorhombic sulfur, α-S8" ( كتاب إلكتروني PDF ). Acta Crystallographica Section C. 43 (12): 2260–2262. doi:10.1107/S0108270187088152. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 13 أبريل 2020.
- Wiberg, Egon; Holleman, Arnold Frederick (2001). Inorganic Chemistry. Elsevier. . مؤرشف من الأصل في 13 أبريل 2020.
- Paul D. Bartlett and William R. Roderick: Hexaatomic sulfur. In: Henry F. Holtzclaw, Jr. (Hrsg.): Inorganic Syntheses. Band 8. McGraw-Hill Book Company, Inc., 1966, S. 100–103
- R. Engel: Compt. Rend., 112, 866 (1891).
- Theilig, Eilene (1982). A primer on sulfur for the planetary geologist. NASA Contractor Report 3594, Grant NAGW-132, Office of Space Science and Applications, Washington, DC, USA: National Aeronautics and Space Administration, Scientific and Technical Information Branch. صفحة 4. مؤرشف من الأصل في 13 أبريل 2020.