اسبارتاتي ناقل الكربامويل ((Aspartate carbamoyltransferase))اسبارتاتي ناقلة الكربامويل يختصرب( ATCase) يحفز الخطوة الأولى في طريق السكروز بيريميدين شيفرته المختصرة هي(EC 2.1.3.2).وهوانزيم معقد ومتعدد الوحيدات يتكون من 12 مفارز (300 كيلو دالتون في كل مجموعة).[1] . وظيفته هي تكوين مفارز هو C6R6، وتشكيل مفارز من 2 أرتب الحفاز (34 كيلو دالتون) و 3 من ديميرس (dimers) مفارز التنظيمية (17 كيلو دالتون). ترتيب خاص للمفارز المحفزة وينظمها في سلوك تفارغي و يعلق ركائز لها.[2] .
| اسبارتاتي ناقل الكربامويل | |
|---|---|
|
اسبارتاتي ناقل الكربامويل في الإشريكية القولونية. 2ATC PDB. | |
| أرقام التعريف | |
| رقم التصنيف الإنزيمي | 2.1.3.2 |
| رقم التسجيل CAS | 9012-49-1 |
| قواعد البيانات | |
| قاعدة بيانات الإنزيم | راجع IntEnz |
| قاعدة بيانات براونشفايغ | راجع BRENDA |
| إكسباسي | راجع NiceZyme |
| موسوعة كيوتو | راجع KEGG |
| ميتاسيك | المسار الأيضي |
| بريام | ملف التعريف |
| تركيب بنك بيانات البروتين | RCSB PDB PDBe PDBsum |
| الأونتولوجيا الجينية | AmiGO / EGO |
موقعه
اسبارتاتي ناقل الكربامويل لا يتبع ميكايليسالمينتن، ولكنه يقع بين منخفضة النشاط، "بنطاق ضيق" وعالية النشاط، بشكل واسع "استرخاء" .[3] يقوم هذا الانزيم بربط ركائز إلى مفارز المحفزات ويحولها في توازن إلى وحدات صغيرة النتائج التنظيمية .
رد الفعل
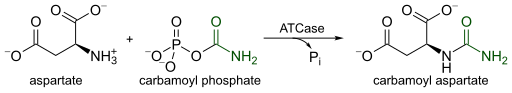
اسبارتاتي ناقل الكربامويل هو انزيم ذو درجة عالية من التنظيم يحفز الخطوة الأولى التي تتم في البيريميدين الحيوي، والتكثيف من اسبارتاتي و كرباميل الفوسفات إلى شكل N-كرباميل-L-اسبارتاتي و فوسفات غير عضوي . و يتحكم في معدل الحيوي بيريميدين عن طريق تغيير سرعة الحفاز في الاستجابة إلى مستويات الخلايا في كل من بيريميدين و البيورين . المنتج النهائي للمسار بيريميدين، CTP، يؤدي إلى انخفاض في سرعة الحفاز، في حين أن أدينوسين ثلاثي الفوسفات ( ATP)، والمنتج النهائي للمسار مواز البيورين، يمارس تأثير معاكس، في عملية النشاط التحفيزي.
المراجع
- Simmer JP, Kelly RE, Rinker AG Jr, Zimmermann BH, Scully JL, Kim H, Evans DR (1990). "Mammalian dihydroorotase: nucleotide sequence, peptide sequences, and evolution of the dihydroorotase domain of the multifunctional protein CAD". Proceedings of the National Academy of Sciences of the United States of America. 87 (1): 174–8. doi:10.1073/pnas.87.1.174. PMC . PMID 1967494. مؤرشف من الأصل في 03 يونيو 2018.
- Macol CP, Tsuruta H, Stec B, Kantrowitz ER (2001). "Direct structural evidence for a concerted allosteric transition in Escherichia coli aspartate transcarbamoylase". Nature Structural Biology. 8 (5): 423–6. doi:10.1038/87582. PMID 11323717.
- Helmstaedt K, Krappmann S, Braus GH (2001). "Allosteric regulation of catalytic activity: Escherichia coli aspartate transcarbamoylase versus yeast chorismate mutase". Microbiology and Molecular Biology Reviews : MMBR. 65 (3): 404–21, table of contents. doi:10.1128/MMBR.65.3.404-421.2001. PMC . PMID 11528003.
وصلات اضافية
- Aspartate carbamoyltransferase في المَكتبة الوَطنية الأمريكية للطب نظام فهرسة المواضيع الطبية (MeSH).
