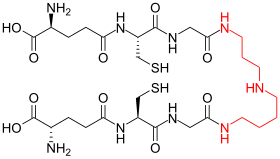
التريبانوثيون (الكتلة المولية = 721.86 غ/مول) هو شكل غير عادي من الجلوتاثيون يحتوي على جزيئين من الجلوتاثيون ينضم إليهما رابط سبيرميدين (بولي أمين). يوجد في الحيواناتُ الوحيدةُ الخَلِيَّةِ الطفيلية مثل الليشمانيا والمثقبيات.[1] هذه الحيواناتُ الوحيدةُ الخَلِيَّةِ الطفيلية هي السبب في داء الليشمانيات، مرض النوم ومرض شاغاس. تم اكتشاف التريبانوثيون بواسطة الان فايرلامب. تم إثبات تركيبته بواسطة التركيب الكيميائي.[2] وهو فريد من نوعه بالنسبة إلى ذَواتُ مَنْشَأ الحَرَكَة (رُتْبَةٌ مِنَ السَّوائِط) وغير موجود في الحيواناتُ الوحيدةُ الخَلِيَّةِ الطفيلية مثل المتحولة الحالة للنسج.[3] بما أن هذا الثايول ( مُركَّب عُضوي يحتوي على الكِبريت ) غائب عن البشر وهو ضروري لبقاء الطفيليات، فإن الإنزيمات التي تصنع هذا الجزيء وتستعمله هي أهداف لتطوير أدوية جديدة لعلاج هذه الأمراض.[4]
| Trypanothione (reduced and oxidized) | |
|---|---|
| أسماء أخرى | |
N1,N8-bis(glutathionyl)spermidine |
|
| المعرفات | |
| رقم CAS | 96304-42-6  |
| بوب كيم (PubChem) | 449517 |
| الخواص | |
| الصيغة الجزيئية | C27H49N9O10S2 |
| الكتلة المولية | 723.86226 (reduced) |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
تشمل الأنزيمات المعتمِدة على التريباناثون المختزلات، البيروكسيديز، الغليوكسالات واانزيمات الناقلة. كان التريبانوثيون - ثُنائِيُّ السَّلْفيد المختزل (TryR) أول إنزيم معتمد على التريباناثون تم اكتشافه (EC 1.8.1.12). وهو NADPH المعتمد على فلافوانزيم الذي يختزل يقلل من ثاني كبريتيد التريبانوثيون. وTryR ضروري لبقاء هذه الطفيليات على حد سواء في المختبر وفي المضيف البشري.[5][6]
إحدى الوظائف الرئيسية لتريباناثيون هي في الدفاع ضد الإجهاد التأكسدي.[7] هنا، تعمل الإنزيمات المعتمدة على التريباناثون مثل التريبانوثيون - ثُنائِيُّ السَّلْفيد (TryR) على تقليل البيروكسيدات باستخدام الإلكترونات الممنوحة إما مباشرة من التريبانوثيون، أو عن طريق
تريباريدوكسين الوسطي (TryX).
ان ايض بيروكسيد الهيدروجين المعتمد على الريبانوثيون له أهمية خاصة في هذه الكائنات لأنها تفتقر إلى المحفز. وبما أن التريبانوسوماتيدات تفتقر أيضاً إلى مكافئ من اختزال الثيوميدوكسين، فإن مختزل التريبانوثيون هو المسار الوحيد الذي يمكن أن تأخذه الإلكترونات من NADPH إلى هذه الأنزيمات المضادة للأكسدة.
روابط خارجية
المراجع
- Fairlamb AH, Cerami A (1992). "Metabolism and functions of trypanothione in the Kinetoplastida". Annu. Rev. Microbiol. 46: 695–729. doi:10.1146/annurev.mi.46.100192.003403. PMID 1444271. مؤرشف من الأصل في 14 ديسمبر 2019.
- Fairlamb, A. H.; Blackburn, P.; Ulrich, P.; Chait, B. T.; Cerami, A. (مارس 1985). "Trypanothione: a novel bis(glutathionyl)spermidine cofactor for glutathione reductase in trypanosomatids". Science. 227 (4693): 1485–1487. Bibcode:1985Sci...227.1485F. doi:10.1126/science.3883489. ISSN 0036-8075. PMID 3883489.
- Ariyanayagam MR, Fairlamb AH (سبتمبر 1999). "Entamoeba histolytica lacks trypanothione metabolism". Mol. Biochem. Parasitol. 103 (1): 61–9. doi:10.1016/S0166-6851(99)00118-8. PMID 10514081. مؤرشف من الأصل في 15 أكتوبر 2019.
- Schmidt A, Krauth-Siegel RL (نوفمبر 2002). "Enzymes of the trypanothione metabolism as targets for antitrypanosomal drug development". Curr Top Med Chem. 2 (11): 1239–59. doi:10.2174/1568026023393048. PMID 12171583. مؤرشف من الأصل في 26 مارس 2020.
- Tovar J, Wilkinson S, Mottram JC, Fairlamb AH (يوليو 1998). "Evidence that trypanothione reductase is an essential enzyme in Leishmania by targeted replacement of the tryA gene locus". Mol. Microbiol. 29 (2): 653–60. doi:10.1046/j.1365-2958.1998.00968.x. PMID 9720880. مؤرشف من الأصل في 14 ديسمبر 2019.
- Krieger S, Schwarz W, Ariyanayagam MR, Fairlamb AH, Krauth-Siegel RL, Clayton C (فبراير 2000). "Trypanosomes lacking trypanothione reductase are avirulent and show increased sensitivity to oxidative stress". Mol. Microbiol. 35 (3): 542–52. doi:10.1046/j.1365-2958.2000.01721.x. PMID 10672177. مؤرشف من الأصل في 14 ديسمبر 2019.
- Krauth-Siegel RL, Meiering SK, Schmidt H (أبريل 2003). "The parasite-specific trypanothione metabolism of trypanosoma and leishmania". Biol. Chem. 384 (4): 539–49. doi:10.1515/BC.2003.062. PMID 12751784. مؤرشف من الأصل في 26 مارس 2020.