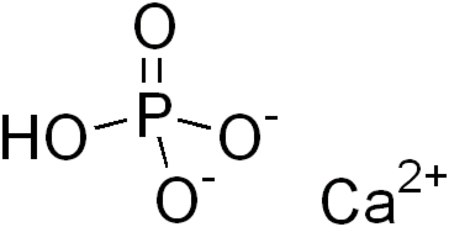
فوسفات ثنائي الكالسيوم أو فوسفات الكالسيوم أحادي الهيدروجين مركب كيميائي له الصيغة CaHPO4، ويكون على شكل مسحوق بلوري عديم اللون. غالباً ما يوجد هذا المركب على شكل ثنائي هيدرات CaHPO4.2H2O.
| فوسفات ثنائي الكالسيوم | |
|---|---|
| الاسم النظامي (IUPAC) | |
فوسفات الكالسيوم أحادي الهيدروجين |
|
| أسماء أخرى | |
فوسفات ثنائي الكالسيوم |
|
| المعرفات | |
| رقم CAS | 7757-93-9 7789-77-7 (ثنائي هيدرات) |
| بوب كيم (PubChem) | 24441 |
| الخواص | |
| الصيغة الجزيئية | CaHPO4 |
| الكتلة المولية | 136.06 غ/مول |
| المظهر | مسحوق بلوري عديم اللون |
| الكثافة | 2.89 غ/سم3 (لامائي) 2.32 غ/سم3 (ثنائي هيدرات) |
| نقطة الانصهار | 370 °س يتفكك |
| الذوبانية في الماء | 0.02 غ/100 مل ماء (ضعيفة) |
| المخاطر | |
| توصيف المخاطر | - |
| تحذيرات وقائية | - |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الخواص
- لمركب فوسفات الكالسيوم أحادي الهيدروجين انحلالية ضعيفة في الماء، لكنه بالمقابل ينحل في الحموض المعدنية.
- يفقد فوسفات الكالسيوم أحادي الهيدروجين ثنائي الهيدرات ماء التبلور بالتسخين فوق 109°س، في حين أن استمرار التسخين يؤدي إلى تفككه إلى فوسفات الكالسيوم.
- تتبع بلورات فوسفات الكالسيوم أحادي الهيدروجين الخالية من الماء النظام البلوري ثلاثي الميل، أما بلورات ثنائي الهيدرات فهي أحادية الميل.
الوفرة الطبيعية والتحضير
يوجد فوسفات الكالسيوم أحادي الهيدروجين في الطبيعة على عدة أشكال. الشكل الخالي من الماء يوجد في معدن المونيتيت Monetite ، أما ثنائي الهيدرات فيكون في معدن البروشيت Brushite.
يحضر فوسفات الكالسيوم أحادي الهيدروجين الخالي من الماء من تفاعل هيدروكسيد الكالسيوم مع حمض الفوسفوريك عند درجات حرارة أعلى من 75°س حسب المعادلة:
- Ca(OH)2 + H3PO4 → CaHPO4 + 2H2O
في حال إتمام التفاعل عند درجات حرارة أقل من 45°س نحصل على ثنائي الهيدرات.
الاستخدامات
له تطبيقات عدة في الصناعات الغذائية. فهو يستخدم كمضاف غذائي من أجل ضبط حموضة الوسط. له رقم الإي E 341b، كما يدخل في تركيب الأسمدة.
الاستخدام الصيدلاني
ممدد في المضغوطات والمحافظ . هي المادة الأكثر استخداماً كسواغ للمضغوطات في الولايات المتحدة خاصة في قطاع الأغذية الصحية لكنها أقل استخداماً في أوروبا . و هي تُستخدم في مستحضرات الفيتامينات والمعادن و هي ذات كلفة قليلة وانسيابية حية وخواص قابلة للضغط . و هذه المادة متوفرة بشكل مطحون أو غير مطحون وتُستخدم إما للضغط بصورة مباشرة أو في عملية التخثير الرطب والشكل المائي واللامائي للمادة يُعدان غير ماصين للرطوبة عند درجة الحرارة 25 . و تمتلك رطوبة نسبية بحدود 90% . و في التطبيقات التي تقتضي استخدام حرارة تتعدى 45 يُستخدم الشكل غير المائي للمادة بينما يجب أن يخضع الشكل المائي لعملية فقد ماء التبلور أولاً . و تمتلك هذه المادة خواص قابلة للضغط جيدة ويتم الاندماج مبدئياً بالضغط لكلا الشكلين المائي وغير المائي ونظراً لطبيعة هذه المادة الكاشطة فإنه من الضروري تأمين تزليق كافي أثناء عملية الضغط فمثلاً بإضافة 1% من شمعات المغنيزيوم . و تُعتبر هذه المادة غير منحلة في الماء على الرغم من أنها في المحاليل الحامضية كالحمض المعدي . و لذا فالمضغوطات التي تُستخدم فيها هذه المادة لا تتفكك بسهولة ولذا فإنه من المُفضل إضافة عامل مفكك لها مثل النشاء أو البوفيدون وغليكولات النشاء الصودي، وكروس كارميلوز الصوديوم وتُستخدم كمواد مُضافة Supplements و كمصدر للكالسيوم وفي المستحضرات السنية نظراً لخواصها الكاشطة .
التأثير على صحة الجسم
تُستخدم هذه المادة بصورة واسعة في المستحضرات الفموية والمنتجات الغذائية وتُعتبر بصورة عامة مادة غير سامة وغير مخرشة . لكن تناولها فموياً وبجرعات كبيرة قد يُسبب انزعاج وآلام بطنية.[2] LD50 (rat,oral) = 4.6-10 g/kg
المصادر
- وصلة : معرف بوب كيم — الرخصة: محتوى حر
- Handbook of Pharmaceutical Excipients SIXTH EDITION Edited by Raymond C Rowe BPharm, PhD, DSC, FRPharmS, FRSC, CPhys, MInstP Chief Scientist Intelligensys Ltd, Stokesley, North Yorkshire, UK Paul J Sheskey BSc, RPh Application Development Leader The Dow Chemical Company, Midland, MI, USA Marian E Quinn BSc, MSc Development Editor Royal Pharmaceutical Society of Great Britain, London, UK
- موسوعة رومب الكيميائية Römpp Lexikon Chemie, Georg Thieme Verlag