الكالبروتكتين (calprotectin) عبارة عن معقد من البروتينين الثديِيَّين S100A8 و S100A9 [1][2]، الكالبروتكتين في وجود الكالسيوم قادر على احتجاز العناصر الغذائية الأساسية : المنغنيز والزنك .[2][3] . واحتجاز المعادن هذا يقدم خصائص معقدة مضادة للعضيات الدقيقة[2][3]. الكالبروتكتين هو المعقد البروتيني الوحيد المضاد للعضيات الدقيقة والمعروف باحتجازه للمنغنيز[4]. يشكل الكالبروتكتين ما يصل إلى 60% من المحتوى البروتيني المنحل في العصارة الخلوية للعدلات [2][5][6]، ويتم إفرازه بآلية لا تزال مجهولة في حالات الالتهاب [7] . يتم استخدام الكالبروتكتين البرازي لتحديد التهاب الأمعاء[5][8]، ويمكن أن يعمل كواسم للأمراض المعوية الالتهابية. ويمتلك المعقد أسماء مرادفة مختلفة مثل MRP8-MRP14 والكالغرانيولين A وB ومستضد التليف الكيسي ومستضد 60BBB ومستضد 27E10[2][7].
البنية
الارتباط بالمعادن
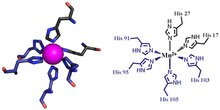
يمتلك الكالبروتكتين إلفة مرتفعة لكل من الكالسيوم والزنك والمنغنيز[5][6][9]. إذ يحتوي كل من S100A8 وS100A9 مواقع ارتباط بالكالسيوم Ca2+ [4][7] من نمط الذراع EF ويكون الكالبروتكتين قادراً على ربط أربع ذرات كالسيوم في كل ديمر أو ثمان ذرات كالسيوم في كل تترامير[10]. يؤدي الارتباط مع الكالسيوم إلى تغير بنيوي في المعقد مما يحسن من إلفته للمعادن الانتقالية ويحفز تشكل التترامير[2][4]. قد ترتبط ذرتا معدنين انتقاليين كحد أقصى في كل ديمر كالبروتكتين S100A8 وS100A9[4].
يمكن لديمر الكالبروتكتين أن يرتبط مع شاردة منغنيز واحدة فقط بإلفة مرتفعة ويتم ذلك فقط بوجود الكالسيوم[4][11]. يمكن للزنك أن يرتبط في موقعين في ديمر الكالبروتكتين ويمكن أن يحدث ذلك حتى في غياب الكالسيوم[2].[4] . لكن الكالسيوم يحسن في كل الأحوال من إلفة الكالبروتكتين للزنك[4] . وبينما تظهر القدرة الرابطة للمعادن في الكالبروتكتين عند ارتباط المونوميرين S100A8 وS100A9 فإن هذين المونوميرين عند استقلالهما يمتلكان بعض القدرة على ربط الزنك وقد يساهم ذلك في استتباب الزنك عند الثدييات[2][12][13].
يتكون أول مقطعي ارتباط المعادن في الكالبروتكتين من عنصر أساسي His3Asp مع مشاركة S100A8 بلجينتي هيستيدين (His83 وHis87) ومشاركة S100A9 بلجينتي هيستيدين وحمض أسبارتيك (His20 وAsp30)[4]. يمكن للموقع الثاني أن يتعاون مع المعادن من خلال مكون أساسي مرتبط مع الهيتسيدين الرباعي (His4) أو الهيستيدين السداسي (His6). في حالة الارتباط مع His4 يساهم S100A8 من خلال كل من His17 وHis27 بينما يساهم S100A9 من خلال His91 وHis95 [4]. وفي حالة الارتباط مع His6 يتم إضافة ثمالتي هيستيدين إضافيتين هما His103 وHis105 من النهاية الطرفية C في S100A9 لتمكن من الارتباط ثماني الوجوه مع المعدن الانتقالي [4] . يرتبط المنغنيز مع ديمر الكالبروتكتين في موقعه His6 [4] . ويمكن أن يرتبط الزنك مع أي من الموقعين اللذين يتشكلان بين مونوميري S100A8 وS100A9 [4][11].
الخصائص المضادة للعضيات الدقيقة
المعادن الانتقالية ضرورية لاستمرار الكائنات الحية على قيد الحياة[14]. تحد الثدييات بقوة من توافر المعادن كجزء من الجهاز المناعي السليم مما يساعد في الوقاية من الإنتانات الناجمة عن الجراثيم والفطور[14]. لقد وصف الكالبروتكتين لأول مرة في ثمانينات القرن الماضي كبروتين ثديي مضاد للعضيات يعمل من خلال احتجاز الزنك [1][2][4]. من المعروف اليوم أن الكالبروتكتين يمتلك أيضاً خصائص مضادة للجراثيم ومضادة للفطور تعود إلى قدرته على احتجاز المنغنيز[3][4] والكالبروتكتين هو العامل المضاد للعضيات الدقيقة الوحيد الذي يعمل من خلال احتجاز المنجنيز [4].
يشكل الكالبروتكتين ما يصل إلى 60% من المحتوى البروتيني المنحل في العصارة الخلوية للعدلات[2][5][6]، وقد يوجد بتراكيز أقل في الوحيدات والبالعات والخلايا الظهارية المتوسفة[2][5][6] . يدخل الكالبروتكتين في القيح وسائل الخراجات عند موت العدلات شأنه شأن البروتينات الأخرى المضادة للعضيات[2]. تفرز الخلايا الثديية الكالبروتكتين خلال الاستجابة الالتهابية[15][16]. فيفرز مثلا في الفم عند التهاب اللثة وفي عدوى المبيضات الفموي. يبدو أن الأشخاص الذين يمتلكون طفرات في مورثة الكالبروتكتين يكونون أكثر عرضة لانتانات اللثة[15]. يبدو أن احتجاز المنغنيز بواسطة الكالبروتكتين هام في إنتانات الرئة[3]. ولا تزال الآلية التي تقوم من خلالها الخلايا الثديية بإفراز S100A8 وS100A9 غير معروفة[7].
الكالبروتكتين البرازي
- طالع أيضًا: قياس الكالبروتكتين في البراز
يصبح الكالبروتكتين موجوداً في اللمعة المعوية من خلال طرح الكريات البيض [1] والإفراز الفعال[2][6] وتوزع الخلية وموتها[1][6]. وهذا يؤدي إلى ارتفاع مستويات الكالبروتكتين البرازية وهو ما يمكن تحديده في البراز[1][6]. ولذلك فإن ارتفاع مستويات الكالبروتكتين البرازية يشير إلى هجرة العدلات إلى المخاطية المعوية[1][6][9]. وبما أن الأشخاص المصابين بأمراض معوية التهابية (IBD) كالتهاب القولون القرحي أو داء كرون يمتلكون زيادة قد تصل إلى عشرة أضعاف في مستويات الكالبروتكتين البرازية[5]، فإن قياس الكالبروتكتين البرازي يمكن أن يشكل اختباراً كيميائياً حيوياً لهذه الأمراض. وعلى الرغم من كون اختبار الكالبروتكتين البرازي اختباراً حديثاً نسبياً فإنه يستخدم بشكل منتظم كمؤشر على IBD خلال المعالجة، وكواسم تشخيصي[8]. يمكن أن تعمل اختبارات الكالبروتكتين البرازي أيضاً على تمييز مرضى متلازمة الأمعاء التهيجية عن المرضى المصابين بـIBD[1][6] . الكالبروتكتين مفيد كواسم لأنه يقاوم التخرب الأنزيمي ويمكن قياسه بسهولة في البراز[17]. وعلى الرغم من أن الكالبروتكتين البرازي يتعلق بشكل ملحوظ بفعالية المرض عند المرضى المصابين بـIBD[18]، مؤكد فإن ارتفاع الكالبروتكتين البرازي قد يكون مؤشراً إيجابياً كاذباً على IBD في بعض الحالات. ومن الجدير بالذكر أن تناول مثبطات مضخة البروتون يترافق مع ارتفاع ملحوظ في قيم الكالبروتكتين[19]. كما أن الكالبروتكتين البرازي الإيجابي لا يساعد في تحديد موضع IBD أو تمييز التهاب القولون القرحي عن داء كرون[1] . يمكن للكالبروتكتين البرازي أن يشير أيضاً إلى حالات هضمية أخرى مثل السرطان القولوني المستقيمي والتهاب المعدة والأمعاء وعدم تحمل الطعام[1]. تتغير مستويات الكالبروتكتين بناء على العمر والحالة المرضية، وقد تتغير من يوم لآخر بين الأشخاص[1] . يمكن استخدام الكالبروتكتين البرازي أيضاً كمسح أولي عند المرضى الآخرين الذين تتوقع إصابتهم بـIBD أو كطريقة لمتابعة شفاء المخاطية[1]. ولا تزال احتمالية استخدام الكالبروتكتين البرازي في هذا المجال موضع شك حتى الآن ولم يتم الاتفاق على المستويات الصفرية[1].
انظر أيضاً
المصادر
- Lehmann, F. S.; Burri, E.; Beglinger, C. (13 October 2014). "The role and utility of faecal markers in inflammatory bowel disease". Therapeutic Advances in Gastroenterology. 8 (1): 23–36. doi:10.1177/1756283X14553384. مؤرشف من الأصل في 17 ديسمبر 201920 يناير 2015.
- Striz, I; Trebichavsky, I (2004). "Calprotectin - a pleiotropic molecule in acute and chronic inflammation". Physiological research / Academia Scientiarum Bohemoslovaca. 53 (3): 245–53. PMID 15209531.
- Costa, Lucio G; Aschner, Michael (2014). Manganese in Health and Disease. Royal Society of Chemistry. صفحة 146. . مؤرشف من الأصل في 26 يناير 202027 يناير 2015.
- Brophy, Megan Brunjes; Nolan, Elizabeth M. (16 January 2015). "Manganese and Microbial Pathogenesis: Sequestration by the Mammalian Immune System and Utilization by Microorganisms". ACS Chemical Biology: 150116125412006. doi:10.1021/cb500792b.
- Marshall, William Marshall,; Lapsley, Marta; Day, Andrew; Ayling, Ruth (2014). Clinical Biochemistry: Metabolic and Clinical Aspects (الطبعة 3). Elsevier Health Sciences, 2014. . مؤرشف من الأصل في 17 ديسمبر 201919 يناير 2015.
- Gupta, Ramesh (2014). Biomarkers in toxicology. San Diego, CA: Academic Press. صفحات 272–273. . مؤرشف من الأصل في 26 يناير 202019 يناير 2015.
- Celio, Marco R.; Pauls, Thomas; Schwaller, Beat (1996). Guidebook to the calcium-binding proteins. Oxford: Sambrook & Tooze Publication at Oxford University Press. صفحات 147–148. .
- van Rheenen PF, Van de Vijver E, Fidler V (2010). "Faecal calprotectin for screening of patients with suspected inflammatory bowel disease: diagnostic meta-analysis". BMJ. 341: c3369. PMC . PMID 20634346. ضع ملخصا – MedScape.
- Evans, G.O. (2009). Animal Clinical Chemistry: A Practical Handbook for Toxicologists and Biomedical Researchers (الطبعة 2). Boca Raton: Taylor & Francis. صفحات 107–108. . مؤرشف من الأصل في 6 أبريل 201619 يناير 2015.
- Strupat, K; Rogniaux, H; Van Dorsselaer, A; Roth, J; Vogl, T (September 2000). "Calcium-induced noncovalently linked tetramers of MRP8 and MRP14 are confirmed by electrospray ionization-mass analysis". Journal of the American Society for Mass Spectrometry. 11 (9): 780–8. PMID 10976885.
- Maret, Wolfgang; Wedd, Anthony (2014). Binding, transport and storage of metal ions in biological cells. [S.l.]: Royal Soc Of Chemistry. صفحة 271. . مؤرشف من الأصل في 26 يناير 202027 يناير 2015.
- UniProt Consortium. "P05109- S10A8_HUMAN". http://www.uniprot.org/. UniProt Consortium. مؤرشف من الأصل في 16 ديسمبر 201721 يناير 2015.
- UniProt Consortium. "P06702- S10A9_HUMAN". http://www.uniprot.org/. UniProt Consortium. مؤرشف من الأصل في 23 ديسمبر 201721 يناير 2015.
- Hood, M; Skaar, E (2013). "Nutritional immunity: transition metals at the pathogen-host interface". Nature Reviews Microbiology. 10 (8): 525–537. doi:10.1038/nrmicro2836. PMC .
- Schaechter, Moselio (2009). Encyclopedia of microbiology (الطبعة 3). [S.l.]: Elsevier. صفحة 570. . مؤرشف من الأصل في 26 يناير 202027 يناير 2015.
- Vacharaksa, Anjalee (2007). Restricted HIV-1 Infection Increases Susceptibility of Candida Infection in Oral Keratinocytes. ProQuest. صفحة 20. . مؤرشف من الأصل في 26 يناير 202027 يناير 2015.
- Tibble J, Teahon K, Thjodleifsson B, Roseth A, Sigthorsson G, Bridger S, Foster R, Sherwood R, Fagerhol M, Bjarnason I (2000). "A simple method for assessing intestinal inflammation in Crohn's disease". Gut. 47 (4): 506–13. PMC . PMID 10986210.
- D'Haens G, Ferrante M, Vermeire S, Baert F, Noman M, Moortgat L, Geens P, Iwens D, Aerden I, Van Assche G, Van Olmen G, Rutgeerts P (2012). "Fecal calprotectin is a surrogate marker for endoscopic lesions in inflammatory bowel disease". Inflamm. Bowel Dis. 18 (12): 2218–24. doi:10.1002/ibd.22917. PMID 22344983.
- Poullis A, Foster R, Mendall MA, Shreeve D, Wiener K (2003). "Proton pump inhibitors are associated with elevation of faecal calprotectin and may affect specificity". Eur J Gastroenterol Hepatol. 15 (5): 573–4, author reply 574. PMID 12702920.