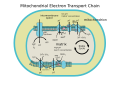
كوأنزيم كيو-سيتوكروم سي ريدوكتاز ((Coenzyme Q – cytochrome c reductase))انزيم يعمل على ثنائات الفينول والمواد الشبيهة التي تعمل كمركبات مانحة وتصنيفه هو (EC 1.10.2).و يعتبر المجمع الثالث في سلسلة نقل الإلكترون ( EC 1.10.2.2 )، ويلعب دورا حاسما في توليد البيوكيميائية (الفسفرة التأكسدية). في بروتين عبر الغشاء لمتعدد الوحيدات (multisubunit) المشفرة بواسطة كل من الميتوكوندريا ( السيتوكروم ب الجينوم)، والحمض النووي (جميع الوحدات الصغرى الأخرى). والمعقد الثالث الموجود في الميتوكوندريا في البشر وجميع الحيوانات وكل حقيقيات النوى الهوائية والأغشية الداخلية لمعظم الجراثيم الحقيقية أو بكتيريا حقيقية (eubacteria) وهي الوحيدات من الوحدانات التي تتضمن البكتيريا الحقيقية مثل كولاي. وهي واحدة من المجموعات الرئيسية الثلاث من بدائيات النوى في مملكة الوحدانات. والتي تكون في جدران الخلايا التي تحتوي على ببتيدوغليكان [1] ، وكذلك الاضطرابات المتعدد، في المجمع (BC1) الذي يحتوي على 11 مفرز، 3 في الجهاز التنفسي وهي وحدات صغرى (السيتوكروم B، السيتوكروم C1، البروتين Rieske)، 2 الأساسية البروتينات و6 جزيئية منخفضة الوزن البروتينات .[2]
يوبيكوينول-السيتوكروم-C اختزال يحفز التفاعل الكيميائي.
- QH2 + 2فيرساي توكروم سي (ferricytochrome c( Q + 2فيرساتوكروم سي (ferrocytochrome c) c + 2 H+
QH 2 + 2 فيرساي توكروم سي \ rightleftharpoons س 2 + ج + فيرساتوكروم 2 H +
وركائز هذا الإنزيم هي dihydroquinone (QH2) وحديدي (الحديد 3 +) السيتوكروم ج، التي لها 3 منتجات هي كينون (Q)، الإسمنت (الحديد 2 +) السيتوكروم ج، و H + .
العائلة
هذا الانزيم ينتمي إلى عائلة من نازعات الاوكسيدور(oxidoreductases) ، . يشارك هذا الانزيم في الفسفرة التأكسدية . في أربعة عوامل مساعدة هي : السيتوكروم C1 ، السيتوكروم B-562 ، السيتوكروم B-566 و 2 الحديد فيريدوكسين .[3][4]
التسميات
اسم المنهجي لهذه الفئة الانزيم هو يوبيكوينول:فيرساي توكروم سي(ferricytochrome-C ) المؤكسدة المختزلة. وله أسماء أخرى شائعة وهي :
- أنزيم Q-السيتوكروم ج مختزلة.
dihydrocoenzyme Q-السيتوكروم ج مختزلة،
خفضت يوبيكوينون-السيتوكروم ج مختزلة، مجمع الثالث،
(الميتوكوندريا نقل الإلكترون)،
يوبيكوينون-السيتوكروم ج مختزلة،
يوبيكوينول-السيتوكروم ج مؤكسدة مختزلة،
انخفاض أنزيم Q-السيتوكروم ج مختزلة،
يوبيكوينون-السيتوكروم ج مؤكسدة مختزلة،
خفضت يوبيكوينون-السيتوكروم ج مؤكسدة مختزلة،
الميتوكوندريا الإلكترون النقل المعقدة الثالث،
يوبيكوينول-السيتوكروم C-2 مؤكسدة مختزلة،
يوبيكوينون-السيتوكروم B-C1 مؤكسدة مختزلة،
يوبيكوينول-C2 اختزال السيتوكروم،
يوبيكوينول-C1 مؤكسدة مختزلة السيتوكروم،
CoQH2السيتوكروم سي مؤكسدة مختزلة،
ubihydroquinol: السيتوكروم سي مؤكسدة مختزلة،
أنزيم السيتوكروم C-QH2 مختزلة، و
QH2
- السيتوكروم ج مؤكسدة مختزلة.
أسماء الجينات البشرية
CYC1 : السيتوكروم C1
CYCS : السيتوكروم ج
UQCRFS1 : Rieske الحديد البروتين الكبريت
UQCRB : يوبيكوينون ملزمة البروتين، الطفرة مرتبطة مع الميتوكوندريا معقدة الثالث نقص نوع النووية 3
UQCRH : البروتين المفصلي
UQCRC2 : كور 2، والطفرات المرتبطة نقص III مجمع الميتوكوندريا، نوع النووية 5
UQCRC1 : كور 1
UQCR : الوحيدات 6.4KD
UQCR10 : 7.2KD الوحيدات
TTC19 : التي تم تشخيصها حديثا الوحيدات، والطفرات المرتبطة معقدة الثالث نقص نوع النووية 2
رد الفعل
آلية رد الفعل للمجمع الثالث (السيتوكروم C مؤكسدة مختزلة السيتوكروم BC1، أنزيم Q). في هذه الدورة يقوم بالإفراج عن أربعة بروتونات في إيجابي "P" الجانب (المحيط بين الغشاء)، ولكن للحصول على هذا الإفراج يتم في اثنين من البروتونات من السلبي "N" الجانب (المصفوفة). ونتيجة لذلك يتدرج البروتون ليتشكل عبر الغشاء. أما في رد الفعل العام، فان اثنين من البوبيكوينول ( إنزيم كيو 10 . )ubiquinols تتأكسد ل ubiquinones واحد يوبيكوينون يتم تخفيضها إلى يوبيكوينول . في آلية كاملة، يتم نقل اثنين من الإلكترونات من يوبيكوينول إلى يوبيكوينون، عن طريق وسيطة السيتوكروم سي اثنين.وعمل السيتوكروم ب هو ربط يوبيكوينول ويوبيكوينون. يتم نقل واحد من إلكترون السيتوكروم سي 1 من مركز 2Fe/2S، في حين يتم نقل آخر من B L الهيم إلى B H الهيم. (وينبغي عدم الخلط بينه وبين السيتوكروم .[5]
2 × 2 QH يتأكسد إلى س خفضت 1 × س 2 إلى QH
2 × CYT ج 1 تخفيض 4 × H + التي تطلق في الفضاء intermembrane
2 × H + التقطت من مصفوفة
المراجع
- See more at: http://ar.superglossary.com/Glossary/علم/علم_الاحياء/Eubacteria.html#sthash.AdCDC9Uy.dpuf
- Iwata S, Lee JW, Okada K, Lee JK, Iwata M, Rasmussen B, Link TA, Ramaswamy S, Jap BK (1998). "Complete structure of the 11-subunit bovine mitochondrial cytochrome bc1 complex". Science. 281 (5373): 64–71. doi:10.1126/science.281.5373.64. PMID 9651245.
- Kramer DM, Roberts AG, Muller F, Cape J, Bowman MK (2004). "Q-cycle bypass reactions at the Qo site of the cytochrome bc1 (and related) complexes". Meth. Enzymol. 382: 21–45. doi:10.1016/S0076-6879(04)82002-0. . PMID 15047094.
- Crofts AR (2004). "The cytochrome bc1 complex: function in the context of structure". Annu. Rev. Physiol. 66: 689–733. doi:10.1146/annurev.physiol.66.032102.150251. PMID 14977419.
- Ferguson SJ, Nicholls D, Ferguson S (2002). Bioenergetics (الطبعة 3rd). San Diego: Academic. صفحات 114–117. .
وصلات خارجية
- cytochrome bc1 complex site (Edward A. Berry) at lbl.gov
- cytochrome bc1 complex site (Antony R. Crofts) at uiuc.edu
- PROMISE Database: cytochrome bc1 complex at scripps.edu
- Interactive Molecular Model of Complex III (Requires MDL Chime)
- قاعدة بيانات توجهات البروتينات في الأغشية families/superfamily-3 - Calculated positions of bc1 and related complexes in membranes
- Coenzyme Q-Cytochrome-c Reductase في المَكتبة الوَطنية الأمريكية للطب نظام فهرسة المواضيع الطبية (MeSH).