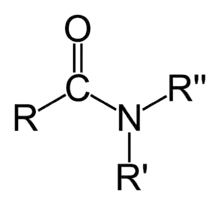
Un amide est un composé organique dérivé d'un acide carboxylique. Un amide possède un atome d'azote lié à son groupe carbonyle. Les amides sont un groupe important en biochimie, parce qu'ils sont responsables de la liaison peptidique entre les différents acides aminés qui forment les protéines.
Classe
Comme certaines autres familles de composés organiques (alcools, amines, etc.), les amides peuvent être classés en trois familles — amides primaires, secondaires ou tertiaires — selon le nombre de groupes acyles (R-C=O) liés à l'atome d'azote[1] :
- les amides primaires, de forme RCONH2, RCONHR1 ou RCONR1R2, avec un seul groupe R-C=O lié à l'azote ;
- les amides secondaires appelés également imides, de forme (RCO)2NH ou (RCO)2NR', avec deux groupes R-C=O liés à l'azote ;
- les amides tertiaires, de forme (RCO)3N, avec trois groupes R-C=O liés à l'azote.
Attention, contrairement à ce qui est parfois rencontré dans la littérature, ce classement tient en compte uniquement le nombre de groupes R-C=O liés à l'atome d'azote, et pas des éventuels groupes alkyle qui pourraient y être liés.
Ainsi, les amides primaires peuvent être :
- non substitués à l'azote, et donc de la forme RCONH2 ;
- monosubstitués (amides N-substitués), et donc de la forme RCONHR1 ;
- disubstitués (amides N,N-disubstitués), et donc de la forme RCONR1R2.
Nomenclature
Amides acycliques
Lorsque la fonction amide est prioritaire, le nom des amides primaires non substitués est celui de l'acide carboxylique correspondant en substituant la terminaison oïque par la terminaison amide (et en enlevant le terme acide) :
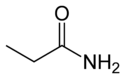
- propanamide :
Les amides primaires substitués sur l'atome d'azote sont nommés en faisant précéder le nom de l'amide de la lettre N suivie du nom du groupe substituant. S'il y en a plusieurs, chacun est précédé de N et ils sont énoncés dans l'ordre alphabétique :
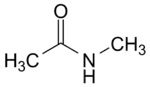
- N-méthyléthanamide :
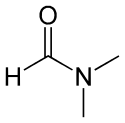
- N,N-diméthylméthanamide (ou N,N-diméthylformamide) :
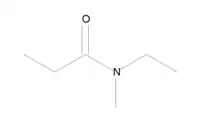
- N-éthyl-N-méthylpropanamide :
Lorsque la fonction amide n'est pas prioritaire (par exemple par rapport à une fonction ester), elle est nommée par le préfixe amido :
- 2-éthanamidopropanoate de méthyle
Lorsque l'amide comporte un groupe phényle lié à l'atome d'azote, on parle alors d'anilide (dérivé acylé de l'aniline).
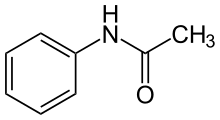
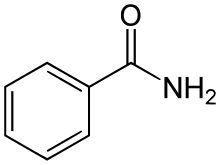
Lorsque le groupe phényle est lié au carbone du groupe amide, la règle générale s'applique, on a un dérivé de l'acide benzoïque appelé benzamide.
Amides cycliques
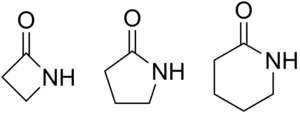
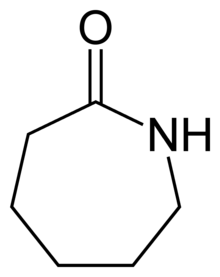
Les amides cycliques sont appelés lactames. Leur nom est celui de l'alcane cyclique correspondant, précédé du préfixe aza et terminé par le suffixe one. Ils sont cependant souvent nommés par une autre nomenclature qui consiste à utiliser le nom de l'amide non cyclique correspondant, dans lequel le suffixe amide est remplacé par lactame. Comme leurs équivalents oxygénés, les lactones, ils sont précédés d'une lettre de l'alphabet grec indiquant le nombre d'atomes composant le cycle :
Occurrence naturelle
Peptides, protéines
Les peptides et les protéines sont des chaines constituées de plusieurs acides aminés (au moins 100 pour les protéines) liés entre eux par des fonctions amides, liaisons appelées peptidiques (ou pseudo-peptidique dans le cas du glutathion par exemple, où la liaison se fait entre l'azote α et le carbone secondaire appartenant à un acide aminé acide).
Autres
Certains antibiotiques possèdent un cycle de bêta-lactame. On les appelle les bêta-lactamines, parmi lesquels on trouve notamment la pénicilline et ses dérivés, les céphalosporines, les monobactames ou les carbapénèmes. Dans ces antibiotiques, ce sont justement les cycles de bêta-lactame qui sont actifs, bloquant la synthèse de la paroi des bactéries.
Synthèse
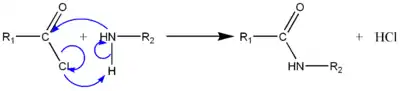
Les amides sont généralement formés à partir d'un acide carboxylique et d'une amine :
- RCO2H + R'R"NH RC(O)NR'R" + H2O.
Cette réaction étant un équilibre défavorable à la formation de l'amide, il existe de nombreuses façons de déplacer cet équilibre vers la droite, la plupart du temps en « activant » l'acide, par exemple en le transformant en chlorure d'acyle (R-CO-Cl) avec libération de chlorure d'hydrogène HCl, piégé par l'amine.
Le chlorure d'hydrogène (HCl) produit peut être neutralisé par l'amine mais également par l'ajout d'un capteur de proton comme la pyridine par exemple. La meilleure méthode connue utilisant cette technique est la réaction de Schotten-Baumann.
Une autre possibilité est de partir d'un anhydride d'acide (R-CO-O-CO-R) avec libération d'acide carboxylique, qui réagit avec un deuxième équivalent de l'amine.
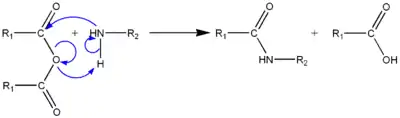 L'acide produit n'est pas assez réactif pour former un amide avec l'amine.
Il est également possible d'utiliser l'acide carboxylique activé par un réactif de couplage peptidique, de faire réagir un acide carboxylique et une amine pour former un sel qui peut être converti en amide par déshydratation, ou de partir d'oximes comme dans le réarrangement de Beckmann.
L'acide produit n'est pas assez réactif pour former un amide avec l'amine.
Il est également possible d'utiliser l'acide carboxylique activé par un réactif de couplage peptidique, de faire réagir un acide carboxylique et une amine pour former un sel qui peut être converti en amide par déshydratation, ou de partir d'oximes comme dans le réarrangement de Beckmann.
| Nom de la réaction | Réactifs | Détails |
|---|---|---|
| réarrangement de Beckmann | cétone cyclique | réactifs : hydroxylamine et acide |
| réaction de Schmidt | cétones, acide azothydrique | |
| hydrolyse de nitrile | nitrile, eau | catalyse acide |
| réaction de Willgerodt-Kindler (en) | arylalkylcétones, soufre et amine (morpholine) | |
| réaction de Passerini | acide carboxylique, cétone ou aldéhyde | |
| réaction d'Ugi | isocyanure, acide carboxylique, cétone, amine primaire | |
| réaction de Bodroux[2],[3] | acide carboxylique, réactif de Grignard avec un dérivé de l'aniline (ArNHR') | 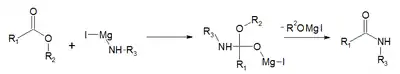 |
| réarrangement de Chapman[4],[5] | imino éther d'aryle | Pour les N,N-diaryl amides. Le mécanisme réactionnel est basé sur une substitution nucléophile aromatique[6] 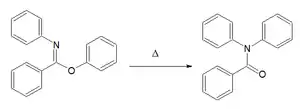 réarrangement de Chapman |
| synthèse d'amide de Leuckart[7] | isocyanate | Réaction d'un arène avec l'isocyanate catalysée par le chlorure d'aluminium, avec formation d'un amide aromatique. |
Autres méthodes
La réaction simple et directe entre un alcool et une amine n'a jamais été essayée avant 2007, date à laquelle a été rapporté un catalyseur à base de ruthénium capable d'effectuer une « acylation déshydrogénative »[8] :
La génération de dihydrogène gazeux compense la thermodynamique défavorable. On pense que cette réaction procède par une déshydrogénation de l'alcool en aldéhyde suivie par la formation d'un hémiaminal, et ensuite une seconde déshydrogénation pour former l'amide. L'élimination d'eau de l'hémiaminal pour former une imine n'a pas été observée.
Conversion des amides
Les amides sont des composés peu réactifs. Ils peuvent être hydrolysés par chauffage en milieu acide, pour générer un acide carboxylique et une amine. Il est aussi possible de les réduire à l'aide de tétrahydruroaluminate de lithium LiAlH4 pour générer une amine substituée.
Polyamides
Les polyamides sont des polymères comportant la fonction amide. Le polyamide 6,6 est un nylon ; le polyamide 11, quant à lui, a pour nom commercial Rilsan. Les chiffres indiqués correspondent aux nombres d'atomes de carbone sur la chaîne polyamide entre deux fonctions amides.
Notes et références
- ↑ (en) « amides », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- ↑ Bodroux F., Bull. Soc. Chim. France, 1905, 33, 831
- ↑ Bodroux reaction at the Institute of Chemistry, Skopje, Macedonia Link
- ↑ Schulenberg, J. W.; Archer, S. Org. React. 1965, 14.
- ↑ A. W. Chapman, CCLXIX. - Imino-aryl ethers. Part III. The molecular rearrangement of N-phenylbenziminophenyl ether, Journal of the Chemical Society, Transactions, 127:1992-1998, 1925. DOI 10.1039/CT9252701992
- ↑ (en) Jerry March, Advanced organic chemistry : reactions, mechanisms, and structure, New York, Wiley, , 3e éd., 1346 p. (ISBN 978-0-471-88841-3 et 978-0-471-85472-2, OCLC 10998226)
- ↑ R. Leuckart (en), Ueber einige Reaktionen der aromatischen Cyanate, Berichte der deutschen chemischen Gesellschaft, vol. 18, issue 1, p. 873-877 1885 DOI 10.1002/cber.188501801182
- ↑ Chidambaram Gunanathan, Yehoshoa Ben-David, David Milstein, Direct Synthesis of Amides from Alcohols and Amines with Liberation of H2, Science, 10 août 2007, vol. 317, no 5839, p. 790-792 DOI 10.1126/science.1145295
Voir aussi
Articles connexes
- Amine
- Lactame
- Thioamide