Les aminosides ou aminoglycosides constituent une famille d'antibiotiques actifs sur certains types de bactéries. Ils comprennent l'amikacine, l'isépamicine, la gentamicine, la kanamycine, la néomycine (dont la néomycine B ou framycétine), la nétilmicine, la paromomycine, la streptomycine (le plus connu, découvert non pas par Selman Waksman, comme on l'a longtemps cru, mais par son étudiant, Albert Schatz), la généticine et la tobramycine.
La plupart de ces antibiotiques sont produits par des bactéries de la famille des actinomycètes, ou en sont dérivés par hémisynthèse. Ceux qui sont dérivés des actinomycètes du genre Streptomyces prennent le suffixe -mycine, ceux qui sont dérivés du genre Micromonospora prennent le suffixe -micine.
Structure chimique

Les aminoglycosides sont composés de deux à cinq unités de sucres (glucide) substitués par des fonctions amine (-NH2), ce qui constitue l'origine de leur dénomination (amino → amine, glycoside → sucre). La plupart d'entre eux sont construits autour d'un noyau central commun, constitué de 2-désoxystreptamine et de glucosamine (voir figure). Cette structure minimale correspond à l'antibiotique néamine ou néomycine A. La plupart des aminosides utilisés en clinique comportent d'autres sucres aminés, substitués soit en position 4, soit en position 5 du cycle désoxystreptamine. On a ainsi deux familles d'aminosides :
- Les aminosides 4,6 disubstitués, tels que la kanamycine, la gentamicine ou l'amikacine
- Les aminosides 4,5 disubstitués, tels que la néomycine ou la ribostamycine.
Synthèse
La plupart des aminoglycosides sont des produits naturels, produits par des bactéries de la famille des actinomycètes. Un certain nombre de molécules actuellement utilisées en clinique sont produites par hémisynthèse à partir d'un antibiotique naturel de première génération, c'est le cas par exemple de l'amikacine qui est une forme alkylée de la kanamycine où l'une des deux fonctions amines de la désoxystreptamine est modifiée chimiquement. Cette modification a pour conséquence de permettre à l'amikacine d'échapper à un certain nombre de mécanismes de résistance.
La biosynthèse du noyau central de 2-désoxystreptamine s'effectue en plusieurs étapes à partir du glucose-6-phosphate. Puis différents sucres sont ajoutés par des glycosyltransférases. Les amines sont introduites par l'action successive de réductases et aminotransférases. En tout, plus d'une vingtaine de gènes participent à la synthèse.
Mécanisme d'action
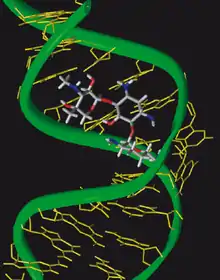
Les aminosides [1],[2] se lient à la sous-unité 30S des ribosomes des bactéries et interfèrent avec la traduction des ARN messagers en protéines. Plus précisément, la plupart des aminoglycosides se fixent à l'ARN ribosomique 16S, au niveau du site de décodage (site A). Cette fixation ne bloque pas la traduction, mais induit des erreurs dans le décodage des codons effectués par le ribosome. C'est l'accumulation des erreurs dans les protéines synthétisées qui est responsable de la létalité induite par les aminosides, par l'accumulation de protéines aberrantes.
Effet post-antibiotique
L'effet post-antibiotique est un phénomène très particulier, observé seulement avec les antibiotiques les plus puissants. Cet effet se produit avec les aminosides : même après que la majeure partie de la dose a été éliminée de l'organisme, et qu'il ne reste que de faibles traces d'aminoside dans le corps, on observe une inhibition durable de la croissance bactérienne.
Métabolisme
- Les aminosides sont peu ou pas absorbés par l'intestin; dans les infections systémiques, ils devront être administrés par voie parentérale.
- Ils pénètrent difficilement dans la bile et dans le liquide céphalorachidien mais traversent bien le placenta.
- Ils sont peu ou pas métabolisés et sont éliminés par filtration glomérulaire.
Effets secondaires
Les aminoglycosides sont toxiques chez les cellules eucaryotes. Le principal mécanisme de cette toxicité est le blocage des ribosomes mitochondriaux qui sont également sensibles à l'action de ces composés. La faible perméabilité mitochondriale limite cet effet. Chez l'homme, il existe toutefois une toxicité avérée au niveau des oreilles (ototoxique) et des reins (néphrotoxique) qui nécessite une surveillance lors de l'administration par voie générale. Les atteintes rénales sont une conséquence de la concentration des aminosides au niveau de cet organe. Les aminoglycosides sont filtrés puis pinocytosés par les cellules tubulaires rénales pour y être détruits dans les lysosomes. Ceci intoxique progressivement la cellule et mène à une nécrose tubulaire. Pour plusieurs aminoglycosides, il a été prouvé que la néphrotoxicité est moindre lors de l'administration de la dose journalière en une seule prise, sans diminution de l'efficacité.
L'ototoxicité peut être de deux ordres, soit réversible (atteinte de l'équilibre), soit irréversible (surdité). Elle est dose-dépendante[3], mais chez certains sujets prédisposés, elle peut survenir dès la première dose. Ces derniers ont souvent une mutation sur l'ADN mitochondrial, et donc, uniquement transmissible par la mère[4]. L'atteinte de l'audition est plus fréquente pour les fréquences aiguës[5]. Les aminosides pénètrent dans l'endolymphe de l'oreille avant de détruire les cellules ciliées de la cochlée[6]. De fortes doses d'aspirine pourraient atténuer cette complication[7].
Il peut exister également une aggravation des troubles de la conduction neuromusculaire, avec possibilité de parésies[8].
En raison de leurs effets toxiques (néphrotoxicité et ototoxicité), les aminoglycosides doivent être évités pendant la grossesse.
Précautions d'emploi
La marge thérapeutique-toxique est étroite, d'où l'importance des contrôles sanguins.
On les administre à des doses basées sur le poids corporel. Il faut surveiller le taux plasmatique, la fonction rénale (créatinine) et il peut être pertinent de passer des audiogrammes de contrôle après le traitement.
Les aminosides ne doivent pas être administrés pendant la grossesse (à moins d'extrême nécessité), vu le risque important de rendre le nouveau-né sourd.
Chez les malades atteints d'insuffisance rénale et chez les patients âgés, l'excrétion des aminoglycosides est retardée et le risque de toxicité est encore plus élevé. Toute atteinte de la fonction rénale exige une réduction de la posologie, de préférence par une diminution de la fréquence des administrations, éventuellement par une diminution de chaque dose.
Voies d'administration
Il existe une forme orale de ces antibiotiques, en particulier pour la paromomycine, mais qui est utilisée de manière assez rare, pour traiter des infections du tractus digestif, car l'absorption entérale (par l'intestin) est faible. Les voies d'administration principales des aminoglycosides sont les voies intraveineuse, intramusculaire, ou topique (externe) pour le traitement des plaies ou des infections oculaires (sous forme de collyres).
Indications
Les aminosides sont actifs contre certains bacilles à Gram négatif, en particulier les entérobactéries et Pseudomonas aeruginosa. La streptomycine est utile pour traiter la tuberculose résistante aux traitements habituels, la spectinomycine vient à bout de l'infection résistante à gonocoques, responsable de la gonorrhée, et la paromomycine est un anti-parasitaire employé contre certaines amibes, le Cryptosporidium et les Leishmanias.
Comme la plupart des antibiotiques, ils sont sans effets sur les champignons et les virus.
Les aminosides sont sans effet contre les bactéries anaérobies et la plupart des bactéries à Gram positif.
Ils sont indiqués dans les infections microbiennes sensibles, particulièrement en cas d'infections urinaires graves[9].
Notes et références
- ↑ Harrisson Principes de Médecine Interne (ISBN 2-25717-549-2)
- ↑ BIAM
- ↑ Bitner-Glindzicz M, Rahman S, Ototoxicity caused by aminoglycosides, BMJ, 2007;335:784-785
- ↑ Usami S, Abe S, Shinkawa H, Kimberling WJ, Sensorineural hearing loss caused by mitochondrial DNA mutations: special reference to the A1555G mutation, J Commun Disord, 1998;31:423-34
- ↑ Fausti SA, Henry JA, Schaffer HI, Olson DJ, Frey RH, McDonald WJ, High-frequency audiometric monitoring for early detection of aminoglycoside ototoxicity, J Infect Dis, 1992;165:1026–1032
- ↑ Li H, Steyger PS, Systemic aminoglycosides are trafficked via endolymph into cochlear hair cells, Sci Rep, 2011;1:159
- ↑ Sha SH, Qiu JH, Schacht J, Aspirin to prevent gentamicin-induced hearing loss, N Engl J Med, 2006;354:1856–1857
- ↑ Tao Yang, Zhi-Qiang Li, Hong-Liang Li et Jian-Xin Zhou, « Aminoglycoside use and intensive care unit-acquired weakness: A systematic review and meta-analysis », PloS One, vol. 15, no 3, , e0230181 (ISSN 1932-6203, PMID 32191708, PMCID 7082020, DOI 10.1371/journal.pone.0230181, lire en ligne, consulté le )
- ↑ Vidal L, Gafter-Gvili A, Borok S, Fraser A, Leibovici L, Paul M, Efficacy and safety of aminoglycoside monotherapy: systematic review and meta-analysis of randomized controlled trials, J Antimicrob Chemother, 2007;60:247–257
Lien externe