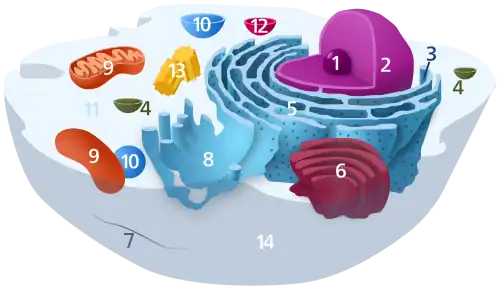
(1) Nucléole
(2) Noyau
(3) Ribosomes
(4) Vésicule
(5) Réticulum endoplasmique rugueux (ou granuleux) (REG)
(6) Appareil de Golgi
(7) Cytosquelette
(8) Réticulum endoplasmique lisse
(9) Mitochondries
(10) Vacuole (absent des cellules animales)
(11) Cytosol
(12) Lysosome
(13) Centrosome (constitué de deux centrioles)
(14) Membrane plasmique
Les ribosomes sont des complexes ribonucléoprotéiques — c'est-à-dire composés d'acide ribonucléique (ARN) et de protéines — présents dans les cellules eucaryotes et procaryotes. Extrêmement bien conservés au cours de l'évolution[1], ils ont pour fonction de synthétiser les protéines en décodant l'information contenue dans l'ARN messager. Ils sont constitués d'ARN ribosomiques, qui portent l'activité catalytique, et de protéines ribosomiques. Les ribosomes sont constitués de deux sous-unités, une plus petite qui « lit » l'ARN messager et une plus grosse qui se charge de la polymérisation des acides aminés pour former la protéine correspondante.
Généralités
Une séquence d'ADN peut conduire dans certains cas à la production d'ARNm (ou ARN messager) par transcription. Ces derniers pourront alors être traduits en séquences d'acides aminés. Les ribosomes sont un des facteurs essentiels de la traduction. Ils ont la capacité de se lier à l'ARNm, et de former une correspondance entre code de l'ARNm et séquence d'acides aminés pour une protéine donnée. Les acides aminés sont choisis par l'intermédiaire d'ARNt (ou ARN de transfert) permettant le lien physique entre séquence peptidique et séquence génétique, le tout supporté par l'activité du ribosome. En effet, ce dernier à différents niveaux (cytosolique ou réticulum endoplasmique par exemple) permet la synthèse peptidique et donc la traduction du code génétique en futures protéines.
Comme dit précédemment, les ribosomes sont des ribonucléoprotéines, résultant de l'assemblage de deux sous-unités :
- une petite sous-unité qui permet de se lier à l'ARNm, mais aussi de relier à la plus grande sous-unité, et ;
- une grande sous-unité, qui permet de contrôler l'arrivée des ARNt (mais aussi de se lier à la petite sous-unité).
Localisation
Chez les eucaryotes, les ribosomes se trouvent dans le cytoplasme, libres, ou associés aux membranes du réticulum endoplasmique ou à l'enveloppe nucléaire (cette dernière étant en continuité du système endomembranaire), sous forme de polysomes (ou polyribosomes). Chez les bactéries, on trouve aussi les ribosomes dans le cytoplasme ou liés à la membrane plasmique. On trouve aussi des ribosomes dans les mitochondries et certains plastes, et leur structure est proche de celle des ribosomes procaryotes. Ceci s'explique par la théorie de l'endosymbiose. Leur fonction est de traduire les ARN messagers issus de l'ADN mitochondrial ou de l'ADN chloroplastique.
Lorsque la traduction est très active, plusieurs ribosomes peuvent être associés simultanément à un même ARN messager, ce chapelet de ribosomes consécutifs sur l'ARN étant appelé polysome ou polyribosome.
Structure
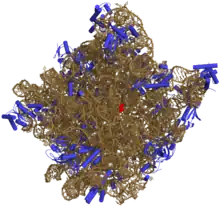
Les protéines sont colorées en bleu et les ARN en brun.
Le site actif, l'adénine 2486, est coloré en rouge.
Comportant des ARN dits ARN ribosomiques (ARNr) et des protéines ribosomiques, les ribosomes sont composés de deux sous-unités : une grande (L pour l'anglais large, « grand ») et une petite (S pour small, « petit »). Ces sous-unités sont construites autour d'un cœur d'ARN ribosomique possédant une structure très compacte, autour duquel sont accrochées les protéines. Le site actif du ribosome qui catalyse la formation de liaison peptidique est constitué d'ARN. Chez les eucaryotes, la biogenèse des ribosomes a lieu dans le nucléole, une structure interne du noyau.
- Grande sous-unité : dans le ribosome cytoplasmique des eucaryotes, elle est constituée de trois molécules d'ARNr (5S, 28S et 5,8S, comportant respectivement environ 120, 4 700 et 160 nucléotides), et de 49 protéines ribosomiques. Cette grande sous-unité a une masse moléculaire de 2,8 × 106 daltons, un coefficient de sédimentation de 60 svedbergs. Chez les procaryotes, cette grande sous-unité est caractérisée par un coefficient de sédimentation de 50 svedbergs ; elle est composée d'ARN 23S (2 900 nucléotides[2]), d'ARN 5S (120 nucléotides) et de 34 protéines.
- Centre peptidyltransférase (CPT) : au cœur de la grande sous-unité se trouve un segment semi-symétrique en forme de poche, constitué d'ARN. C'est là que deux acides aminés (transportés par des ARNt) sont rapprochés et assemblés en un dipeptide. La séquence de nucléotides du CPT varie d'une espèce à l'autre mais sa forme est toujours la même[3].
- Petite sous-unité : dans le ribosome cytoplasmique des eucaryotes, elle n'est constituée que d'une molécule d'ARNr (18S, comportant 1 900 nucléotides) et de 33 protéines ribosomiques. Cette petite sous-unité a une masse moléculaire de 1,4 × 106 daltons, un coefficient de sédimentation de 40 svedbergs. Chez les procaryotes, elle est constituée d'ARNr 16S (1 540 nucléotides[4]) et de 21 protéines. Son coefficient de sédimentation est de 30 svedbergs.
| Compositions | Procaryotes | Eucaryotes | |
|---|---|---|---|
| Grande sous-unité | Coefficient de sédimentation | 50S | 60S |
| ARN ribosomiques | 23S, 5S | 5S, 5,8S, 28S | |
| Protéines (nombres) | 34 | 49 | |
| Petite sous-unité | Coefficient de sédimentation | 30S | 40S |
| ARN ribosomiques | 16S | 18S | |
| Protéines (nombres) | 21 | 33 |
Au total, le ribosome fonctionnel (composé des deux sous-unités réunies) a une masse moléculaire de 4,2 × 106 daltons, un coefficient de sédimentation de 80 svedbergs chez les eucaryotes et 70 svedbergs chez les procaryotes.
Les ribosomes 70S des procaryotes ont une taille de 25 nanomètres de diamètre (il y a une distance de 20 nanomètres entre le site A et le site E).
Les ribosomes 70S des procaryotes sont sensibles à certains antibiotiques (amino-glycosides et chloramphénicol par exemple) qui n'ont pas d'effet sur les ribosomes 80S des eucaryotes.
Les mitochondries et les chloroplastes (des cellules végétales) contiennent également des ribosomes 70S, ce qui, en plus du fait qu'ils ont leur propre ADN et leur propre mécanisme de reproduction, étayerait la thèse selon laquelle ces organites seraient issus de procaryotes en symbiose avec la cellule eucaryote (théorie de l'endosymbiose).
Fonctions
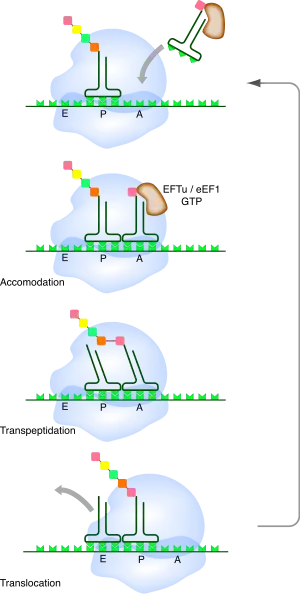
Le ribosome est la « machine » qui assure la traduction de la molécule d'ARNm dans la synthèse des protéines. Le code génétique assure la correspondance entre la séquence de l'ARNm et la séquence du polypeptide synthétisé. Le ribosome utilise les ARN de transfert ou ARNt comme « adaptateurs » entre l'ARN messager et les acides aminés.
L'ARN messager passe à travers la petite sous-unité (30S ou 40S) qui contient les sites de fixation des ARNt sur l'ARNm. La grande sous-unité contient la partie catalytique, appelée centre peptidyl-transférase, qui effectue la synthèse de la liaison peptidique entre les acides aminés consécutifs de la protéine. La grande sous-unité contient également un tunnel par lequel sort la chaîne protéique en cours de synthèse. Il existe aussi dans la grande sous-unité trois sites où vont se fixer les ARNt porteurs des acides aminés pendant la traduction : le site A (pour aminoacyl-ARNt), qui est occupé par un ARNt porteur d'un acide aminé en attente d'être lié à la chaîne polypeptidique ; le site P (pour peptidyl-ARNt), qui est occupé par un ARNt porteur d'un acide aminé lié à la chaîne polypeptidique résultante ; enfin, le site E (pour exit), qui permet la libération de l'ARNt désacétylé qui a livré son acide aminé.
Le ribosome est de plus un moteur moléculaire, qui avance sur l'ARN messager en consommant l'énergie fournie par l'hydrolyse de la GTP. Plusieurs protéines, appelées facteurs d'élongation, sont associées à ce mouvement, appelé translocation.
Origine évolutive
En se focalisant sur la structure de l'ARNr 23S de la grande sous-unité du ribosome procaryote, deux biophysiciens de l'Université de Montréal tentent en 2019 de reconstituer l'ordre dans lequel les constituants se sont successivement ajoutés pour aboutir à la structure actuelle de ce complexe macromoléculaire[5]. Ce travail a l'intérêt de modéliser la transition entre un hypothétique monde à ARN originel, où l'activité catalytique aurait été cantonnée aux ribozymes (ARN autocatalytiques), et le monde actuel dans lequel les protéines et notamment les enzymes assurent la plupart des fonctions biochimiques de catalyse.
L'assemblage des acides aminés se réalisant dans le centre peptidyltransférase (CPT), il est plausible que ce CPT constitue un « protoribosome », à partir duquel le ribosome a évolué. Constitué de 178 nucléotides, il est cependant difficile d'admettre que le CPT soit apparu spontanément dans le monde prébiotique[alpha 1]. Se fondant sur sa symétrie, Ilana Agmon a proposé sa construction à partir de deux ARN similaires en forme de L, de 60 et 61 nucléotides. Il est aussi possible que le protoribosome soit dérivé d'éléments encore plus simples, notamment des ARN de transfert (ARNt) car le noyau du CPT ressemble à la réunion de quatre ARNt[3].
Notes et références
Notes
Références
- ↑ George E. Fox, « Origin and Evolution of the Ribosome », Cold Spring Harbor Perspectives in Biology, vol. 2, no 9, (ISSN 1943-0264, PMID 20534711, PMCID 2926754, DOI 10.1101/cshperspect.a003483, lire en ligne, consulté le )
- ↑ J. Brosius, T. J. Dull et H. F. Noller, « Complete nucleotide sequence of a 23S ribosomal RNA gene from Escherichia coli », Proceedings of the National Academy of Sciences of the United States of America, vol. 77, , p. 201–204 (ISSN 0027-8424, lire en ligne, consulté le )
- 1 2 3 Amber Dance, « L'ARN par qui tout a commencé », Pour la science, hors-série no 120, , p. 18-25.
- ↑ J. Brosius, M. L. Palmer, P. J. Kennedy et H. F. Noller, « Complete nucleotide sequence of a 16S ribosomal RNA gene from Escherichia coli », Proceedings of the National Academy of Sciences of the United States of America, vol. 75, , p. 4801–4805 (ISSN 0027-8424, lire en ligne, consulté le )
- ↑ (en) Konstantin Bokov et Sergey V. Steinberg, « A hierarchical model for evolution of 23S ribosomal RNA », Nature, vol. 457, no 7232, , p. 977-980 (DOI 10.1038/nature07749
 ).
).
Voir aussi
Bibliographie
- D. Fourmy, S. Yoshizawa et H. Grosjean, « Le ribosome : l'usine à protéines », Pour la Science, 313, .
Articles connexes
Liens externes
- (en) Vidéo de reconstitutions en 3 dimensions de la structure et du mode d'action des ribosomes, sur le site de Tom Steitz, récipiendaire du prix Nobel de chimie 2009