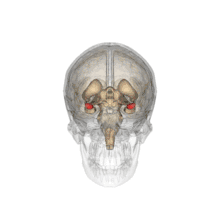
L'amygdale ou complexe amygdalien est un noyau pair situé dans la région antéro-interne du lobe temporal au sein de l'uncus, en avant de l'hippocampe et sous le cortex péri-amygdalien.
Elle fait partie du système limbique et est impliquée dans la reconnaissance et l'évaluation de la valence émotionnelle des stimuli sensoriels, dans l'apprentissage associatif et dans les réponses comportementales et végétatives associées en particulier dans la peur et l'anxiété. L'amygdale fonctionnerait comme un système d'alerte et serait également impliquée dans la détection du plaisir.
Le terme d'amygdale est emprunté au latin amygdala « amande », lui-même emprunté au grec ἀμυγδάλη « amande ». Le physiologiste allemand Burdach (1776-1847) est considéré comme le premier à avoir employé le terme d'amygdala pour décrire une formation de matière grise en forme d'amande dans la position antérieure du lobe temporal[1].
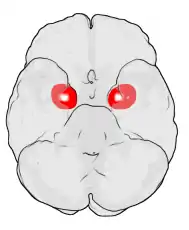 Position de l'amygdale dans le cerveau vu de dessous. |
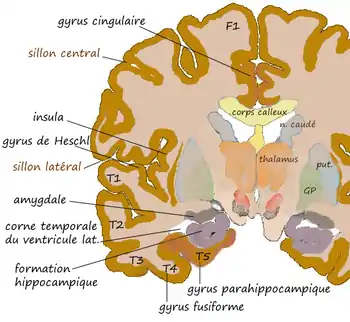 Coupe coronale au niveau de l'amygdale. |
Les noyaux amygdaliens

L'amygdale des primates est un complexe de noyaux en forme d'amande composé d'au moins 13 noyaux situés dans la région antéromédiale du lobe temporal[2]. Du point de vue de la connectivité, ce complexe de noyaux peut être classé en trois groupes[3] :
- les noyaux corticomédians, qui sont connectés avec le bulbe olfactif et le cortex olfactif ;
- les noyaux basolatéraux, avec le cortex cérébral, en particulier avec les aires sensorielles associatives ;
- les noyaux centraux et antérieurs, avec le tronc cérébral, l'hypothalamus et les régions viscéro-sensibles comme le noyau du faisceau solitaire.
Développement
L’amygdale connait une croissance considérable au cours des premières années[4]. Pendant cette période, les structures limbiques féminines se développent plus rapidement que celles des hommes. Chez les femmes, l’amygdale atteint son plein potentiel de croissance environ un an et demi avant le pic de développement masculin. De ce fait, l’amygdale mâle est relativement plus grande.
L'amygdale est riche en récepteurs aux androgènes « des récepteurs nucléaires qui se lient à la testostérone » qui jouent un rôle dans l'expression des gènes. Bien que la testostérone soit aussi présente dans les systèmes hormonaux féminins, les hommes ont des niveaux de testostérone supérieurs. Le volume de matière grise sur l'amygdale est dépendant du niveau de testostérone, ce qui peut contribuer à l'augmentation de la masse de l'amygdale masculine. En plus de la taille, il existe des différences de développement observables entre les amygdales droite et gauche. L'amygdale gauche atteint son développement maximal environ 1,5 à 2 ans avant l'amygdale droite.
L'amygdale droite est associée à la réponse à des stimuli effrayants et à la reconnaissance du visage. On en déduit que le développement précoce de l'amygdale gauche permet aux nourrissons de détecter un danger[4]. Dans l'enfance, l'amygdale réagit différemment aux personnes du même sexe par rapport aux personnes du sexe opposé. Cette réactivité diminue jusqu'à l'adolescence, où elle augmente considérablement à la puberté[5].
L'amygdale est l'une des régions du cerveau les mieux comprises en ce qui concerne les dimorphisme sexuel. L'amygdale est plus grande chez les hommes que chez les femmes, chez les enfants âgés de 7 à 11 ans[6], chez les adultes[7] comme chez les rats adultes[8]). En 2019, une étude a observé sur modèle murin une influence des hormones stéroïdiennes sur le développement prénatal de l’amygdale, se traduisant par des jeux sociaux plus violents chez les jeunes mâles. En effet, à un moment critique du développement de l'amygdale, les endocannabinoïdes favorisent la phagocytose des astrocytes par la microglie, contribuant ainsi à la différentiation sexuelle de cet organe affectant le comportement social de l'individu[9].
Outre la taille, d'autres différences fonctionnelles et structurelles entre les amygdales masculines et féminines ont été observées. On a observé l'activation de l'amygdale chez des sujets visualisant un film d'horreur et de stimuli subliminaux. Les résultats de l'étude ont montré une latéralisation différente de l'amygdale chez les hommes et les femmes. La mémoire pour le film était corrélée à une activité accrue de l'amygdale gauche chez les femmes, droite chez les hommes[10]. Une étude a montré qu'en moyenne les femmes ont tendance à mieux retenir les événements émotionnellement forts que les hommes[11].
L'amygdale droite est liée autant à la prise d’action qu’aux émotions négatives[12], ce qui peut aider à expliquer pourquoi les hommes ont tendance à réagir physiquement aux stimuli stressants sur le plan émotionnel. L'amygdale gauche permet le souvenir de détails, mais induit également des réponses aux stimuli émotionnellement stressants plus en pensées qu'en actions.
Connexions de l'amygdale
La majorité des fibres arrivant et partant du complexe corticomédian passent par la strie terminale, une voie qui court à la limite interne du noyau caudé.
Principales afférences vers l'amygdale

Les voies pénétrant dans l'amygdale peuvent être classées en 6 catégories[13] suivant leur origine :
- Le bulbe olfactif : les fibres partant du bulbe olfactif aboutissent dans le noyau cortical ;
- L'hypothalamus (noyau ventromédian, aire latérale) ainsi que le noyau du lit de la strie terminale se projettent sur la partie médiane et le noyau central ;
- Le thalamus (noyaux intralaminaires, corps genouillé médian) ;
- Le tronc cérébral (substance noire, aire tegmentale ventrale, raphe, locus coeruleus, noyau solitaire…) se projette sur le noyau central ;
- L'hippocampe envoie des fibres des champs CA1 vers les noyaux centraux et basolatéraux ;
- Le cortex cérébral (cortex orbitofrontal, cingulaire, insulaire, temporal) se projette sur les parties basolatérales ou profondes de l'amygdale.
Principales efférences issues de l'amygdale

Les voies sortant de l'amygdale sont classées en 5 catégories suivant qu'elles se projettent sur :
- l'hypothalamus : les fibres provenant des noyaux corticomédians passent principalement par la strie terminale et aboutissent sur l'aire septopréopticohypothalamique. Les fibres se projetant sur les noyaux du lit de la strie terminale (BST) sont très développées ;
- le thalamus dorsal reçoit des projections des noyaux basolatéraux ;
- le tronc cérébral : les fibres provenant des noyaux centraux descendent surtout vers la substance noire, le raphe et la formation réticulée : une partie importante de ces fibres sont GABAergiques ;
- le striatum : les fibres provenant des noyaux basaux passent par la strie terminale et se projettent sur le striatum ventral (noyau accumbens) et dorsal (noyau caudé, putamen) ;
- le cortex cérébral (tout le cortex à l'exception du lobe pariétal et du cuneus) : les fibres provenant des noyaux basolatéraux se projettent sur le cortex entorhinal qui représente la voie d'entrée principale de l'hippocampe.
L'amygdale et la peur
La fonction essentielle de l'amygdale est de décoder les stimuli qui pourraient être menaçants pour l'organisme.
La partie basolatérale de l'amygdale est directement connectée avec les structures corticales qui lui envoient des informations visuelles, auditives, somatosensorielles et gustatives provenant de l'environnement. Les noyaux centraux reçoivent les informations olfactives. Ces diverses informations sensorielles sont ensuite transmises, via les connexions internes du complexe amygdalien, à l'amygdale centromediale[13].
Lorsque ces informations sont analysées comme dangereuses pour l'organisme (ou peut-être plus généralement comme pertinentes), elles vont donner lieu à l'activation de voies de sortie en direction de l'hypothalamus et du tronc cérébral. Ces voies sont idéalement appropriées pour générer des réponses du système endocrinien, du système nerveux autonome et des voies somatomotrices associées aux émotions. L'amygdale donne la dimension émotionnelle des expériences sensorielles pertinentes pour l'organisme.
Les circuits de la peur

Le complexe amygdalien fait partie du circuit de la peur que Joseph Ledoux[14],[15] a divisé en deux :
- une voie courte : traitement sensoriel → thalamus → amygdale → réponse
- une voie longue : traitement sensoriel → thalamus → cortex cérébral → hippocampe / amygdale → réponse.
L'analyse du stimulus par le cortex va maintenir ou freiner l'action de l'amygdale sur les structures cérébrales responsables de l'expression physiologiques de la peur.
Le « serpent de Joseph LeDoux »[16] (1994) illustre l'action de ce circuit. Un promeneur marche dans la nature et voit ce qu'il prend pour un serpent. La voie courte active une réponse instantanée de sursaut et de recul de frayeur. Par la voie longue, après une courte latence, l'information arrive au cortex visuel (lobes occipitaux) puis au cortex sémantique (lobes temporaux). S'il s'agit bel et bien d'un serpent, le cortex visuel renforce l'action amygdalienne et maintient les réponses corporelles. S'il s'agit d'un bâton, l'action amygdalienne est freinée et les réponses corporelles s'estompent.
L'action amygdalienne a un rôle de survie : il vaut mieux prendre le bâton pour un serpent et agir en toute sécurité plutôt que de risquer de prendre un serpent pour un bâton.
Le point central du modèle d'activation par la peur de LeDoux (1996) est que l'amygdale peut être activée rapidement et inconsciemment par une « voie basse » passant par le thalamus sans monter jusqu'au cortex. Cette voie a été précisée par Morris et al.[17] (1999) qui ont montré que l'activation de l'amygdale droite par un stimulus masqué (non vu consciemment) s'effectuait via les colliculus supérieurs et le pulvinar (du thalamus) sans passer par le cortex :
- traitement visuel → colliculus sup.→ pulvinar → amygdale droite → réponse
La « voie haute » qui passe par le thalamus et le cortex visuel primaire va ensuite dans le lobe temporal sur le sillon temporal supérieur et le gyrus fusiforme puis sur l'amygdale. Elle peut fournir une analyse très raffinée mais plus lente que la « voie basse », qui elle, est très rapide mais assez grossière. La voie basse sous-corticale ne demande pas d'attention, elle est automatique. Au contraire, la voie haute corticale est indirecte et intègre des informations cognitives plus élaborées.
Effets de la stimulation de l'amygdale
Chez le chat, la stimulation électrique de l'amygdale conduit[18] à :
- un arrêt immédiat du comportement en cours suivi par des mouvements de recherche
- une érection des poils, une miction ;
- des grognements, sifflements ;
- une posture d'attaque ;
- une élévation de la tension et une tachycardie ;
- une augmentation du niveau de corticostérone du plasma sanguin.
Chez l'humain, la stimulation de l'amygdale est effectuée sur des patients éveillés lors d'une exploration pré-opératoire pour délimiter la zone épileptogène des patients souffrant d'épilepsie sévère. La stimulation électrique de l'amygdale provoque des sentiments de peur et d'anxiété et des réactions autonomes de peur.
Effets des lésions de l'amygdale
Chez le singe, une lésion bilatérale de l'amygdale se traduit par des changements de comportements assez spectaculaires, rassemblés sous le nom de syndrome de Klüver-Bucy. Les animaux restent indifférents aux stimuli qui habituellement provoquent une grande frayeur chez leurs congénères. Ils restent toujours placides, dociles[19], ne reconnaissent pas les objets (agnosie visuelle), pratiquent une exploration manuelle et orale excessive des objets, ne distinguent pas les aliments des objets non comestibles, ni ne discriminent leurs partenaires sexuels (ils cherchent à s'accoupler avec des mâles ou des femelles, avec d'autres animaux ou des objets).
Ces observations anciennes ont été reprises par Amaral et al[20] (2003) sur les singes rhésus adultes et sur les bébés singes. Les lésions de l'amygdale chez l'adulte provoquent bien une baisse de la peur des serpents (sous forme de jouet) mais ne produisent pas d'altérations significatives dans le comportement social et affiliatif. Au contraire, les lésions chez les bébés de deux semaines et élevés par leur mère altèrent leur comportement. Comme les adultes, ils manifestent une absence de peur des serpents mais à leur différence ils manifestent plus de peur lorsqu'ils sont placés dans un environnement social nouveau. L'amygdale est un composant critique d'un système d'évaluation des dangers potentiels de l'environnement.
Chez l'humain, des lésions bilatérales de l'amygdale ou plus largement des lobes temporaux sont aussi associées au syndrome de Klüver-Bucy. Une lésion de l'amygdale survenue au début de la vie, entraîne un déficit de la reconnaissance des expressions faciales de peur mais aussi de colère, de surprise et de dégoût. Les sujets ne développent pas de méfiance à l'égard de visages non familiers, jugés non fréquentables et indignes de confiance[21]. Une lésion au niveau de l'amygdale entraîne une incapacité d'exprimer ses émotions. S'il y a un serpent devant lui, le patient lésé dira : « je suis censé avoir peur mais je n'ai pas vraiment peur » et il n'aura aucune manifestation somatique de peur.
Ces études ont suggéré l'implication de l'amygdale dans l'attribution d'une valeur positive ou négative à des événements vécus, de manière à pouvoir y répondre par une réaction émotionnelle et un comportement appropriés.
Effets d'une ablation de l'amygdale
L'ablation de l'amygdale droite chez certains patients a entraîné une incapacité complète à ressentir la peur, même en présence d'informations sensorielles qui devraient normalement la déclencher[22]. Cette ablation de l'amygdale droite chez deux patients a permis d'atténuer profondément des symptômes de stress post-traumatique[23].
Des chercheurs ont observé qu'en raison de lésions cérébrales, en particulier de l'amygdale, une femme atteinte de la maladie d'Urbach-Wiethe était totalement incapable de ressentir la peur[24].
L'apprentissage de la peur
Les expériences chez le rat, concernant le conditionnement classique à la peur (LeDoux[14], 1998) montrent que ce circuit est déjà présent chez de nombreux mammifères.
| Le conditionnement classique aversif | |||
| Phase de répétition | Stimulus neutre SC ↔ son | Stimulus inconditionnel SI choc électrique —→ |
Réponse inconditionnelle RI figement |
| 2e phase | Stimulus conditionnel SC | ————————→ | Réponse conditionnée émotionnelle RCE |
Selon le modèle d'étude de LeDoux, on associe un stimulus désagréable « non équivoque » (décharge électrique par exemple), le stimulus de peur non conditionné (ou inconditionnel) SI, à un stimulus en soi neutre (un son par exemple), le stimulus de peur conditionné SC. Le stimulus neutre, seul, entraîne uniquement une action exploratoire chez le rat. Après répétition de l'association SC-SI, le rat va réagir de la même manière au stimulus conditionné qu'au stimulus non conditionné, même en absence de ce dernier : il s'immobilise totalement, il se fige (freezing).

Avant le conditionnement, le stimulus inconditionnel SI (choc électrique) provoquait une réponse inconditionnelle RI (figement). Après le conditionnement, le stimulus neutre (son) acquiert des propriétés aversives et devient un stimulus conditionnel SC capable d'évoquer une réponse conditionnée émotionnelle RCE (peur, figement).
Cette méthodologie valide l'hypothèse du circuit de la peur puisque si on lèse le cortex auditif ou l'hippocampe du rat après le conditionnement, la réponse à la peur est maintenue. En revanche, elle est éliminée si on lèse l'amygdale. Cet apprentissage correspond donc bien à des phénomènes de plasticité dans plusieurs structures amygdaliennes. Le noyau latéral basal serait le lieu de convergence entre les informations non conditionnées et les informations conditionnées.
Dans l'amygdale, le noyau latéral L est la porte d'entrée des informations sensorielles provenant du thalamus ou du cortex et le noyau central C se comporte comme la porte de sortie vers l'hypothalamus et le tronc cérébral[25]. Le noyau latéral L se projette directement et indirectement sur le noyau central. Des études électrophysiologiques[26] ont identifié deux groupes de cellules dans le noyau latéral, le premier impliqué dans l'apprentissage initial et le second dans le stockage mnésique. Ces régions comporteraient environ 12 000 neurones et seraient situées dans la partie dorsale du noyau latéral.
Événements activateurs de l'amygdale
La reconnaissance des émotions implique de multiples structures cérébrales faisant partie des structures limbiques ou paralimbiques. L'amygdale a un rôle prédominant dans la reconnaissance des expressions faciales de peur (Morris et al., 1996[27], 1998[28]). Toutefois ces dernières années, les études de neuro-imagerie ont montré que l'activation de l'amygdale se fait pour un spectre d'émotions beaucoup plus large que la frayeur. La neuro-imagerie a montré aussi que des stimuli odorants très désagréables provoquaient une activation bilatérale de l'amygdale et des régions orbitofrontales gauche[29].
La vue d'un événement effrayant active l'amygdale mais la vue d'un visage effrayé active aussi l'amygdale. Comme c'est souvent le cas en sémantique, on comprend une émotion ou une action effectuée par une autre personne en se mettant à sa place, en évoquant neuronalement ce que l'on a vécu soi-même antérieurement.
Un résultat paradoxal pour l'hypothèse qui voudrait que l'amygdale soit le module spécialisé dans le traitement des informations menaçantes pour l'organisme a été obtenu en comparant l'effet d'un visage en colère ayant un regard direct et menaçant avec un visage effrayé. Ce n'est pas le premier type de visage qui active le plus l'amygdale mais c'est le second[30].
En ce qui concerne le traitement des mots, il a été observé une activation de l'amygdale pour les mots aversifs ou menaçants (comme « viol », « meurtre ») par rapport à des mots neutres. Mais une étude par IRMf a montré que les mots émotionnellement positifs ou négatifs activaient plus l'amygdale gauche que les mots neutres[31]. Les mots émotionnellement positifs activent en outre les régions du striatum impliquées dans le système de récompense.
Les développements récents de la neuro-imagerie ont produit une multitude de mesures de l'activation de l'amygdale qui ont conduit à des interprétations variables, voire des controverses sur la véritable fonction de celle-ci. Une méta-analyse de 385 études de neuro-imagerie du traitement émotionnel de l'amygdale, comportant 1324 expériences portant sur 5307 individus, a dégagé les facteurs expérimentaux caractéristiques de la probabilité d'activation de l'amygdale (Costafreda et al.[32] 2008).
Tous les stimuli émotionnels sont associés avec une plus grande probabilité d'activation de l'amygdale que les stimuli neutres. Mais parmi les émotions, la peur et le dégoût ont une probabilité plus élevée d'activation de l'amygdale que le bonheur et les émotions positives non spécifiques. L'ordre des probabilités est :
- peur > dégoût > humour > émotion sexuelle > tristesse > colère
L'amygdale joue principalement le rôle de détecteur de danger mais n'est pas limitée aux émotions négatives.
Elle semble aussi jouer le rôle de mise en éveil rapide du système cognitif. Ce système d'alerte peut aussi fonctionner de manière automatique, inconsciente. Si on présente très brièvement un visage effrayé, de façon subliminale, sans que le sujet ait le temps d'en prendre conscience, on observe pourtant une activation de son amygdale. Le niveau d'attention entrave le traitement informationnel de l'amygdale : la méta-analyse de Costafreda[32] a montré qu'un traitement passif était associé à une plus grande probabilité d'activation de l'amygdale qu'une instruction d'action sollicitant l'attention.
L'amygdale et la modulation émotionnelle de la mémoire
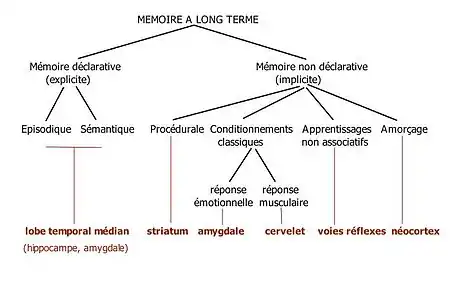
Il est maintenant bien établi qu'il existe plusieurs systèmes de mémoire contrôlés par des substrats neuronaux distincts et en interaction. On distingue dans la mémoire à long terme[33] :
- la mémoire non déclarative : elle recouvre différents types de mémorisation qui sont encore possibles chez les amnésiques. Il peut s'agir d'habiletés comme faire du vélo (mémoire procédurale), de conditionnements classiques pavloviens, de l'apprentissage non associatif (sensibilisation, habituation comme l'habituation au tic-tac d'une horloge) ou d'amorçage.
- la mémoire déclarative : elle concerne des faits et événements qui peuvent être récupérés par un effort conscient et être décrits verbalement. Elle dépend essentiellement de l'intégrité de la formation hippocampique. Elle concerne soit des événements autobiographiques ancrés dans le temps et l'espace (mémoire épisodique) soit des concepts généraux (mémoire sémantique)
Implications de l'amygdale
L'amygdale intervient dans les systèmes de mémorisation là où l'émotion est impliquée. On la retrouve dans les deux systèmes[34] :
- dans le premier système, non déclaratif, l'amygdale est spécialisée dans le traitement des émotions principalement négatives. Elle joue un rôle essentiel dans le conditionnement classique aversif dans lequel un stimulus neutre est associé avec un événement désagréable (voir section précédente).
- dans le second système, déclaratif et contrôlé par le complexe hippocampique, elle renforce la rétention mnésique de la mémoire épisodique lorsque les souvenirs sont marqués par l'émotion.
L'indépendance de la mémoire épisodique et du conditionnement classique peut être mise en évidence en neuropsychologie avec des patients ayant une lésion de l'hippocampe ou de l'amygdale. Prenons le cas d'un conditionnement aversif classique dans lequel un carré bleu est associé avec un choc électrique désagréable au poignet : un patient ayant une lésion de l'amygdale n'a aucune manifestation physiologique de peur à la vue d'un carré bleu même s'il est capable de se souvenir qu'un carré bleu est associé à un électrochoc. Et un patient présentant une lésion bilatérale de l'hippocampe exprime l'inverse : à la vue d'un carré bleu il manifeste une réponse conditionnée émotionnelle de peur mais est incapable de rapporter explicitement l'expérience de conditionnement passée. L'indépendance de ces deux systèmes mnésiques mise en évidence par cette double dissociation n'exclut pas leur coopération dans le traitement des souvenirs chargés d'émotions.
Mécanisme de modulation de la mémoire émotionnelle épisodique
Certains événements ayant une dimension affective importante s'inscrivent plus ou moins durablement dans la mémoire. Cinquante ans plus tard, on peut encore se souvenir des premiers amours, d'une dispute avec un copain ou de la lecture d'un livre remarquable. Ces souvenirs portant une forte imprégnation émotive constituent ce qu'on appelle la mémoire émotionnelle. Le souvenir d'un événement chargé d'émotion est généralement accru et plus durable que celui d'un événement neutre[35]. L'augmentation de la rétention mnésique d'événements émotionnellement connotés s'explique par l'influence de l'amygdale sur la phase d'encodage puis de consolidation du souvenir.
- L'amygdale renforce l'encodage des souvenirs. Plusieurs études ont montré que l'émotion peut accroître l'éveil et faciliter la mémoire épisodique[34].
- L'amygdale module la consolidation des souvenirs épisodiques. Les souvenirs dépendant de l'hippocampe ne sont pas stockés d'une manière tout ou rien comme sur un ordinateur. Après avoir été encodée, il existe une période de grande fragilité de la trace mnésique qui pour ne pas disparaître doit être consolidée.
La phase d'apprentissage lorsqu'elle s'accompagne d'une charge émotionnelle induit une libération d'adrénaline et de glucocorticoïdes par les glandes surrénales. L'adrénaline active le nerf vague qui par diverses voies entraîne une libération de noradrénaline allant activer des récepteurs noradrénergiques du complexe basolatéral de l'amygdale. Les glucocorticoïdes participent aussi à la potentialisation de ce signal noradrénergique amygdalien[36]. Il en résulte une activation des projections de l'amygdale sur les structures clés de la mémoire permettant d'expliquer le rôle modulateur de l'amygdale sur les souvenirs émotionnels.
Plusieurs travaux de neuro-imagerie TEP et IRMf ont montré que le niveau d'activation de l'amygdale basolatérale lors de la vision de scènes provoquant des émotions négatives ou neutres, prédisait la force du rappel du souvenir plus tard. Ainsi, les sujets qui montraient une plus grande activation de leur amygdale et qui disaient avoir été les plus émus étaient aussi ceux qui se souvenaient ultérieurement le mieux des scènes émotionnelles visionnées[37].
Inversement, des patients porteurs de lésions de l'amygdale ne présentent pas d'amélioration typique de la mémoire épisodique pour des événements émotionnellement chargés versus des événements neutres[38].
Amygdale et neuropsychologie
Pour LeDoux (1998), les troubles anxieux seraient dus à l'activation pathologique du circuit court. Des traumatismes psychologiques très précoces marqueraient l'amygdale et le circuit de la peur pendant la maturation du cerveau. Ces perturbations seraient permanentes. L'activation de l'amygdale serait exagérée chez les sujets anxieux (Thomas et al., 2001) ou en état de dépression, de phobie sociale, de stress post-traumatique.
En revanche, une lésion des amygdales provoque une absence de la reconnaissance de la peur, ce qui a des conséquences psychosociales dramatiques. Les jugements sociaux sont alors impossibles (Damasio) et une lésion bilatérale peut provoquer un syndrome de Klüver & Bucy.
Dépression
Une revue de 2022[39] de nombreuses études considère que si l'hyperréactivité de l'amygdale semble statistiquement bien établie dans les dépressions, son rôle reste mal compris et l'association trouvée est trop faible pour servir de marqueur biologique de la maladie.
Phobie sociale
Devoir s'exprimer en public, devant des inconnus, crée un trac, un malaise qui est en général surmonté. Mais pour les personnes souffrant de phobie sociale, cette situation peut provoquer une attaque panique paralysante, incontrôlable, très handicapante dans la vie sociale.
Une étude par imagerie TEP (tomographie par émission de positons) a montré que chez les sujets phobiques sociaux, l’accroissement d'anxiété au moment de s'exprimer en public était accompagnée par une suractivation du complexe amygdalien par rapport aux sujets témoins (Tillfors et al., 2001[40]). L'hyperactivité de l'amygdale des anxieux sociaux a ensuite été vérifiée dans de nombreuses situations. Par exemple, l'activation de leur amygdale à la vue de visages en colère ou effrayés est plus grande que chez les sujets témoins et l'ampleur de l'activation est positivement corrélée à la sévérité de leurs symptômes[41].
En alertant contre des dangers potentiels, l'amygdale joue normalement un rôle protecteur. Mais pour les anxieux sociaux, l'hyper-réactivité de l'amygdale provoque une hyperémotivité pouvant aller jusqu'à la peur panique, conduisant le sujet à fuir ces situations d'interactions sociales.
L'amélioration des symptômes de phobie sociale peut s'obtenir par un traitement avec un antagoniste des récepteurs NK1 et le citalopram. Des mesures par tomographie avant et après le traitement ont montré que l'amélioration des symptômes était parallèle à une réduction significative de l'activation de l'amygdale dans le test d'expression publique[42], confirmant ainsi le rôle crucial de l'amygdale dans cette phobie.
Références
- ↑ McDonald AJ., « Is there an amygdala and how far does it extend? An anatomical perspective. », Ann N Y Acad Sci., vol. 985, .
- ↑ Sander, D.; Grafman, J.; Zalla, T., « The human amygdala: An evolved system for relevance detection », Reviews in the Neurosciences, vol. 14, no 4, , p. 303-316.
- ↑ P. SAH, E. S. L. FABER, M. LOPEZ DE ARMENTIA, AND J. POWER, « The Amygdaloid Complex: Anatomy and Physiology », Physiol Rev, vol. 83, , p. 803-834.
- 1 2 Uematsu A, Matsui M, Tanaka C, Takahashi T, Noguchi K, Suzuki M, Nishijo H, « Developmental trajectories of amygdala and hippocampus from infancy to early adulthood in healthy individuals », PLOS ONE, vol. 7, no 10, , e46970 (PMID 23056545, PMCID 3467280, DOI 10.1371/journal.pone.0046970)
- ↑ Telzer EH, Flannery J, Humphreys KL, Goff B, Gabard-Durman L, Gee DG, Tottenham N, « "The Cooties Effect": Amygdala Reactivity to Opposite- versus Same-sex Faces Declines from Childhood to Adolescence », Journal of Cognitive Neuroscience, vol. 27, no 9, , p. 1685–96 (PMID 25848681, PMCID 5723398, DOI 10.1162/jocn_a_00813)
- ↑ Caviness VS, Kennedy DN, Richelme C, Rademacher J, Filipek PA, « The human brain age 7-11 years: a volumetric analysis based on magnetic resonance images », Cerebral Cortex, vol. 6, no 5, , p. 726–36 (PMID 8921207, DOI 10.1093/cercor/6.5.726)
- ↑ Goldstein JM, Seidman LJ, Horton NJ, Makris N, Kennedy DN, Caviness VS, Faraone SV, Tsuang MT, « Normal sexual dimorphism of the adult human brain assessed by in vivo magnetic resonance imaging », Cerebral Cortex, vol. 11, no 6, , p. 490–7 (PMID 11375910, DOI 10.1093/cercor/11.6.490)
- ↑ Hines M, Allen LS, Gorski RA, « Sex differences in subregions of the medial nucleus of the amygdala and the bed nucleus of the stria terminalis of the rat », Brain Research, vol. 579, no 2, , p. 321–6 (PMID 1352729, DOI 10.1016/0006-8993(92)90068-K)
- ↑ VanRyzin JW et al., Microglial Phagocytosis of Newborn Cells Is Induced by Endocannabinoids and Sculpts Sex Differences in Juvenile Rat Social Play, 2019. DOI 10.1016/j.neuron.2019.02.006
- ↑ Cahill L, Haier RJ, White NS, Fallon J, Kilpatrick L, Lawrence C, Potkin SG, Alkire MT, « Sex-related difference in amygdala activity during emotionally influenced memory storage », Neurobiology of Learning and Memory, vol. 75, no 1, , p. 1–9 (PMID 11124043, DOI 10.1006/nlme.2000.3999)
- ↑ Hamann S, « Sex differences in the responses of the human amygdala », The Neuroscientist, vol. 11, no 4, , p. 288–93 (PMID 16061516, DOI 10.1177/1073858404271981)
- ↑ Lanteaume L, Khalfa S, Régis J, Marquis P, Chauvel P, Bartolomei F, « Emotion induction after direct intracerebral stimulations of human amygdala », Cerebral Cortex, vol. 17, no 6, , p. 1307–13 (PMID 16880223, DOI 10.1093/cercor/bhl041)
- 1 2 (en) Nieuwenhuys, Voogd, van Huijzen, The Human Central Nervous System, Springer, 1978, 2008, 967 p..
- 1 2 LEDOUX J., The emotional brain, Weidenfeld & Nicolson, .
- ↑ LEDOUX J., Le cerveau des émotions : Les mystérieux fondements de notre vie émotionnelle, Odile Jacob, , 374 p..
- ↑ LEDOUX J., « Émotion, mémoire et cerveau », Pour la Science, vol. 202, , p. 50-57.
- ↑ J. S. Morris, A. Öhman, and R. J. Dolan, « A subcortical pathway to the right amygdala mediating “unseen” fear », Proc Natl Acad Sci U S A, vol. 96, no 4, , p. 1680-1685.
- ↑ S. M. Hilton and A. W. Zbrożyna, « Amygdaloid region for defence reactions and its efferent pathway to the brain stem », J Physiol, vol. 165, no 1, .
- ↑ Meunier, Martine and Bachevalier, Jocelyne and Murray, Elisabeth A. and Málková, Ludi and Mishkin, Mortimer, « EFFECTS OF ASPIRATION VERSUS NEUROTOXIC LESIONS OF THE AMYGDALA ON EMOTIONAL RESPONSES IN MONKEYS », European Journal of Neuroscence, vol. 11, .
- ↑ DAVID G. AMARAL, « The Amygdala, Social Behavior, and Danger Detection », Annals of the New York Academy of Sciences, vol. 1000, no 1, .
- ↑ Roger Gil, Neuropsychologie, Elsevier Masson, , 496 p..
- ↑ (de) « Jody wurde ein Teil des Gehirns entfernt, jetzt spürt er keine Angst mehr », sur www.vice.com (consulté le )
- ↑ Kelly R Bijanki, Sanne J H van Rooij, Timothy D Ely et Jennifer S Stevens, « Case Series: Unilateral Amygdala Ablation Ameliorates Post-Traumatic Stress Disorder Symptoms and Biomarkers », Neurosurgery, vol. 87, no 4, , p. 796–802 (ISSN 0148-396X, PMID 32259241, PMCID 7593359, DOI 10.1093/neuros/nyaa051, lire en ligne, consulté le )
- ↑ (de) Nina Weber, DER SPIEGEL, « Hirnforschung: Die Frau, die keine Angst kennt », sur www.spiegel.de (consulté le )
- 1 2 Elizabeth A. Phelps, Joseph E. LeDoux, « Contributions of the Amygdala to Emotion Processing: From Animal Models to Human Behavior », Neuron, vol. 48, no 2, , p. 175-187.
- ↑ J C Repa, J Muller, J Apergis, T M Desrochers, Y Zhou, J E LeDoux, « Two different lateral amygdala cell populations contribute to the initiation and storage of memory. », Nature Neuroscience, vol. 4, no 7, , p. 724-731.
- ↑ J.S. Morris, C.D. Frith, D.I. Perrett, D. Rowland, A.W. Young, A.J. Calder et R.J. Dolan, « A differential neural response in the human amygdala to fearful and happy facial expressions », Nature, no 383, , p. 812-815 (PMID 8893004, DOI 10.1038/383812a0)
- ↑ J.S. Morris, K.J. Friston, C. Büchel, C.D. Frith, A.W. Young, A.J. Calder et R.J. Dolan, « A neuromodulatory role for the human amygdala in processing emotional facial expressions », Brain, vol. 121, no 1, , p. 47–57 (DOI 10.1093/brain/121.1.47)
- ↑ David H. Zald and José V. Pardo, « Emotion, olfaction, and the human amygdala: Amygdala activation during aversive olfactory stimulation », PNAS, vol. 94, no 8, .
- ↑ Whalen PJ, Shin LM, McInerney SC, Fischer H, Wright CI, Rauch SL., « A functional MRI study of human amygdala responses to facial expressions of fear versus anger. », Emotion, vol. 1, , p. 70-83.
- ↑ Hamann, Stephan; Mao, Hui, « Positive and negative emotional verbal stimuli elicit activity in the left amygdala », Neuroreport, vol. 13, no 1, .
- 1 2 Costafreda SG, Brammer MJ, David AS, Fu CH., « Predictors of amygdala activation during the processing of emotional stimuli: a meta-analysis of 385 PET and fMRI studies. », Brain Res Rev., vol. 58, no 1, , p. 57-70.
- ↑ Larry R. Squire, « Memory systems of the brain: A brief history and current perspective », Neurobiology of Learning and Memory, vol. 82, , p. 171-177.
- 1 2 Elizabeth A Phelps, « Human emotion and memory: interactions of the amygdala and hippocampal complex », Current Opinion in Neurobiology, vol. 14, no 2, .
- ↑ Sven-Åke Christianson, The Handbook of emotion and memory, Routledge, , 507 p..
- ↑ McGaugh JL, Roozendaal B., « Role of adrenal stress hormones in forming lasting memories in the brain. », Curr Opin Neurobiol., vol. 12, no 2, , p. 205-210.
- ↑ Turhan Canli, Zuo Zhao, James Brewer, John D. E. Gabrieli, and Larry Cahill, « Event-Related Activation in the Human Amygdala Associates with Later Memory for Individual Emotional Experience », The Journal of Neuroscience,, vol. 20, .
- ↑ Larry Cahill, Ralf Babinsky, Hans J. Markowitsch & James L. McGaugh, « The amygdala and emotional memory », Nature, vol. 377, , p. 295-296.
- ↑ S.E. Grogans, A.S. Fox et A.J. Shackman, « The Amygdala and Depression: A Sober Reconsideration », American Journal of Psychiatry, vol. 179, no 7, , p. 454-457 (PMID 35775156, PMCID PMC9260949, DOI 10.1176/appi.ajp.20220412)
- ↑ Tillfors M, Furmark T, Marteinsdottir I, Fischer H, Pissiota A, Långström B, Fredrikson M., « Cerebral Blood Flow in Subjects With Social Phobia During Stressful Speaking Tasks: A PET Study », The American Journal of Psychiatry, vol. 158, no 8, .
- ↑ K. Luan Phana, Daniel A. Fitzgeraldb, Pradeep J. Nathanc, Manuel E. Tancerb, « Association between Amygdala Hyperactivity to Harsh Faces and Severity of Social Anxiety in Generalized Social Phobia », Biological Psychiatry, vol. 59, no 5, .
- ↑ Tomas Furmark, Lieuwe Appel, Åsa Michelgård, Kurt Wahlstedt, Fredrik Åhs, Stefano Zancan, Eva Jacobsson, Karin Flyckt, Magnus Grohp, Mats Bergström, Emilio Merlo Pich, Lars-Göran Nilsson, Massimo Bani, Bengt Långström, and Mats Fredrikson, « Cerebral Blood Flow Changes After Treatment of Social Phobia with the Neurokinin-1 Antagonist GR205171,Citalopram, or Placebo », BIOL PSYCHIATRY, vol. 58, .
Bibliographie
- Antonio Damasio, Le sentiment même de soi, Paris, Odile Jacob, 1999.
- Joseph LeDoux, « Émotion, mémoire et cerveau », Pour La Science, 1994, 202 : 50-57.
- (en) Joseph LeDoux The emotional brain, London, Weidenfeld & Nicolson, 1998.
- (en) Murray E., Wise S.P., « Interactions between orbital prefrontal cortex and amygdala: advanced cognition, learned responses and instinctive behaviors », Current Opinion in Neurobiology, 2010, vol. 20, 212-220; Science News, 2011, vol. 179 #5, p. 22, Bethesda, Md., National Institute of Mental Health.
- (en) Ledoux J. E., Muller J. (1997), « Emotional memory and psychopathogy », Phil. Trans. R. Soc, B 352 : 1719-1726.
- (en) Morris J.S., Friston K.J., Büchel C., Young A. W., Calder A. J., & Dolan R.J., « A neuromodulatory role for the human amygdala in processing emotional facial expressions », Brain, 1998, 121 : 47-57.
- (en) Morris J.S., Frith C. D., Perrett D. I., Rowland D., Young A.W., Calder A.J., Dolan, « A differential neural response in the human amygdala to fearful and happy facial expressions », Nature, 1996, 383 : 812-815.
- (en) Thomas K.M., Drevets W.C., Dahl R.E., Ryan N. D. Birmaher B. Eccard C.H., Axelson D. Whalen P. J., Casey B.J., « Amygdala response to fearful faces in anxious and depressed children », Anch Gen Psychiatry, 2001, 58 : 1057-1063.
- (en) Murray E., Wise S.P., Science News, 2011, vol. 179 #5, p. 22, Bethesda, Md., National Institute of Mental Health.