

Le dimorphisme sexuel est l'ensemble des différences morphologiques plus ou moins marquées entre les individus mâles et femelles d'une même espèce. Plus généralement, le dimorphisme sexuel peut porter : soit sur des caractères sexuels primaires (par exemple les organes génitaux), soit sur des caractères sexuels secondaires, qui peuvent être morphologiques (taille, pilosité, couleur du plumage ou du pelage, différence appelée dichromatisme sexuel…), physiologiques (métabolisme, odeur…) ou comportementaux (parade nuptiale, chant de certains oiseaux, construction du nid, socialisation…).
Lorsque ces différences ne peuvent se distinguer, les zoologues parlent de monomorphisme sexuel. Cette caractéristique peut être vue comme une adaptation en vue d'éviter la compétition[1].
L'origine évolutive de telles différences entre mâles et femelles d'une même espèce s'explique en général par la sélection sexuelle ou le conflit sexuel mais aussi par des pressions de sélection différentes liées à l'investissement parental.
Aspects évolutionnaires

Dans de nombreux cas, le dimorphisme sexuel apparaît en première analyse constituer un désavantage pour la survie du mâle. Par exemple, la coloration brillante des mâles dans le cas du gibier à plumes en fait des cibles plus repérables par les prédateurs, alors que les femelles de couleurs ternes sont mieux camouflées. De même, les bois de cerfs et d'autres caractères sexuels secondaires exubérants constituent un fardeau du fait qu’ils nécessitent une grande dépense d'énergie pour les faire croître et pour ensuite les porter. Néanmoins, dans la compétition pour conquérir les femelles, ces traits assurent ces dernières de la bonne santé du mâle.
Sélection sexuelle
En effet, si on se place au niveau évolutionnaire, le succès d'un organisme dans la reproduction est pour le mâle plus important que sa propre durée de vie : en termes de transmission génétique, le patrimoine d'un individu sera d'autant plus répliqué que cet individu engendre de descendants. Dans le cadre de la sélection sexuelle, les gènes qui favorisent un succès reproductif se propagent donc plus rapidement dans la population quand bien même les individus porteurs de ces gènes meurent rapidement après la reproduction. C'est particulièrement évident dans le cas du gibier à plumes : à l'état sauvage un faisan commun mâle ne dépasse pas le plus souvent 10 mois, tandis que les femelles vivent deux fois plus longtemps et élèvent seules les poussins. Le nombre de descendants d'un faisan mâle dépend donc moins de la durée de sa propre vie que du fait que les femelles le choisiront pour les féconder. Une coloration chatoyante est donc un signal pour la femelle que cet individu mâle est en bonne santé et qu'il a (jusqu'alors) réussi à échapper à ses prédateurs malgré ce handicap, ce serait donc un "bon" partenaire sexuel pour engendrer ses poussins car elle garantit ainsi à ses propres gènes qu'ils seront portés par des individus à haut potentiel reproducteur. Cette interprétation évolutionnaire a été développée dans le cadre de la théorie du handicap. D'autres auteurs[2] refusent ces hypothèses en considérant que c'est davantage la femelle qui perd ses couleurs (les oiseaux nichant dans des cavités restent aussi colorés dans les deux sexes) plutôt que le mâle qui acquiert des caractères particuliers. La nouvelle théorie évolutive du conflit sexuel, propose que l'extravagance des traits provient de l'affirmation de biais sensoriels et notamment de stimulus supranormaux.
Bien entendu, cette attirance des femelles pour certains attributs des mâles, et réciproquement, n'est pas une stratégie consciente : les individus sont simplement "attirés" par les attributs de l'autre sexe. Il se peut même que le dimorphisme sexuel résulte du fait que les caractères sexuels secondaires des individus d'un sexe les rendent simplement plus facilement détectables par les individus du sexe opposé, ce qui augmente leur probabilité d'être repérés dans l'environnement et donc, in fine, leurs chances de se reproduire.
A contrario, pour certaines espèces l'absence de dimorphisme favorise les mâles en diminuant la compétition d'approche aux femelles et par conséquent, augmente in fine les chances de reproduction. C'est par exemple le cas chez les busards des roseaux[3].
Parfois, le dimorphisme sexuel est bien marqué alors que les différences entre les sexes ne sont pas perceptibles par l'homme. Ce paradoxe s'explique notamment par le système visuel de l'animal qui perçoit d'autres couleurs (longueur d'onde UV ou infrarouge) que la vision humaine[4]. Ainsi, pour l'œil humain, le plumage des mésanges bleues, des perroquets ou des étourneaux mâles et femelles est quasiment identique ; mais il n'en va pas de même pour l'oiseau lui-même, en raison de ses capacités à percevoir la lumière ultraviolette[5].
Le dimorphisme sexuel chez les araignées (dimorphisme sexuel inversé avec des femelles généralement plus grosses que les mâles) a été expliqué par l'avantage que possèdent les petits mâles sur leurs rivaux de plus grande taille en termes de mobilité. En période de reproduction, les mâles deviennent tous errants, partant à la recherche d'une partenaire, les mâles les plus mobiles ayant plus de succès d'accouplement[6].
Compétition intra-sexe
Dans le cas des animaux qui vivent en harde comme les cerfs, le succès des cerfs mâles dans la reproduction est directement proportionnel au nombre de femelles sexuellement réceptives avec lesquelles il pourra s'accoupler. Les bois des mâles sont un exemple d'une arme sexuellement dimorphique avec laquelle les mâles les plus vieux luttent les uns contre les autres pour décider qui aura le droit de se reproduire, pendant que les plus jeunes peuvent s'accoupler. Là encore, malgré le coût en ce qui concerne la survie personnelle, la nature garantit que la jeunesse réussit le mieux à se reproduire et que l'espèce pourra ainsi transmettre leurs caractéristiques à la génération suivante.
Investissement parental

.png.webp)
La sélection sexuelle n'est pas la seule raison pour laquelle le dimorphisme sexuel existe. Chez les insectes en particulier, les femelles sont souvent plus grandes que les mâles. La raison serait l'énorme quantité d'œufs que les insectes pondent ; un corps plus grand permet à une femelle de pondre davantage. Dans certaines espèces, le dimorphisme peut être extrême : les mâles sont réduits à un état vestigial, vivant accrochés comme des parasites au corps de la femelle, qui peut être plusieurs centaines de fois plus grosse. Par exemple, chez les vers bonelliidés, la femelle, qui mesure plusieurs dizaines de centimètres, porte des dizaines de mâles mesurant quelques millimètres seulement qui n'ont même pas d'appareil digestif et qui ont uniquement un rôle reproducteur[7]. On retrouve aussi des cas similaires de dimorphisme extrême dans certaines espèces de lophiiformes[8].
Selon Robert Trivers, ces comportements parentaux et sexuels du mâle et de la femelle peuvent être expliqués par le principe de Bateman et l'anisogamie : un spermatozoïde est bien plus petit et bien moins coûteux à produire et à entretenir qu'un ovule, favorisant les mâles à en produire beaucoup et une compétition intrasexuelle plus violente. Cette anisogamie due à un investissement parental différentiel favoriserait les mâles les plus robustes et expliquerait le dimorphisme sexuel[9].
Séparation écologique
Par ailleurs, le dimorphisme sexuel permet aux mâles et aux femelles d'exploiter des ressources alimentaires différentes, ce qui augmente leur capacité collective à trouver de quoi se nourrir. Dans différentes espèces de pics, les mâles et les femelles ont des becs de grandeur et de forme différentes, ce qui permet aux deux sexes de trouver des insectes dans des couches différentes de l'écorce d'un arbre[10].
Mécanismes génétiques
Le dimorphisme sexuel est considéré comme un exemple classique de polymorphisme génétique, bien que le mécanisme qui le sous-tend varie selon les organismes. Il est souvent contrôlé par les gènes qui se trouvent sur les chromosomes sexuels. Par exemple, chez la mouche drosophile, la mutation d'un seul gène suffit à transformer le comportement sexuel des femelles qui se comportent alors comme les mâles.
Gynandromorphisme
Le gynandromorphisme est une anomalie présente chez certains insectes qui développent des parties femelles et des parties mâles. Le plus souvent de façon bilatérale, cette anomalie touche aussi les organes.
Indice de dimorphisme
Le dimorphisme sexuel est quelquefois quantifié par les biologistes au moyen de l'indice de dimorphisme, qui est d'habitude le rapport entre la masse moyenne de la femelle adulte et la masse moyenne du mâle adulte. Pour quelques espèces la masse n'est pas une mesure adéquate, c'est pourquoi on utilise plutôt un paramètre analogue comme le volume. Cet indice est communément désigné par le sigle SSDI, pour « sexual size dimorphism index » (index sexuel de dimorphisme de taille). Les espèces typiquement polygyniques ont tendance à avoir des rapports de SSDI élevés, tandis que les espèces qui sont typiquement polyandriques ont tendance à avoir des rapports plus bas.
Exemples
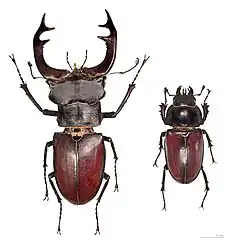

Dans quelques espèces, dont beaucoup de mammifères[11], le mâle est plus grand que la femelle. Le putois Mustela putorius mâle par exemple pèse presque le double du poids de la femelle. Dans d'autres, comme certaines araignées, certains oiseaux et de nombreuses espèces d'insectes, c'est la femelle qui est plus grande que le mâle ; on considère qu'une plus grande taille est un avantage pour porter ou pondre des œufs. Parmi les autres différences spécifiques au sexe on peut citer la couleur (la plupart des oiseaux), la taille ou la présence de parties du corps utilisées dans les combats pour la dominance, comme les cornes, les bois et les défenses ; la grandeur des yeux (les abeilles) ; la possession de dards (différentes sortes d'abeilles) et différents seuils pour certaines conduites (agression, soin aux jeunes, etc.).
D'autres exemples remarquables de dimorphisme sexuel se rencontrent chez les araignées (Arachnides : ordre des Aranéides), les mâles pouvant différer des femelles par la taille (mâles "pygmées"), la livrée, la conformation du céphalothorax et la présence d'organes glandulaires particuliers (glande clypéale des Argyrodes, glandes gnathocoxales, appareil épigastrique)
Un des exemples extrêmes de dimorphisme sexuel concerne de petits vers du genre Osedax, qui vivent sur les carcasses de baleines tombées au fond de l'océan. Les femelles se nourrissent des os de baleine. Les mâles vivent en colonie de quelques individus à plusieurs centaines à l'intérieur du tube créé par une femelle et ne se développent pas au-delà du stade larvaire et sont fertiles à ce stade. Le mâle de certaines espèces mesure de 0,2 à 1,1 millimètre, alors que la femelle qui les héberge mesure dans sa forme adulte quelques centimètres de long[12]. Cette particularité étrange s’explique simplement par le fait que l’évolution a eu pour résultat que la femelle seule quitte le stade larvaire et que la maturité sexuelle du mâle est acquise précocement.
Chez les oiseaux
Le dimorphisme sexuel est particulièrement net chez certaines espèces d'oiseaux comme le faisan. Les faisans mâles sont notablement plus grands que les femelles et possèdent un plumage brillant ; les femelles sont d'habitude d'un marron terne. Quelques cas de dimorphisme sexuel chez les oiseaux frappent tellement que les mâles et les femelles d'une même espèce ont été à l'origine considérés comme appartenant à des espèces entièrement différentes, comme c'est le cas du perroquet Eclectus (Eclectus roratus), où le mâle est majoritairement vert avec un bec orange et la femelle majoritairement écarlate avec un bec noir.
Le dimorphise sexuel du plumage du mérion superbe (Malurus cyaneus) a par le passé valu à l'espèce d'être considérée comme polygame, les oiseaux ternes étant systématiquement pris pour des femelles
Le huia dimorphe (Heteralocha acutirostris), une espèce d'oiseau de Nouvelle-Zélande qui a disparu en 1903, était un autre exemple frappant de dimorphisme sexuel. Le bec du mâle était court, pointu et gros et celui de la femelle long, fin et en forme de croissant. Ce dimorphisme du bec permettait aux couples de Huia de s'entraider pour leur nourriture ; le mâle agrandissait l'entrée des trous de larve de scarabée dans les arbres vivants, après quoi la femelle fouillait à l'intérieur du trou élargi pour retirer la larve. D'autres effets du dimorphisme de ces oiseaux n'avaient pas encore été vérifiés quand les huias ont disparu.
Chez les êtres humains

S'agissant des caractères sexuels secondaires, Homo sapiens, comme les autres mammifères, n'a pas un niveau de dimorphisme sexuel très élevé. Des études montrent qu’au cours de l’histoire humaine, le dimorphisme a été plus marqué lorsque la santé générale de la population était meilleure et qu’il s’est réduit lorsque la santé générale a été moins bonne[13].
La taille moyenne d’un homme est de 10% supérieure à celle d’une femme, cet écart se retrouve dans tous les groupes humains[14].
La différence apparait aussi au niveau des os, L'homme possède une mâchoire plus carrée et en général une ossature plus robuste où la femme aura une ossature liée à l'accouchement[15].
Il existe aussi un dimorphisme quant à la quantité et à la répartition des poils sur le corps : les hommes possèdent plus de poils terminaux, surtout sur le visage, la poitrine, l'abdomen et le dos, et les femmes ont davantage de poils sous forme de duvet, qui se remarquent donc moins. Un tel fait peut être mis en relation avec la néoténie chez les êtres humains, car le duvet est une caractéristique juvénile.
Galerie
 Stagmatoptera supplicaria - Muséum de Toulouse
Stagmatoptera supplicaria - Muséum de Toulouse Orgyia antiqua mâle et femelle Muséum de Toulouse
Orgyia antiqua mâle et femelle Muséum de Toulouse Canard mandarin mâle, et femelle
Canard mandarin mâle, et femelle Cerf élaphe mâle et femelle adultes.
Cerf élaphe mâle et femelle adultes. Mérion superbe mâle et femelle
Mérion superbe mâle et femelle
Notes et références
- ↑ (en) Mats Björklund, « The Adaptive Significance of Sexual Indistinguishability in Birds: A Critique of a Recent Hypothesis », Oikos, vol. 43, no 3, , p. 417 (DOI 10.2307/3544167)
- ↑ Thierry Lodé La guerre des sexes chez les animaux, Eds Odile Jacob, Paris 2006 (ISBN 2-7381-1901-8)
- ↑ « Chez les busards des roseaux, les mâles se déguisent en femelles », sur futura-sciences.com (consulté le ).
- ↑ (en) Staffan Andersson, Jonas Örnborg, Malte Andersson, « Ultraviolet sexual dimorphism and assortative 389 mating in blue tits », Proc. R. Soc. London B, vol. 265, no 445, , p. 445-450 (DOI 10.1098/rspb.1998.0315)
- ↑ L'Oiseau et ses Sens, Tim Birkhead, éd. Buchet-Castel, 2014 ; pages 24 et 57-59.
- ↑ (en) Volker W. Framenau, « Gender Specific Differences in Activity and Home Range Reflect Morphological Dimorphism in Wolf Spiders (Araneae, Lycosidae) », The Journal of Arachnology, vol. 33, no 2, , p. 334-346.
- ↑
- ↑ Arnqvist, Göran, Therésa M. Jones, Mark A. Elgar (2003)Reversal of sex roles in nuptial feeding. Nature 424:387
- ↑ Peggy Sastre, « Si les femmes sont plus petites que les hommes, ce n'est pas à cause du steak », sur slate.fr, .
- ↑ Extreme Sexual Dimorphism in Green Woodhoopoe (Phoeniculus Purpureus) Bill Length: a Case of Sexual Selection? Andrew N. Radford and Morné A. du Plessis, The Auk (janvier 2004) 121 (1):178-183
- ↑ Thierry Lodé, Les stratégies de reproduction des animaux, Dunod, Masson sciences, Paris, 2001
- ↑ (en) G. W. Rouse, S. K. Goffredi et R. C. Vrijenhoek, « Osedax : Bone-Eating Marine Worms with Dwarf Males », Science, vol. 305, no 5684, , p. 668–671 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.1098650, lire en ligne, consulté le )
- ↑ Clark, A. L. (2013). Human sexual dimorphism and health during the intensification of agriculture in prehistoric Thailand (Doctoral dissertation, University of Otago).
- ↑ (en) Alan R. Rogers et Arindam Mukherjee, « QUANTITATIVE GENETICS OF SEXUAL DIMORPHISM IN HUMAN BODY SIZE », Evolution, vol. 46, no 1, , p. 226–234 (DOI 10.1111/j.1558-5646.1992.tb01997.x, lire en ligne, consulté le )
- ↑ « Biodiversité et EDD: Le dimorphisme sexuel chez Homo sapiens : estimation du sexe à partir du crâne », sur edu.mnhn.fr (consulté le )
Source
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Sexual dimorphism » (voir la liste des auteurs).
