La capillarité est le phénomène d'interaction qui se produit aux interfaces entre deux liquides non miscibles, entre un liquide et l'air ou entre un liquide et une surface. Elle est due aux forces de tension superficielle entre les différentes phases en présence.
Exemples
On retrouve la capillarité lorsque les buvards aspirent l’encre, les éponges s’imbibent d’eau, ou quand on trempe une partie de son morceau de sucre dans son café et que ce sucre devient tout noir.
Bougie

Une bougie est constituée d'une mèche et de cire ou de stéarine. Lorsque l'on allume la mèche, l'air surchauffé fait fondre la cire qui monte alors le long de la mèche par capillarité. Au contact de la flamme les gaz émis brûlent, entretenant le phénomène.
Tube capillaire
Elle est plus connue pour l'effet d'un liquide à forte tension superficielle remontant contre la gravité dans un tube très fin, dit tube capillaire (car « aussi fin qu'un cheveu »). La tension superficielle est proportionnelle à la force de cohésion intermoléculaire du liquide concerné (qui elle-même dépend de sa composition chimique et des conditions physiques ambiantes). Plus les molécules du liquide ont une cohésion forte, plus le liquide est susceptible d'être transporté par capillarité.
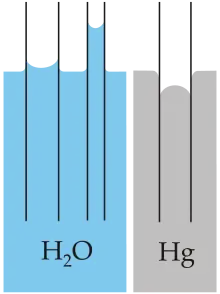
Lorsqu'un fin tube en verre est plongé dans de l'eau, les molécules d'eau sont plus attirées par le verre que par l'air : l'eau adhère aux surfaces du tube pour augmenter sa surface de contact avec le verre et diminuer sa surface de contact avec l'air, puis ses molécules sont attirées sur la partie de la surface du tube immédiatement au-delà, et par répétition de ce phénomène l'eau monte ainsi le long du tube comme représenté sur la figure (H2O), jusqu'à ce que la gravité qui s'exerce sur la colonne d'eau compense exactement l'effet d'attirance vers le haut. À l'inverse, le mercure (Hg) évite le contact avec le verre et descend dans le tube pour minimiser sa surface de contact avec lui. En effet, la force d'adhésion entre le verre et le mercure est plus faible que la force de cohésion entre les atomes de mercure. L’article tension superficielle décrit comment calculer la hauteur à laquelle monte ou descend le liquide dans un tube capillaire, grâce à la loi de Jurin.
La capillarité ne dépend pas du champ magnétique ou électrique local.
Voir aussi
Articles connexes
- Loi de Jurin
- Porosité
- Brasage
- Adhésion capillaire
- Mouillabilité
- Loi de Darcy
- Sève
- Électromouillage
Liens externes
Notes et références