

On appelle verre :
- un matériau dur, fragile (cassant) et transparent[alpha 1], à base de dioxyde de silicium[alpha 2] et de fondants[1]. Cette définition est celle du sens commun et c'était aussi celle des scientifiques jusqu'au xixe siècle[alpha 3]. Avant le xxe siècle en effet les verres silicatés (verres sodocalciques) étaient pratiquement les seuls matériaux transparents que l'on savait produire industriellement, et encore aujourd'hui ce sont les verres produits en plus grande quantité (vitrages, vaisselle et verrerie de laboratoire, notamment). Cette définition est porteuse de toute la symbolique établie de la transparence présentée par le verre[2] ;
- plus généralement, tout solide non cristallin présentant le phénomène de transition vitreuse. Cette définition, proposée par Jerzy Zarzycki[3],[4], est celle qui fait aujourd'hui consensus au sein de la communauté scientifique.
Les verres sont généralement obtenus par le refroidissement d'un liquide, suffisamment rapide pour empêcher la cristallisation. Pour certains matériaux — dits « vitrifiables » — il suffit d'une vitesse de refroidissement de l'ordre de quelques degrés par minute, pour d'autres il faut dépasser le milliard de degrés par seconde[5]. On peut aussi former des verres par déposition d'une vapeur sur un substrat froid[6].
Extensions du mot « verre »
La définition classique du mot « verre » (un matériau dur, fragile et transparent, à base de silice) est insuffisamment précise, notamment parce qu'elle inclurait le quartz parmi les verres. Le développement de nouveaux matériaux transparents, depuis un siècle, a rendu cette définition désuète et source de confusion, notamment parce qu'il est difficile de s'assurer qu'un matériau fragile et transparent est bien réellement dur et réellement fait de silice. L'exemple le plus flagrant est le verre de lunettes qui, bien qu'on l'appelle « verre » ne répond pas à la définition première : les verres actuels ne sont, ni particulièrement durs, ni à base de silice (ce sont des matériaux organiques). La glace de montre est couramment appelé "verre de montre" alors qu'elle n'est pas nécessairement faite de verre (elle peut être en "verre saphir" qui ne contient pas de silice et au sens scientifique n'est pas un verre).
On parle également de « perles de verre » pour des matériaux produits depuis plus de 3 000 ans, même si ces perles ne sont pas du tout transparentes (l'aspect vitreux suffit à leur attribuer le nom de verre). Il en va de même pour les millefiori produits depuis l'antiquité. La laine de verre n'a aucune nécessité d'être transparente, elle peut donc être juste translucide, voire noire (de même pour la mousse de verre). On nomme donc « verre » dans le langage courant des objets qui n'en sont pas faits, au sens de la définition commune du verre. À l'inverse, certains matériaux correspondent parfaitement à la définition commune du verre sans en être : outre le quartz certaines céramiques[7] sont des matériaux silicatés, durs, fragiles, transparents dans le visible mais ce ne sont pas des verres.
La communauté scientifique internationale donne donc une autre définition du verre : du point de vue physique, le verre est un matériau amorphe (c’est-à-dire non cristallin) présentant le phénomène de transition vitreuse. En dessous de sa température de transition vitreuse, qui varie fortement avec la composition du verre (plus de 1 000 °C pour la silice vitreuse, moins de 40 °C pour le sélénium amorphe), le verre se présente à l’état vitreux. Aujourd'hui, un grand nombre de solides amorphes sont regroupés sous le nom de « verre ». Ainsi, on fabrique non seulement des verres minéraux, mais aussi des verres organiques et même des verres métalliques[8].
Typologie
Il y a un peu plus d'un siècle, n'étaient considérés comme « verre », même pour la communauté scientifique, qu'un matériau ou un alliage dur, fragile (cassant) et transparent à la lumière visible (bien souvent même, ce terme est réservé à un alliage à base de silice). À cette époque, le verre était le plus souvent constitué de dioxyde de silicium (silice SiO2, le constituant principal du sable) et de fondants[1]. Dans le langage courant, cette définition persiste, car aujourd'hui encore, parmi tous les types de verre artificiels, le plus courant est le verre sodocalcique.
Il y a plus de quatre mille ans, les céramistes et chaufourniers égyptiens ont découvert qu'en chauffant de la silice SiO2 (sable), avec du natron, transformé en soude par dessèchement et purification, et de la chaux vive, ils fabriquaient une matière plus ou moins vitreuse et transparente. En ajoutant certains ingrédients ou poudres minérales colorées au mélange, ces premiers verriers obtenaient des verres spécifiques ou diversement colorés. Les proportions massiques du mélange de départ pour obtenir un verre stable à 650 °C sont d'environ :
- SiO2 70 % ;
- Na2O équivalent soude 15 % ;
- addition nécessaire de fondants : par exemple CaO 10 % et oxydes métalliques divers 5 %.
D'où l'esquisse sans stœchiométrie de la réaction chimique expliquant la formation concrète de matière vitreuse[alpha 4] :
- SiO2solide + Na2CO3solide + … -→ SiO2.Na2O…verre stable + CO2 gaz
Depuis les années 1920[9], on a constaté et mis en évidence, par la diffraction de rayons X (DRX), qu'une des spécificités des verres étaient leur absence de structure cristalline (« d'ordre ») détectable par cristallographie aux rayons X. Cette spécificité n'étant pas propre aux oxydes transparents, mais à tous les amorphes, on a, depuis les années 1920, rassemblé sous le terme « verre » la plupart des solides amorphes. Depuis le début du XXe siècle, nombre de définitions[10] ont permis d'élargir la définition désuète du verre (à travers leurs points communs : absence d'ordre, transition vitreuse, etc.) qui le limitait aux matériaux transparents à base d'oxydes. Ainsi, on fabrique non seulement des verres minéraux, mais aussi des verres organiques et même des verres métalliques[8]. On peut regrouper les verres inorganiques sous différentes classes, dont voici la liste exhaustive[11] :
- verres sodocalciques ;
- verres au plomb ;
- verres borosilicatés ;
- verres oxyazotés ;
- verres d'alumino-silicates ;
- verres de fluorures ;
- verres de phosphates ;
- verres de chalcogénures ;
- verres métalliques ;
- verre de quartz.
Parmi ces verres, beaucoup ne sont pas transparents (verres oxyazotés, verres métalliques…) ou du moins pas dans le visible (verres de chalcogénures). Il est par ailleurs aisé, sans avoir à rajouter des fractions volumiques importantes d'oxydes métalliques, de produire des verres silicatés faiblement transparents voire opaque. L'obsidienne est par exemple un verre volcanique silicaté généralement légèrement translucide, mais noir. Le verre de REFIOM est également un verre d'oxydes, qui n'a rien de transparent.
Histoire

Les verres les plus anciens se trouvent dans certaines météorites, sous la forme de petites veines résultant d'impacts[12] ou celle d'inclusions produites par condensation directe dans la nébuleuse solaire[13], et datent donc de jusqu'à 4,6 Ga (milliards d'années)[14]. Les astronautes d'Apollo 15 ont également ramené du sol lunaire des petites perles formées il y a plus de 3 Ga. Les verres terrestres les plus anciens, d'origine volcanique, sont des obsidiennes restées à l'état de verre depuis 75 Ma (millions d'années)[5].
Il y a environ 100 000 ans, l'homme utilisait déjà des tectites (des billes de verre formées par des impacts cosmiques) comme bijoux et taillait l'obsidienne pour fabriquer des pointes de flèches. Les premiers verres fabriqués par l'Homme sont des glaçures, qui apparaissent sur des céramiques dès le Ve millénaire av. J.-C., en Mésopotamie.
Science
Physico-chimie
Cette partie aborde le verre et ses caractéristiques d’un point de vue physico-chimique. Dans cette partie, nous limiterons notre étude à des verres d’oxydes. Cependant, il existe d’autres grands types de verres (en particulier ceux composés uniquement d’éléments métalliques) non transparents à l'optique mais au magnétisme, les verres métalliques amorphes et les verres de spin, composés cristallisés caractérisés par une absence d’ordre magnétique à grande distance (spin).
Structure
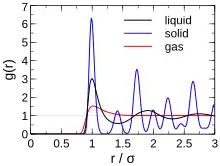
Le verre est un matériau amorphe, c’est-à-dire non cristallin. De ce fait, il présente un désordre structural important. Sa structure microscopique est telle qu’il n’existe aucun ordre à grande distance dans un verre. En cela, il est assez analogue à un liquide. Prenons l'exemple de l'eau pure, constituée de molécules d'eau (H2O). Si on isole chaque molécule d'eau, autour de chaque atome d'oxygène, on trouvera toujours deux atomes d'hydrogène : c'est un « ordre » (c'est reproductible d'une molécule à l'autre) à courte distance (à l'échelle de la molécule d'H2O). En revanche, si on prend deux molécules distinctes d'H2O en référence à un instant t et que l'on regarde leurs voisinages, c'est-à-dire l'emplacement exact des molécules d'H2O voisines, on obtiendra deux résultats complètement différents pour nos deux références. Il n'y a pas d'ordre à grande distance (à une distance supérieure à l'échelle de la molécule). On appelle fonction de distribution radiale, ou fonction de distribution de paires, la fonction donnant la probabilité de trouver une particule (dans cet exemple la molécule d'eau) entre un rayon r et r + dr de la référence. La diffraction de neutron permet, par exemple, l'évaluation des fonctions de distribution radiale d'un matériau, pour chaque élément, et montre des pics plus élargis pour des verres que des cristaux, soulignant le caractère aléatoire de la position des voisins de l'élément atomique de référence, dans les verres[15].
On retrouve dans les verres l'ordre à courte distance (à l'échelle maximale de quelques distances interatomiques), mais pas au-delà. Ce qui s'illustre par un premier pic fin de fonctions de distribution radiale comme pour un cristal, puis des pics de plus en plus élargis, contrairement à un cristal idéal.
Un verre peut même être vu comme un « réseau » tridimensionnel, semblable à celui d’un cristal, mais dans lequel seul l’ordre à courte distance est conservé. Comparons, par exemple, la structure du dioxyde de silicium (SiO2) cristallin (sous sa forme cristobalite) et celle de la silice vitreuse :
- Représentation schématique bi-dimensionnelle des états de la silice
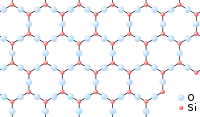 Silice cristalline (cristobalite).
Silice cristalline (cristobalite).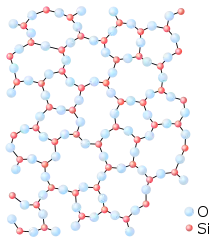 Silice vitreuse.
Silice vitreuse.
Dans les deux cas, chaque atome de silicium est lié à quatre atomes d’oxygène, formant ainsi des tétraèdres SiO4 (ordre à courte distance) ; chaque tétraèdre pouvant être considéré comme une « brique » de l’édifice final. Mais tandis que la cristobalite peut être définie comme un empilement régulier de ces briques SiO4 (elle a un ordre à grande distance), la silice vitreuse peut être considérée comme un empilement aléatoire de ces mêmes briques SiO4 (elle n'a plus d'ordre à grande distance).

En raison de sa structure amorphe, les verres produisent, en diffraction de rayons X, un halo de diffusion, contrairement aux cristaux qui donnent des pics étroits et intenses.
Principaux composants
En raison de sa structure amorphe, le verre est soumis à très peu de contraintes stœchiométriques. De ce fait, un verre peut inclure en son sein une très grande variété d’éléments et présenter des compositions très complexes.
Dans un verre d’oxydes, ces différents éléments sont sous une forme cationique, afin de former des oxydes avec l’anion oxygène O2−.
Les cations intervenant dans la composition de verres peuvent être classés en trois catégories selon le rôle structural qu’ils jouent lors de la vitrification (formation du verre) : les formateurs de réseau, les non-formateurs de réseau (ou modificateurs de réseau) et les intermédiaires. Les critères structuraux de cette classification prennent en compte le nombre de coordination (nombre d’atomes d’oxygène auxquels est lié le cation) et les forces de liaison.
Dans les verres non-oxydes (chalcogénures, verres métalliques, etc.), on ne peut pas parler en termes de formateurs/modificateurs de réseau. On peut en particulier réaliser des verres avec un unique élément, comme le verre de soufre ou le verre de sélénium (seuls éléments connus aujourd'hui pouvant former, seuls, un verre) : ces éléments ne sont donc classables ni comme formateurs, ni comme modificateurs. Une multitude de verres de chalcogénures peuvent être formés, dont germanium-sélénium, arsenic-sélénium, tellure-arsenic-sélénium[16]. Pour ces verres, on ne parlera pas en termes de formateurs/modificateurs de réseau. Les verres métalliques sont généralement formés à partir d'au moins trois atomes ayant de grandes différences de rayon atomique, de façon à rendre la cristallisation plus difficile, et l'obtention du verre possible avec des vitesses de trempe acceptables[alpha 5]. Les verres métalliques n'ont pas de liaisons covalentes, on ne parlera donc également pas en termes de formateurs/modificateurs de réseau.
Formateurs de réseau
Les formateurs de réseau sont des éléments qui peuvent à eux seuls former un verre. Les éléments formateurs les plus courants sont le silicium Si (sous sa forme oxyde SiO2), le bore B (sous sa forme oxyde B2O3), le phosphore P (sous sa forme oxyde P2O5), le germanium Ge (sous sa forme oxyde GeO2) et l’arsenic As (sous sa forme oxyde As2O3).
Ce sont des éléments métalliques de valence assez élevée (généralement 3 ou 4, parfois 5), qui forment des liaisons iono-covalentes (mi-covalentes mi-ioniques) avec les atomes d’oxygène. Ils donnent des polyèdres de faible coordinence (3 ou 4), comme SiO4, BO4 ou BO3. Ces polyèdres sont liés par leurs sommets et forment le réseau vitreux.
Modificateurs de réseau
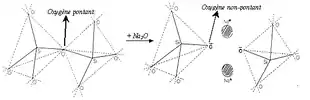
Les modificateurs de réseau (ou non-formateurs) ne peuvent pas former de verre à eux seuls. Ce sont essentiellement les alcalins, les alcalino-terreux et dans une moindre mesure certains éléments de transition et les terres rares.
Ils sont habituellement plus volumineux (rayon ionique plus important) que les formateurs de réseau, faiblement chargés et donnent des polyèdres de grande coordinence. Leurs liaisons avec les atomes d’oxygène sont plus ioniques que celles établies par les formateurs.
Ils peuvent avoir deux rôles structuraux bien distincts, soit modificateurs de réseau vrais, soit compensateurs de charge.
- Les modificateurs de réseau vrais cassent les liaisons entre les polyèdres du réseau vitreux, provoquant une dépolymérisation de ce dernier. Ils transforment alors les oxygènes pontants, qui lient deux éléments formateurs de réseau, en oxygènes non-pontants, liés à un seul formateur de réseau. Ceci se traduit à l’échelle macroscopique par une diminution du point de fusion et de la viscosité.
- Les compensateurs de charge, quant à eux, compensent une charge négative sur un polyèdre formateur de réseau, par exemple BO4−, lui permettant d’être stable dans cette configuration.
Intermédiaires
Les éléments intermédiaires ont différents comportements : certains de ces éléments sont soit formateurs, soit modificateurs selon la composition du verre, tandis que d’autres n’auront ni l’une ni l’autre de ces fonctions mais un rôle intermédiaire.
Les principaux éléments intermédiaires dans les verres d’oxydes sont l’aluminium Al, le fer Fe, le titane Ti, le nickel Ni et le zinc Zn.
Centres colorés


Des métaux et des oxydes métalliques peuvent être ajoutés lors du processus de fabrication du verre pour influer sur sa couleur.
- L’ajout d’une faible quantité de manganèse permet d’éliminer la teinte verte produite par le fer. À des concentrations plus élevées, il permet l’obtention d’une couleur proche de celle de l’améthyste.
- De même que le manganèse, le sélénium utilisé en faible quantité permet de décolorer le verre. Une quantité plus importante produit une teinte rouge. Le verre est teint en bleu par l’ajout d’une faible concentration de cobalt (0,025 à 0,1 %).
- L’oxyde d’étain et les oxydes d’antimoine et d’arsenic permettent de produire un verre blanc opaque. Ce procédé a été utilisé pour la première fois à Venise pour obtenir une imitation de porcelaine.
- L’ajout de 2 à 3 % d’oxyde de cuivre produit une couleur turquoise, alors que l’ajout de cuivre métallique pur conduit à un verre rouge très sombre, opaque, parfois utilisé comme substitut au rubis doré.
- Suivant la concentration utilisée, le nickel permet de produire des verres bleus, violets ou même noirs.
- L’ajout de titane conduit à un verre jaune-brun.
- L’or métallique ajouté à des concentrations très faibles (voisines de 0,001 %) permet d’obtenir un verre de couleur rubis, tandis que des concentrations plus faibles encore conduisent à un verre de rouge moins intense, souvent présenté comme « groseille ».
- De l’uranium (0,1 à 2 %) peut être ajouté pour donner au verre une teinte jaune, verte ou encore mauve, fluorescente (ouraline). Ce dernier n’est pas assez radioactif pour être dangereux. En revanche, s’il est broyé pour former une poudre, par exemple en le polissant avec du papier de verre, celle-ci peut être cancérigène par inhalation.
- Les composés à base d’argent (notamment le nitrate d’argent) permettent d’obtenir des teintes dans une gamme allant du rouge orangé au jaune. La couleur obtenue par l’ajout de ces différents additifs dépend de manière significative de la façon dont le verre a été chauffé et refroidi au cours du processus de fabrication.
La couleur des emballages en verre a une influence sur la conservation du contenu. Lorsque le houblon est exposé à une lumière riche en longueurs d'onde du bleu vers l'ultraviolet, il se forme du mercaptan, un composé chimique très odorant. Les bouteilles de bière sont souvent de couleur sombre, qui filtre ces longueurs d'onde. La couleur verte, qui filtre mal le bleu, est réservée aux bières pauvres en houblon[17].
Transition vitreuse
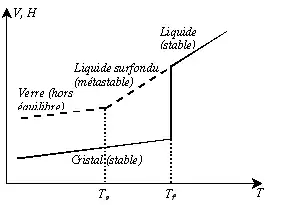
D’un point de vue thermodynamique, le verre est obtenu à partir d’une phase liquide surfondue solidifiée au point de transition vitreuse, Tv.
Pour une composition donnée, on s’intéresse à la variation d’une grandeur thermodynamique du premier ordre comme le volume occupé par cette phase (en maintenant la pression constante) ou une des fonctions thermodynamiques énergétiques molaires, comme l’enthalpie H, par exemple (on aurait aussi pu choisir l’énergie interne U).
Intéressons-nous au refroidissement d’un liquide. A priori, pour des températures inférieures à la température de fusion Tf (Tf dépend de la pression), l’état le plus stable thermodynamiquement correspond à l’état cristallisé (enthalpie la plus faible possible). À Tf, on observe alors une variation de H ou de volume : il s'agit d'une modification d'une grandeur thermodynamique du premier ordre, qui correspond à un changement d'état. Sous la Tf, on observe aussi un changement de pente de H (cette pente est beaucoup plus faible pour un solide que pour un liquide).
Mais si, lors du refroidissement du liquide, la viscosité est trop importante ou le refroidissement très rapide, la cristallisation n’a pas le temps de se produire et un liquide surfondu est alors obtenu. Aucune discontinuité de H n’est alors observée à Tf et sa pente reste inchangée. En poursuivant le refroidissement, la viscosité du liquide augmente de façon exponentielle et le liquide surfondu devient quasiment solide. Lorsqu’elle atteint 1013 poises, la rigidité empêche les mouvements microscopiques locaux et on observe un changement de pente de l’enthalpie : il n'y a pas de variation de grandeur thermodynamique du premier ordre, mais un changement de grandeur thermodynamique du second ordre comme le coefficient de dilatation, ou la capacité calorifique (qui s'observent par dilatométrie et calorimétrie différentielle à balayage respectivement). La température à laquelle se produit ce changement s’appelle température de transition vitreuse, Tv. La transition vitreuse est donc appelée « transition thermodynamique du second ordre » (par opposition à la fusion qui est une transition du premier ordre)[alpha 6]. La transition vitreuse résulte d'une perte de mobilité atomique au fur et à mesure du refroidissement. Elle n'est pas intrinsèque et dépend donc de la vitesse de refroidissement[11]: elle augmente si la vitesse de trempe augmente. Pour une température inférieure à Tv, le matériau est un solide avec le désordre structural d’un liquide : c’est un verre. Le désordre, et donc l’entropie, sont plus élevés dans un verre que dans un cristal. Sous la Tv, l'entropie (l'enthalpie ou le volume) varie de la même façon pour le verre et pour le cristal. Mais, en théorie, si le verre est refroidi suffisamment lentement, la Tv s'abaissant, par extrapolation de la variation d'entropie du liquide surfondu, on pourrait obtenir un verre d'entropie plus faible que le cristal équivalent : c'est ce que l'on appelle le paradoxe de Kauzmann (en). L'alternative à ce paradoxe reste débattue.
Le passage continu de l’état liquide à l’état vitreux se fait dans une plage de température délimitée par la température de fusion (Tf) et la température de transition vitreuse (Tv). La zone de transition vitreuse encadre Tv. En dessous de Tv, le verre devient « hors équilibre » : il s'éloigne de son équilibre thermodynamique, puisque les mobilités atomiques ne sont plus suffisantes (la viscosité augmentant) pour que l'équilibre soit atteint (il s'éloigne donc d'autant plus de l'équilibre que la vitesse de refroidissement est élevée). Hors équilibre, on dit que le verre est l'isostructural d'un liquide de température plus élevée (ce qu'on appelle la température fictive[18]). Le temps de relaxation nécessaire pour atteindre l’équilibre de configuration (l'équilibre thermodynamique) est alors supérieur au temps d’expérience. Ainsi, le verre est un matériau métastable, évoluant inévitablement vers l’état d'équilibre (jusqu'à ce que sa température fictive égale sa température effective).
Viscosité
Une des caractéristiques essentielles des verres est la possibilité de les mettre en forme par soufflage ou fibrage. Ceci vient du fait qu'en chauffant du verre, on va continuellement diminuer sa viscosité, alors que pour un solide cristallin, on observe une forte variation de viscosité au moment de la fusion. La glace a une viscosité à température légèrement négative, de l'ordre de 1014 Pas (calcul d'après les bandes de Forbes de la Mer de Glace[19]) alors que la viscosité de l'eau liquide est de l'ordre de 10−3 Pa s. L'eau est donc 100 millions de milliards de fois plus fluide que la glace, et il n'existe pas de forme de glace ayant une viscosité telle qu'on puisse la souffler comme le verre (il n'y a pas de glace à viscosité intermédiaire entre 1014 et 10−3 Pa s à pression ambiante). De même pour l'acier et n'importe quel métal courant. Lorsqu'on chauffe un verre, sa viscosité diminue continuellement, typiquement de 1045−50 Pa s, pour un verre à vitre à température ambiante[alpha 7], à 1–10 Pa s, à 1 500–1 550 °C. Il n'y a pas de variation brutale de viscosité car le verre n'a pas de transition thermodynamique du premier ordre (de température de fusion). On peut donc trouver une bonne température pour un verre, s'il ne cristallise pas, où il a exactement la bonne viscosité pour le souffler, le fibrer, le mouler, l'étirer, le couler ou le façonner de tout autre manière.
Certaines viscosités sont importantes d'un point de vue industriel et scientifique pour produire le verre. En chauffant progressivement le verre, on passe par des viscosités de[20],[21]:
- 1013,5 Pa s. point de recuit minimum (parfois "point de déformation" -strain point-). On ne peut pas recuire une verre à une température plus basse que celle où il a cette viscosité. Ce serait beaucoup trop long pour un processus industriel, le verre relaxant trop lentement ses contraintes
- 1012 Pa s. Pour un très grand nombre de verres d’oxydes, cette viscosité correspond à une température proche de la transition vitreuse mesurée par calorimétrie différentielle à balayage à 10 K/min.
- 1010 Pa s. Point de ramollissement dilatométrique : En dilatométrie, la température correspondante est mesurée par le maximum "virtuel" de dilatation. L’échantillon commence à se contracter sous le poids du support de mesure du dilatomètre (bien qu’il continue à se dilater, mais ça ne compense pas). À partir de là le verre va commencer à être malléable (pour avoir l’ordre de grandeur de cette viscosité, il faut imaginer que si la glace avait cette viscosité, la Mer de Glace s’écoulerait de plus d’une centaine de mètres par heure).
- 106,6 Pa s. Point de Littleton. un verre centimétrique commence à "s’effondrer", à une échelle de temps de quelques minutes (pour la mesure, elle est standardisée : ASTM C338, ISO 7884-3), sous son propre poids. Ce point définit la température au-dessous de laquelle on ne peut plus envisager de processus industriel pour mettre le verre en forme par écoulement.
- 104 Pa s. Point d’écoulement. Il est plutôt utilisé pour définir la "longueur" du verre, dont on parlera ensuite. A cette viscosité, il devient très compliqué de gérer l’écoulement du verre s’il n’est soumis qu’à son propre poids.
- 103 Pa s. Point de travail, selon le procédé. C’est la température où un procédé donné peut-être utilisé. 103 Pa s est la bonne viscosité pour le soufflage. Le point d’écoulement, en soit, n’a d’intérêt que s’il est comparé au point de travail.
- 101 Pa s. Point de fusion. Viscosité où le liquide dont sera issu le verre peut être homogénéisé et affiné.
On définit la "longueur" d'un verre par l'écart de température entre son point d'écoulement et son point de travail[22]. Un verre "long" est un verre qu'un souffleur de verre peut travailler pendant un long moment à l'air libre avant que sa viscosité ne devienne trop grande (puisqu'il refroidit). Un verre "court" est un verre qu'il ne peut travailler que pendant un court moment.
Un liquide qui s'ignore ?
Le verre est souvent décrit comme un liquide extraordinairement visqueux et son caractère de solide est souvent discuté[23]. Le verre est parfois décrit comme un liquide qui s'ignore, car il aurait la propriété de couler à température ambiante. Rappelons tout d'abord que cette propriété n'est pas propre au verre : la glace, par exemple, pourtant solide cristallin, s'écoule à l'échelle des temps humains avec une viscosité à −13 °C à peine supérieure à celle des verres à leur Tv[alpha 8]. Rappelons ensuite que le caractère solide, en rhéologie, ne se définit que par rapport au temps d'observation. Le temps de relaxation mécanique d'un corps est défini, au sens de Maxwell, comme le ratio entre sa viscosité et son module d'élasticité en cisaillement[24]. Il est de l'ordre de grandeur de l'inverse de la fréquence des mouvements atomiques associés à l'écoulement. Le nombre de Deborah est défini comme le ratio entre le temps de relaxation et le temps d'observation. Un corps est dit solide si ce nombre est très supérieur à 1, liquide sinon.
La plupart des verres silicatés ont des temps de relaxation à l'ambiante qui dépassent l'âge de l'Univers[alpha 7], et donc des nombres de Deborah très supérieurs à 1, même en considérant un temps d'observation de l'ordre de l'âge de l'humanité. Ce sont des solides au sens rhéologique. Ainsi d’après Daniel Bonn, du Laboratoire de physique statistique de l’ENS, si les vitraux des cathédrales ou les glaces de la Galerie des Glaces au château de Versailles sont plus épais à la base qu’à leur sommet, c’est du fait du procédé de fabrication utilisé, la partie la plus épaisse étant disposée vers le bas pour des raisons de stabilité[25],[26]. En revanche, certains verres, dont les verres de chalcogénures, ont des Tv relativement basses, proches de l'ambiante. C'est le cas du sélénium amorphe, ou sélénium noir[27] (Tv = 42 °C)[28], qui a un temps de relaxation à l'ambiante de l'ordre de 15 000 s (3,7 h). L'écoulement du sélénium amorphe s'observe donc facilement à température ambiante[29] bien qu'il soit sous sa Tv.
Cependant, bien que l'idée de « liquides figés » est la première chose assimilée au mot verre, ce n’est qu’une infime partie de ce que ce mot désigne d’un point de vue de la physique des matériaux. Cette image vient du fait que la méthode pour obtenir un verre la plus répandue est de fondre le matériau pour ensuite le refroidir rapidement et éviter la cristallisation, comme indiqué ci-dessus au paragraphe Principaux composants. Il existe d’autres méthodes d’amorphisation comme le broyage mécanique[30], concentration sans cristallisation (condensation d’une vapeur sur une surface froide ou concentration d’un soluté en solution)[31], lyophilisation[32] ou encore atomisation[33]. En français, on utilise parfois le mot « verre » uniquement pour les solides amorphes issus de trempe du liquide[34]. Un verre est, en réalité et d'un point de vue physique des matériaux, un matériau solide amorphe présentant le phénomène de transition vitreuse, quelle que soit la méthode d'obtention du verre utilisée. En anglais notamment, cette distinction n'existe pas.
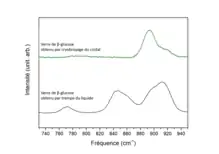
Il existe des différences structurales entre le liquide et l'amorphe pour certains matériaux. Le glucose possède deux formes anomériques, α et β. En spectroscopie Raman, il existe une zone appelée « anomérique », qui permet de différencier ces deux formes. Les spectres Raman des verres de β-glucose obtenus par trempe du liquide et par cryobroyage mécanique représentés ci-contre sont différents, avec la présence de bandes de vibrations dans le liquide trempé supplémentaires dues à la mutarotation du glucose[35] présente dans le glucose liquide. Cela démontre que structuralement, un verre issu d'une trempe d'un liquide et un verre issu d'un broyage mécanique peuvent être différents.
L'image de « liquide figé » est donc un cas particulier du solide amorphe. Le consensus actuel pour la définition du verre est « solide non-cristallin »[4].
Transparence
De nombreux verres sont transparents dans le visible, c'est notamment le cas de la plupart des verres silicatés, et c'est l'une des propriétés les plus exploitées des verres. D'autres sont transparents dans d'autres gammes de longueurs d'onde, comme les verres de chalcogénures. Le verre à vitre courant est transparent de l'UV jusqu'au moyen infrarouge[36], il ne transmet pas les UV-B et les UV-C. Ainsi, on peut bronzer derrière une vitre, puisque les UV-A sont transmis, mais très difficilement attraper des coups de soleil. Les verres qui sont transparents ne le sont toujours que dans une certaine gamme de longueurs d'onde, limitée aux basses longueurs d'onde par l'énergie de bande interdite et aux hautes longueurs d'onde par la coupure multi-phonon.
Les verres silicatés, du fait du silicium, possèdent une large bande interdite séparant la bande de valence de la bande de conduction (9 eV[37] pour la silice vitreuse, entre 1 et 3 eV pour les verres de chalcogénures). Pour qu'un photon soit absorbé par le verre, il doit avoir une énergie suffisante pour exciter les électrons de valence vers la bande de conduction. Si le photon a une énergie trop faible (une longueur d'onde trop grande) pour permettre à un électron de franchir la bande interdite, il est transmis et le verre est transparent à cette énergie de photon.
Du fait du désordre qui caractérise un verre, les bandes de valence et de conduction s'étendent dans la bande interdite (ils forment ce qu'on appelle des queues de bandes) et réduisent l'énergie séparant bande de valence et bande de conduction. La limite optique d'absorption (limite basse, en longueur d'onde, où le verre commence à transmettre) n'est donc pas abrupte (il n'y a pas un seuil précis d'énergie de photon pour laquelle la transparence commence) mais progressive, une fraction infime des photons pouvant être absorbés même à des énergies bien plus faibles que l'énergie de bande interdite. Cette zone de faible absorption correspond à la « queue d'Urbach »[38].
À la vibration du réseau atomique, on associe également une quasi-particule appelée « phonon ». Les phonons interagissent de diverses façons avec les photons (voir la diffusion Raman et la diffusion Brillouin). Des phonons peuvent interagir entre eux et générer un moment électrique qui affectera le rayonnement électromagnétique[39] : c'est ce que l'on appelle l'absorption multi-phonons. Aux longueurs d'onde élevées (énergies faibles), les verres ne transmettent donc plus du fait des interactions photons-phonons. Dans les verres silicatés, la vibration d'élongation de la liaison Si-O correspond à une longueur d'onde de 8,9 μm, et le verre absorbe donc énormément à cette longueur d'onde. Tellement que la première harmonique (fréquence double, donc longueur d'onde deux fois plus faible : 4,5 μm) produit déjà une très forte absorption[11].
La fréquence de vibration d'un réseau atomique, et donc l'énergie de phonon, est inversement proportionnelle à la masse des atomes[40]. Les éléments chalcogènes étant relativement lourds, ils repoussent la limite de transparence à de plus grandes longueurs d'onde (de plus faibles énergies) que les verres silicatés. Les verres de chalcogénures sont donc transparents plus loin dans l'infrarouge que les verres silicatés.
Chaque type d'impureté dans le verre va induire une ou plusieurs bandes d'absorption perturbant sa transparence ; pour le verre à vitre, le fer (ses oxydes) est l'impureté qui génère la teinte vert-bleutée que l'on peut déceler en regardant une vitre sur la tranche. Des verres de silice contenant énormément d'impuretés, comme le verre de REFIOM, ne sont pas transparents mais noirs.
Les verres métalliques (alliages métalliques amorphes) possèdent des électrons libres, ils sont conducteurs et n'ont donc pas de bande interdite. En conséquence, ils ne sont pas transparents.
Résistance chimique et altération du verre
Le verre industriel présente une bonne compatibilité avec la plupart des composés chimiques ; toutefois l’acide fluorhydrique (HF) dégrade facilement le verre.
Les verres ne sont pas insensibles à l’action de l’eau ou de l’air. L'eau affecte la plupart des propriétés du verre, comme par exemple sa viscosité[41]. Un des effets connus de l'eau sur le verre est la « propagation sous-critique »[42] : par réaction d'hydrolyse, les fissures se propagent progressivement dans les verres sous contrainte, ceci pouvant conduire à leur rupture à plus ou moins long terme. Bien sûr, cela n’empêche pas l’existence de verres ayant plusieurs millions d’années et non altérés, car la sensibilité des verres à l’altération dépend de leur composition chimique.
Résistance mécanique : fragilité
Le verre, au sens commun, apparaît comme un matériau fragile. Les verres silicatés, comme la plupart des verres d'oxydes ou de chalcogénures, sont effectivement fragiles à température ambiante dans le sens où ils peuvent être brisés sans la moindre déformation permanente (à l'inverse d'un matériau ductile, comme le plomb, qu'on peut déformer, plier, avant de le casser). Il est cependant possible de déformer un verre de façon permanente, sous haute pression : on parle de « densification »[43]. La silice vitreuse peut ainsi voir son volume réduit de près de 25 %. Le caractère fragile des verres, donc l'absence de mécanisme de déformation plastique à température et pression ambiantes, est dû à leurs liaisons atomiques fortes (covalentes ou ioniques en majorité). D'une manière générale, on s'attendrait à ce qu'un matériau ayant de fortes énergies de liaison soit très résistant mécaniquement, car il faudrait une grande énergie mécanique pour parvenir à rompre ses liaisons (le diamant est le matériau type qui soutiendrait cette idée). On sait aujourd'hui que la moindre rayure de surface sur ces matériaux peut être l'initiateur d'une fissure puis d'une rupture (cassure), par un phénomène de concentration de contrainte[44]. Comme il est quasi-inévitable qu'un matériau dur comme le verre présente des défauts anguleux en surface, ce qui compte pour caractériser sa résistance mécanique n'est pas son énergie de liaisons atomiques, mais sa ténacité, c'est-à-dire la résistance à la propagation de ces défauts. La ténacité des verres d'oxyde est relativement faible (0,5-1,0 MPa.√m), soit quasiment cent fois moins que les métaux courants[45]. La ténacité des verres silico-sodo-calciques peut cependant être considérablement augmentée par trempe thermique ou chimique. La plupart des écrans de smartphone et tablette tactile sont aujourd'hui des verres fins trempés chimiquement.
Éclatement spontané du verre
Il existe de nombreux témoignages de personnes ayant observé des récipients en verre qui "explosent tout seuls", sans qu'on les touche. Ce phénomène n'a rien de paranormal. Pour qu'un verre casse, il suffit qu'il présente une fissure, et qu'une contrainte de traction provoque la propagation de la fissure (c'est la base de la définition de la ténacité). Si la contrainte est trop faible, la fissure ne bouge pas. Toutefois, les verres silicatés sont sensibles à l'eau, et une réaction d'hydrolyse peut faire avancer la fissure dès lors qu'elle subit une contrainte de tension inférieure à ce seuil : on appelle cela de la propagation sous-critique[46]. La fissure peut alors avancer très lentement, nanomètre par nanomètre, sous le simple effet de l'humidité de l'air. La contrainte quant à elle peut venir d'un mauvais recuit du verre. Une fois que la fissure a atteint une taille critique ou qu'elle est entrée dans une zone de forte tension, la pièce en verre éclate. Suivant l'humidité, la température, l'histoire thermique du verre et la taille initiale de la fissure, le processus peut prendre des années.
Dans les verres trempés thermique, le phénomène peut en principe être évité. Néanmoins, les vitrages peuvent être sujets à une pollution de sulfure de nickel (NiS), venant des matières premières (calcite, dolomite)[47]. À la température de chauffe du traitement thermique, le NiS change de phase (α, stable à partir de 379 °C) et se contracte (de 2 à 4 %), et lors de la trempe, il n'a pas le temps de revenir à sa phase stable (β) à la température ambiante et reste en phase α. Mais cette phase étant métastable, elle revient progressivement à la forme β en grossissant à nouveau (ce qui peut demander beaucoup de temps), générant d'énormes contraintes dans le verre et son "explosion spontanée" longtemps après l'installation du vitrage.
Impacts de projectiles
Le verre, selon son épaisseur, sa composition et son mode de production, est plus ou moins résistant aux chocs, chutes et impacts.
Il a été montré[48] que pour un verre donné, le nombre de fissures en étoile compté autour d'un point d'impact (de balle par exemple) traduit la vitesse relative du projectile contre le verre au moment de l'impact. En cas d'accident ou d'utilisation d'arme à feu ayant percuté du verre, il devient donc possible d'obtenir des informations sur la vitesse du projectile (et donc sur la distance du tireur si on connait le type d'arme et de munition utilisées) ; selon des tests ayant porté sur des projectiles lancés à une vitesse de plus en plus élevée jusqu'à 432 km/h, plus la quantité d'énergie cinétique est importante, plus le nombre de fissures est important, avec une équation simple reliant ces deux paramètres. Inversement, on peut maintenant déduire aussi la vitesse d'un véhicule au moment d'un accident, par l'observation des fissures d'un phare ou pare-brise perforé lors de l'accident[48].
De plus, selon des mesures d'amateurs[49], la vitesse de propagation des craquelures au sein d'un verre trempé de 5 mm d'épaisseur est d'environ 1 458 m/s.
Calcul de propriétés
Valeurs représentatives
Les valeurs qui suivent ne sont destinées qu’à fournir un ordre de grandeur, car il existe plusieurs variétés de verres, des flints lourds (chargés en plomb ; masse volumique variant de 2 500 à 5 900 kg/m3) au verre à vitre standard (2 500 kg/m3) en passant par les crowns (de 2 200 à 3 800 kg/m3), etc.
| Propriété physique | Valeur | Unité |
|---|---|---|
| Masse volumique | 2 500[50] | kg/m3 |
| Module de Young | 69 000[50] | MPa |
| Coefficient de Poisson | 0,25[51] | |
| Limite d'élasticité | 3 600[50] | MPa |
| Résilience | de 1 500 à 2 500[52] | Pa |
| Coefficient de dilatation linéaire | de 0,5 à 15 × 10-6[52] | /°C |
| Conductibilité thermique | 1[51] | W m−1 K−1 |
Calcul par combinaison des propriétés de différentes phases
Les propriétés de verre peuvent être calculées par l’analyse statistique des bases de données de verre[53],[54], par exemple SciGlass[55] et Interglad[56]. Si la propriété de verre désirée n’est pas liée à la cristallisation (par exemple, la température de liquidus) ou à la séparation de phase, la régression linéaire peut être appliquée en utilisant des fonctions polynomiales communes jusqu’au troisième degré. Au-dessous figure une équation d’exemple du deuxième degré. Les C-valeurs sont les concentrations composantes de verre comme Na2O ou CaO en pourcentage ou d’autres fractions, les b-valeurs sont des coefficients, et n est le chiffre total des composants de verre. La composante principale de verre, le dioxyde de silicium SiO2, est exclue dans l’équation ci-dessous en raison de l’au-dessus-paramétrisation, due à la contrainte que tous les composants résument à 100 %. Beaucoup de termes dans l’équation ci-dessous peuvent être négligés au moyen de l’analyse de corrélation et de signification.
Propriété du verre =
Prédiction par apprentissage profond ("deep learning")
Les propriétés d'un verre étant assez difficiles à prédire, notamment par la difficulté de créer des modèles universels[57] pour chaque propriété, les solutions actuelles pour prédire des propriétés de verres et permettre le développement de nouveaux verres à propriétés spécifiques, s'orientent, depuis peu, vers l'apprentissage profond[58]. Schématiquement, le principe consiste à entraîner un réseau de neurone par apprentissage automatique (il s'agit d'intelligence artificielle) à déterminer les propriétés de nombreux verres (typiquement 100 000[57]) déjà connues, pour qu'il soit, par la suite, capable de prédire par extrapolation les propriétés de verres encore jamais élaborés. Cette méthode permet de s'affranchir de tout modèle physique que des décennies de recherche scientifiques n'ont toujours pas réussir à établir.
Verre naturel
Le verre naturel est tout type de verre formé naturellement. On distingue deux grandes familles : le verre biologique et le verre géologique.
Verre biologique

L’espèce produisant le plus de verre sur Terre n’est pas l'Homme, mais la famille des diatomées. En effet, ces algues unicellulaires sont protégées par une coque de verre[59] aux formes surprenantes et délicates. Constituant du plancton, ce verre a une densité considérable et bien supérieure à celle du verre produit dans l'industrie. Depuis 2008, les scientifiques commencent à identifier le détail de la synthèse : elle part des silicates présents dans l’eau de mer, et ils commencent à savoir reproduire en laboratoire des réactions similaires[60]. Cette fabrication a lieu dans des conditions physiques de la chimie douce, c’est-à-dire qu’elle ne nécessite ni température ni pression élevées.
L’intérêt majeur du verre pour la diatomée est de ne pas faire obstacle à la photosynthèse en laissant passer la lumière. Il est synthétisé très rapidement au moment de la méiose.
Verre géologique
De nombreuses roches silicatées, si elles sont refroidies suffisamment rapidement, ont tendance à vitrifier. On observe en particulier ce phénomène, sur Terre, auprès des volcans, où on peut par exemple observer la formation d'obsidienne, de pierres ponces (de composition généralement proche de l'obsidienne), de tachylyte, de palagonite.
Les fulgurites sont un autre exemple de verre naturel produit par un impact de foudre (généralement sur le sable). L'impactite se forme, elle, par l'impact d'une météorite. Sa forme la plus connue est le verre lybique[11]. La Lune possède également, à sa surface, de la roche vitrifiée par des impacts de météorites[11]. On parle alors de verre lunaire.

Contrairement aux impactites que l'on retrouve au sein du cratère, les tectites sont éjectées au moment de l'impact hors du cratère jusqu'à des distances pouvant atteindre 2 000 km[61]. A l'impact, l'encaissant rocheux et l'impactant sont fondus car la température dépasse typiquement 1 600 °C. L’atmosphère ayant été soufflée par le projectile météoritique lors de l’impact, les éléments de transition comme le fer sont principalement présents sous forme réduite[62]. Les éjectas fondus constitués d'un mélange d'encaissant et d'impacteur empruntent une trajectoire balistique à plusieurs km/s et subissent de faibles pressions. Au cours de leur trajet dans l'atmosphère, le liquide silicaté subit une trempe extrêmement rapide. Les tectites sont caractérisées par des morphologies diverses et parfois étonnantes (sphère, haltère, goutte, poire, larme, etc.) selon leur histoire thermique, leur vitesse de rotation et leur érosion après la retombée.
Les comètes seraient également constituées de « verre d'eau » ou glace amorphe[alpha 9].
Verre bioactif
Les verres bioactifs, ou bioverres, sont des matériaux utilisés en chirurgie réparatrice comme substituts osseux.
Autres verres
Par extrapolation, le nom de verre est employé pour d’autres matériaux amorphes.
Par exemple, des mélanges à base de fluorures de zirconium, baryum, lanthane et aluminium produisent des verres fluorés plus transparents dans l’ultraviolet et le proche infrarouge que le verre de silice. Ils servent donc à fabriquer des instruments optiques pour ces rayonnements[63].
Beaucoup de verres de lunettes sont fabriqués avec des verres organiques qui sont des polymères à base de carbone comme le polycarbonate de bisphénol A ou le polycarbonate d’allyle.
Certains alliages métalliques peuvent être solidifiés avec une structure amorphe grâce à un refroidissement très rapide, on les appelle alors des verres métalliques. On peut par exemple projeter le métal en fusion sur un tambour de cuivre tournant à grande vitesse. Ces alliages sont utilisés par exemple pour les cœurs de transformateurs. En effet leur cycle d’hystérésis est très faible, ce qui réduit considérablement les pertes.
On peut obtenir des dépôts d’alliages métalliques (Al-Cu-Fe) amorphe par dépôt sous vide.
Production
En dehors de films minces, déposés suivant diverses méthodes, le processus de synthèse de verre est très souvent le suivant : fusion, trempe et recuit[11] (la méthode de « fusion-trempe » ou melt quenching method, en anglais).
Fusion
Concernant les verres silico-sodocalciques, les éléments nécessaires à la synthèse du verre, généralement des oxydes (silice) et des carbonates (carbonates de calcium, de sodium) sont mélangés puis amenés à fusion. Pour le verre à vitre standard, on utilise du sable blanc, de la soude, de la chaux et du verre cassé (le calcin)[64] qu'on porte à 1 550 °C. La fraction de calcin dépend des apports disponibles. En pratique, on peut produire du verre avec 100 % de calcin[65]. Le verre est ensuite souvent affiné, surtout pour des volumes importants : on le débarrasse de ses bulles en le maintenant à haute température. La viscosité assez faible favorise alors la remontée des bulles à la surface. On peut également passer par un processus d'homogénéisation, en mélangeant par exemple le liquide, si les mouvements de convection au sein du liquide ne suffisent pas.
Trempe
Si le mélange en fusion est refroidi doucement, il aura tendance à cristalliser puisque le cristal est la forme solide la plus stable thermodynamiquement. Pour éviter la cristallisation et obtenir une structure amorphe, donc un verre, il faut refroidir violemment le liquide : on parle de trempe, bien que pour les verres, il ne s'agisse que rarement de plonger le mélange en fusion dans l'eau. Les verres silicatés sont le plus souvent trempés dans l'air (ramené brutalement du four de fusion vers l'air ambiant ou vers un autre four à plus basse température). Les verres métalliques nécessitent des trempes plus violentes, puisque le refroidissement doit parfois atteindre plusieurs milliers de kelvins par seconde. Les verres de chalcogénures dont la fusion est faite dans une ampoule de silice sont souvent trempés en plongeant l'ampoule dans l'eau ou la glace.
Recuit
La trempe induit un refroidissement plus rapide de la surface du verre (en contact avec l'air) que du cœur. La surface se refroidissant, se contracte, et se solidifie. Ce phénomène génère des contraintes dans le verre. Ce phénomène est bien connu lors des chocs thermiques : si on prend un plat en verre sorti du four à 200 °C et qu'on le met dans l'évier, sous un jet d'eau froide, il casse car la surface veut se contracter au contact de l'eau froide mais le cœur, chaud, l'en empêche. La surface est donc mis en tension brutale, ce qui entraîne la rupture. Lors de la trempe après fusion, la surface se contracte mais pas le cœur. Mais le cœur, très chaud, a une viscosité assez faible pour accommoder la contraction. Le verre ne casse donc pas, mais reste fortement contraint. Sans traitement, ces contraintes peuvent entraîner un éclatement du verre à long terme. On réalise donc un recuit, à température proche de la température de transition vitreuse pour que la viscosité du verre soit assez faible pour que les contraintes se relaxent en une à quelques heures, selon la nature et le volume de verre.
Si l'objet en verre se présente sous une forme fine, le recuit n'est pas indispensable, car le gradient thermique entre la surface et le cœur reste faible : les fibres optiques ou la laine de verre ne sont pas recuits.
Si un verre est mal recuit, les contraintes internes peuvent s'observer en lumière polarisée par photoélasticimétrie. Cette expérience peut être réalisé par tout un chacun : un écran d'ordinateur fournit la lumière polarisée, on place l'objet en verre devant et on le regarde avec des lunettes de soleil polarisantes: si un "arc-en-ciel" apparaît dans le verre, il est mal recuit.
Mise en forme
a.jpg.webp)
Le verre peut être mis en forme selon différentes méthodes qui peuvent être classées en continues et en discontinues :
| Classe | Procédé | Définition | Exemples |
|---|---|---|---|
| Discontinu | Soufflage | Verre creux | |
| Coulage dans un moule | Le verre fondu est versé dans un moule ayant la forme de l'objet à fabriquer. | Verre creux | |
| Pressage | Le verre fondu est comprimé dans un moule ayant la forme de l'objet à fabriquer. | Tube cathodique, verre creux | |
| Coulée par centrifugation | Verre creux | ||
| Continu | Laminage | Le verre fondu est passé entre deux cylindres lamineurs. | Verre plat (procédé peu utilisé) |
| Étirage | Verre plat (procédé peu utilisé), tube luminescent, fibre de verre | ||
| Flottage | Le verre fondu est versé sur un bain d'étain liquide et s'y étale en formant un ruban continu[66]. | Verre plat | |
| Coulage sur table | Le verre fondu est versé sur une table et laminé. | Verre plat (procédé peu utilisé) | |
| Extrusion |
Utilisation




Le verre à base de silice est utilisé essentiellement en optique pour ses propriétés réfringentes (lentilles, verres de lunettes) depuis le Moyen Âge.
Les verres d'oxydes sont connus pour leur application en optique dans le visible et le proche infrarouge (lentilles, prismes, miroir depuis le Moyen Âge; fibre optique moderne de télécommunication).
La transparence des verres silicatés en font un élément majeur dans le développement de l'énergie solaire moderne[67],[68]. Les verres de chalcogénures se développent aujourd'hui pour des applications d'optique infrarouge, dont la vision nocturne, la spectroscopie infrarouge par onde évanescente[69], des applications d'holographie, d'optoélectronique[70]…
Il est également utilisé en chimie et dans l’industrie agroalimentaire : il réagit très peu avec la plupart des composés utilisés dans ces domaines, c’est donc un matériau idéal pour les contenants (bouteilles, pots de yaourt, béchers, erlenmeyers, colonnes de distillation, éprouvettes, tubes à essai). Un des seuls liquides ayant le pouvoir de dissoudre efficacement le verre est l’acide fluorhydrique (HF).
Le verre est le matériau dans lequel sont confinés les déchets radioactifs de haute activité (HAVL) par le procédé de vitrification. Étant désordonné, le verre supporte en effet bien les radiations sur le long terme, à l'inverse des métaux dont la structure a justement tendance à s'amorphiser et donc à perdre ses propriétés mécaniques sous irradiation. De plus, le verre vieillit très bien à l'échelle géologique, même en présence d'eau.
Le verre est aussi un matériau de construction très important dans l’architecture. En dehors des vitrages en verre flotté habituels depuis le milieu du XXe siècle, la brique de verre utilisée depuis une centaine d'années réalise des parois translucides horizontales et verticales ; elle a pour origine la dalle de verre carrée antique[71]. La pâte de verre a remplacé les éléments de céramique issus de la mosaïque sur les façades dans l'architecture moderne, sur les étanchéités des piscines ; en 2019, les salles de bains « raffinées » remettent à la mode ce matériau. Le verre est notamment présent maintenant sous forme de laine de verre, isolant léger, imputrescible et ininflammable.
Les fibres de verre à base de silice jouent un rôle important dans les ouvrages d'art actuels par des guides optiques véhiculant l'information des différents capteurs permettant la surveillance continue des ouvrages[72].
Le verre est aussi un matériau très important dans l’actuelle industrie automobile.
Les verres de chalcogénures sont également massivement utilisés dans le DVD où ils sont supports de l'information[69]. Le verre est également présent dans les éléments de haute technologie du quotidien : disques durs, écrans tactiles[73], verres autonettoyants, et les industriels du verre envisagent de multiples applications futures[74].
Certains métaux peuvent être solidifiés sous forme amorphe, « verre métallique ». Les verres métalliques se sont également introduits dans les articles de sports (raquettes, skis, battes)[75].
Du fait de leur isotropie, ces métaux ont des propriétés non-magnétiques intéressantes notamment spécifiquement pour la construction de sous-marins furtifs. Ils ont également une grande dureté et une très bonne tenue à la corrosion.
Dans de nombreuses applications, le verre est actuellement remplacé par des matières plastiques, plus légères et souvent plus résistantes au choc.
On peut le rencontrer sous forme de microbilles, de fibres (coupées ou non), de mats (fibres disposées « en vrac ») ou de tissus (mode de tissage « taffetas », par exemple). Incorporées dans la matrice polymère ou déposées en surface, ces présentations sont utilisées notamment comme renfort (fibreux[alpha 10] ou non) de résines thermoplastiques (polyamides) ou thermodurcissables (polyesters, époxydes) dans les plastiques, ainsi que dans les matériaux composites.
Les utilisations artistiques du verre sont innombrables depuis des siècles. Dans l'art actuel, on trouve aussi bien la glace brisée et recuite[76] que les robes de haute couture lumineuses. Elles ont accompagné ou nécessité de nombreuses innovations techniques (vitraux en verre non sodique médiévaux[71], pâte de verre, fusing, thermo-formage, etc.).
Types de verres industriels
- Verre plat :
- Verre « float » ou verre flotté.
- Verre coulé.
- Verre creux :
- Verre moulé : utilisé surtout pour fabriquer des bouteilles et de la vaisselle.
- Verre étiré : produit semi-fini permettant de réaliser des ampoules, des flacons ou de la verrerie de laboratoire.
Le verre peut subir des modifications pour le renforcer et le sécuriser :
- Verre trempé :
- Trempe thermique : des traitements thermiques permettent d’améliorer la résistance des pièces : les vitres latérales et arrières des automobiles comme certaines pièces d’ameublement sont trempées par un refroidissement rapide et contrôlé, le plus souvent par de l'air.
- Trempe chimique : ce type de trempe a lieu en remplaçant par diffusion une partie des ions alcalins par d'autres ions alcalins de plus gros rayon ionique. Par exemple le sodium ou le lithium du verre par des ions potassium.
- Verre feuilleté : composé de couches verre-plastique-verre ou plus. Les pare-brises des automobiles et les vitres blindées sont en verre feuilleté. Ainsi, lors d’un choc, le pare-brise se casse, mais reste en place. Les passagers risquent moins d’être blessés par des bris. Le verre blindé ayant huit couches de plastique peut résister à 70 coups de hache avant d'être traversé.
Le verre peut aussi subir des traitements de surface, le plus souvent des dépôts :
- verre antireflet : verres de lunettes de vue ;
- verre hydrophobe : pare-brises et miroirs…
Techniques artisanales du verre
La verrerie constitue une activité artisanale.
- Travail du verre à la flamme « souffleur de verre au chalumeau » : les verriers travaillent à partir de tubes et de baguettes de verre étiré qu’ils ramollissent à l’aide de la flamme d’un chalumeau pour le transformer par le souffle ou par différents outils. En France, le travail du verre soufflé, à la flamme, pour la réalisation d’objets décoratifs ou utilitaires[alpha 11], ou de pièces uniques est pratiqué par plusieurs artisans.
- Verre soufflé : les souffleurs de verre font chauffer une boule de verre en fusion prise au bout d’une canne dans laquelle ils soufflent pour faire gonfler le verre et réaliser une boule vide. Ensuite, ils étirent, aplatissent, percent cette boule pour lui donner sa forme finale. Une fois durci, certains le dépolissent pour réaliser des motifs.
- Verre bombé : déformé à la température de ramollissement (environ 600 °C) sur la courbure d'un moule, ce procédé de bombage peut être combiné à la trempe, au feuilletage, de manière artisanale (bombeur de verre fabriquant des lampadaires, vitrines d'argentier, globes d'horloges) ou industrielle (pare-brise et lunettes automobiles, miroirs optiques)[77].
Depuis l'Antiquité, les artistes-peintres ont adopté la feuille de verre comme support pour peindre; entre autres la peinture sur verre inversé (ou peinture sous verre ou peinture sur verre) est une technique artistique difficile qui s'exécute directement sur une feuille de verre. Le verre supporte la peinture comme le ferait une toile. Soudée au verre, c'est à travers ce support que l'on contemple l'œuvre. Ainsi le verre sert à la fois de support et de vernis protecteur. Précisons que c'est une technique de peinture à froid de sorte que le procédé n'exige pas de cuisson au four. Le pigment est lié au verre par un véhicule huileux le plus souvent à base de vernis. Une grande partie des couleurs utilisées avant notre époque est actuellement interdite à l'emploi (santé des verriers).
Terminologie
- Cristal : verre à haute teneur en plomb qui lui donne un éclat plus intense et se travaille de façon similaire au verre. Pour mériter l’appellation de cristal, la concentration en oxyde de plomb doit être comprise entre 24[alpha 12] et 56 %.
- Pâte de verre : le moule de la pièce à réaliser se fabrique dans un matériau réfractaire (à base de kaolin par exemple) selon diverses techniques dont la cire perdue. Après cuisson, selon des paliers de chauffe destinés à éviter les fissures, le moule est refroidi et garni de poudres ou de granulés de verres colorés diversement selon le décor recherché. Une nouvelle cuisson a lieu et, après refroidissement, le moule est détruit délicatement par un moyen chimique ou mécanique pour dégager la pièce dont la forme et les couleurs auront été parfaitement contrôlées. Cette technique, attribuée aux Égyptiens, a été réinventée presque simultanément par Henry Cros, François Décorchemont et Georges Despret dans la deuxième partie du XIXe siècle. Almaric Walter, Gabriel Argy-Rousseau s’y sont illustrés.
- Thermoformage : cette technique consiste à poser à froid une (ou plusieurs) feuilles de verre, éventuellement colorées, sur un réfractaire dont elle épousera le relief à la cuisson.
- Fritte : composition de verre, pouvant être colorée (à l’aide d’oxydes métalliques), portée à fusion et trempée dans un bain d’eau froide afin de la réduire en granulés servant à l’élaboration d’émaux ou de « ballottes » (barres) colorées, matériaux de base des verriers.
- Cueiller : action de prélever une masse de verre dans le four à l’aide d’une canne ou d’un pontil.
- Pontil : tube métallique plein, le pontil permet une mise en forme au « marbre » ou à l’aide de divers outils. Il sert aussi à la séparation de l’objet de la canne afin de percer et travailler le col, à rapporter des éléments de décor, des anses, un pied.
Recyclage

Le verre, s’il est bien trié (tri sélectif), peut se recycler indéfiniment sans perdre ses qualités, et un verre peut être produit à 100 % à partir de verre recyclé[65]. Dans certains pays tels que l'Allemagne, la Belgique, la Suisse ou les pays nordiques, le tri peut différencier le verre blanc, vert et brun pour un recyclage plus performant, et les bouteilles consignées puis réutilisées sont plus fréquemment choisies par les producteurs et consommateurs.
Le grésil et le verre pilé issu de la collecte (souillé par des poussières et d'autres déchets) et du nettoyage des routes et sols imperméabilisés urbains sont toutefois refusés par les verreries. D'autres usages leur sont recherchés ou sont testés afin de ne pas avoir à continuer à les envoyer en décharge ou incinérateur[78],[79]). Il peut servir comme élément décoratif (verre de couleur) dans le béton[80],[81].
Dans l’asphalte, par exemple en Guyane, depuis fin 2006, les déchets de verre (70 t collectées de fin 2006 avec un premier chantier-test mi 2007 au centre de Cayenne) sont utilisés en fond de couche routière sous forme de verre pilé. Il faut 4 600 t de verre pour 30 km de route. Ce type de réutilisation peut cependant poser des problèmes de dangerosité (lors des chantiers[82] et peut-être pour la faune fouisseuse).
Refonte

Les bouteilles de verre usagées peuvent être fondues. La matière ainsi récupérée permet de fabriquer de nouvelles bouteilles.
Le verre peut également être produit à partir de calcin (verre broyé) de récupération. La fabrication du verre à partir de calcin de récupération économise des matières premières et de l’énergie et réduit les émissions de dioxyde de carbone issues des carbonates utilisés en matière première. La production d'une tonne de verre à partir de verre recyclé émet au total (CO2 provenant des carbonates et CO2 produit par les dépenses énergétiques) 500 kg de dioxyde de carbone de moins que sans calcin[83].
Avant d’être refondu, le verre subit différents traitements : broyage, lavage, élimination des colles, étiquettes, capsules, séparation du verre et des métaux et élimination des rebuts (porcelaine, cailloux, etc.).
En France, le gros du verre est récupéré sous forme de verre brisé. 77 % des bouteilles commercialisées en France vont être recyclées, pour constituer de 65 à 90 % de la matière première de bouteilles suivantes[83]. Le verre consigné est récupéré dans l'ensemble des bars et cafés, ainsi que pour les bouteilles de bière en vente publique en Alsace. L'agence de l'environnement et de la maîtrise de l'énergie (Ademe) pense que le bénéfice de la consigne de contenants en verre n'est pas évident, compte tenu des circuits d'approvisionnement assez longs en France[84].
Consigne
Avec ce système les bouteilles sont récupérées entières, moyennant une contrepartie financière, lavées puis réutilisées.
En Europe, la consigne du verre re-remplissable est autorisée à la discrétion des États membres, à condition de ne pas générer de distorsions de concurrence et dans le cadre d'une politique de protection de l’environnement[84].
L’Allemagne et la Belgique ont privilégié la consigne. Le Canada utilise un système similaire à l’Allemagne et a uniformisé le format des bouteilles de bière pour faciliter une réutilisation plus rentable et facile par diverses compagnies.
Entretien et restauration du verre
Le verre peut se cristalliser et devenir plus ou moins opaque voire pulvérulent.
Les verres de fouille peuvent s'iriser au contact des substances présentes dans le sol.
Des dépôts ou des altérations chimiques peuvent modifier sa surface.
Les verres supportent en général une savonnée légère. Attention cependant aux dorures qu'il vaut mieux ne pas frotter.
En principe, la corrosion du verre est liée à la présence des ions H+ dans H2O.
Les fêlures sont sans solution et les collages sont généralement visibles à cause d'une différence d'indice de réfraction. Les colles cyanoacrylates et les silicones donnent parfois des résultats satisfaisants mais on leur préfère des colles époxyde pour leur plus grande stabilité, leur indice de réfraction proche de celui de certains verres et leur basse viscosité. Autrefois, on utilisait surtout le baume du Canada.
Économie
Dans la culture
Le verre est un des premiers matériaux mis au point. Il est le symbole de la fragilité, la finesse et la transparence[2] : par exemple, la pantoufle de verre de Cendrillon dans le conte de Charles Perrault et le dessin animé de Walt Disney. Il est souvent considéré que dans le conte original, la pantoufle était de vair, mais Perrault a écrit sa version de l’histoire avec une pantoufle de verre[85],[86], le dessin animé reprend également cette idée.
Dans l'univers des Elder Scrolls, le verre est un minerai volcanique précieux utilisé pour forger en particulier des armes et des armures. Elles sont efficaces, mais paradoxalement fragiles. Cependant, dans le dernier opus, Skyrim, aucune précision n'est donnée sur sa solidité, étant donné que la dégradation de l'équipement n'est plus prise en compte dans le jeu.
Notes et références
Notes
- ↑ Quand on dit que le verre est transparent, on parle de la lumière visible, car le verre peut être opaque à d'autres longueurs d'onde.
- ↑ La silice, de formule chimique SiO2, est le constituant principal du sable.
- ↑ On peut retrouver facilement, dans la littérature scientifique du XIXe siècle, cette définition du verre, par exemple dans ce compte-rendu de conférence : Henderson, C. H. (1887), Glass-making, Journal of the Franklin Institute, 124(3), 199-224.
- ↑ S'il chauffe le mélange stœchiométrique soude-silice, sans fondant, donc moins fusible, l'opérateur obtient au-delà de 1 000 °C au four à charbon le métasilicate de sodium, matière sèche, soluble dans l'eau nommée « water glass », connue pour son usage antique comme desséchant, revêtement anti-feu, poudre protectrice des œufs, détergent. La réaction chimique est la suivante :
- Na2CO3solide + SiO2solide -→ Na2SiO3métasilicate anhydre, solide + CO2 gaz.
- ↑ Voir Alliage métallique amorphe, notamment les sections « Histoire » et « Méthodes de trempe ».
- ↑ Si une dérivée première de l'enthalpie libre par rapport à la température subit une variation brutale, il s'agit d'une transition du premier ordre, si une dérivée seconde de l'enthalpie libre (coefficient de dilatation, capacité calorifique, compressibilité) subit une variation brutale, il s'agit d'une transition du second ordre. Voir : Jo Perez, Matériaux non cristallins et science du désordre, PPUR, 2001.
- 1 2 Edgar Dutra Zanotto, Do cathedral glasses flow ?, American Journal of Physics, mai 1998, vol. 66, no 5, p. 392-395. Selon Zanotto, le temps de relaxation d’un verre serait supérieur à 1032 années, ce qui correspond à une durée dix mille milliards de milliards de fois supérieure à l’âge de l’Univers.
- ↑ Voir Viscosité.
- ↑ Voir Glace amorphe de haute densité.
- ↑ Les renforts fibreux sont caractérisés par leur grammage (poids de fibres au mètre carré).
- ↑ Par exemple, le formage des tubes en y introduisant un gaz rare appelé néon.
- ↑ Voir Composition du cristal.
Références
- 1 2 Informations lexicographiques et étymologiques de « verre » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales et étymologiques de « verre » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales
- 1 2 Cnrtl, verre, définition « maison de verre [égale] information ouverte et disponible ».
- ↑ « Jerzy Zarzycki » (consulté le ).
- 1 2 Jerzy Zarzycki, Les verres et l'état vitreux, Masson, , 391 p. (ISBN 978-2-225-69036-5).
- 1 2 (en) Ludovic Berthier et Mark D. Ediger, « Facets of glass physics », Physics Today, vol. 69, no 1, , p. 40-46 (DOI 10.1063/PT.3.3052, lire en ligne
 , consulté le ).
, consulté le ). - ↑ (en) Stephen F. Swallen, Kenneth L. Kearns, Marie K. Mapes, Yong Seol Kim, Robert J. McMahon et al., « Organic Glasses with Exceptional Thermodynamic and Kinetic Stability », Science, vol. 315, no 5810, , p. 353-356 (DOI 10.1126/science.1135795).
- ↑ La cristallisation dans les verres application aux vitro, L'actualité chimique.
- 1 2 Traité des matériaux - Volume 1 - Introduction à la science des matériaux, PPUR, 1999 (ISBN 2-88074-402-4), p. 64 ; plus de détails sur les substances vitrifiables p. 205-210.
- ↑ Rossington, D. R. (1972), Surface chemistry of glass. In Introduction to Glass Science, p. 513-543, Springer US., p. 3
- ↑ Parks, G. S., Huffman, H. M. et Cattoir, F. R. (1928), Studies on glass. II. The transition between the glassy and liquid states in the case of glucose, The Journal of Physical Chemistry, 32(9), 1366-1379
- 1 2 3 4 5 6 Barton, J. et Guillemet, C. (2005), Le verre, science et technologie, L'Éditeur : EDP Sciences.
- ↑ (en) Ming Chen et Ahmed El Goresy, « The nature of maskelynite in shocked meteorites: not diaplectic glass but a glass quenched from shock-induced dense melt at high pressures », Earth and Planetary Science Letters, vol. 179, nos 3-4, , p. 489-502 (DOI 10.1016/S0012-821X(00)00130-8).
- ↑ (en) Maria Eugenia Varela, Nicole Metrich, Michelle Bonnin–Mosbah et Gero Kurat, « Carbon in glass inclusions of Allende, Vigarano, Bali, and Kaba (CV3) olivines », Geochimica et Cosmochimica Acta, vol. 64, no 22, , p. 3923-3930 (DOI 10.1016/S0016-7037(00)00478-6).
- ↑ (en) James N. Connelly, Yuri Amelin, Alexander N. Krot et Martin Bizzarro, « Chronology of the Solar System’s Oldest Solids », The Astrophysical Journal, vol. 675, no 2, , article no L121 (DOI 10.1086/533586
 ).
). - ↑ P. Bordet, « Étude de la structure locale par la fonction de distribution de paires », sur https://www.neutron-sciences.org, Collection SFN9(2008) 139–147 ©EDP Sciences, Les Ulis (consulté le )
- ↑ Popescu, M. A. ; Science, S.-S. et Library, T. (éds.), Non-Crystalline Chalcogenides Kluwer, Academic Publishers, 2000
- ↑ « Bouteille de bière : pourquoi ont-elles cette couleur ? », sur La couleur des bouteilles de verre (consulté le )
- ↑ Tool, A. Q., Relation between inelastic deformability and thermal expansion of glass in its annealing range, Journal of the American Ceramic Society, 1946, vol. 29, p. 240-253
- ↑ Frédéric Chambat, « Viscosité d’un glacier et bandes de Forbes, Petit amusement de mécanique des fluides géophysiques », sur http://frederic.chambat.free.fr, ENS Lyon
- ↑ (en) « Glass-Viscosity-Fixpoints », sur https://glassproperties.com
- ↑ (en) Juejun Hu, « Viscosity of glass (Lecture of the MIT) », sur https://ocw.mit.edu
- ↑ (en) J. David Musgraves, Juejun Hu, Laurent Calvez, Springer Handbook of Glass, Springer,
- ↑ Philip Gibbs, « Le verre est-il un solide ou un liquide ? », octobre 1996.
- ↑ J.C. Maxwell, Philos. Trans. 157 (1867) 49.
- ↑ « L'obscure nature du verre », sur cnrs.fr
- ↑ Aurélien Ledieu, Les verres coulent-ils ?, Pour la science, no 383, septembre 2009, p. 20
- ↑ « Sélénium 1. Allotropie et propriétés physiques », sur universalis.fr
- ↑ (en) Creep of selenium near the glass temperature [PDF], sur polymerphysics.net
- ↑ (en) Böhmer, R. et Angell, C. A., Elastic and viscoelastic properties of amorphous selenium and identification of the phase transition between ring and chain structures, Physical Review B, 1993, 48, 5857-5864
- ↑ Perez Jo, Matériaux non cristallins et science du désordre, PPUR, , 557 p. (ISBN 978-2-88074-485-4, OCLC 49287083, lire en ligne)
- ↑ M. Descamps, « États amorphe et vitreux des composés moléculaires et pharmaceutiques - Propriétés générales », Techniques de l'ingénieur,
- ↑ Alain Hedoux, « Lyophilisation de produits pharmaceutiques et biopharmaceutiques », Techniques de l'ingénieur,
- ↑ (en) Tomaž Einfalt, Odon Planinšek et Klemen Hrovat, « Methods of amorphization and investigation of the amorphous state », Acta Pharmaceutica, vol. 63, no 3, (ISSN 1846-9558, DOI 10.2478/acph-2013-0026, lire en ligne, consulté le )
- ↑ Jean Phalippou, « Verres - Aspects théoriques », Techniques de l'ingénieur,
- ↑ Nicolas Dujardin, Vitrification à l’état solide du glucose et maîtrise de la mutarotation, Villeneuve d'Ascq, université Lille1 - Sciences et Technologies, , 270 p. (lire en ligne), p. 72
- ↑ Le verre et le rayonnement solaire [PDF], sur lacentraleduverre.com
- ↑ (en) Femtosecond ultraviolet autocorrelation measurements based on two-photon conductivity in fused silica [PDF], sur Optic letters, 15 mai 1998
- ↑ Introduction a la luminescence des materiaux [PDF], sur pcml.univ-lyon1.fr
- ↑ (en) Lattice absorption, sur reading.ac.uk
- ↑ Vibration du reseau chrisalin : Phonons [PDF], sur ief.u-psud.fr
- ↑ (en) Davis, K. M. et Tomozawa, M., « Water diffusion into silica glass: structural changes in silica glass and their effect on water solubility and diffusivity », Journal of Non-Crystalline Solids, no 185, , p. 203-220
- ↑ Haussonne, J.M., Céramiques et verres : principes et techniques d'élaboration, vol. 16, PPUR, , p. 410–
- ↑ (en) Cohen, H.M. et Roy, R., Densification of glass at very high pressure [PDF], Phys. Chem. Glasses, 1965, 6(5), 149-61, sur htracyhall.org.
- ↑ (en) The phenomenon of rupture and flow in solids [PDF], Philosophical Transactions of the Royal Society, vol. A221, p. 163-98, sur cmse.ed.ac.uk
- ↑ Ténacité des matériaux standards en fonction de leurs limites d'élasticité, sur nature.com
- ↑ (en) Etude de la propagation sous critique dans les fibres deverre par relaxation de la charge, M. R’Mili, N. Godin, J. Lamon [PDF]
- ↑ Oussama YOUSFI, Transformations de phase des Sulfures de Nickel dans lesverres trempés, INSTITUT POLYTECHNIQUE DE GRENOBLE, THESE pour obtenir le grade de DOCTEUR DE L’Institut polytechnique de Grenoble Spécialité :«Matériaux, Mécanique, Génie civil, Electrochimie», (lire en ligne)
- 1 2 Nicolas Vandenberghe et al., Star-like cracks can reveal the speed of a bullet « Starburst fractures can help forensic experts crack a case », New Scientist magazine, no 2915, p. 17, 4 mai 2013 (consulté le 5 mai 2013)
- ↑ The Slow Mo Guys, « How fast does glass crack? - The Slow Mo Guys » (consulté le )
- 1 2 3 Michel F. Ashby et D.R.H. Jones, Matériaux, Dunod, coll. « Sciences Sup », .
- 1 2 (de) Horst Küchling, Taschenbuch der Physik, Francfort, Harri Deutsch Verlag, .
- 1 2 G. Pissarenko et al., Aide-mémoire de résistance des matériaux, Moscou, éd. Mir, .
- ↑ Calcul de propriétés de verre, sur glassproperties.com
- ↑ (en) N. T. Huff et A. D. Call, Computerized Prediction of Glass Compositions from Properties, J. Am. Ceram. Soc., vol. 56, 1973, p. 55-57.
- ↑ (en) SciGlass - Glass Property Information System, sur sciglass.info
- ↑ (en) « Interglad Ver. 8 », 29 mars 2019, sur newglass.jp (consulté le 30 juillet 2019)
- 1 2 (en) R. Ravinder, Karthikeya H. Sreedhara, Suresh Bishnoi, Hargun Singh Grover, Mathieu Bauchy, Jayadeva, Hariprasad Kodamana, N. M. Anoop Krishnan, « Deep LearningAided Rational Designof Oxide Glasses », sur https://arxiv.org, (consulté le )
- ↑ (en) Han Liu, Zipeng Fu, Kai Yang, Xinyi Xu, Mathieu Bauchy, « Machine learning for glass science and engineering: A review », Journal of Non-Crystalline Solids: X, volume 4, december 2019, p. 100036 (lire en ligne)
- ↑ Quand le verre se forge une carapace : du nouveau chez les diatomées, sur cnrs.fr
- ↑ Le verre biologique inspire les chimistes [PDF], sur bio-nica.info
- ↑ (en) V. Bouska, Natural Glasses, Ellis Horwood series in applied science and industrial technology, (ISBN 978-0-7458-0564-1)
- ↑ (en) Fudali. R, « The oxidation state of iron in tektite glasses », Geochemica et Cosmochimica Acta, vol. 51, , p. 2749-2756
- ↑ Le verre fluoré, sur leverrefluore.com
- ↑ La fabrication du verre
- 1 2 Adrien Pouthier, « Du verre avec 100 % de calcin, une première mondiale pour Saint-Gobain », sur https://www.lemoniteur.fr, (consulté le )
- ↑ Dictionnaire Larousse, « flottage »
- ↑ Verres pour les applications solaires
- ↑ Énergie solaire : avancées vers un verre transparent
- 1 2 Bureau, B. et Lucas, J, Verres et optiques, Bulletin de l'union des physiciens (BUP), 2006, 100, p. 581-598
- ↑ La magie des verres chalcogénures
- 1 2 En verre sodique avec le « natrium », originaires de l'est du bassin méditerranéen, elles ont été refondues, réutilisées et deviennent rares après la période VIe siècle où se rompent les circuits commerciaux. Sophie Lagabrielle, Stéphane Palaude, Yves-Marie Adrian et Emmanuel Laurentin, La Fabrique de l'Histoire, Les révolutions du verre, France Culture, 26 juin 2019.
- ↑ Des ouvrages sous haute surveillance, Les dossiers de la recherche, no 48, avril 2012, Cahiers technologiques, p. 86-87
- ↑ Asahi Glass Co dévoile le substrat de verre le plus fin au monde pour écrans tactiles, sur fr.akihabaranews.com
- ↑ A day made of glass 2, une nouvelle vision du futur, sur nowhereelse.fr
- ↑ Liquidmetals
- ↑ Kate Newby, contribution Wild was the night (fusing) à OTIUM #4, 28 mai-11 août 2019, IAC, cartel (consulté le 10 juillet 2019). Projet de l'artiste pour introduire par le hasard des trous et des défauts de transparence et des défauts de planéité dans des vitres remplaçant des vitres du patio du musée (plusieurs vitres ont explosé lors du transport depuis l'atelier de verrerie d'art).
- ↑ « Le bombage du verre », sur verreonline.fr
- ↑ İlker Bekir Topçu et Mehmet Canbaz, Properties of concrete containing waste glass Cement and Concrete Research, vol. 34, no 2, février 2004, p. 267–274
- ↑ Caijun Shi et Keren Zheng, A review on the use of waste glasses in the production of cement and concrete, Resources, Conservation and Recycling, vol. 52, no 2, décembre 2007, p. 234–247
- ↑ Terro, M. J. (2006), Properties of concrete made with recycled crushed glass at elevated temperatures, Building and Environment, 41(5), 633-639
- ↑ Seung Bum Park, Bong Chun Lee et Jeong Hwan Kim, Studies on mechanical properties of concrete containing waste glass aggregate, Cement and Concrete Research, vol. 34, no 12, décembre 2004, p. 2181–2189
- ↑ Disfani, M. M., Arulrajah, A., Bo, M. W. et Sivakugan, N. (2012), Environmental risks of using recycled crushed glass in road applications [PDF], Journal of Cleaner Production, 20(1), 170-179, 11 p.
- 1 2 « Recyclage du verre : on peut encore et toujours mieux faire », sur Recyclage Récupération (consulté le )
- 1 2 Ademe, « Fiche technique de l'Ademe sur la Consigne pour les emballages boissons », Ademe, (consulté le )
- ↑ Nomenclature de la Bibliothèque nationale de France
- ↑ Lire le conte de Charles Perrault
Voir aussi
Articles connexes
- Alliage métallique amorphe
- Ampoule (récipient)
- Collage du verre
- Lampe électrique
- Lentilles de contact
- Microbille de verre pour marquage routier
- Perle d'art
- Polyamorphisme
- Procédé sol-gel
- Refroidissement du verre
- Verre (récipient)
- Verre autonettoyant
- Verre cannelé
- Verre craquelé
- Verre filé
- Verre mercuré
- Verre optique
- Verre parfait
- Verrerie
Liens externes
- Ressource relative à la santé :
- Ressource relative aux beaux-arts :
- (en) Grove Art Online
- Notices dans des dictionnaires ou encyclopédies généralistes :
