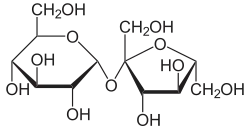
En chimie, un dimère est une molécule de la famille des polymères ne comportant que deux sous-unités. Certains types de sucre sont parmi les dimères les plus communs : le saccharose, par exemple, est un dimère réunissant une molécule de glucose et une de fructose.
Un dimère physique est une situation où deux molécules de structure similaire sont fortement rapprochées par des interactions intermoléculaires, sans former de liaison chimique.
En physique de la matière condensée, des systèmes géométriquement frustrés peuvent être représentés et étudiés à l'aide de pavages de dimères. Par exemple, dans le cas de spins sur un réseau triangulaire, et dont les interactions entre voisins sont antiferromagnétiques (favorisant des spins d'orientation opposée de part et d'autre d'un lien), on peut associer à chacune des nombreuses configurations de basse énergie un tel pavage en plaçant perpendiculairement à chaque lien frustré (c'est-à-dire où les deux torsions de part sont de même orientation d'autre du lien) un dimère joignant les centres des deux triangles jouxtant le lien. Cette représentation ramène l'énumération et la caractérisation des états de basse énergie à un problème d'énumération de pavages (pavages de dominos (en)), et permet d'aborder plus facilement les effets d'interactions plus faibles ou d'un champ magnétique[1].
En biologie, un dimère est un complexe de protéines composé de deux sous-unités, identiques dans le cas d'un homodimère, différentes dans un hétérodimère, quoiqu'elles aient en principe des structures très similaires. Les sous-unités n'ont pas besoin d'être liées de façon covalente, et ne le sont généralement pas. Un dimère peut également être constitué de deux bases nucléiques adjacentes (donc sur le même brin) reliées par une double liaison, ce qui inhibe les ADN polymérases.
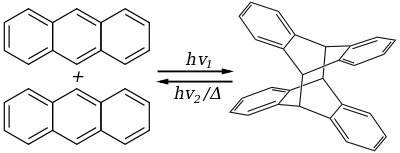
Certaines dimérisations sont provoquées par l'action de photons et portent le nom de « photodimérisation », comme dans le cas de la photodimérisation de l'anthracène qui donne un dimère caractérisé par une paire de liaisons carbone-carbone résultant de la cycloaddition [4+4]. La réaction inverse s'obtient par voie thermique ou sous irradiations UV (> 300 nm). Cette réversibilité et les propriétés photochromiques des anthracènes et de leurs dérivés sont susceptibles d'applications en opto-électronique.
Notes et références
- ↑ (en) Roderich Moessner, S. Sondhi et P. Chandra, « Two-dimensional periodic frustrated Ising models in a transverse field », Physical Review Letters, (lire en ligne [PDF]).