
Les immunoglobulines de type G (IgG) constituent une classe de molécules anticorps. C'est la principale des cinq classes d'immunoglobulines IgM, IgD, IgG, IgA et IgE présentes chez l'être humain. Les anticorps sont un composant majeur du système immunitaire adaptatif.
Chaque IgG est composée de quatre chaînes de peptides – deux chaînes lourdes γ et deux chaînes légères soit κ (kappa), soit λ (lambda) communes à toutes les classes d'immunoglobulines. Chaque IgG possède deux sites de liaison à l'antigène. D'autres immunoglobulines peuvent être décrites en termes de polymères dont la structure monomérique serait celle d'une IgG.
Ces glycoprotéines étroitement apparentées, composées de 82 à 96 % de protéines et de 4 à 18 % de glucides, diffèrent par la structure des chaînes lourdes et ont différentes fonctions effectrices. Les IgG peuvent être divisées en quatre sous-classes, nommées, par ordre décroissant d'abondance IgG1, IgG2, IgG3 et IgG4 [1] Les IgG présentent aussi des variations allotypiques transmises génétiquement qui constituent le système de groupe Gm, porté par la chaîne lourde, la chaîne légère κ portant elle le système Km.
Bien qu'elles soient identiques à plus de 90 % au niveau des acides aminés, chaque sous-classe a un profil unique en ce qui concerne la liaison à l'antigène, la formation de complexes immuns, l'activation du complément, la liaison au récepteur cellulaire, demi-vie et transport placentaire.
Les IgG sont les immunoglobulines les plus abondantes et sont approximativement distribuées également dans le sang et les tissus. Elles constituent 85 % des immunoglobulines du sérum humain. Les IgG sont sécrétées par les plasmocytes, issus des lymphocytes B plasmatiques.
La réponse humorale du système immunitaire
Les réponses des anticorps IgG à différents types d'antigènes conduisent à une réponse orientée vers l'une des sous-classes. Les carences sélectives de la sous-classe ne sont généralement pas préjudiciables à l'individu, mais conduisent parfois à une sensibilité accrue à des classes spécifiques d'agents pathogènes. Cela peut être causé par une carence complète en isotype ou en sous-classe due à des suppressions dans les loci Ig du chromosome 14, mais cela est rare[2]. Plus souvent, un ou plusieurs des niveaux de sous-classe d'IgG – principalement IgG2 et / ou IgG4 – sont inférieurs à la normale chez les individus en bonne santé[3], ce qui conduit parfois à une réponse altérée aux infections par des bactéries encapsulées.

La voie par laquelle un antigène pénètre dans notre corps et sa composition chimique oriente la réaction immunitaire adaptative Outre la stimulation directe des cellules B par l'antigène lui-même, un certain nombre de signaux secondaires influenceront la différenciation des cellules B, y compris la reconnaissance par des récepteurs de reconnaissance de formes comme les récepteurs de type Toll et les cytokines produites par d'autres lymphocytes et cellules présentant l'antigène[4],[5]. Par exemple, les antigènes protéiques déclenchent généralement les lymphocytes B qui reçoivent l'aide des lymphocytes T CD+ auxiliaire via le CMH de classe II exprimé par les lymphocytes B. Pour ces antigènes, la polarisation du lymphocyte T CD4+ oriente la production vers IgG1 ou IgG3, mais peut également être IgG4 ou IgE.
En revanche, en l'absence d'aide des lymphocytes T, les antigènes polysaccharidiques peuvent induire un changement de classe en IgG2 en particulier. Les cellules B subissant un changement de sécrétion de classe dans une réaction immunitaire primaire ou secondaire peuvent également repasser à l'isotype précédent[6], mais ces événements sont limités par la disponibilité des gènes de chaîne lourde restants, non excisés du génome lors des événements de changement de classe précédents.
Immunoglobuline G1
Les réponses des anticorps aux antigènes protéiques solubles et aux protéines membranaires induisent principalement l'IgG1, mais s'accompagnent de sécrétion à un niveau moindre des autres sous-classes, principalement IgG3 et IgG4[7]. Étant donné que l'IgG1 est normalement la sous-classe la plus abondante, un manque d'IgG1 observé dans une variété de carences en anticorps primaires et secondaires peut entraîner une diminution des taux d'IgG totaux (hypogammaglobulinémie). Les carences en IgG1, parfois en combinaison avec d'autres carences en sous-classe d'IgG, sont associées à des infections récurrentes[8].
Immunoglobuline G2
Les réponses des immunoglobulines G-anticorps aux polysaccharides membranaires peuvent être presque entièrement limitées aux IgG2[7],[9],[10],[11], et une carence en IgG2 peut entraîner la quasi-absence d'anticorps IgG dirigés contre les carbohydrates[12], bien que ces réponses puissent également être compensé par des niveaux accrus d'autres sous-classes d'IgG, en particulier par des niveaux élevés d'IgG1 et d'IgG3[13]. Une sensibilité accrue à certaines infections bactériennes est associée à une carence en IgG2, suggérant un rôle des IgG2 dans la défense contre ces pathogènes[14]. De faibles concentrations d'IgG2 se produisent souvent en association avec une carence en IgG4 et / ou IgA1 et IgA2[15].
Une analyse approfondie des réactivités aux carbohydrates dans les immunoglobulines intraveineuses a révélé que bien que les IgG2 représentent en effet la majeure partie de la réactivité à de nombreux glycanes, ce n'est pas toujours le cas[16]. Des anticorps IgG1 auraient également prévalu contre le polysaccharide Haemophilus influenzae B lors d'infections naturelles[7]. Dans les réponses immunitaires normales chez des individus en bonne santé, des réponses IgG1 et IgG3 peuvent également être observées, et certainement contre les glycanes conjugués aux protéines, ce qui se produit lors de la réaction aux vaccins antipneumococciques de deuxième génération[17].
Immunoglobuline G3
Les anticorps IgG3 sont particulièrement efficaces dans l'induction de fonctions effectrices. Les anticorps IgG3 déclenchent une puissante réaction pro-inflammatoire, sa demi-vie est plus courte pour limiter le risque de réponses inflammatoires excessives. Cependant, la constatation que certains individus portant le marqueur allotypique «s» ou «15» G3m ont également des IgG3 avec une demi-vie plus importante peut remettre en cause cette hypothèse[18]. Curieusement, les niveaux d'IgG3 chez ces individus ne semblent pas augmenter, ce qui peut s'expliquer par les polymorphismes du promoteur γ3 connus pour affecter la fréquence de passage des classes aux IgG3 dans les allotypes G3m (g), expliquant la faible concentration dans la plupart des individus homozygotes G3m (g)[19],[20] Les infections virales en général conduisent à des anticorps IgG des sous-classes IgG1 et IgG3, les anticorps IgG3 apparaissant en premier au cours de l'infection[7]. Les réponses dominées par les IgG3 semblent rares. Un exemple curieux est celui des anticorps dits anti-charnière (23), qui se lient à la région charnière des fragments Fab2 mais pas aux anticorps IgG intacts. De plus, les anticorps dirigés contre les antigènes érythrocytaires P et Pk sont largement limités aux IgG3[21]. Les réponses contre d'autres antigènes érythrocytaires (par exemple, RhD) et les plaquettes (par exemple, l'antigène plaquettaire humain 1a), comme en transfusion et pendant la grossesse, sont souvent dominées par les IgG1, IgG3 ou les deux[22],[23],[24]. Une baisse des taux d'IgG3 est fréquemment associée à d'autres carences en sous-classe d'IgG[25].
Immunoglobuline G4
Les allergènes sont souvent de bons inducteurs des IgG1 et IgG4, en plus des IgE. Les anticorps IgG4 se forment souvent après une exposition répétée ou à long terme à l'antigène dans un environnement non infectieux et peuvent devenir la sous-classe dominante. Des exemples sont les apiculteurs à long terme et les personnes allergiques qui ont subi une immunothérapie[26],[27],[28],[29]. En immunothérapie, l'amélioration des symptômes semble être en corrélation avec l'induction d'IgG4. Le passage à l'IgG4 peut être modulé par IL10, reliant cette sous-classe à la régulation négative des réponses immunitaires ou de l'induction de la tolérance[26],[30]. L'IgG4 peut également représenter la sous-classe d'anticorps dominante dans les réponses immunitaires aux protéines thérapeutiques, telles que les facteurs VIII et IX[31],[32],[33] et au moins certains anticorps recombinants tels que l'adalimumab[34]. En outre, les helminthiases ou les infections filariennes parasitaires peuvent entraîner la formation d'anticorps IgG4[35],[36], et des titres élevés en IgG4 peuvent être associés à une infection asymptomatique[36].
Les carences isolées en IgG4 sont rares ; les conséquences possibles en sont mal connues. D'un autre côté, un groupe de troubles, aujourd'hui appelés maladies liées aux IgG4, se caractérisent par une concentration sérique élevée d'IgG4 et une infiltration tissulaire par les plasmocytes IgG4 positifs et peuvent affecter un certain nombre d'organes[37],[38]. Le spectre des maladies liées aux IgG4 est large et comprend les patients atteints de pancréatite auto-immune, de maladie de Mikulicz, d'hypophysite, de thyroïdite de Riedel, de pneumopathie interstitielle, de néphrite interstitielle, de prostatite, de lymphadénopathie, de fibrose rétropéritonéale, d'anévrisme aortique inflammatoire et de pseudotumeur inflammatoire[26]. Chez les patients AIP, une élévation des IgG4 sériques (> 1,4 g / L) est observée dans 70 à 80 % des cas, ainsi que chez 10 % des patients atteints de cancer du pancréas. Cependant, comme 5 % de la population normale a également des niveaux élevés d'IgG4, cela ne le rend approprié que pour le diagnostic en combinaison avec d'autres caractéristiques de la pancréatite auto-immune
Tableaux des différentes caractéristiques des isotypes "G"
Structure
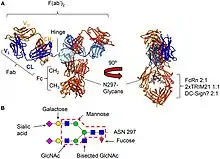
Comme les autres isotypes, la molécule d'immunoglobuline IgG se compose de quatre chaînes polypeptidiques, composées de deux chaînes lourdes (H) de 50 kDa γ identiques et de deux chaînes légères (L) de 25 kDa κ ou λ identiques, liées entre elles par des liaisons disulfures inter-chaînes. Chaque chaîne lourde se compose d'un domaine variable N-terminal (VH) et de trois domaines constants (CH1, CH2, CH3), avec une « région charnière » supplémentaire entre CH1 et CH2. De même, les chaînes légères sont constituées d'un domaine variable N-terminal (VL) et d'un domaine constant (CL). La chaîne légère s'associe aux domaines VH et CH1 pour former un bras Fab (« Fab » = liaison à l'antigène du fragment), et fonctionnellement, les régions V interagissent pour former la région de liaison à l'antigène – acquise par l'assemblage différentiel de Variable, Diversity (VH uniquement) et Joining gene segments et inclusion de mutations somatiques (43–45), bien que leur contribution relative à la liaison à l'antigène varie considérablement. Deux hétérodimères chaîne lourde-chaîne légère (HL) se combinent en une seule molécule d'anticorps (H2L2) via des liaisons disulfure dans la région charnière et des interactions non covalentes entre les domaines CH3. La partie de l'anticorps formée par la région charnière inférieure et les domaines CH2 / CH3 est appelée « Fc » (« fragment cristallin »)[39].
Les structures globales des quatre sous-classes d'IgG humaines sont très similaires mais avec des différences importantes entre chaque sous-classe qui affectent leur liaison aux molécules et récepteurs, affectant leur efficacité. Les quatre sous-classes présentent plus de 90 % d'homologie dans la séquence d'acides aminés, avec des différences qui ne sont pas distribuées au hasard. Beaucoup de variations se trouvent dans la région charnière et le domaine CH2 N-terminal, tandis que moins de différences d'acides aminés sont trouvées dans les autres domaines. On sait peu de choses sur les variations trouvées trouvées dans le domaine CH1. En revanche, les différences structurelles dans les domaines CH2 / CH3, formant la tige Fc, sont relativement bien étudiées[39].
Les résidus les plus proches de la région charnière dans le domaine CH2 de la partie Fc sont responsables des fonctions effectrices des anticorps car il contient un site de liaison se chevauchant largement pour le domaine de liaison du facteur du complément C1q et récepteurs Fcγ sur les cellules effectrices du système immunitaire inné[39].
L'interface entre les domaines CH2 – CH3 contient également le domaine de liaison au récepteur Fc néonatal, responsable de la demi-vie prolongée des IgG, du passage placentaire et du transport des IgG vers et depuis les surfaces muqueuses. Il existe peu de variations dans cette région, la liaison au récepteur Fc néonatal n'étant que très peu affectée[39].
Cependant, les profils de liaison au récepteur Fcγ et au facteur du complément C1q aux différentes sous-classes d'IgG vont de pair La manière dont les différences dans les séquences primaires des sous-classes d'IgG (Fc et charnière) entraînent des variations des éléments structuraux tertiaires, influençant ainsi de manière critique les propriétés de chaque sous-classe[39].
Variation structurelle dans la région charnière
La région charnière forme un lien flexible entre les bras Fab et la partie Fc. La longueur et la flexibilité de la région charnière varient considérablement entre les sous-classes d'IgG[40]. Cela affecte les conformations possibles des bras Fab par rapport à la tige Fc ainsi qu'entre eux.
Immunoglobuline G1
L'exon charnière de l'IgG1 comprend 15 acides aminés et est très flexible.
Immunoglobuline G2
L'IgG2 a une charnière plus courte que l'IgG1, avec 12 résidus d'acides aminés. La région de charnière inférieure de l'IgG2 (en fait codée par la région CH2) a également une suppression d'un acide aminé (sans l'une des doubles glycines trouvées en position 235-6), ce qui donne à l'IgG2 la charnière la plus courte de toutes les sous-classes d'IgG. De plus, les charnières de l'IgG2 sont encore plus rigides en raison d'une hélice de polyproline, stabilisée par jusqu'à quatre (à quelques exceptions près discutées ci-dessous) des ponts disulfure de chaîne inter-lourds supplémentaires. Ces propriétés limitent la flexibilité de la molécule d'IgG2.
Immunoglobuline G3
L'IgG3 a une région charnière beaucoup plus longue que toute autre sous-classe d'IgG ou isotype humain Ig, c'est-à-dire environ quatre fois plus longue que la charnière IgG1, contenant jusqu'à 62 acides aminés (dont 21 prolines et 11 cystéines), formant une hélice poly-proline avec une flexibilité limitée[41],[42]. La longueur exacte de la charnière varie entre les allotypes d'IgG3, qui a apparemment subi une évolution plus importante que les autres sous-classes. Dans l'IgG3, les fragments Fab sont relativement éloignés du fragment Fc, ce qui confère à la molécule une plus grande flexibilité Cette longue charnière d'IgG3 est le résultat de la duplication d'un exon de charnière, codé par un exon dans IgG1, IgG2 et IgG4, mais jusqu'à quatre exons dans IgG3. L'un de ces exons est commun à tous les allotypes d'IgG3, mais il possède également 1 à 3 copies d'un deuxième type homologue d'exon à charnière IgG3. La charnière allongée en IgG3 est également responsable de son poids moléculaire plus élevé par rapport aux autres sous-classes. La différence de flexibilité de la charnière influence l'orientation et le mouvement relatifs des bras Fab et de la queue Fc de l'anticorps IgG.
Immunoglobuline G4
De même, la région charnière de l'IgG4 contient également 12 acides aminés et est donc plus courte que celle de l'IgG1. Sa flexibilité est intermédiaire entre celle de l'IgG1 et de l'IgG2[43]. Contrairement à l'IgG2, il code les glycines codées CH2 235-6 dans la charnière inférieure.
Les domaines de liaison pour le facteur du complément C1q et / ou du récepteur Fcγ peuvent être partiellement ou complètement protégés par des bras Fab, affectant la liaison de l'IgG à ces molécules. La flexibilité relative des bras Fab par rapport au Fc diffère entre les sous-classes comme suit : lgG3> lgG1> lgG4> lgG2[43],[44], ce qui reflète également la liaison relative de ces sous-classes au facteur du complément C1q et au récepteur Fcγ, bien que cela n'explique que partiellement les activités respectives de la sous-classe d'IgG. Cette flexibilité affecte également la capacité de liaison à l'antigène et la formation de complexes immuns.
Liaisons disulfures
Les quatre sous-classes d'IgG diffèrent également en ce qui concerne le nombre de liaisons disulfure entre les chaînes lourdes dans la région charnière. De plus, l'IgG2 et l'IgG4 se trouvent sous la forme de plusieurs isomères, dans lesquels les liaisons disulfure charnières sont interconnectées de manière différentielle. Une autre différence structurelle entre les sous-classes d'IgG humaines est la liaison de la chaîne lourde et légère par une liaison disulfure. Cette liaison relie la cystéine carboxy-terminale de la chaîne légère à la cystéine en position 220 (en IgG1) ou en position 131 (en IgG2, IgG3 et IgG4) dans le domaine CH1 Ces deux positions sont juxtaposées spatialement et la structure et la fonction essentielles de la molécule semblent être conservées entre les deux types de liaison entre chaîne lourde et chaîne légère
Fonctions
L'IgG est le principal type d'anticorps trouvé dans le sang et dans le liquide interstitiel. Elle permet de contrôler les infections des tissus du corps. Elle se lie à divers types de pathogènes – incluant les virus, les bactéries et les mycètes – et protège le corps contre ces éléments en utilisant de nombreux mécanismes immunitaires : par exemple, agglutination et immobilisation, activation du complément (voie classique), opsonisation pour la phagocytose, et la neutralisation des toxines.
Grâce à sa capacité de fixation sur une série de récepteurs (en particulier les Fcγ récepteurs). Elle joue aussi un rôle important dans la médiation cellulaire de la cytotoxicité dépendante de l'anticorps (ADCC) et de la protéolyse intracellulaire médiée par l'anticorps, dans laquelle il se lie aussi à TRIM21 (le récepteur avec la plus grande affinité à l'IgG chez les humains), ce qui entraîne le marquage des virions vers le protéasome dans le cytosol[45]. La classe IgG caractérise aussi des auto-anticorps significativement associés aux manifestations d'auto-immunité ou encore d'hypersensibilité (de type II et de type III).
Mécanismes de liaison
Les anticorps relient le système immunitaire adaptatif au système immunitaire inné. Ils forment un pont en combinant des sites de liaison à l'antigène avec des sites de liaison pour de nombreux récepteurs innés et co-récepteurs. Les voies de signalisation qui seront déclenchées varient selon les différentes sous-classes d'immunoglobulines. En règle générale, les IgG1 et IgG3 sont de puissants déclencheurs des mécanismes effecteurs, tandis que les IgG2 et IgG4 induisent des réponses plus subtiles, et seulement dans certains cas. Cependant, ces anticorps restent capables de neutraliser les particules virales et les toxines.
Facteur du complément C1q
Lors de la liaison antigéniques, l'IgG ainsi que l'IgM peuvent activer le complément. L'activation du complément est initiée par la liaison et l'activation subséquente de C1q, conduisant au dépôt de C3b pour opsoniser davantage la cible, mais également à la formation du complexe d'attaque membranaire, C5 – C9, provoquant une perturbation de la membrane lipidique[46]. L'IgG1 et l'IgG3 peuvent déclencher efficacement cette voie classique du complément[47] ; l'IgG2 et l'IgG4 le font beaucoup moins efficacement ou seulement dans certaines conditions pour l'IgG2. Cela est dû en grande partie à la liaison réduite de C1q dans ces dernières sous-classes[47],[48],[49]Les événements en aval de la cascade du complément (dépôt de C4b) sont différentiellement affectés par les différentes sous-classes d'IgG[47]. Dans l'IgG2, la liaison réduite de C1q semble être largement causée par le résidu A235 (qui est Leu dans d'autres sous-classes)[50], tandis que dans l'IgG4, P331 est – au moins en partie – responsable de la liaison réduite ou absente de C1q[49],[51],[50],[52] Les déterminants structurels dans la région charnière centrale ou «centrale» (résidus 226–230) peuvent influencer la liaison de C1q[53]. D'une part, la rigidité dans cette région contribue favorablement à la liaison C1q, tandis que l'élimination des liaisons cystéine affecte négativement la liaison. Il a également été suggéré que la charnière relativement longue de l'IgG3 rend le site de liaison C1q plus accessible, ce qui entraîne une activation du complément plus efficace[54],[55]. Cependant, l'IgG3 conçue avec une charnière courte IgG4 lie efficacement C1q, bien que l'activation du complément soit moins forte[56].
Récepteur Fc
Le récepteur Fcγ couvre une région chevauchant partiellement le domaine de liaison du facteur de complément C1q. Pour toutes les interactions du récepteur Fcγ, l'étirement des acides aminés comprenant l'extrémité N-terminale des domaines et des brins CH2 adjacents dans le repli d'immunoglobuline tridimensionnelle est important pour la liaison. En général, cela englobe les acides aminés 234-239, 265-269, 297-299 et 327-330[57],[58] Cependant, chacune des sous-classes d'IgG a un profil de liaison unique à chaque récepteur Fcγ[2], et leurs profils d'expression sont très variables entre les différentes cellules immunitaires d'origine myéloïde et NK[59]. Une distinction majeure peut être faite entre les IgG1 / IgG3 qui interagissent efficacement avec la plupart des récepteur Fcγ et les IgG2 / IgG4, qui montrent une affinité réduite pour un certain nombre de récepteurs Fcγ. De plus, l'IgG3 monomère se lie plus efficacement que l'IgG1 monomère à FcγRIIa, FcγRIIIa et FcγRIIIb, et l'efficacité de liaison de l'IgG3 à tous les récepteur néonatals Fcγ s dépasse celle de l'IgG1[2]. Les déterminants structurels responsables des différences entre IgG1 et IgG3 sont encore inconnus.
Récepteurs alternatifs
Les protéines de type récepteur Fc
Les protéines de type récepteur Fc, composées de six membres (FCRL1-6) ont été initialement identifiées comme homologues du récepteur Fcγ mais ont longtemps été considérées comme des récepteurs orphelins, principalement exprimés sur les cellules B. Récemment, cependant, la protéine de type récepteur Fc4 et en particulier la protéine de type récepteur Fc5 se sont également avérées se lier aux immunoglobulines, la première reconnaissant les IgA, IgG3 et IgG4, tandis que le FcRL5 lie toutes les sous-classes d'IgG de la même manière, mais pas les IgA. Ces deux récepteurs sont exprimés sur les cellules B, expriment un ITIM et sont connus pour réguler à la baisse les cellules B après la réticulation du BCR par le recrutement de SHP-1[60],[61]. Alors que la protéine de type récepteur Fc5 semble largement exprimée sur les populations de cellules B[62], la protéine de type récepteur Fc4 n'est exprimée que sur les cellules B du tissu sous-épithélial[63], ce qui suggère que ce récepteur est peut-être impliqué dans l'inhibition de rétroaction négative par le biais d'IgG et IgA spécifiques de l'antigène.
La protéine 21 contenant un motif tripartite
La protéine 21 contenant un motif tripartite (TRIM21) est une protéine cytosolique exprimée dans presque tous les types de cellules mais fortement exprimée dans les cellules immunitaires. TRIM21 était auparavant connu comme un autoantigène impliqué dans plusieurs maladies auto-immunes, par exemple le lupus érythémateux disséminé[64]. Plus tard, TRIM21 s'est révélé lier les IgG avec une affinité nanomolaire[49],[65]. TRIM21 se lie aux IgG dans le domaine Fc à l'interface CH2 – CH3 similaire au récepteur Fc de la naissance et à la protéine A / G, il entre en compétition pour la liaison aux IgG avec la protéine A / G, et la liaison est indépendante de la N-glycosylation du domaine CH2[66]. Plus tard, il a été démontré que TRIM21 fonctionnait comme un capteur immunologique, ciblant le virus et les bactéries opsonisées par les IgG pour la neutralisation intracellulaire dépendante des anticorps par le protéosome dépendant de l'ubiquitine[67],[68],[69]. La détection du virus opsonisé par des anticorps par ce récepteur s'active, nécessite le protéasome et l'ATPase et le VCP unfoldase[70],[71]. Il active également une signalisation supplémentaire et les réponses d'immunité innée sont activées, caractérisées par les voies de transcription NF-kB, AP-1 et IRF[72].
La localisation unique de ce récepteur dans le cytoplasme laisse de nombreuses questions sans réponse mais répond simultanément à plusieurs. Il aide à expliquer comment les agents pathogènes partiellement opsonisés peuvent encore être reconnus et neutralisés pendant la phase précoce de l'infection, échappant à la reconnaissance par le complément et le système des récepteurs Fcγ. L'importance relative de ce système est encore inconnue pendant les infections secondaires, mais peut-être peut-être relativement plus importante aux endroits où le complément et le système myéloïde sont moins présents, par exemple, aux surfaces muqueuses de l'intestin.
Sources
- Vidarsson G, Dekkers G and Rispens T (2014) IgG subclasses and allotypes: from structure to effector functions. Front. Immunol. 5:520. doi: 10.3389/fimmu.2014.00520 Article sous licence CC-BY-SA
Notes et références
- ↑ Schur PH. IgG subclasses. A historical perspective. Monogr Allergy (1988) 23:1–11.
- 1 2 3 (en) Qiang Pan et Lennart Hammarstrom, « Molecular basis of IgG subclass deficiency », Immunological Reviews, vol. 178, no 1, , p. 99–110 (ISSN 0105-2896 et 1600-065X, DOI 10.1034/j.1600-065X.2000.17815.x, lire en ligne, consulté le )
- ↑ Vlug A, Nieuwenhuys EJ, van Eijk RV, Geertzen HG, van Houte AJ. Nephelometric measurements of human IgG subclasses and their reference ranges. Ann Biol Clin (Paris) (1994) 52(7–8):561–7.
- ↑ (en) Egest J. Pone, Jinsong Zhang, Thach Mai et Clayton A. White, « BCR-signalling synergizes with TLR-signalling for induction of AID and immunoglobulin class-switching through the non-canonical NF-κB pathway », Nature Communications, vol. 3, no 1, , p. 767 (ISSN 2041-1723, PMID 22473011, PMCID PMC3337981, DOI 10.1038/ncomms1769, lire en ligne, consulté le )
- ↑ (en) Egest J. Pone, Hong Zan, Jingsong Zhang et Ahmed Al-Qahtani, « Toll-Like Receptors and B-Cell Receptors Synergize to Induce Immunoglobulin Class-Switch DNA Recombination: Relevance to Microbial Antibody Responses », Critical Reviews™ in Immunology, vol. 30, no 1, , p. 1–29 (ISSN 2162-6472, DOI 10.1615/CritRevImmunol.v30.i1.10, lire en ligne, consulté le )
- ↑ (en) Magdalena A. Berkowska, Gertjan J. A. Driessen, Vasilis Bikos et Christina Grosserichter-Wagener, « Human memory B cells originate from three distinct germinal center-dependent and -independent maturation pathways », Blood, vol. 118, no 8, , p. 2150–2158 (ISSN 0006-4971 et 1528-0020, PMID 21690558, PMCID PMC3342861, DOI 10.1182/blood-2011-04-345579, lire en ligne, consulté le )
- 1 2 3 4 (en) Antonio Ferrante, Lorraine J. Beard et Robert G. Feldman, « IgG subclass distribution of antibodies to bacterial and viral antigens: », The Pediatric Infectious Disease Journal, vol. 9, no Supplement, , p. 516–524 (ISSN 0891-3668, DOI 10.1097/00006454-199008001-00004, lire en ligne, consulté le )
- ↑ (en) R. Jefferis et D. S. Kumararatne, « Selective IgG subclass deficiency: quantification and clinical relevance », Clinical & Experimental Immunology, vol. 81, no 3, , p. 357–367 (PMID 2204502, PMCID PMC1534990, DOI 10.1111/j.1365-2249.1990.tb05339.x, lire en ligne, consulté le )
- ↑ (en) George R. Siber, Peter H. Schur, Alan C. Aisenberg et Sigmund A. Weitzman, « Correlation between Serum IgG-2 Concentrations and the Antibody Response to Bacterial Polysaccharide Antigens », New England Journal of Medicine, vol. 303, no 4, , p. 178–182 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJM198007243030402, lire en ligne, consulté le )
- ↑ Barrett DJ, Ayoub EM. IgG2 subclass restriction of antibody to pneumococcal polysaccharides. Clin Exp Immunol (1986) 63(1):127–34.
- ↑ (en) Uwe Schauer, Frank Stemberg, Christian H. L. Rieger et Wolfgang Büttner, « Levels of Antibodies Specific to Tetanus Toxoid, Haemophilus influenzae Type b, and Pneumococcal Capsular Polysaccharide in Healthy Children and Adults », Clinical Diagnostic Laboratory Immunology, vol. 10, no 2, , p. 202–207 (ISSN 1071-412X et 1098-6588, PMID 12626443, PMCID PMC150524, DOI 10.1128/CDLI.10.2.202-207.2003, lire en ligne, consulté le )
- ↑ Hammarstrom L, Smith CI. IgG2 deficiency in a healthy blood donor. Concomitant lack of IgG2, IgA and IgE immunoglobulins and specific anti-carbohydrate antibodies. Clin Exp Immunol (1983) 51(3):600–4.
- ↑ (en) L. Hammarström, A.O. Carbonara, M. DeMarchi et G. Lefranc, « Subclass restriction pattern of antigen-specific antibodies in donors with defective expression of IgG or IgA subclass heavy chain constant region genes », Clinical Immunology and Immunopathology, vol. 45, no 3, , p. 461–470 (DOI 10.1016/0090-1229(87)90097-3, lire en ligne, consulté le )
- ↑ Kuijpers TW, Weening RS, Out TA. IgG subclass deficiencies and recurrent pyogenic infections, unresponsiveness against bacterial polysaccharide antigens. Allergol Immunopathol (Madr) (1992) 20(1):28–34.
- ↑ (en) Amir H Abdul Latiff et Michael A Kerr, « The clinical significance of immunoglobulin A deficiency », Annals of Clinical Biochemistry, vol. 44, no 2, , p. 131–139 (DOI 10.1258/000456307780117993, lire en ligne, consulté le )
- ↑ (en) Stephan von Gunten, David F. Smith, Richard D. Cummings et Stefan Riedel, « Intravenous immunoglobulin contains a broad repertoire of anticarbohydrate antibodies that is not restricted to the IgG2 subclass », Journal of Allergy and Clinical Immunology, vol. 123, no 6, , p. 1268–1276.e15 (PMID 19443021, PMCID PMC2777748, DOI 10.1016/j.jaci.2009.03.013, lire en ligne, consulté le )
- ↑ Vidarsson G, Sigurdardottir ST, Gudnason T, Kjartansson S, Kristinsson KG, Ingolfsdottir G, et al. Isotypes and opsonophagocytosis of pneumococcus type 6B antibodies elicited in infants and adults by an experimental pneumococcus type 6B-tetanus toxoid vaccine. Infect Immun (1998) 66(6):2866–70.
- ↑ (en) Nigel M. Stapleton, Jan Terje Andersen, Annette M. Stemerding et Stefania P. Bjarnarson, « Competition for FcRn-mediated transport gives rise to short half-life of human IgG3 and offers therapeutic potential », Nature Communications, vol. 2, no 1, , p. 599 (ISSN 2041-1723, PMID 22186895, PMCID PMC3247843, DOI 10.1038/ncomms1608, lire en ligne, consulté le )
- ↑ Seppala IJ, Sarvas H, Makela O. Low concentrations of Gm allotypic subsets G3 mg and G1 mf in homozygotes and heterozygotes. J Immunol (1993) 151(5):2529–37.
- ↑ Hassan MS, Islam KB, Hammarstrom L, Smith CI. Regulation of C gamma 3 expression. Role of switch in the allotype-associated variation of human serum IgG3 levels. J Immunol (1992) 148(8):2555–62.
- ↑ Soderstrom T, Enskog A, Samuelsson BE, Cedergren B. Immunoglobulin subclass (IgG3) restriction of anti-P and anti-Pk antibodies in patients of the rare p blood group. J Immunol (1985) 134(1):1–3.
- ↑ (en) H. A. A. Brouwers, M. A. M. Overbeeke, W. H. Ouwehand et K. Keuning, « Maternal antibodies against fetal blood group antigens A or B: lytic activity of IgG subclasses in monocyte-driven cytotoxicity and correlation with ABO haemolytic disease of the newborn », British Journal of Haematology, vol. 70, no 4, , p. 465–469 (ISSN 0007-1048 et 1365-2141, DOI 10.1111/j.1365-2141.1988.tb02518.x, lire en ligne, consulté le )
- ↑ (en) F. Mawas, E. Wiener, L. M. Williamson et C. H. Rodeck, « Immunoglobulin G subclasses of anti-human platelet antigen la in maternal sera: relation to the severity of neonatal alloimmune thrombocytopenia », European Journal of Haematology, vol. 59, no 5, , p. 287–292 (DOI 10.1111/j.1600-0609.1997.tb01688.x, lire en ligne, consulté le )
- ↑ (en) Janet M. Pollock et John M. Bowman, « Anti-Rh(D) IgG Subclasses and Severity of Rh Hemolytic Disease of the Newborn », Vox Sanguinis, vol. 59, no 3, , p. 176–179 (DOI 10.1111/j.1423-0410.1990.tb00854.x, lire en ligne, consulté le )
- ↑ (en) Isabelle Meyts, X Bossuyt, M Proesmans et Boeck De, « Isolated IgG3 deficiency in children: to treat or not to treat? Case presentation and review of the literature », Pediatric Allergy and Immunology, vol. 17, no 7, , p. 544–550 (ISSN 0905-6157 et 1399-3038, DOI 10.1111/j.1399-3038.2006.00454.x, lire en ligne, consulté le )
- 1 2 3 (en) Vinay S. Mahajan, Hamid Mattoo, Vikram Deshpande et Shiv S. Pillai, « IgG4-Related Disease », Annual Review of Pathology: Mechanisms of Disease, vol. 9, no 1, , p. 315–347 (ISSN 1553-4006 et 1553-4014, DOI 10.1146/annurev-pathol-012513-104708, lire en ligne, consulté le )
- ↑ Aalberse RC, van der Gaag R, van Leeuwen J. Serologic aspects of IgG4 antibodies. I. Prolonged immunization results in an IgG4-restricted response. J Immunol (1983) 130:722–6.
- ↑ Aalberse RC, Dieges PH, Knul-Bretlova V, Vooren P, Aalbers M, van Leeuwen J. IgG4 as a blocking antibody. Clin Rev Allergy (1983) 1(2):289–302.
- ↑ (en) Kayhan T. Nouri-Aria, Petra A. Wachholz, James N. Francis et Mikila R. Jacobson, « Grass Pollen Immunotherapy Induces Mucosal and Peripheral IL-10 Responses and Blocking IgG Activity », The Journal of Immunology, vol. 172, no 5, , p. 3252–3259 (ISSN 0022-1767 et 1550-6606, DOI 10.4049/jimmunol.172.5.3252, lire en ligne, consulté le )
- ↑ (en) M. Jutel et C. A. Akdis, « Immunological mechanisms of allergen-specific immunotherapy: Immunological mechanisms of allergen-specific immunotherapy », Allergy, vol. 66, no 6, , p. 725–732 (DOI 10.1111/j.1398-9995.2011.02589.x, lire en ligne, consulté le )
- ↑ (en) Pauline M. W. van Helden, H. Marijke van den Berg, Samantha C. Gouw et Paul H. P. Kaijen, « IgG subclasses of anti-FVIII antibodies during immune tolerance induction in patients with hemophilia A: Anti-factor VIII IgG Subclasses During ITI », British Journal of Haematology, vol. 142, no 4, , p. 644–652 (DOI 10.1111/j.1365-2141.2008.07232.x, lire en ligne, consulté le )
- ↑ (en) Burton R. Andersen et William D. Terry, « Gamma G4-Globulin Antibody causing Inhibition of Clotting Factor VIII », Nature, vol. 217, no 5124, , p. 174–175 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/217174a0, lire en ligne, consulté le )
- ↑ (en) A. Iizuka et T. Nagao, « ANALYSIS OF IgG HEAVY CHAIN SUBCLASSES OF ALLOANTIBODIES TO FACTOR IX BY CROSSED IMMUNOELECTROPHORESIS OF FACTOR IX USING THE INTERMEDIATE GEL TECHNIQUE », British Journal of Haematology, vol. 53, no 4, , p. 687–688 (ISSN 0007-1048 et 1365-2141, DOI 10.1111/j.1365-2141.1983.tb07323.x, lire en ligne, consulté le )
- ↑ (en) Pauline A. van Schouwenburg, Charlotte L. Krieckaert, Michael Nurmohamed et Margreet Hart, « IgG4 Production Against Adalimumab During Long Term Treatment of RA Patients », Journal of Clinical Immunology, vol. 32, no 5, , p. 1000–1006 (ISSN 0271-9142 et 1573-2592, DOI 10.1007/s10875-012-9705-0, lire en ligne, consulté le )
- ↑ Ottesen EA, Skvaril F, Tripathy SP, Poindexter RW, Hussain R. Prominence of IgG4 in the IgG antibody response to human filariasis. J Immunol (1985) 134(4):2707–12.
- 1 2 (en) T. Adjobimey et A. Hoerauf, « Induction of immunoglobulin G4 in human filariasis: an indicator of immunoregulation », Annals of Tropical Medicine & Parasitology, vol. 104, no 6, , p. 455–464 (ISSN 0003-4983 et 1364-8594, PMID 20863434, PMCID PMC3065634, DOI 10.1179/136485910X12786389891407, lire en ligne, consulté le )
- ↑ (en) Raghuwansh P Sah et Suresh T Chari, « Serologic issues in IgG4-related systemic disease and autoimmune pancreatitis: », Current Opinion in Rheumatology, vol. 23, no 1, , p. 108–113 (ISSN 1040-8711, DOI 10.1097/BOR.0b013e3283413469, lire en ligne, consulté le )
- ↑ (en) Motohisa Yamamoto, Tetsuya Tabeya, Yasuyoshi Naishiro et Hidetaka Yajima, « Value of serum IgG4 in the diagnosis of IgG4-related disease and in differentiation from rheumatic diseases and other diseases », Modern Rheumatology, vol. 22, no 3, , p. 419–425 (ISSN 1439-7595 et 1439-7609, DOI 10.3109/s10165-011-0532-6, lire en ligne, consulté le )
- 1 2 3 4 5 Gestur Vidarsson, Gillian Dekkers et Theo Rispens, « IgG Subclasses and Allotypes: From Structure to Effector Functions », Frontiers in Immunology, vol. 5, (ISSN 1664-3224, PMID 25368619, PMCID PMC4202688, DOI 10.3389/fimmu.2014.00520, lire en ligne, consulté le )
- ↑ Hamilton RG. Human IgG subclass measurements in the clinical laboratory. Clin Chem (1987) 33(10):1707–25.
- ↑ (en) Terje E. Michaelsen, Lisbeth M. Næss et Audun Aase, « Human IgG3 is decreased and IgG1, IgG2 and IgG4 are unchanged in molecular size by mild reduction and reoxidation without any major change in effector functions », Molecular Immunology, vol. 30, no 1, , p. 35–45 (DOI 10.1016/0161-5890(93)90424-A, lire en ligne, consulté le )
- ↑ Saluk PH, Clem LW. The unique molecular weight of the heavy chain from human IgG3. J Immunol (1971) 107(1):298–301
- 1 2 Roux KH, Strelets L, Michaelsen TE. Flexibility of human IgG subclasses. J Immunol (1997) 159(7):3372–82.
- ↑ (en) Beatriz Carrasco, Jose Garcia de la Torre, Kenneth G Davis et Susan Jones, « Crystallohydrodynamics for solving the hydration problem for multi-domain proteins: open physiological conformations for human IgG », Biophysical Chemistry, vol. 93, nos 2-3, , p. 181–196 (DOI 10.1016/S0301-4622(01)00220-4, lire en ligne, consulté le )
- ↑ (en) Mallery DL, McEwan WA, Bidgood SR, Towers GJ, Johnson CM, James LC, « Antibodies mediate intracellular immunity through tripartite motif-containing 21 (TRIM21) », Proc. Natl. Acad. Sci. U.S.A., vol. 107, no 46, , p. 19985–19990 (PMID 21045130, PMCID 2993423, DOI 10.1073/pnas.1014074107, lire en ligne)
- ↑ (en) J. Vidya Sarma et Peter A. Ward, « The complement system », Cell and Tissue Research, vol. 343, no 1, , p. 227–235 (ISSN 0302-766X et 1432-0878, PMID 20838815, PMCID PMC3097465, DOI 10.1007/s00441-010-1034-0, lire en ligne, consulté le )
- 1 2 3 (en) C I Bindon, G Hale, M Brüggemann et H Waldmann, « Human monoclonal IgG isotypes differ in complement activating function at the level of C4 as well as C1q. », The Journal of Experimental Medicine, vol. 168, no 1, , p. 127–142 (ISSN 0022-1007 et 1540-9538, PMID 3260935, PMCID PMC2188986, DOI 10.1084/jem.168.1.127, lire en ligne, consulté le )
- ↑ (en) Verne N. Schumaker, Mary A. Calcott, Hans L. Spiegelberg et Hans J. Mueller-Eberhard, « Ultracentrifuge studies of the binding of IgG of different subclasses to the Clq subunit of the first component of complement », Biochemistry, vol. 15, no 23, , p. 5175–5181 (ISSN 0006-2960 et 1520-4995, DOI 10.1021/bi00668a035, lire en ligne, consulté le )
- 1 2 3 (en) M H Tao, R I Smith et S L Morrison, « Structural features of human immunoglobulin G that determine isotype-specific differences in complement activation. », The Journal of Experimental Medicine, vol. 178, no 2, , p. 661–667 (ISSN 0022-1007 et 1540-9538, PMID 8340761, PMCID PMC2191116, DOI 10.1084/jem.178.2.661, lire en ligne, consulté le )
- 1 2 Morgan A, Jones ND, Nesbitt AM, Chaplin L, Bodmer MW, Emtage JS. The N-terminal end of the CH2 domain of chimeric human IgG1 anti-HLA-DR is necessary for C1q, Fc gamma RI and Fc gamma RIII binding. Immunology (1995) 86(2):319–24.
- ↑ (en) Esohe E. Idusogie, Leonard G. Presta, Helene Gazzano-Santoro et Klara Totpal, « Mapping of the C1q Binding Site on Rituxan, a Chimeric Antibody with a Human IgG1 Fc », The Journal of Immunology, vol. 164, no 8, , p. 4178–4184 (ISSN 0022-1767 et 1550-6606, DOI 10.4049/jimmunol.164.8.4178, lire en ligne, consulté le )
- ↑ (en) Ole Henrik Brekke, Terje E. Michaelsen, Audun Aase et Randi H. Sandin, « Human IgG isotype-specific amino acid residues affecting complement-mediated cell lysis and phagocytosis », European Journal of Immunology, vol. 24, no 10, , p. 2542–2547 (DOI 10.1002/eji.1830241042, lire en ligne, consulté le )
- ↑ (en) William F. Dall’Acqua, Kimberly E. Cook, Melissa M. Damschroder et Robert M. Woods, « Modulation of the Effector Functions of a Human IgG1 through Engineering of Its Hinge Region », The Journal of Immunology, vol. 177, no 2, , p. 1129–1138 (ISSN 0022-1767 et 1550-6606, DOI 10.4049/jimmunol.177.2.1129, lire en ligne, consulté le )
- ↑ Dangl JL, Wensel TG, Morrison SL, Stryer L, Herzenberg LA, Oi VT. Segmental flexibility and complement fixation of genetically engineered chimeric human, rabbit and mouse antibodies. EMBO J (1988) 7(7):1989–94.
- ↑ (en) Yanling Lu, Stephen E. Harding, Terje E. Michaelsen et Emma Longman, « Solution Conformation of Wild-Type and Mutant IgG3 and IgG4 Immunoglobulins Using Crystallohydrodynamics: Possible Implications for Complement Activation », Biophysical Journal, vol. 93, no 11, , p. 3733–3744 (PMID 17704171, PMCID PMC2084252, DOI 10.1529/biophysj.107.108993, lire en ligne, consulté le )
- ↑ (en) L. K. Tan, R. J. Shopes, V. T. Oi et S. L. Morrison, « Influence of the hinge region on complement activation, C1q binding, and segmental flexibility in chimeric human immunoglobulins. », Proceedings of the National Academy of Sciences, vol. 87, no 1, , p. 162–166 (ISSN 0027-8424 et 1091-6490, PMID 2296577, PMCID PMC53220, DOI 10.1073/pnas.87.1.162, lire en ligne, consulté le )
- ↑ (en) Peter Sondermann, Robert Huber, Vaughan Oosthuizen et Uwe Jacob, « The 3.2-Å crystal structure of the human IgG1 Fc fragment–FcγRIII complex », Nature, vol. 406, no 6793, , p. 267–273 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/35018508, lire en ligne, consulté le )
- ↑ (en) Paul A. Ramsland, William Farrugia, Tessa M. Bradford et Caroline Tan Sardjono, « Structural Basis for FcγRIIa Recognition of Human IgG and Formation of Inflammatory Signaling Complexes », The Journal of Immunology, vol. 187, no 6, , p. 3208–3217 (ISSN 0022-1767 et 1550-6606, PMID 21856937, PMCID PMC3282893, DOI 10.4049/jimmunol.1101467, lire en ligne, consulté le )
- ↑ (en) Martin Guilliams, Pierre Bruhns, Yvan Saeys et Hamida Hammad, « The function of Fcγ receptors in dendritic cells and macrophages », Nature Reviews Immunology, vol. 14, no 2, , p. 94–108 (ISSN 1474-1733 et 1474-1741, DOI 10.1038/nri3582, lire en ligne, consulté le )
- ↑ (en) G. R. A. Ehrhardt, R. S. Davis, J. T. Hsu et C.-M. Leu, « The inhibitory potential of Fc receptor homolog 4 on memory B cells », Proceedings of the National Academy of Sciences, vol. 100, no 23, , p. 13489–13494 (ISSN 0027-8424 et 1091-6490, PMID 14597715, PMCID PMC263841, DOI 10.1073/pnas.1935944100, lire en ligne, consulté le )
- ↑ (en) C. L. Haga, G. R. A. Ehrhardt, R. J. Boohaker et R. S. Davis, « Fc receptor-like 5 inhibits B cell activation via SHP-1 tyrosine phosphatase recruitment », Proceedings of the National Academy of Sciences, vol. 104, no 23, , p. 9770–9775 (ISSN 0027-8424 et 1091-6490, PMID 17522256, PMCID PMC1887609, DOI 10.1073/pnas.0703354104, lire en ligne, consulté le )
- ↑ (en) A. G. Polson, « Expression pattern of the human FcRH/IRTA receptors in normal tissue and in B-chronic lymphocytic leukemia », International Immunology, vol. 18, no 9, , p. 1363–1373 (ISSN 0953-8178 et 1460-2377, DOI 10.1093/intimm/dxl069, lire en ligne, consulté le )
- ↑ (en) Götz R.A. Ehrhardt, Joyce T. Hsu, Lanier Gartland et Chuen-Miin Leu, « Expression of the immunoregulatory molecule FcRH4 defines a distinctive tissue-based population of memory B cells », Journal of Experimental Medicine, vol. 202, no 6, , p. 783–791 (ISSN 1540-9538 et 0022-1007, PMID 16157685, PMCID PMC2212938, DOI 10.1084/jem.20050879, lire en ligne, consulté le )
- ↑ Frank MB, Itoh K, Fujisaku A, Pontarotti P, Mattei MG, Neas BR. The mapping of the human 52-kD Ro/SSA autoantigen gene to human chromosome 11, and its polymorphisms. Am J Hum Genet (1993) 52(1):183–91.
- ↑ (en) Yih-Sheng Yang, Meng-Chun W Yang, Bin Wang et Jonathan C Weissler, « Autoantigen Ro52 directly interacts with human IgG heavy chain in vivo in mammalian cells », Molecular Immunology, vol. 37, no 10, , p. 591–602 (DOI 10.1016/S0161-5890(00)00068-7, lire en ligne, consulté le )
- ↑ (en) David A. Rhodes et John Trowsdale, « TRIM21 is a trimeric protein that binds IgG Fc via the B30.2 domain », Molecular Immunology, vol. 44, no 9, , p. 2406–2414 (DOI 10.1016/j.molimm.2006.10.013, lire en ligne, consulté le )
- ↑ (en) M. Vaysburd, R. E. Watkinson, H. Cooper et M. Reed, « Intracellular antibody receptor TRIM21 prevents fatal viral infection », Proceedings of the National Academy of Sciences, vol. 110, no 30, , p. 12397–12401 (ISSN 0027-8424 et 1091-6490, PMID 23840060, PMCID PMC3725055, DOI 10.1073/pnas.1301918110, lire en ligne, consulté le )
- ↑ (en) R. E. Watkinson, J. C. H. Tam, M. J. Vaysburd et L. C. James, « Simultaneous Neutralization and Innate Immune Detection of a Replicating Virus by TRIM21 », Journal of Virology, vol. 87, no 13, , p. 7309–7313 (ISSN 0022-538X, PMID 23596308, PMCID PMC3700317, DOI 10.1128/JVI.00647-13, lire en ligne, consulté le )
- ↑ (en) Nikolas Rakebrandt, Sabine Lentes, Heinz Neumann et Leo C. James, « Antibody- and TRIM21-dependent intracellular restriction of Salmonella enterica », Pathogens and Disease, , n/a–n/a (DOI 10.1111/2049-632X.12192, lire en ligne, consulté le )
- ↑ (en) D. L. Mallery, W. A. McEwan, S. R. Bidgood et G. J. Towers, « Antibodies mediate intracellular immunity through tripartite motif-containing 21 (TRIM21) », Proceedings of the National Academy of Sciences, vol. 107, no 46, , p. 19985–19990 (ISSN 0027-8424 et 1091-6490, PMID 21045130, PMCID PMC2993423, DOI 10.1073/pnas.1014074107, lire en ligne, consulté le )
- ↑ (en) William A. McEwan, Donna L. Mallery, David A. Rhodes et John Trowsdale, « Intracellular antibody-mediated immunity and the role of TRIM21: Insights & Perspectives », BioEssays, vol. 33, no 11, , p. 803–809 (DOI 10.1002/bies.201100093, lire en ligne, consulté le )
- ↑ (en) William A McEwan, Jerry C H Tam, Ruth E Watkinson et Susanna R Bidgood, « Intracellular antibody-bound pathogens stimulate immune signaling via the Fc receptor TRIM21 », Nature Immunology, vol. 14, no 4, , p. 327–336 (ISSN 1529-2908 et 1529-2916, PMID 23455675, PMCID PMC3672961, DOI 10.1038/ni.2548, lire en ligne, consulté le )