
| Président de la Royal Geographical Society | |
|---|---|
| - | |
William Crookes Charles Scott Sherrington | |
| Président de la Royal Society | |
| - | |
William Crookes Charles Scott Sherrington |
| Naissance | |
|---|---|
| Décès |
(à 83 ans) Cambridge |
| Sépulture | |
| Nom de naissance |
Joseph John Thomson. |
| Nationalité | |
| Formation |
Université de Manchester Université Victoria de Manchester Trinity College Université de Cambridge |
| Activités | |
| Père |
Joseph James Thomson (d) |
| Mère |
Emma Swindells (d) |
| Fratrie |
Frederick Vernon Thomson (d) |
| Conjoint |
Rose Thomson (d) |
| Enfants |
George Paget Thomson Joan Paget Thomson (d) |
| A travaillé pour | |
|---|---|
| Membre de |
Royal Society () Académie des sciences de Turin () Académie américaine des sciences () Académie nationale des sciences Académie des sciences de Saint-Pétersbourg Académie bavaroise des sciences Académie royale néerlandaise des arts et des sciences Internacia Scienca Asocio Esperanta (d) Académie royale des sciences de Prusse Académie royale des sciences de Suède Académie américaine des arts et des sciences Académie des sciences de l'URSS (en) Académie des sciences de Russie |
| Maître | |
| Directeur de thèse | |
| Distinction |
Prix Smith (1880); Prix Nobel de physique (1906) |
Modèle atomique de Thomson |
Joseph John Thomson, né le et mort le , est un physicien britannique.
Il a découvert l'électron ainsi que les isotopes et a inventé la spectrométrie de masse ; il a analysé la propagation d'ondes guidées.
Il a reçu le prix Nobel de physique de 1906 pour « ses recherches théoriques et expérimentales sur la conductivité électrique dans les gaz[1] ». Ces recherches ont fourni les preuves de l'existence de l'électron.
Biographie

Joseph John Thomson est né de parents écossais à Cheetham Hill dans la banlieue de Manchester le . En 1870, il commence ses études en génie à l'université de Manchester, alors connue sous le nom de Owens College, puis en 1876, il entre au Trinity College à Cambridge. Le , il se marie avec Rose Elizabeth Paget[note 1] qui était chercheuse au laboratoire Cavendish. Ils eurent deux enfants, Joan Paget Thomson et George Paget Thomson, futur lauréat du prix Nobel de physique de 1937. En 1884, il succède à Lord Rayleigh à la chaire Cavendish de physique expérimentale[2]. La même année, Thomson devient membre de la Royal Society.
En 1902, il reçoit la médaille Hughes, en 1906, le prix Nobel de physique pour son travail sur la conductivité électrique des gaz[1], et en 1914, la médaille Copley. En 1908, il devient membre de l'ordre du Mérite et est anobli[3], ce qui lui donne droit au titre de Sir.
Il est président de la Royal Society de 1916 à 1920. En 1919, un de ses étudiants, Ernest Rutherford, lui succède à la chaire Cavendish de physique expérimentale. Il meurt le à Cambridge, et est enterré dans l'abbaye de Westminster.
Recherches sur les rayons cathodiques
En 1898, Thomson prouve expérimentalement l'existence des électrons, qui avait été prédite par George Johnstone Stoney en 1874.
Cette découverte est le résultat d'une série d'expériences sur les rayons cathodiques.
La même année, il énonce son modèle de l'atome, le modèle de plum pudding.
Première expérience
Dans sa première expérience, il explore la possibilité de séparer la charge électrique négative des rayons cathodiques par le magnétisme.
Il construit un tube cathodique qui se termine dans une paire de cylindres avec des fentes branchées à un électromètre.
Thomson découvre que si les rayons cathodiques sont déviés par un champ magnétique de sorte qu'ils ne peuvent pas entrer par les fentes, alors l'électromètre n'enregistre guère de charge électrique. Il conclut que la charge négative ne peut pas être séparée des rayons.
Deuxième expérience

Dans sa deuxième expérience, il démontre que les rayons cathodiques peuvent être déviés par un champ électrique, ce qui est prévisible pour les particules chargées. En effet, d'autres chercheurs avaient essayé sans succès d'observer cet effet, mais Thomson croit que les expériences antérieures étaient erronées à cause de traces de gaz.
Il construit un tube cathodique avec un vide plus poussé, et muni d'une couche de peinture phosphorescente au bout pour détecter des rayons incidents.
Thomson démontre une déviation dans un sens, qui indique que la charge des rayons cathodiques est négative.
Troisième expérience
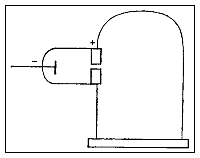
Dans une troisième expérience, Thomson détermine le rapport de la charge à la masse (e/m) des rayons cathodiques en mesurant leur déviation sous l'influence du champ magnétique ainsi que de leur énergie cinétique. Il calcule un e/m mille fois plus élevé que le rapport analogue pour un ion hydrogène (H+), ce qui suggère que les rayons cathodiques contiennent des particules soit très légères soit très hautement chargées.
Thomson arrive à une conclusion audacieuse : les rayons cathodiques sont composés de « corpuscules » qui proviennent de l'intérieur des atomes des électrodes, ce qui implique que les atomes sont divisibles. Le « corpuscule » découvert par Thomson est l'électron déjà prévu par Stoney.
Thomson imagine un « modèle de plum pudding » de l'atome auquel ces corpuscules (les prunes) se déplacent à l'intérieur d'une mer de charges positives (le pudding). Cette idée est toutefois contredite plus tard par Ernest Rutherford, qui démontre que la charge positive est concentrée dans le noyau.
La découverte de l'électron est annoncée le devant la Royal Institution[4] et fait sensation dans le monde scientifique. En 1906, Thomson reçoit le Prix Nobel de physique[1].
Autres recherches : les isotopes et la spectrométrie de masse
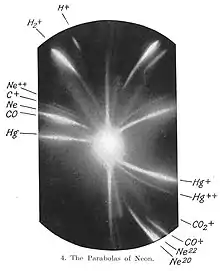
En 1906, Thomson montre que l'atome d'hydrogène ne contient qu'un électron. À cette époque certaines théories ont envisagé divers nombres d'électrons.
En 1912, il étudie la composition des mélanges des ions positifs dits « ions anodiques ». Au cours de cette recherche, il mesure la déflexion d'un faisceau de néon ionisé (Ne+) qui passe à travers un champ magnétique ainsi qu'un champ électrique. Sur la plaque photographique qui lui sert comme détecteur, il observe deux taches (voir image) qui correspondent aux atomes de masses 20 et 22. Il conclut que le néon est constitué d'atomes de deux masses différentes ou isotopes.
Cette séparation des atomes par leur masse est le premier exemple de la spectrométrie de masse, méthode qui est subséquemment mise au point par Francis William Aston (étudiant de Thomson) et par Arthur Jeffrey Dempster.
Ouvrages
- 1883 : A Treatise on the Motion of Vortex Rings, université de Cambridge, Londres (ISBN 0-543-95696-2).
- 1888 : Applications of Dynamics to Physics and Chemistry, Londres. (ISBN 1-4021-8397-6).
- 1893 : Notes on recent researches in electricity and magnetism, Oxford University Press, 1991. (ISBN 1-4297-4053-1).
- 1895 : Elements Of The Mathematical Theory Of Electricity And Magnetism, Londres.
- 1897 : « Cathode Rays », Proceedings of the Royal Institution.
- 1897 : « Cathode rays », Philosophical Magazine.
- 1901 : A Text book of Physics in Five Volumes, coécrit avec J.H. Poynting.
- 1903 : Conduction of electricity through gases, Cambridge University Press (seconde édition plus complète en 1906).
- 1904 : On the Structure of the Atom.
- 1912 : Further experiments on positive rays.
- 1912 : Passage de l'électricité à travers les gaz, Gauthier-Villars (Paris) texte en ligne disponible sur IRIS.
- 1913 : « Rays of positive electricity », Proceedings of the Royal Society.
- 1922 : Électricité et matière, préface de Paul Langevin.
- 1923 : The Electron in Chemistry, Philadelphie.
Notes et références
Notes
- ↑ Fille de Sir George E. Paget.
Références
- 1 2 3 (en) « in recognition of the great merits of his theoretical and experimental investigations on the conduction of electricity by gases » in Personnel de rédaction, « The Nobel Prize in Physics 1906 », Fondation Nobel, 2010. Consulté le 13 juin 2010.
- ↑ Cavendish Professor of Experimental Physics.
- ↑ London Gazette : no 28206, p. 9650, 18-12-1908.
- ↑ (en) Harald Fritzsch, Elementary Particles: Building Blocks of Matter, World Scientific, , p. 12.
Voir aussi
Articles connexes
- Diffusion Thomson
- Laboratoire Cavendish
- Électron
- Modèle de Thomson
- Spectrométrie de masse
- George Paget Thomson
Liens externes
- (en) Biographie sur le site de la fondation Nobel (le bandeau sur la page comprend plusieurs liens relatifs à la remise du prix, dont un document rédigé par la personne lauréate — le Nobel Lecture — qui détaille ses apports)
- Ressources relatives aux beaux-arts :
- Ressources relatives à la recherche :
- Ressource relative à la santé :
- Ressource relative à la musique :
- (en) MusicBrainz
- Notices dans des dictionnaires ou encyclopédies généralistes :