| Oxyde de calcium | |||
| |||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.013.763 | ||
| No CE | 215-138-9 | ||
| No E | E529 | ||
| Apparence | poudre cristalline, hygroscopique, blanche[1]. | ||
| Propriétés chimiques | |||
| Formule | CaO [Isomères] |
||
| Masse molaire[alpha 1] | 56,077 ± 0,004 g/mol Ca 71,47 %, O 28,53 %, |
||
| Propriétés physiques | |||
| T° fusion | 2 570 °C[1] | ||
| T° ébullition | 2 850 °C[1] | ||
| Solubilité | 1,65 g·l-1 (eau à 20 °C) Réagit violemment avec l'eau |
||
| Masse volumique | 3,3–3,4 g·cm-3[1] | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 6,66 ± 0,18 eV (gaz)[2] | ||
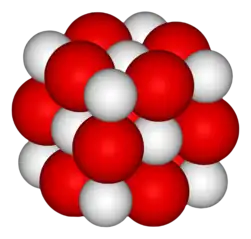
| Cristallographie | |||
| Système cristallin | cubique | ||
| Symbole de Pearson | [3] | ||
| Classe cristalline ou groupe d’espace | Fm3m (n°225) [3] | ||
| Strukturbericht | B1[3] | ||
| Structure type | NaCl[3] | ||
| Paramètres de maille | a = 4,810 8 Å | ||
| Précautions | |||
| SIMDUT[4] | |||
 E, |
|||
| NFPA 704 | |||
| Directive 67/548/EEC[5] | |||
 C |
|||
| Transport | |||
|
|||
| Composés apparentés | |||
| Autres cations | Oxyde de béryllium, Oxyde de magnésium, Oxyde de strontium, Oxyde de baryum | ||
| Autres anions | Sulfure de calcium | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
L'oxyde de calcium, de formule chimique CaO, est le seul oxyde connu du calcium.
Communément appelé chaux vive, il est obtenu par calcination du calcaire à 825 °C. Mais il existe aussi à l'état naturel, sous la forme d'un minéral rare qu'il est possible d'observer en petites masses blanches dans les éjectas transformés à haute température parmi les laves communes sur les flancs des formations volcaniques, par exemple sur le Vésuve en Italie[alpha 2]. Référencée officiellement en 1935 dans le champ de la minéralogie, la chaux (vive) fait partie du groupe isostructurel Fm3m du périclase MgO[6].
On dit que CaO est de la chaux vive car elle réagit violemment avec l'eau, en produisant de la chaleur, selon la réaction :
- CaO + H2O → Ca(OH)2
On obtient la chaux dite « éteinte » (elle ne réagit plus avec l'eau). La chaux est un enduit de choix, car, par carbonatation à l'air libre (grâce au CO2 atmosphérique) :
- Ca(OH)2 + CO2 → CaCO3 + H2O
Elle devient du carbonate de calcium (CaCO3), ou calcaire, retrouvant sa solidité initiale. Ainsi, la chaux éteinte enduite sur les murs crée une couche de calcaire (généralement colorée rouge, orange ou encore jaune).
La chaux vive est irritante pour la peau, car elle réagit avec l'eau présente sur la peau et produit de la chaux éteinte, qui est très basique (pKa = 12,6 pour le couple Ca2 + 2 H2O/Ca(OH)2).
Articles connexes
Notes et références
Notes
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ Des dépôts se trouvent aussi en Suède près de Malmö, dans la région russe de l'Oural, au Tibet, en Australie, en Arizona à Bisbee.
Références
- 1 2 3 4 OXYDE DE CALCIUM, Fiches internationales de sécurité chimique
- ↑ (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- 1 2 3 4 « The NaCl (B1) Structure », sur http://cst-www.nrl.navy.mil/ (consulté le )
- ↑ « Oxyde de calcium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Entrée « Calcium oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 4 juillet 2009 (JavaScript nécessaire)
- ↑ (en) « Lime », sur Mindat.org (consulté le ).


