يعد التحصي المكروي السنخي الرئوي (Pulmonary alveolar microlithiasis ) اضطرابًا وراثيًا نادرًا في توازن فوسفات الرئة مرتبطًا بتكوين حصوات صغيرة في الفراغات الهوائية للرئة، وتؤدي الطفرات في جين SLC34A2 [1][2] إلى فقدان الصوديوم الرئيسي -الناقل المشترك للفوسفات (يُسمى Npt2b )- والمعروف أنه يتم التعبير عنه في الخلايا السنخية الظهارية من النوع الثاني في مجرى الهواء وكذلك في الغدة الثديية وبدرجة أقل في الأمعاء والكلى والجلد والبروستاتا والخصيتين، ومع تقدم المرض تصبح حقول الرئة أكثر كثافة (بيضاء) بشكل تدريجي في الأشعة السينية للصدر كما يصبح مستوى الأكسجين منخفضا ويؤدي تقدم المرض أيضا إلى التهاب وتليف الرئة والضغوط المرتفعة في الأوعية الدموية الرئوية ويحدث الفشل التنفسي عادة في منتصف العمر، وقد يكون المسار السريري لـ PAM متغيرًا بدرجة كبيرة بالنسبة لبعض المرضى الذين يبقون بدون أعراض لعدة عقود بينما يتقدم آخرون بسرعة أكبر، ولا يوجد علاج فعال لهذا المرض وآليات تشكل الحصوات والالتهابات والتندب غير معروفة.
| تحص مكروي سنخي رئوي | |
|---|---|
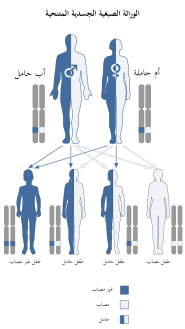
يتوارث التحصي المكروي السنخي الرئوي عن طريق الصبغيات المتنحية
| |
| معلومات عامة | |
| الاختصاص | طب الرئة |
| من أنواع | مرض رئوي |
علامات وأعراض
المرضى عادة لا تظهر عليهم أعراض حتى العقد الثالث أو الرابع من العمر، وفي معظم الحالات يتم اكتشاف المرض بالمصادفة على الأشعة السينية الروتينية، وتشمل الأعراض الأكثر شيوعًا ما يلي: [3][4][5][6][7]
- ضيق التنفس
- سعال جاف
- ألم في الصدر
- نفث الدم المتقطع
- الوهن
- استرواح صدري
علم الوراثة
يعد مرض التحصي المكروي السنخي الرئوي وراثيا ويمكن تحديد أحد أفراد الأسرة المصابين بالمرض نفسه في 36٪ إلى 61٪ من الحالات،[4] ويعتبر النشاط المعوق لجين SLC34A2 مسؤولا عن PAM؛[1][2][5][8][9][10] حيث يقوم الجين SLC34A2 بتشفير بروتين الغشاء الذي يتم التعبير عنه بشكل أساسي في الأجزاء القمية للخلايا السنخية من النوع الثاني[11] وهو حامل الفوسفات الأكثر وفرة في الرئتين.[5]
نشأة وتطور المرض
للخلايا السنخية من النوع الثاني وظائف عديدة مهمة في الرئة بما في ذلك إنتاج المادة الفعالة بالسطح الرئوي والحفاظ على توازن السوائل وتكوينها في الحيز الهوائي، يقوم المرض بتكسير الشحميات الفسفورية التي تشكل المادة الفعالة بالسطح الرئوي عن طريق البلاعم وتطلق الفوسفات في سائل البطانة السنخية، ويؤدي فقدان ناقل الفوسفات (Npt2b) إلى القضاء على قدرة خلايا السنخية من النوع الثاني على ضخ أيونات الفوسفور من الفضاء السنخي مرة أخرى إلى مجرى الدم ويؤدي إلى تكوين حصاة دقيقة.[5][12]
يؤدي الحذف الظهاري لNpt2b في الفئران إلى محاكاة ذات حجة للحالة الإنسانية بما في ذلك تراكم حصوات فوسفات الكالسيوم الدقيقة في أنسجة الرئة والعتامة الإشعاعية المنتشرة التدريجية، كما يوفر نموذج الفأرة منصة مفيدة للدراسات قبل السريرية بما في ذلك التجارب العلاجية للغسل بEDTA وتقليل حمية الفوسفات (رباط الفوسفات).[13]
علم الأمراض
قد يقتصر PAM على مناطق معينة أو يظهر توزيع منتشر خلال الرئتين،[6] وتبرز خزعة الرئة وعينات تشريح الجثث حصوات صغيرة صفاحية داخل السنخي،[6][14] وتبدأ رواسب الكالسيوم في الحويصلات الهوائية في الفصوص السفلية وتنتشر على مدى سنوات في جميع أنحاء الرئتين.[3]
تشخيص
عادة ما يتم تشخيص PAM على أساس نمط إشعاعي نموذجي أي العقد الصغرية الدقيقة للغاية التي تشبه حبات الرمل لكثافة الكالسيوم التي تنتشر على كلا الرئتين مع غلبة القاعدية، ويجادل العديد من المؤلفين بأن هذا النمط يحول دون الحاجة إلى خزعة الرئة في معظم الحالات،[3][15][16] وبعد تشخيص PAM في مريض معين يجب فحص أفراد الأسرة من خلال تصوير الصدر بالأشعة السينية، ويجب نصح الآباء بأن الأطفال في المستقبل معرضون أيضًا لخطر الإصابة بالمرض.[17]
طب إشعاعي
عادة ما تكشف الآشعة الصدرية للمرضى الذين يعانون من PAM تكلسات عقد صغرية دقيقة منتشرة ثنائية الجانب وإنتاج "عاصفة رملية" المظهر تنطوي أولا الأجزاء السفلية ثم الأجزاء الوسطى والعليا من الرئتين.[3]
تصوير مقطعي محوسب عالي الميز
إن أكثر النتائج شيوعًا في التصوير المقطعي المحوسب عالي الميز هي التوهين الزجاجي المفرط الكثافة المنتشر والتكلسات الخطية تحت الجنبية، وغالبًا ما تكون الأكثر شيوعًا في الأجزاء السفلية والخلفية من الرئتين،[15][18][19][20][21][22] وبالإضافة إلى ذلك يبدو أن الجوانب المتوسطة للرئتين متورطة بشكل أكبر من الجوانب الجانبية،[20] وتعد عتامات الزجاج الأرضي -ربما نتيجةً للحصيات الصغيرة في الفراغات الهوائية- أكثر النتائج شيوعًا عند الأطفال والمرضى الذين يعانون من PAM في المرحلة المبكرة.[19]
تصوير بالرنين المغناطيسي
في التصوير بالرنين المغنطيسي (MRI) عادةً ما تُظهر الآفات الكلسية نقص الكثافة أو إبطال الإشارة على الصور المرجحة T1 و T2.
دراسات وظائف الرئة
تعد اختبارات وظائف الرئة وغازات الدم الشرياني وعلاقات نضح التهوية والقدرة على انتشار O2 طبيعية في المراحل الأولية من PAM، ومع تقدم المرض تكشف الاختبارات الوظيفة الرئوية عن السمات النموذجية لعيب مقيد مع انخفاض القدرة الحيوية القسرية (FVC) وارتفاع حجم الزفير القسري في FEV1 / FVC.
علاج
حتى الآن لم يثبت أي علاج لعكس أو منع تطور PAM بشكل فعال، ويعتبر زرع الرئة خيارًا لمرض المرحلة النهائية ولكن يوصى به عادة كملاذ أخير فقط عندما تكون جودة الحياة ضعيفة.[23]
الإيتدرونات عبارة عن فسفونات ثنائية ويمكن أن تقلل من تكوين بلورات هيدروكسي أباتيت الكالسيوم، وقد أدى إلى تحسينات سريرية وإشعاعية في حالات قليلة.[24]
علم الأوبئة
منذ أن تم وصف المرض لأول مرة في عام 1918 ظهر أكثر من 500 تقرير حالة في الوثائق،[25] ويرتبط PAM بالقرابة، وتعد نسبة الإصابة أعلى في تركيا واليابان والهند وإيطاليا،[26] ومتوسط العمر عند التشخيص هو 35 عامًا بناءً على الحالات المذكورة في الوثائق.
المجتمع
يعد التحصي المكروي السنخي الرئوي أحد أمراض الرئة النادرة التي تدرسها حاليًا جمعية أمراض الرئة النادرة (RLDC)، ويتم تشجيع مرضى وعائلات داء الحويصلات الرئوية الصغير السنّي ومقدمي الرعاية على الانضمام إلى سجل الاتصال التابع لجمعية أمراض الرئة النادرة لمعاهد الصحة العالمية، ويعد هذا موقع محمي من الخصوصية يوفر معلومات حديثة للأفراد المهتمين بأحدث الأخبار العلمية والتجارب والعلاجات المتعلقة بأمراض الرئة النادرة.
مراجع
- Huqun; Izumi, S; Miyazawa, H; Ishii, K; Uchiyama, B; Ishida, T; Tanaka, S; Tazawa, R; Fukuyama, S (2007). "Mutations in the SLC34A2 gene are associated with pulmonary alveolar microlithiasis". Am J Respir Crit Care Med. 175 (3): 263–268. doi:10.1164/rccm.200609-1274oc. PMID 17095743.
- Corut, A; Senyigit, A; Ugur, SA; Altin, S; Ozcelik, U; Calisir, H; Yildirim, Z; Gocmen, A; Tolun, A (2006). "Mutations in SLC34A2 cause pulmonary alveolar microlithiasis and are possibly associated with testicular microlithiasis". Am J Hum Genet. 79 (4): 650–656. doi:10.1086/508263. PMID 16960801.
- Mariotta, S; Ricci, A; Papale, M; DeClementi, F; Sposato, B; Guidi, L; et al. (2004). "Pulmonary alveolar microlithiasis: report on 576 cases published in the literature". Sarcoidosis Vasc Diffuse Lung Dis. 21 (3): 173–181. PMID 15554073.
- Castellana, G; Lamorgese, V (2003). "Pulmonary alveolar microlithiasis. World cases and review of the literature". Respiration. 70 (5): 549–555. doi:10.1159/000074218. PMID 14665786.
- Tachibana, T; Hagiwara, K; Johkoh, T (2009). "Pulmonary alveolar microlithiasis: review and management". Curr Opin Pulm Med. 15 (5): 486–490. doi:10.1097/mcp.0b013e32832d03bb. PMID 19617834.
- Lauta, VM (2003). "Pulmonary alveolar microlithiasis: an overview of clinical and pathological features together with possible therapies". Respir Med. 97 (10): 1081–1085. doi:10.1016/s0954-6111(03)00140-9. PMID 14561014.
- Korn, MA; Schurawitzki, H; Klepetko, W; Burghuber, OC (1992). "Pulmonary alveolar microlithiasis: findings on high-resolution CT". AJR Am J Roentgenol. 158 (5): 981–982. doi:10.2214/ajr.158.5.1566701. PMID 1566701.
- Senyiğit, A; Yaramiş, A; Gürkan, F; Kirbaş, G; Büyükbayram, H; Nazaroğlu, H; Alp, MN; Topçu, F (2001). "Pulmonary alveolar microlithiasis: a rare familial inheritance with report of six cases in a family. Contribution of six new cases to the number of case reports in Turkey". Respiration. 68 (2): 204–209. doi:10.1159/000050494. PMID 11287838.
- Huqun; Izumi, S; Miyazawa, H; Ishii, K; Uchiyama, B; Ishida, T; et al. (2006). "The autozygous segments predicted by a genome-wide SNP typing revealed mutations in the type IIb sodium phosphate cotransporter (SLC34A2) causing pulmonary alveolar microlithiasis". Proc Am Thorac Soc. 3: A102.
- Hagiwara, K; Johkoh, T; Tachibana, T (2009). Pulmonary alveolar microlithiasis. New Jersey: Humana Press.
- Traebert, M; Hattenhauer, O; Murer, H; Kaissling, B; Biber, J (1999). "Expression of type II Na-P(i) cotransporter in alveolar type II cells". Am J Physiol. 277 (5 Pt 1): 868–873. doi:10.1152/ajplung.1999.277.5.L868. PMID 10564169.
- Poelma, DL; Ju, MR; Bakker, SC; Zimmermann, LJ; Lachmann, BF; van Iwaarden, JF (2004). "A common pathway for the uptake of surfactant lipids by alveolar cells". Am J Respir Cell Mol Biol. 30 (5): 751–758. doi:10.1165/rcmb.2003-0127oc. PMID 14644915.
- Saito, A; Nikolaidis, NM; Amlal, H; Uehara, Y; Gardner, JC; LaSance, K; Pitstick, LB; Bridges, JP; Wikenheiser-Brokamp, KA (2015). "Modeling pulmonary alveolar microlithiasis by epithelial deletion of the Npt2b sodium phosphate cotransporter reveals putative biomarkers and strategies for treatment". Sci Transl Med. 7 (313): 313ra181. doi:10.1126/scitranslmed.aac8577. PMID 26560359.
- Barnard, NJ; Crocker, PR; Blainey, AD; Davies, RJ; Ell, SR; Levison, DA (1987). "Pulmonary alveolar microlithiasis. A new analytical approach". Histopathology. 11 (6): 639–645. doi:10.1111/j.1365-2559.1987.tb02674.x. PMID 3623431.
- Marchiori, E; Gonçalves, CM; Escuissato, DL; Teixeira, KI; Rodrigues, R; Barreto, MM; Esteves, M (2007). "Pulmonary alveolar microlithiasis: high-resolution computed tomography findings in 10 patients". J Bras Pneumol. 33 (5): 552–557. doi:10.1590/S1806-37132007000500010. PMID 18026653.
- Sahin, U; Yildiz, M; Bircan, HA; Akkaya, A; Candir, O (2004). "Absence of pulmonary uptake of Tc-99m methylenediphosphonate in alveolar microlithiasis". Ann Nucl Med. 18 (8): 695–698. doi:10.1007/bf02985964. PMID 15682851.
- Helbich, TH; Wojnarovsky, C; Wunderbaldinger, P; Heinz-Peer, G; Eichler, I; Herold, CJ (1997). "Pulmonary alveolar microlithiasis in children: radiographic and high- resolution CT findings". AJR Am J Roentgenol. 168 (1): 63–65. doi:10.2214/ajr.168.1.8976922. PMID 8976922.
- Cluzel, P; Grenier, P; Bernadac, P; Laurent, F; Picard, JD (1991). "Pulmonary alveolar microlithiasis: CT findings". J Comput Assist Tomogr. 15 (6): 938–942. doi:10.1097/00004728-199111000-00006. PMID 1939772.
- Schmidt, H; Lörcher, U; Kitz, R; Zielen, S; Ahrens, P; König, R (1996). "Pulmonary alveolar microlithiasis in children". Pediatr Radiol. 26 (1): 33–36. doi:10.1007/bf01403701. PMID 8598991.
- Deniz, O; Ors, F; Tozkoparan, E; Ozcan, A; Gumus, S; Bozlar, U; Bilgic, H; Ekiz, K; Demirci, N (2005). "High resolution computed tomographic features of pulmonary alveolar microlithiasis". Eur J Radiol. 55 (3): 452–460. doi:10.1016/j.ejrad.2005.01.010. PMID 16129256.
- Hoshino, H; Koba, H; Inomata, S; Kurokawa, K; Morita, Y; Yoshida, K; Akiba, H; Abe, S (1998). "Pulmonary alveolar microlithiasis: highresolution CT and MR findings". J Comput Assist Tomogr. 22 (2): 245–248. doi:10.1097/00004728-199803000-00016. PMID 9530388.
- Gasparetto, EL; Tazoniero, P; Escuissato, DL; Marchiori, E; Frare, E; Silva, RL; Sakamoto, D (2004). "Pulmonary alveolar microlithiasis presenting with crazy-paving pattern on high resolution CT". Br J Radiol. 77 (923): 974–976. doi:10.1259/bjr/96331922. PMID 15507428.
- Stamatis, G; Zerkowski, HR; Doetsch, N; Greschuchna, D; Konietzko, N; Reidemeister, JC (1993). "Sequential bilateral lung transplantation for pulmonary alveolar microlithiasis". Ann Thorac Surg. 56 (4): 972–975. doi:10.1016/0003-4975(93)90370-w. PMID 8215680.
- Ozcelik, U; Yalcin, E; Ariyurek, M; Ersoz, DD; Cinel, G; Gulhan, B; Kiper, N (2010). "Long-term results of disodium etidronate treatment in pulmonary alveolar microlithiasis". Pediatr Pulmonol. 45 (5): 514–517. doi:10.1002/ppul.21209. PMID 20425862.
- Mariotta, S; Guidi, L; Mattia, P; Torrelli, L; Pallone, G; Pedicelli, G; Bisetti, A (1997). "Pulmonary microlithiasis. Report of two cases". Respiration. 64 (2): 165–169. doi:10.1159/000196663. PMID 9097354.
- Castellana, G; Gentile, M; Castellana, R; Fiorente, P; Lamorgese, V (2002). "Pulmonary alveolar microlithiasis: clinical features, evolution of the phenotype, and review of the literature". Am J Med Genet. 111 (2): 220–224. doi:10.1002/ajmg.10530. PMID 12210357.