حمض هيبوفلوروز هو مركب كيميائي من الفلور والأكسجين والهيدروجين له الصيغة HOF، وهو الحمض الأكسجيني الوحيد المعروف للفلور.
| حمض هيبوفلوروز | |
|---|---|
البنية في الحالة الغازية
| |
| الاسم النظامي (IUPAC) | |
Hypofluorous acid |
|
| أسماء أخرى | |
Hydrogen hypofluorite |
|
| المعرفات | |
| رقم CAS | 14034-79-8 |
| بوب كيم (PubChem) | 123334 |
| الخواص | |
| الصيغة الجزيئية | HOF |
| الكتلة المولية | 36.01 غ/مول |
| المظهر | سائل أصفر شاحب (عند 0 °س) |
| نقطة الانصهار | −117 °س |
| نقطة الغليان | 10–20 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التحضير
يحضر حمض هيبوفلوروز بكميات ضئيلة مع حمض هيدروفلوريك والأكسجين من تفاعل الفلور الجزيئي مع الجليد عند درجات حرارة منخفضة تصل إلى −40 °س. عند إجراء التفاعل في مصيدة مبرّدة بالنتروجين السائل يمكن الحصول عندئذ على حمض هيبوفلوروز على شكل صلب أبيض.
الخواص
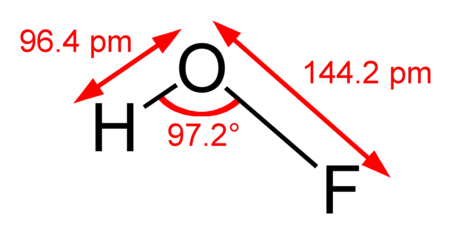
لمركب حمض هيبوفلوروز بنية جزيئية منحنية، حيث تبلغ زاوية الرابطة 97,2°، ولا تكون الروابط متساوية، إذ أن طول الرابطة O–H يبلغ 96.4 بيكومتر، في حين أن طول الرابطة O–F يبلغ 144.2 بيكومتر.[2]
إن حمض هيبوفلوروز هو مركب غير مستقر، إذ سرعان ما يتفكك إلى حمض هيدروفلوريك والأكسجين بشكل عنيف أحياناً:[3]
يكون للأكسجين في هذا المركب حالة أكسدة مقدارها 0، وهو أمر نادر الحدوث. كما يعد من المؤكسدات القوية.
الاستخدامات
يستخدم حمض هيبوفلوروز في الأسيتونتريل، والذي يحضر في الموقع in situ من تمرير الفلور الغازي خلال أسيتونتريل الرطب، وذلك كعامل ناقل للأكسجين محب للإلكترون للغاية.[4][5] عند معالجة مركب فينانثرولين بهذا العامل يعطي مركب 10,1-ثنائي أكسيد فينانثرولين، صعب الاستحصال في العادة.[6]
هيبوفلوريت
تسمى أملاح حمض هيبوفلوروز باسم هيبوفلوريت، وهي صعبة الاستحصال والتحضير في العادة، لعدم ثباتيو واستقرار المركب الأصلي. على الرغم من ذلك فقد جرى التمكن من تحضير مركب هيبوفلوريت ثلاثي فلوروميثيل CF3OF.
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/123334 — تاريخ الاطلاع: 6 أكتوبر 2016 — العنوان : Hypofluorous acid — الرخصة: محتوى حر
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. de Gruyter, Berlin 2007, , P. 466
- W. Poll; G. Pawelke; D. Mootz; E. H. Appelman (1988). "The Crystal Structure of Hypofluorous Acid : Chain Formation by O-H · · · O Hydrogen Bonds". Angew. Chem. Int. Ed. Engl. 27 (3): 392–3. doi:10.1002/anie.198803921.
- S. Rozen; M. Brand (1986). "Epoxidation of Olefins with Elemental Fluorine in Water/Acetonitrile Mixtures". Angew. Chem. Int. Ed. 25 (6): 554–5. doi:10.1002/anie.198605541.
- S. Dayan; Y. Bareket; S. Rozen (1999). "An efficient α-hydroxylation of carbonyls using the HOF·CH3CN complex". Tetrahedron. 55 (12): 3657. doi:10.1016/S0040-4020(98)01173-9.
- S. Rozen; S. Dayan (1999). "At Last, 1,10-Phenanthroline-N,N′-dioxide, A New Type of Helicene, has been Synthesized using HOF·CH3CN". Angew. Chem. Int. Ed. 38 (23): 3471–3. doi:10.1002/(SICI)1521-3773(19991203)38:23<3471::AID-ANIE3471>3.0.CO;2-O.