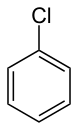
الكلوروبنزين هو مركب عضوي عطري له الصيغة الكيميائية C 6 H 5 Cl. وهو سائل عديم اللون وقابل للاشتعال وهو مذيب شائع وسيط يستخدم على نطاق واسع في تصنيع المواد الكيميائية الأخرى.[3]
| Chlorobenzene | |
|---|---|
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
Chlorobenzene |
|
| أسماء أخرى | |
Phenyl chloride |
|
| المعرفات | |
| الاختصارات | PhCl |
| رقم CAS | 108-90-7  |
| بوب كيم (PubChem) | 7964 |
| الخواص | |
| الصيغة الجزيئية | C6H5Cl |
| الكتلة المولية | 112.56 g/mol |
| المظهر | سائل عديم اللون |
| الرائحة | شبيه برائحة اللوز[1] |
| الكثافة | 1.11 g/cm³, liquid |
| نقطة الانصهار | -45 °س، 228 °ك، -49 °ف |
| نقطة الغليان | 131 °س، 404 °ك، 268 °ف |
| الذوبانية في الماء | 0.5 g l−1 في الماء على20 °C |
| الذوبانية في other solvents | قابل للذوبان في معظم المذيبات العضوية |
| ضغط البخار | 9 mmHg[1] |
| قابلية مغناطيسية | -69.97·10−6 cm3/mol |
| المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| NFPA 704 |
|
| حدود الاشتعال | 1.3%-9.6%[1] |
| حد التعرض المسموح به U.S | TWA 75 ppm (350 mg/m3)[1] |
| LD50 | 2290 mg/kg (rat, oral) 2250 mg/kg (rabbit, oral) 2300 mg/kg (mouse, oral) 2250 mg/kg (guinea pig, oral)[2] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الاستخدامات
الاستخدام الرئيسي لكلور البنزين هو وسيط في إنتاج السلع مثل مبيدات الأعشاب والأصباغ والمطاط. يستخدم الكلوروبنزين أيضًا كمذيب عالي الغليان في العديد من التطبيقات الصناعية وكذلك في المختبرات.[4][5]
الكلوروبنزينه كان يستخدم مرة واحدة في تصنيع بعض المبيدات الحشرية، وأبرزها DDT، من خلال التفاعل مع الكلورال (ثلاثي كلورأسيتالدهيد)، ولكنها امتنعت هذا التطبيق مع استخدام تقلص من DDT. في وقت من الأوقات ، كان كلوروبنزين البشير الرئيسي لتصنيع الفينول : [6]
- C 6 H 5 Cl + NaOH → C 6 H 5 OH + NaCl
يحتوي التفاعل أيضًا على منتج ثانوي من الملح. يُعرف التفاعل باسم عملية Dow ، ويتم إجراء التفاعل عند 350 درجة مئوية باستخدام هيدروكسيد الصوديوم المنصهر بدون مذيب. تُظهر تجارب وضع العلامات أن التفاعل يستمر عبر الإزالة أو الإضافة، من خلال البنزين كوسيط .
إنتاج
تم وصفه لأول مرة في عام 1851. يتم تصنيع كلوروبنزين عن طريق الكلورة للبنزين في وجود كمية حفازة من حمض لويس مثل كلوريد الحديديك وثاني كلوريد الكبريت وكلوريد الألومنيوم اللامائي: [3]
طرق المختبر
يمكن إنتاج الكلوروبنزين من الأنيلين عن طريق كلوريد بنزينديازونيوم، والمعروف باسم تفاعل ساندميير.
السلامة
يُظهر الكلوروبينزين سمية "منخفضة إلى معتدلة" كما يتضح من LD50
حوالي 2.9 جم / كجم.[4] حددت إدارة السلامة والصحة المهنية حد التعرض المسموح به عند 75 جزء في المليون (350 ملغم / م 3) أكثر من متوسط مرجح لمدة ثماني ساعات للعمال الذين يتعاملون مع كلورو بنزين.[7]
علم السموم والتحلل البيولوجي
يمكن أن يستمر الكلوروبنزين في التربة لعدة أشهر، وفي الهواء لمدة ثلاثة أيام ونصف تقريبًا، وفي الماء لمدة تقل عن يوم واحد. قد يتعرض البشر لهذا العامل عن طريق تنفس الهواء الملوث (بشكل أساسي عن طريق التعرض المهني)، أو استهلاك الطعام أو الماء الملوث، أو عن طريق الاتصال بالتربة الملوثة (عادة بالقرب من مواقع النفايات الخطرة). ومع ذلك، فإنه لا يعتبر ملوثًا بيئيًا واسع الانتشار.[8]
إذا دخل الجسم بأي طريقة كانت، فإنه عادةً ما يُفرز عن طريق الرئتين والجهاز البولي.
المراجع
- "NIOSH Pocket Guide to Chemical Hazards #0121". المعهد الوطني للسلامة والصحة المهنية (NIOSH).
- "Chlorobenzene". Immediately Dangerous to Life and Health. المعهد الوطني للسلامة والصحة المهنية (NIOSH).
- U. Beck, E. Löser "Chlorinated Benzenes and other Nucleus-Chlorinated Aromatic Hydrocarbons" Ullmann's Encyclopedia of Industrial Chemistry, 2012, Wiley-VCH, Weinheim. doi:10.1002/14356007.o06_o03
- Rossberg, Manfred; Lendle, Wilhelm; Pfleiderer, Gerhard; Tögel, Adolf; Dreher, Eberhard-Ludwig; Langer, Ernst; Rassaerts, Heinz; Kleinschmidt, Peter; Strack, Heinz (2006). "Chlorinated Hydrocarbons". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a06_233.pub2. .
- Gerald Booth (2007). "Nitro Compounds, Aromatic". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_411. .
- Weber, Manfred; Weber, Markus; Kleine-Boymann, Michael (2004). "Phenol". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a19_299.pub2. .
- CDC - NIOSH Pocket Guide to Chemical Hazards - تصفح: نسخة محفوظة 2020-04-12 على موقع واي باك مشين.
- Rehfuss, M.; Urban, J. (2005). "Rhodococcus phenolicus sp. nov., a novel bioprocessor isolated actinomycete with the ability to degrade chlorobenzene, dichlorobenzene and phenol as sole carbon sources". Systematic and Applied Microbiology. 28 (8): 695–701. doi:10.1016/j.syapm.2005.05.011. PMID 16261859. Erratum: Rehfuss, M. (2006). "Erratum to "Rhodococcus phenolicus sp. nov., a novel bioprocessor isolated actinomycete with the ability to degrade chlorobenzene, dichlorobenzene and phenol as sole carbon sources" [Systematic and Applied Microbiology 28 (2005) 695–701]". Systematic and Applied Microbiology. 29 (2): 182. doi:10.1016/j.syapm.2005.11.005.
روابط خارجية
 وسائط متعلقة بـ كلوروبنزين في كومنز.
وسائط متعلقة بـ كلوروبنزين في كومنز.