ميثيل الليثيوم هو مركب ليثيوم عضوي له الصيغة CH3Li.
| ميثيل الليثيوم | |
|---|---|
| الاسم النظامي (IUPAC) | |
Methyllithium |
|
| المعرفات | |
| الاختصارات | MeLi |
| رقم CAS | 917-54-4 |
| بوب كيم (PubChem) | 2724049 |
| الخواص | |
| الصيغة الجزيئية | CH3Li |
| الكتلة المولية | 21.98 غ/مول |
| المظهر | صلب |
| الذوبانية في الماء | يتفاعل مع الماء |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التحضير
حضر ميثيل الليثيوم لأول مرة من قبل فيلهلم شلينك عام 1917.[2]
يحضّر المركب من تفاعل برومو الميثان مع مستعلق من فلز الليثيوم في وسط من ثنائي إيثيل الإيثر.
يشكّل بروميد الليثيوم الناتج معقّداً مع ميثيل الليثيوم، والذي غالباً ما يظهر كشائبة في العينات التجارية.[3]
يمكن الحصول على ميثيل الليثيوم بشكل خال من الهالوجين وذلك بإجراء تفاعل لليثيوم مع كلورو الميثان، حيث أن كلوريد الليثيوم الناتج لا يشكل معقداً مع ميثيل الليثيوم.[4]
الخصائص
إن مركب ميثيل الليثيوم ذو نشاط كيميائي كبير، لذلك يستخدم في أوساط ومحلات لابروتونية مثل ثنائي إيثيل الإيثر أورباعي هيدرو الفوران أو ثنائي ميثوكسي الإيثان. يعد ميثيل الليثيوم قاعدة قوية بالإضافة إلى كونه كاشف محب للنواة لأن ذرة الكربون تكون حاملة للشحنة السالبة. لذلك فإنه عند درجة حرارة الغرفة فإن MeLi يتفاعل مع THF، كما أن التفاعل يكون عنيفاً مع الماء أو الكحولات.
البنية
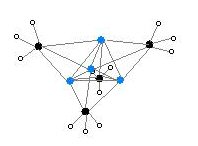
هناك بنيتين لمركب ميثيل الليثيوم جرى التحقق منهما باستخدام دراسة البلورات بالأشعة السينية بالإضافة إلى مطيافية الرنين المغناطيسي النووي NMR الخاصة بـ 6Li و 7Li و 13C. أظهرت هذه الدراسات أن البنية عبارة عن تجمّع عنقودي من أربع وحدات لها بنية كوبان مشوهة، تكون فيها ذرات الكربون والليثيوم على الزوايا بشكل متناوب. إن البعد بين ذرتي ليثيوم Li---Li هو 2.68 Å، وهو فريب من طول الرابطة في ثنائي الليثيوم، في حين أن المسافة بين C-Li هي 2.31 Å. يرتبط الكربون إلى ثلاث ذرات هيدروجين وثلاث ذرات ليثيوم.
إن عدم تطايرية MeLi)4) وعدم انحلاليته في الألكانات ناتج عن حقيقة أن هذه العناقيد تتآثر مع بعضها البعض بشكل بيني. إن هذه الظاهرة لا تلاحظ في ثالثي بوتيل الليثيوم لأن هذه التأثيرات المتبادلة لا تصبح فعالة بسبب الإعاقة الفراغية، بالتالي فالمركب الأخير متطاير وينحل في الألكانات.[5]
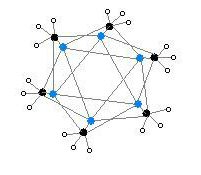
إن النمط الثاني من ميثيل الليثيوم يكون على شكل سداسي وحدات مرتب على هيئة موشور سداسي الوجوه تتاوب فيه ذرات الليثيوم والكربون على الزوايا.
إن درجة التجمع "n" في MeLi)n) تعتمد على المذيب وعلى وجود مواد إضافية مثل بروميد الليثيوم. إن المذيبات الهيدروكربونية مثل البنزين تفضّل تشكيل سداسي الوحدات، في حين أن المذيبات الإيثيرية تفضّل رباعي الوحدات.[6]
الاستخدامات
يستخدم ميثيل الليثيوم ككاشف من أجل الألكلة ومن أجل المَثيَلة (إضافة الميثيل).
يتفاعل على سبيل المثال الكيتون في تفاعل من مرحلتين إلى كحول ثالثي:
يمكن أن تتفاعل المركبات الهالوجينية لغير الفلزات مع ميثيل الليثيوم حيث تنتج مركبات الميثيل الموافقة:
المراجع
- وصلة : معرف بوب كيم — الرخصة: محتوى حر
- W. Schlenk, J. Holtz, Ber. Dtsch. Chem. Ges. 50 (1917) 262–274.
- M. J. Lusch, M. V. Phillips, W. V. Sieloff, G. S. Nomura, H. O. House, Preparation of Low-Halide Methyllithium, Organic Syntheses, 1990, Collective Volume 7, S. 346. (pdf). نسخة محفوظة 23 يناير 2012 على موقع واي باك مشين.
- Lusch, M. J.; Phillips, W. V.; Sieloff, R. F.; Nomura, G. S.; House, H. O. (1984), "Preparation of Low-Halide Methyllithium", Org. Synth. 62: 101; Coll. Vol. 7: 346
- Elschenbroich, C. (2006). Organometallics. Weinheim: Wiley-VCH. .
- Brown, T. L.; Rogers, M. T. (1957). "The Preparation and Properties of Crystalline Lithium Alkyls". Journal of the American Chemical Society. 79 (8): 1859–1861. doi:10.1021/ja01565a024.