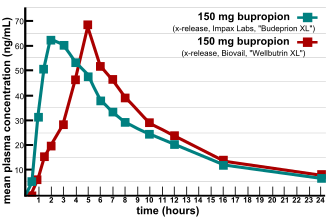
التكافؤ الحيوي (Bioequivalence) هو مصطلح يستخدم في علم الحرائك الدوائية (pharmacokinetics) لتقدير وتقييم التساوي الحيوي بين مستحضرين داوئيين من حيث الفعالية والتأثير داخل الجسم أو يعرف بانه عدم وجود أي فـرق إحصائي اعتباري يتعلق بالتوافر الحيوي للمادة الفاعلة في المستحضرات المتكافئة صيدلانياً أو المتبادلة صيدلانياً بعد اعطاء نفس الجرعة المولية (Molar Dose) وتحت نفس الظروف في دراسة مصممة بشكل ملائم.[1]
- عرف (بيركيت) (Birkett) عام (2003)م التكافؤ الحيوي على أنه يكون "اثنين من المنتجات الصيدلانية متكافئين حيوياً، إذا كانا متكافئين صيدلانياً ولهما نفس التوافر الحيوي (معدل ومدى توافر) بعد ان يتناولهم الشخص بنفس الجرعة، مع الاخذ بالاعتبار كل من الكفاءة والسلامة لكل منهما.[2]
- التكافئ الدوائي (bioequivalence) يعني نفس الكمية من نفس المادة الفعالة (س)، في نفس الجرعة ونفس طريقة تناولها.
- عرفت (إدارة الغذاء والدواء) في الولايات المتحدة، التكافئ الدوائي (bioequivalence)، بانه عدم وجود اختلاف كبير في المواد المتكافئة صيدلانياً أو البدائل الصيدلانية والتي تصبح متوافرة في مكان تأثير الدواء في المعدل والمدى من العناصر الدوائية الفعالة عندما تاخذ تحت نفس الظروف.[3]
التكافؤ الحيوي
هذه العملية الصيدلانيه عباره عن اختبار لفاعلية عقارات علاجية من خلال فحص المادة الخام لمستحضر طبي تقليدي ومقارنتها مع المادة الخام للمستحضر الرئيسي (originator)، وخاصة المضادات الحيوية وأدوية الضغط والسكري وغيرها.
التكافؤ العلاجي (Therapeutic equivalence):
يعتبر المستحضر الصيدلاني متكافئ علاجياً مع مستحضر مرجعي آخر إذا كان لهما نفس التأثير الدوائي ونفس مأمونية الاستخدام ويؤكد ذلك نتائج دراسة التكافؤ الحيوي للمستحضرات المتكافئة صيدلانياً أو المتبادلة صيدلانياً.
التعريف التنظيمي
أستراليا
في أستراليا إدارة السلع الدوائية Therapeutics Goods Administration تشديد هناك في متطلبات الدواء مع تضيق المؤشر العلاجي أو الأيض Cmax و AUC في المدى 0.80-1.25. Tmax يكون مشابه للمنتجات .[2] وبالتالي وجود المنتجات الجنيسة في تشبع السوق الأسترالية لالديجوكسين أو الفينيتوين على سبيل المثال.
أوروبا
الولايات المتحدة
تسجيل الدواء الجديد
يجب ان يحوي طلب الترخيص لاستعمال دواء جديد NDA الفقرات الفنية الستة التالية :
- السريريات.
- الحرائك الدوائية البشرية والتوافر الحيوي.
- التركيب الكيميائي ، والتصنيع ، والضوابط.
- الدراسة الميكروبيولجية.
- الدراسة الفارماكولوجية والسمية غير السريرية.
- الإحصاءات.[4]
مقالات ذات صلة
المراجع
- http://pharmaguidelines.blogspot.com/p/pharma-search.html?cx=partner-pub-8715253958322360:6195957961&cof=FORID:10&ie=UTF-8&q=Bioequivalence&sa=Search
- Birkett DJ (2003). "Generics - equal or not?" ( كتاب إلكتروني PDF ). Aust Prescr. 26: 85–7. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 26 يونيو 2012.
- Center for Drug Evaluation and Research (2003). "Guidance for Industry: Bioavailability and Bioequivalence Studies for Orally Administered Drug Products — General Considerations" ( كتاب إلكتروني PDF ). United States Food and Drug Administration. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 26 فبراير 2015.
- Editing Bioequivalence - Wikipedia, the free encyclopedia - تصفح: نسخة محفوظة 3 مايو 2019 على موقع واي باك مشين.
وصلات خارجية
- Hussain AS, et al. The Biopharmaceutics Classification System: Highlights of the FDA's Draft Guidance Office of Pharmaceutical Science, Center for Drug Evaluation and Research, Food and Drug Administration.
- Mills D (2005). Regulatory Agencies Do Not Require Clinical Trials To Be Expensive International Biopharmaceutical Association: IBPA Publications.
- FDA CDER Office of Generic Drugs – further U.S. information on bioequivalence testing and generic drugs