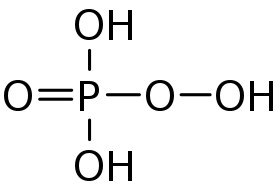
حمض بيروكسي أحادي الفوسفوريك هو حمض أكسجيني للفوسفور صيغته H3PO5، ويوجد على شكل سائل لزج عديم اللون.[2]
| حمض بيروكسي أحادي الفوسفوريك | |
|---|---|
| الاسم النظامي (IUPAC) | |
Peroxymonophosphoric acid |
|
| المعرفات | |
| CAS | 13598-52-2 |
| بوب كيم | 6326786 |
| الخواص | |
| الصيغة الجزيئية | H3PO5 |
| الكتلة المولية | 114.00 غ/مول |
| المظهر | سائل عديم اللون |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
يرمز له اختصاراً PMPA، وتسمى أملاحه بيروكسي أحادي الفوسفات.
التحضير
يحضر هذا الحمض من تفاعل خماسي أكسيد الفوسفور مع بيروكسيد الهيدروجين المركز في وسط عضوي مثل الأسيتونتريل ورباعي كلوريد الكربون:[2][3]
يستحصل أيضاً على هذا الحمض من معالجة حمض الفوسفوريك بغاز الفلور، حيث ينتج بيروكسي ثنائي حمض الفوسفوريك في المزيج أيضاً.[2]
الخواص
يوجد هذا المركب في الشروط القياسية على شكل سائل عديم اللون، وهو قابل للامتزاج مع المذيبات العضوية مثل الأسيتونتريل والديوكسان.
يخضع هذا الحمض في المحاليل المائية ببطء إلى تفاعل تحلل مائي (حلمهة).[2][4]
الاستخدامات
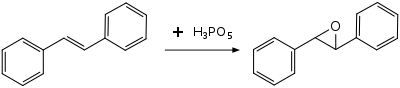
نظراً لخواصه المؤكسدة القوية فهو يستخدم لتفاعلات الأكسدة في المختبرات الكيميائية لعدد من التفاعلات؛ فيمكن الحصول من الستيلبين على الإيبوكسيد الموافق:[5]
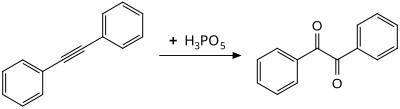
كما يتأكسد ثنائي فينيل الأسيتيلين بواسطته ليعطي البنزل:[6]
كما يؤكسد الميسيتيلين إلى الميسيتول (6,4,2-ثلاثي ميثيل الفينول):[7]
مراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/6326786 — تاريخ الاطلاع: 5 أكتوبر 2016 — العنوان : phosphoroperoxoic acid — الرخصة: محتوى حر
- H. Jakob, S. Leininger, T. Lehmann, S. Jacobi, S. Gutewort: Inorganic Peroxo Compounds. In: Ullmanns Enzyklopädie der Technischen Chemie. Wiley-VCH Verlag, Weinheim 2007, doi:10.1002/14356007.a19_177.pub2.
- T. Zhu, H. Chang, J. F. Kadla: A new method for the preparation of peroxymonophosphoric acid. In: Can. J. Chem. 81, 2003, S. 156–160, doi:10.1139/v03-010.
- C. J. Battaglia, J. O. Edwards: The Dissociation Constants and the Kinetics of Hydrolysis of Peroxymonophosphoric Acid. In: Inorg. Chem. 4, 1965, S. 552–558, doi:10.1021/ic50026a024.
- Y. Ogata, K. Tomizawa, T. Ikeda: Oxidation of trans-stilbene with peroxymonophosphoric acid. In: J. Org. Chem. 44, 1979, S. 2362–2364, doi:10.1021/jo01328a006.
- Y. Ogata, Y. Sawaki, T. Ohno: Mechanism for oxidation of phenylacetylenes with peroxymonophosphoric acid. Oxirene as an intermediate inconvertible to ketocarbene. In: J. Am. Chem. Soc. 104, 1982, S. 216–219, doi:10.1021/ja00365a039.
- Y. Ogata, Y. Sawaki, K. Tomizawa, T. Ohno: Aromatic hydroxylation with peroxymonophosphoric acid. In: Tetrahedron. 37, 1981, S. 1485–1486, doi:10.1016/S0040-4020(01)92087-3.