الحمى القرمزية (وتسمى أيضا الحمى القرمزية العديمة في الادب القديم) [3] هو أحد الأمراض المعدية الأكثر شيوعا في الأطفال. وتشمل علامات وأعراض التهاب الحلق، والحمى، وطفح جلدي أحمر مميز. وعادة ما تنتشر الحمى القرمزية عن طريق الإستنشاق. لا يوجد لقاح معروف لهذه الحالة، ولكن يتم علاج هذا المرض بشكل فعال مع المضادات الحيوية. معظم المظاهر السريرية يسببها السم المولد للحمامى، وهي مادة تنتجها البكتيريا العقدية المقيحة (العقديات مجموعة A) عندما يتلوث بنوع معين من الجراثيم. قبل توافر المضادات الحيوية، كانت الحمى القرمزية سببا رئيسيا للوفاة في العالم. كما أنها أحيانا تسبب بحدوث المضاعفات في وقت لاحق، مثل التهاب كبيبات الكلى والتهاب الشغاف يؤدي إلى مرض صمام القلب، وكلها كانت طويلة الأمد وغالبا ما يرافقها آلام مميتة في ذلك الوقت. سلالات العقيدات من المجموعة (أ) التي تنتج السم المولد للحمامى ليست بطبيعتها أكثر خطورة من السلالات الأخرى التي لا تنتج هذا النوع من السموم . وعملية تشخيص لها أكثر سهولة بسبب الطفح الجلدي المميز.
| حمى قرمزية Scarlet fever | |
|---|---|
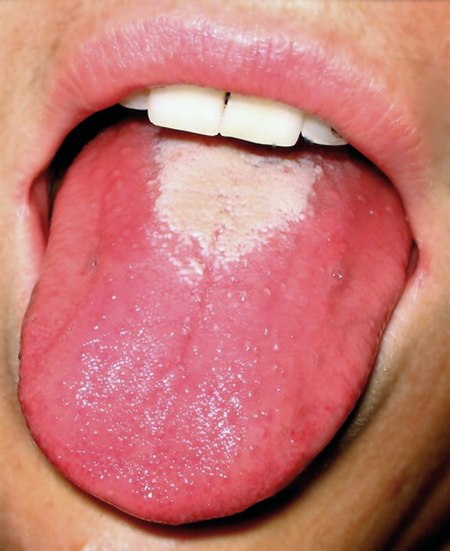
لسان الفراولة الذي يظهر في الحمى القرمزية
| |
| تسميات أخرى | scarlatina,[1] scarletina[2] |
| معلومات عامة | |
| الاختصاص | أمراض معدية |
| من أنواع | أمراض الجهاز التنفسي العلوي، وعدوى المكورة العقدية |
| الأسباب | |
| الأسباب | عقدية مقيحة |
| المظهر السريري | |
| الأعراض | لسان الفراولة، وحمى، وألم بطني، وتقيؤ، وطفح |
العلامات والأعراض
تتميز الحمى القرمزية بما يلي:
- احتقان في الحلق
- حمى
- اللسان الأحمر المشرق يغلب عليه مظهر "الفراولة"
- بقع Forchheimer (، بقع حمراء صغيرة عابرة على الحنك الرخو)
- جنون العظمة
- الهلوسة
- طفح جلدي مميز، بحيث يكون :
- ذو ملمس خشن ودقيق وأحمر اللون
- يتحول للون الابيض عند الضغط عليه
- يظهر بعد 12-72 ساعات من بعد بداية الحمى
- يبدأ عادة على صدره، والآباط، وخلف الأذنين. وقد يظهر أيضا ً في منطقة أصل الفخذ.
- عندما يتواجد على الوجه فهو عادة ما يؤدي إلى مظهر الخدود الحمراء مع وجود منطقة شاحبة مميزة حول الفم
- يكون أسوأ في طيات الجلد (ما يسمى خطوط باستيا، حيث يعمل الطفح معا في الإبطين والاربيه، حيث يمكن أن يظهر ويستمر بعد زوال الطفح الجلدي)
- وقد ينتشر ليغطي اللهاة
- يبدأ بالتلاشي في 3-4 أيام منذ بدء الإصابة والتقشر."هذه المرحلة تبدأ مع رقائق التقشير من الوجه. التقشير من راحة اليد وحول الاصابع قد يحدث بعد مضي أسبوع". وقد يحدث التقشير ايضاً في منطقة الابطين والاربيه ومقدمة أصابع اليدين والقدمين.[3]
الطفح الجلدي
الطفح الجلدي هو العلامة الأكثر لفتا للحمى القرمزية. وعادة ما يظهر أولا على الرقبة والوجه (و غالبا ما يترك المنطقة حول الفم سليمة غير مصابة بالطفح). ويبدو كأنه عبارة عن حروق شمس سيئة مع نتوءات صغيرة، وقد يؤدي إلى الحكة. ثم ينتشر إلى الصدر والظهر وأخيرا إلى باقي الجسم. في طويات الجسم، خصوصا حول الإبطين والمرفقين، الطفح الجلدي يشكل خطوط حمراء معروفة باسم خطوط باستيا. في حالات البشرة الداكنة جدا، قد تظهر خطوط أغمق من بقية الجلد. مناطق الطفح الجلدي عادة ما تتحول إلى اللون الابيض عند الضغط عليه (أو في حالات البشرة الداكنة تتحول إلى اللون البني الفاتح). بدءا ً من اليوم السادس للعدوى، الطفح الجلدي يبدأ عادة بالتلاشي، ولكن الجلد المصاب قد يبدأ بالتقشر.
المظاهر الأخرى
عادة، الاعراض الاخرى التي تساعد على تأكيد تشخيص الحمى القرمزية، تشمل احمرار الحلق والتهابه، الحمى عند أو فوق درجة 101 ° درجه فهرنهايت (38.3ْ درجة مئوية)، وتورم الغدد في الرقبة. يمكن أن تحدث الحمى القرمزية أيضا مع حمى خفيفة. قد تبدو اللوزتين ومؤخرة الحلق مغطاة بطبقة بيضاء، أو تظهر حمراء، منتفخة، ومنقطة مع بقع بيضاء أو صفراء من القيح. في وقت مبكر من العدوى، قد يكون اللسان مغطى بطبقة بيضاء أو صفراء أيضا، قد يصاب الشخص بالقشعريرة وآلام الجسم، والغثيان، والقيء، وفقدان الشهية. في حالات نادرة، قد تتطور الحمى القرمزية من التهاب الجلد الناجم عن العقديات مثل القوباء. وفي هذه الحالات، لا يصاب الشخص بالتهاب الحلق.
الأسباب
عندما تحدث الحمى القرمزية بسبب عدوى في الحلق، تزول الحمى عادة في غضون 3-5 أيام، ويزول التهاب الحلق بعد ذلك بقليل. الطفح القرمزي للحمى يتلاشى عادة في اليوم السادس بعد بدء أعراض التهاب الحلق، وتبدأ بالتقشر (كما هو موضح أعلاه). عادة ما يتم الشفاء من العدوى نفسها مع دورة 10 ايام من المضادات الحيوية، ولكن قد يستغرق بضعة اسابيع للوزتين والغدد المتورمة للعودة إلى وضعها الطبيعي.
الفزيولوجيا المرضية
وعادة ما تنتشر الحمى القرمزية بواسطة استنشاق الأيروسول ولكن يمكن أيضا أن تنتشر عن طريق ملامسة الجلد أو عن طريق الملابس والأشياء. على الرغم من أنه لا تعتبر عادة من الأمراض المنقولة عن طريق الأغذية، الا انه تم الإبلاغ عن تفشي الحمى القرمزية في الصين بسبب لحوم الدجاج المصابة.[4] و قد يحدث حمل المرض بدون أية اعراض ظاهرة في حوالي 20-15% من أطفال المدرسة. فترة الحضانة تعادل 1-4 أيام.
الأحياء المجهرية
وينجم هذا المرض عن طريق إفراز السموم الناتجة عن بعض مولدات الحمى من قبل البكتيريا العقدية.[5][6] الذيفان الخارجي A (sepa A) ربما هو أفضل أنواع السموم المدروسة. ويتم ذلك من قبل جرثومة T12 الذي يندمج مع جينوم العقديات حيث يستنسخ السم. إن الفيروس يقوم بدمج نفسه مع جين سيرين الحمض الريبي النووي النقال على الكرموسوم.[7] لم يتم وضع فيروس T12إلى الأصناف من قبل اللجنة الدولية لتصنيف الفيروسات. أنه يحتوي على جينوم الحمض النووي المزدوج وبناءا ً على الأسس المورفولوجية يبدو أنه عضوا ً في فيروسات سيفاوية. تم استنساخ الجين SPEA وتدرج في عام 1986.[8] تتكون طوليا ً من 753 من الأزواج الأساسية ويقوم بتشفير 29.244 كيلو دالتون بروتين. يحتوي البروتين المزعوم إشارة ببتيدية تتكون من 30 حمض أميني. إزالة تسلسل الإشارة يعطي الوزن الجزيئي المتوقع ما يعادل 25.787 كيلو دالتون للبروتين المفرز. تمثل كل من المروج وموقع ربط الريبوسوم (تسلسل شاين_دالغارنو) المنبع الحالي للجين. يقع الناهي النسخي في 69 قاعدة من نهاية الكودون المترجم النهائي. يظهر الجزء الكاربوكسيلي الطرفي من البروتين تماثل كبير مع النهاية الكاربوكسيلية للمكورات العنقودية الذهبية المعوية C1 وB. قد تحمل اللاقمات العنقودية عدا عن T12 الجين sepaA.[9]
بانتون-فالنتاين لوكوسيدين (PVL) بانتون-فالنتاين لوكوسيدين (PVL) هو ذيفان خلوي مكون من جزئين يستهدف الخلايا المحببة المتعادلة في الإنسان والأرنب، وحيدات الخلايا، أو خلايا البالعات الكبيرة.[10] أقل من 5٪ من سلالات المكورات العنقودية الذهبية التي لديها الجين PVL تنتج هذا السم كعامل سمية، وهي المسؤولة أساسا عن الالتهابات الجلدية والالتهاب الرئوي [11] ويرتبط مع مقاومة الميثيسيلين المكتسبة من المجتمع.[12][13] ويرتبط ذلك مع تفاقم مظاهر جلدية والاستجابة الالتهابية في الأطفال الذين يعانون من الحمى القرمزية العنقودية المرتبطة بالمجتمع.[14]
التشخيص
الحمى القرمزية يمكن تشخيصها بواسطة العلامات والأعراض السريرية. نتائج تعداد الدم المميزة للحمى القرمزية تبين زيادة ملحوظة في تعداد خلايا الدم البيضاء، زيادة في الخلايا المحببة المتعادلة، مع كمية طبيعية أو مرتفعة للخلايا الحمضية، ارتفاع معدل ترسب كريات الدم الحمراء وبروتين C التفاعلي (مؤشرات الالتهاب على حد سواء) وارتفاع حالة العقدية عيار O. ونادرا ً ما تكون زراعة الدم ايجابية. ولكن عادة ما تظهر العقيدات في زراعة الحلق. [بحاجة لمصدر]
التشخيص التفريقي
يجب ان يتم تفريق الحالات من حمى الشرق الاقصى القرمزية، وهو مرض معد تم الإبلاغ عنه لاول مرة في الخمسينات من القرن العشرين في روسيا. بسبب أعراضه السريرية المشابهة للحمى القرمزية، كان يعتقد في البداية أنه ناجم عن المكورات العقدية. ومن المعروف الآن أن عصية-يرسينيا الكاذبة سلبية الغرام هي المسببه له. مرض كاواساكي هو فرق آخر مهم، خاصة في شكلها الغير مكتمل. تظهر الحمى القرمزية مشابهة لمرض كاواساكي في بعض الجوانب، لكنه يفتقر إلى علامات العين أو تورم الأصابع الحمراء وأصابع القدم. ومع ذلك، فإن علامات مرض كاواساكي قد تظهر أكثر من بضعة أيام، بدلا من ظهورها في فترة ظهور الأعراض الأولية. مضاعفات مرض كاواساكي الذي لم يتم تشخيصه كبيرة ولكنها نادرة، وتشمل معدل الوفيات 1-2٪ وتمدد الأوعية الدموية الشريان التاجي.
العلاج
العلاج ومسار الحمى القرمزية لا تختلف عن أي نوع من التهاب الحلق بالبكتيريا العقدية.
مقاومة المضادالحيوي
هنالك سلالة من الحمى القرمزية مقاومة للمضادات الحيوية الماكروليدية مثل الايريثروميسن (أي لا تستجيب لهذه الأدوية)، لكنها لا تزال حساسة إلى المضادات الحيوية البيتالاكتيمية مثل البنسيلين. لقد اكتسحت هذه السلالة مدينة هونجكونج الصينية في عام 2011 مما أدى إلى حدوث حالتي وفاة، لقد كانت هذه الظاهرة الأولى من نوعها منذ حوالي عقد.[15] حسب دراسة أجراها البروفيسور كويك-يونجين، رئيس قسم الأحياء الدقيقة في جامعة هونغ كونغ، هنالك ما يقارب 60٪ من السلالات المنتشرة لمجموعة البكتيريا العقدية التي تسبب الحمى القرمزية مقاومة للمضادات الحيوية الماكروليدية، مقارنة بما كانت عليه بالسابق10-30٪. يعود سبب زيادة المقاومة إلى الاستعمال الزائد للمضادات الحيوية المايكدوليدية في السنوات الاخيرة.
اللقاحات
حالياً، لا يوجد لقاح فعال للحماية من عدوى البكتيريا العقدية المقيحة. لقد تم إيقاف اللقاح الذي تم تطويره من قبل جورج وجلاديس ديك في عام 1924م، وذلك لفاعليته الضعيفة وطرح المضادات الحيوية في الأسواق. الصعوبات في تطوير لقاح فعال تتضمن وجود تشكيلة واسعة من سلالة البكتيريا العقدية المقيحة في البيئة، والوقت الكثير وعدد الناس الكبير الذي يتطلبه إجراء تجارب آمنة وفعالة لتطوير اللقاح الملائم.[16]
المضاعفات
وتشمل مضاعفات الحمى القرمزية المضاعفات الإنتانية بسبب انتشار العقديات في الدم، ومضاعفات المناعية نتيجة لاستجابة مناعية شاذة. وتشمل المضاعفات الانتائية (حاليا ً هي نادرة الحدوث) وتشمل التهاب الاذن والجيوب والالتهاب الرئوي العقدي، الذبال الصدري الصديدي والتهاب السحايا، وتعفن الدم الكامل، حيث يطلق على هذه الحالة حالة الحمى القرمزية الخبيثة. و تشمل المضاعفات المناعية: التهاب كبيبات الكلى، الحكى الروماتزمية، والحمامي العقدية. مرض القرمزية الثانوي، أو متلازمة الحمى القرمزية الخبيثة الثانوية، وتشمل الحمى المتجددة، الذبحة الصدرية المتجددة، أمراض الأذن والانف والحلق والتهاب الكلى أو الحمى الروماتزمية ، ويظهر في اليوم الثامن عشر من الإصابة بالحمى القرمزية الغير معالجة. وقد تبين وجود ارتباط بين الحمى القرمزية والتهاب الكبد لعدة عقود.[17] والآلية المسببة غير معروفة.
الوبائيات
هذا المرض هو الأكثر شيوعا في الأطفال الذين تتراوح أعمارهم 5-15. الذكور والإناث يصابون بالمرض بشكل متعادل.[18][19] بحلول عمر 10 سنين، و80٪ من الأطفال يكونوا قد اكتسبوا الأجسام المضادة الواقية ضد السموم الناتجة عن بعض العقيدات المولدة للحمى، التي تمنع تطور مرض الحمى القرمزية.[19][20]
التاريخ
ولم يتضح متى تم تسجيل أول وصف لهذا المرض.[21] أبقراط، في كتاباته التي تعود إلى حوالي 400 سنة قبل الميلاد، وصف حالة المريض مع التهاب الحلق والجلد والقرح، ولكن ليس من الواضح تماما من الوصف ما إذا كان المريض يعاني من الحمى القرمزية.في القرنين العاشر والحادي عشر، وصف الاطباء ; الرازي، علي عباس، وابن سينا مرض الحصبة التي كانت شبيهة، ولكن مع لون أكثر حيوية وأكثر خطورة. مرة أخرى، فإنه ليس من المؤكد أن هذه الأوصاف تشير إلى الحمى القرمزية. أول وصف لهذا المرض في الأدبيات الطبية ظهر في 1553 كتاب De Tumoribus praeter Naturam من قبل الخبير بعلم التشريح صقلية والطبيب جيوفاني فيليبو انغراسيا، حيث أشار إلى أنها rossalia أو rosania. وتم وصفه من قبل يوهان وير خلال وباء في ألمانيا الصغرى بين 1564 و1565. وأشار إلى أنها scalatina الذباحية. أول وصف صريح للحمى القرمزية ظهر في كتاب جوانز كويتارس لبواتييه، De febre purpura epidemiale et contagiosa libri duo، والذي نشر في 1578 في باريس. وصف دانيال سينيرت من فيتنبرغ "تقشر الحمى القرمزية" في 1572، وكان أيضا أول من وصف التهاب المفاصل في وقت مبكر، استسقاء الحمى القرمزية، والاستسقاء المرتبط بهذا المرض. في عام 1827، كان برايت أول من أدرك انخراط النظام الكلوي في الحمى القرمزية. وكان أول وصف العلاقة بين العقديات والمرض في 1874 من قبل بيلروث، ومناقشة المرضى الذين يعانون من التهابات الجروح. كما صاغ بيلروث اسم جنس العقدية. تم زرع الكائن الحي لأول مرة في عام 1883 من قبل الجراح الألماني فريدريك فيليزين. لقد قام بزرعها من الآفات حول الحمرة . أعطى روزينباخ الكائن الاسم الحالي (العقدية المقيحة) في عام 1884.أيضا في عام 1884، وكان الطبيب الألماني فريدريك لوفلر أول من أظهر وجود العقديات في رقاب المرضى الذين يعانون من الحمى القرمزية. لأن ليس كل المرضى الذين يعانون من بالحمى البلعوم القرمزية الناجمة عن العقيدات، بقيت هذه النتائج مثيرة للجدل لبعض الوقت. تم تأكيد الارتباط بين العقيدات والحمى القرمزية التي كتبها ألفونس دوشز وجورج وغلاديس ديك في أوائل 1900s. قام نيل فلاتو (في عام 1895) وكليمان ديوكس (في عام 1894) بوصف مرض الطفحية الذي اعتقدوا أنه شكل من أشكال الحصبة الألمانية، ولكن في عام 1900، وصفه ديوكس على أنها مرض منفصل الذي أصبح يعرف باسم مرض ديوكس "، [22] مرض فيلاتوف، أو المرض الرابع. ومع ذلك، في عام 1979، حدد كيث باول على أنه نفس المرض الحمى القرمزية التي تسببها ذيفان المكورات العنقودية الخارجي ويعرف باسم متلازمة الجلد المتقشرة المكورة العنقودية .[23][24][25][26] تم استخدام مصل الحمى القرمزية من الخيول في علاج الأطفال ابتداء من عام 1900 وانخفاض معدلات الوفيات بشكل ملحوظ. في عام 1906، افترض طبيب الأطفال النمساوي كليمنس فون بيركيه أن المركبات المناعية المسببة للمرض هي المسؤولة عن التهاب الكلية التي أعقبت الحمى القرمزية.[27] تم اكتشاف البكتيريا في عام 1915 من قبل فريدريك تورت. تم التغاضي عن عمله وتم اكتشاف البكتيريا في وقت لاحق من قبل فيليكس ديريل في عام 1917. وكانت هيئة خاصة بالحمى القرمزية من المجموعة العقيدات أ تراقب تطور مخطط تصنيفلانسفيلد للعقيدات في العشرينات من القرن التاسع عشر. أظهرت جورج وغلاديس ديك أن الرواشح خالية من الخلايا يمكن أن يتضمن خاصية رد الفعل الحمامية للحمى القرمزية، مما يثبت أن هذا التفاعل حدث نتيجة للسم. اكتشف كيرالتز وستمبين أن المستخلصات من مصل الجلوبيولين البشري وجلوبيولين المشيمة يمكن ان تستخدم كعوامل مخففة للحمى القرمزية. وهذه كانت تستخدم فيما بعد كاساسيات لاختبار ديك. وقد وصفت رابطة الحمى القرمزية والبكتيريا في عام 1926 من قبل كانتيوكوزيني وبونشو.[28] اكتشاف البنسلين وانشاره على نطاق واسع لاحقاً أدى إلى انخفاض كبير في معدل الوفيات من هذا المرض المخيف .تم استنساخ السم الأول الذي يسبب هذا المرض وتسلسله في عام 1986 من قبل ويكز وفيريتي.[8]
مطعوم واختبار ديك
اخترع اختبار ديك في عام 1924، وكان يستخدم لتحديد أولئك المعرضون للحمى القرمزية.[29] زراعة الحساء الذي يتم ترشيحه من عقيدات المجموعة A المنتجة للسم المولد للحمى يتم حقنه وريديا ً في الاشخاص المعرضين للإصابة. في حالات الجلد الحمامية والذمية الحساسة يتم تطويرها خلال 24 ساعة بعد الحقن. الجرعة الثانية من الترياق في الموقع تبطل مفعول ردود الفعل. واعتبر الغير مفاعلات لديهم أجسام مضادة كافية للسم، وبالتالي لم تكن عرضة لللحمى القرمزية. وضعت غلاديس هنري ديك وجورج فريدريك ديك لقاح في عام 1924 الذي كان أحجب لاحقا من البنسلين في 1940s. واستخدم مرق الرواشح كأساس للحصول على براءة ديكس للقاح في عام 1924 في المملكة المتحدة في عام 1925 في الولايات المتحدة. ان لقاح واختبار ديك مازال قيد الاستخدام.
معرض صور
المراجع
- "Scarlet Fever: A Group A Streptococcal Infection". Center for Disease Control and Prevention. January 19, 2016. مؤرشف من الأصل في 27 يوليو 201912 مارس 2016.
- Shorter Oxford English dictionary. United Kingdom: Oxford University Press. 2007. صفحة 3804. .
- Sotoodian, Bahman; Rao, Jaggi (9 November 2015). "Scarlet Fever". MedScape. مؤرشف من الأصل في 29 يونيو 201909 يناير 2016.
- Yang, S. G.; Dong, H. J.; Li, F. R.; Xie, S. Y.; Cao, H. C.; Xia, S. C.; Yu, Z.; Li, L. J. (2007). "Report and analysis of a scarlet fever outbreak among adults through food-borne transmission in China". Journal of Infection. 55 (5): 419–424. doi:10.1016/j.jinf.2007.07.011. PMID 17719644.

- Zabriskie, J. B. (1964). "The role of temperate bacteriophage in the production of erythrogenic toxin by Group A Streptococci". Journal of Experimental Medicine. 119 (5): 761–780. doi:10.1084/jem.119.5.761. PMC . PMID 14157029.

- Krause, R. M. (2002). "A Half-century of Streptococcal Research: Then & Now". Indian J Med Res. 115: 215–241. PMID 12440194.
- McShan, W. M.; Ferretti, J. J. (1997). "Genetic diversity in temperate bacteriophages of Streptococcus pyogenes: identification of a second attachment site for phages carrying the erythrogenic toxin A gene". J Bacteriol. 179 (20): 6509–6511. PMC . PMID 9335304.
- Weeks, C. R.; Ferretti, J. J. (1986). "Nucleotide sequence of the type A streptococcal exotoxin (erythrogenic toxin) gene from Streptococcus pyogenes bacteriophage T12". Infect Immun. 52 (1): 144–150. PMID 262210.
- Yu, C. E.; Ferretti, J. J. (1991). "Molecular characterization of new group A streptococcal bacteriophages containing the gene for streptococcal erythrogenic toxin A (speA)". Mol Gen Genet. 231 (1): 161–168. doi:10.1007/BF00293833. PMID 1753942.
- 8.Prévost, G; Mourey, L; Colin, DA; Menestrina, G (2001). "Staphylococcal pore-forming toxins.". Current topics in microbiology and immunology257: 53–83.doi:10.1007/978-3-642-56508-3_4.PMID11417122
- 9.Lina, G.; Piemont, Y.; Godail-Gamot, F.; Bes, M.; Peter, M.-O.; Gauduchon, V.; Vandenesch, F.; Etienne, J. (1 November 1999). "Involvement of Panton–Valentine Leukocidin—Producing Staphylococcus aureus in Primary Skin Infections and Pneumonia". Clinical Infectious Diseases29 (5): 1128–1132. doi:10.1086/313461.PMID10524952.
- 10.Voyich, Jovanka M .; Otto, Michael; Mathema, Barun; Braughton, Kevin R.; Whitney, Adeline R.; Welty, Diane; Long, R. Daniel; Dorward, David W.; Gardner, Donalard; Kreiswirth, Barry N.; DeLeo, Frank R. (15 December 2006). "Is Panton-Valentine Leukocidin the Major Virulence Determinant in Community-Associated Methicillin-Resistant Disease?". The Journal of Infectious Diseases194 (12): 1761–1770. doi:10.1086/509506.PMID17109350.
- 11.Vandenesch, F; Naimi, T; Enright, MC; Lina, G; Nimmo, GR; Heffernan, H; Liassine, N; Bes, M; Greenland, T; Reverdy, ME; Etienne, J (August 2003)."Community-acquired methicillin-resistant Staphylococcus aureus carrying Panton-Valentine leukocidin genes: worldwide emergence.". Emerging Infectious Diseases9 (8): 978–84.doi:10.3201/eid0908.030089.ISSN1080-6040. PMC3020611.PMID12967497.
- 12.Lo, Wen-Tsung; Tang, Ching-Shen; Chen, Shyi-Jou; Huang, Ching-Feng; Tseng, Min-Hua; Wang, Chih-Chien (1 October 2009). "Panton‐Valentine Leukocidin Is Associated with Exacerbated Skin Manifestations and Inflammatory Response in Children with Community-Associated Staphylococcal Scarlet Fever".Clinical Infectious Diseases49 (7): e69–e75. doi:10.1086/605580.PMID19725782.
- "Second HK child dies of mutated scarlet fever". Associated Press (online). 22 June 2011. مؤرشف من الأصل في 31 أغسطس 201123 يونيو 2011.
- "Initiative for Vaccine Research (IVR)—Group A Streptococcus". World Health Organization. مؤرشف من الأصل في 27 يوليو 201315 يونيو 2012.
- Elishkewitz, K.; Shapiro, R.; Amir, J.; Nussinovitch, M. (2004). "Hepatitis in scarlet fever". Isr Med Assoc J. 6 (9): 569–570. PMID 15373323.
- Czarkowski, M. P.; Kondej, B.; Staszewska, E. (2011). "Scarlet fever in Poland in 2009". Przegl Epidemiol. 65 (2): 209–212. PMID 21913461.
- Zabawski Jr, Edward J. "Scarlet Fever: Epidemiology". Medscape. مؤرشف من الأصل في 29 يونيو 201920 أكتوبر 2014.
- Czarkowski, M. P.; Kondej, B. (2010). "Scarlet fever in Poland in 2008". Przegl Epidemiol. 64 (2): 185–188. PMID 20731219.
- Rolleston, J. D. (1928). "The History of Scarlet Fever". BMJ. 2 (3542): 926–929. doi:10.1136/bmj.2.3542.926. PMC . PMID 20774279.
- Dukes, Clement (30 June 1900). "On the confusion of two different diseases under the name of rubella (rose-rash)". The Lancet. 156 (4011): 89–95. doi:10.1016/S0140-6736(00)65681-7.
- Weisse, Martin E (31 December 2000). "The fourth disease, 1900–2000". The Lancet. 357 (9252): 299–301. doi:10.1016/S0140-6736(00)03623-0. PMID 11214144.
- Powell, KR (January 1979). "Filatow-Dukes' disease. Epidermolytic toxin-producing staphylococci as the etiologic agent of the fourth childhood exanthem". American journal of diseases of children (1960). 133 (1): 88–91. doi:10.1001/archpedi.1979.02130010094020. PMID 367152.
- Melish, ME; Glasgow, LA (June 1971). "Staphylococcal scalded skin syndrome: the expanded clinical syndrome". The Journal of pediatrics. 78 (6): 958–67. doi:10.1016/S0022-3476(71)80425-0. PMID 4252715. مؤرشف من الأصل في 13 ديسمبر 2019.
- Morens, David M; Katz, Alan R; Melish, Marian E (31 May 2001). "The fourth disease, 1900–1881, RIP". The Lancet. 357 (9273): 2059. doi:10.1016/S0140-6736(00)05151-5. PMID 11441870.
- Huber, B. (2006). "100 years of allergy: Clemens von Pirquet—his idea of allergy and its immanent concept of disease". Wien. Klin. Wochenschr. 118 (19–20): 573–579. doi:10.1007/s00508-006-0701-3. PMID 17136331.
- Cantacuzène, J.; Bonciu, O. (1926). "Modifications subies par des streptocoques d'origine non scarlatineuse au contact de produits scarlatineux filtrès". CR Acad Sci Paris (باللغة الفرنسية). 182: 1185–1187.
- Dick, G. F.; Dick, G. H. (1924). "A skin test for susceptibility to scarlet fever". J Am Med Assoc. 82 (4): 265–266. doi:10.1001/jama.1924.02650300011003.