سالفينورين أ هو عقار يحتوي على جزيء ذو تأثير نفسي يتواجد في نباتات سالفيا ديفينوروم، وهو نبات مكسيكي استخدمته قبائل الشامان المازتيك لفترة كبيرة كعقار روحي. يعتبر سالفينورين أ عقار مسبب للتفارق.[2]
| سالفينورين أ | |
|---|---|
| الاسم النظامي | |
| ميثيل(2S,4aR,6aR,7R,9S,10aS,10bR)-9-(أسيتيل أوكسي)-2-(فيوران-3-yl)-6a,10b-ديميثيل-4,10-ديوكسو-دوديكاهيدرو-1H-نافثول[2,1-c]بيران-7-كربوكسلات | |
| اعتبارات علاجية | |
| طرق إعطاء الدواء | غشاء الفم المخاطي والتدخين |
| معرّفات | |
| CAS | 83729-01-5  |
| ك ع ت | None |
| بوب كيم | CID 128563 |
| IUPHAR | 1666 |
| ECHA InfoCard ID | 100.215.796 |
| كيم سبايدر | 113947  |
| المكون الفريد | T56W91NG6J  |
| كيوتو | C20196  |
| ChEBI | CHEBI:67900  |
| ChEMBL | CHEMBL445332  |
| بيانات كيميائية | |
| الصيغة الكيميائية | C23H28O8 |
| الكتلة الجزيئية | 432.46362 g/mol |
| بيانات فيزيائية | |
| نقطة الانصهار | 238–240 °C (460–464 °F) (عند242–244 °C)[1] |
| نقطة الغليان | 760.2 °C (1400 °F) |
| انحلالية في خصائص الماء | عند 25.07 ميلليغرام/لتر 25 °C (الماء) mg/mL (20 °C) |
| دوران محدد | -45.3 °C عند 22 درجة C/D (c = 8.530 CHCl3); -41 °C عند25 °C/D (c = 1 in CHCl3) |
يختلف سافينورين أ هيكليًا عن غيره من المهلوسات مثل ثنائي مثيل التربتامين، والسيلوسيبين، والمسكالين لأنه لا يحتوي على ذرات نيتروجين. وبالتالي، فإنه ليس (شبه قلوي) (ولا يمكن اعتباره كملح) ولكنه يعتبر من التربينويدات. كما يختلف سالفيتورين أ في تجربته الذاتية، فبالمقارنة مع غيره من المهلوسات، وُصف سالفينورين أ بأنه عقار مسبب للتفارق.[2]
يمكن أن يُحدث سالفينورين أ تجارب نفسية في البشر مع مدة نموذجية من العمل تتراوح من عدة دقائق إلى ساعة أو نحو ذلك، اعتمادًا على طريقة تناول العقار.[3]
تم العثور على العديد من السالفينورينات الأخرى المتشابهة مع سالفينورين أ هيكليًا. سالفينورين أ هو أحد أعضاء عائلة ديتربينويدات النيوكليرودان. وهو يعمل كمنبه لمستقبلات كابا الأفيونية، كما أنه يعتبر أول مركب شبه قلوي يعمل على هذا المستقبل.
التاريخ
وصف ألفريدو أورتيغا وزملائه في المكسيك سالفينورين أ وسموه باسمه لأول مرة في عام 1982. استخدم أورتيغا وزملائه مجموعة من التحاليل الطيفية وعلم البلورات بالأشعة السينية لتحديد التركيب الكيميائي للمركب، والذي تبين أنه يحتوي جزيء ثنائي الحلقة من الديتربين.[4] في نفس الوقت تقريبًا، عزل ليندر جوليان فالديس الثالث الجزيء بشكل مستقل كجزء من أبحاث الدكتوراه، التي نشرت في عام 1983.[5] سمى فالديز هذا المركب باسم ديفينوروم الكيميائي، وعزل أيضًا مشابه بنيوي سماه ديفينوروم ب.[5] تم تصحيح التسمية في وقت لاحق لسالفينورين أ وب بعد نشر تلك الأبحاث في عام 1984.[6] ثم عزل فالديس بعد ذلك سالفينورين ج.[7]
علم الأدوية
سالفينورين أ هو أحد أعضاء عائلة ديتربينويد نيوكليرودان مع الصيغة الكيميائية C23H28O8.[8] وخلافًا لغيره من مؤثرات مستقبلات الأفيون، لا يعتبر سالفينورين أ مركب شبه قلوي لأنه لا يحتوي على ذرة نيتروجين قاعدية.[9] لا يؤثر سالفينورين أ على مستقبلات السيروتونين 5-HT2A، ولكنه يتسبب بشكل مباشر في تأثيرات التخدير "الكلاسيكية" مثل ثنائي إيثيل أميد حمض الليسرجيك و المسكالين.[3][9]
الفعالية والانتقائية
ينشط سالفينورين أ في جرعات منخفضة تصل إلى 200 ميكروغرام.[10] يمكن أن تكون المواد الكيميائية الاصطناعية، مثل ثنائي إيثيل أميد حمض الليسرجيك (النشطة عند جرعات منخفضة تصل إلى 20-30 ميكروغرام) أكثر فعالية.[11] وقد أظهرت البحوث أن سالفينورين أ منبه قوي لمستقبلات كابا الأفيونية (Ki = 2.4 نانومتر، نصف تركيز فعال= 1.8 نانومتر).[8] تتمتع جزيئات سالفينورين أ بتقارب عالي لتلك المستقبلات، والتي يُشار إليها بانخفاض ثبوت الانحلال بحوالي 1.0 نانومولار.[12] وقد أفادت الأبحاث التي أجريت على الفئران أن آثار سالفينورين أ ثبطتها مضادات المستقبلات الأفيونية.[13] وبالإضافة إلى ذلك، تم العثور على سالفينورين أ مؤخرًا لتكون بمثابة مستقبلات جزئية لمستقبلات D2، مع تقارب يصل إلى 5-10 نانومتر، وهو نشاط جوهري يقدر بحوالي 40-60٪، ونصف تركيز فعال يصل إلى 48 نانومتر. وهذا يشير إلى أن مستقبلات D2 قد تلعب أيضا دورًا هامًا في الآثار التي يسببها سالفينورين أ.
يتميز سالفينورين أ بأنه عقار فريد من نوعه لأنه المادة الوحيدة التي تسبب هلاوس بصرية عن طريق هذا النمط من العمل؛ إذ لا يتشابه معها إلا منبهات مستقبلات KOR الاصطناعية، (مثل إينادولين، وكيتازوسين، وبنتازوسين، والتي تظهر آثار هلوسة وانفصامية مماثلة.
لا ينبغي الخلط بين فعالية وبين سمية سالفينورين أ. لم تظهر الفئران التي أُعطيت جرعات مزمنة "مرات عديدة مما يتعرض له البشر"[14] أي علامات لتلف الأعضاء. ومع ذلك، "ينبغي إجراء مزيد من الدراسات حول آثار ضغط الدم إذ لم يرتفع ضغط النبض بعد إعطاء العقار بعشرين وأربعين دقيقة، ومع ذلك، لم تكن هذه الزيادة ذات دلالة إحصائية" (لاحظ أن البيانات تظهر زيادة في ضغط النبض الذي كان يقرب من 1.5-2 ضعف مجموعة التحكم).[15]
ومن المثير للاهتمام، أظهر سالفينورين أ خصائص غير نمطية كمنبه لمستقبلات KOR نسبةً إلى غيرها من تلك المنبهات.[16] على سبيل المثال، يعزز سالفينورين أ الاستيعاب الداخلي لتلك المستقبلات بتركيزات تقل بأربعين مقارنةً بمنبهات مستقبلات KOR المتعارف عليها مثل U-50488، كما أظهر الحد الأدنى للتأثير المضاد للحكة والمسكن للآلام في الفئران،[17] على الرغم من وجود تقارير متضاربة فيما يتعلق بتأثيره كمسكن للألم.[17] وعلى غرار معظم منبهات مستقبلات KOR الأخرى، لا يُحدث سالفينورين أ آثار مثل التخدير، (والانزعاج أو النفور، وانعدام التلذذ أو الاكتئاب.[18][19] ومع ذلك، وُجد أن هذا العقار يتسبب في إدرار البول في الفئران، ربما بسبب فترة تأثيره القصيرة.[18][20]
التأثير على حركة الأمعاء
يستطيه سالفينورين أ تثبيط حركية الأمعاء الزائدة (على سبيل المثال الإسهال)، من خلال التأثيرات الفعالة كمنبه لمستقبلات كابا الأفيونية. وقد وصفت آلية العمل لسالفينورين A على الأنسجة اللفائفية بأنها تحدث قبل الوصلات العصبية، كما كان قادرًا على تعديل الانقباضات المستحثة كهربائيًا، ولكن ليست بمثل آلية عمل الأسيتيل كولين.[21] وهناك جانب مهم دوائيًا من خصائص التقليل من حركية الأمعاء الخاصة بسالفينورين أ على أنسجة الأمعاء، وهو أنه لا ينشط من الناحية الدوائية إلا على الأنسجة الملتهبة، وبالتالي يقلل هذا من الآثار الجانبية المحتملة.[22]
القابلية للذوبان
سالفينورين أ قابل للذوبان في المذيبات العضوية مثل الإيثانول والأسيتون، ولكنه لا يذوب في الماء.[23] من الممكن أيضًا أن يكون سالفينورين أ قابلًا للذوبان في الدهون كما تذوب بعض التيربينويدات ذات الصلة مثل الكانابينويد والكوركومينويدات.
الكشف في البول
وُجدت تركيزات من سالفينورين أ في هؤلاء الذين كانوا يدخنون 580 ميكروغرام من الدواء النقي في البول تصل إلى 2.4-10.9 ميكروغرام / لتر خلال الساعة الأولى، ولكن انخفضت تلك المستويات أقل من المستويات المسموح بالكشف عنها بعد ساعة ونصف بعد التدخين. ويمكن إجراء القياسات التحليلية باستخدام الاستشراب الغازي أو مطياف الكتلة اللوني للسوائل.[24]
المركبات ذات الصلة
عُزلت العديد من التيربينويدات الأخرى من نبات سالفيا ديفينوروم، بما في ذلك السالفينورينات الأخرى والمركبات ذات الصلة المسماة بالديفيناتورينات والسالفينيسينات. لم تظهر أي من هذه المركبات تقارب شبه ميكرومولاري كبير في مستقبلات كابا الأفيونية، وليس هناك دليل على أنها تساهم في التأثير الروحي لتلك النباتات.[25][26]
التخليق
التخليق الحيوي
تم توضيح الأصل الحيوي لسالفينورين أ توليف باستخدام الرنين المغناطيسي النووي والتأين بالترذيذ الإلكتروني باستخدام مطيافية الكتلة وتحليل السلائف المدرجة المسماة مع نظائر مستقرة من الكربون (كربون -13 C13) والهيدروجين و الديوتيريوم.
يتم تخليق سالفينورين أ عن طريق مسار "1-ديوكسي د- زيلولوز-5-فوسفات"، بدلا من مسار الميفالونات الكلاسيكية، بما يتفق مع المسار الأيضي المشترك لعائلة الديتربينويدات.[27]
يتم تخليق التربينويدات من اثنين من سلائف الكربون C5، وإيزوبنتينيل ثنائي الفوسفات وثنائي ميثيلال ثنائي فوسفات. وأشارت دراسة الرنين المغناطيسي النووي والتأين بالترذيذ الإلكتروني باستخدام مطيافية الكتلة وتحليل السلائف المدرجة المسماة مع نظائر مستقرة من الكربونالتي أجراها زجاويوني أن التخليق الحيوي لسالفينورين أ يتم عن طريق مسار "1-ديوكسي د- زيلولوز-5-فوسفات". في مسار الفوسفات ديوكسي د- زيلولوز، يتم تحويل د-غليسيرالدهيد 3-فوسفات والبيروفات، وسيط التحلل، إلى 1-ديوكسي- د- زيلولوز 5-فوسفات عن طريق نزع مجموعة الكربوكسيل. يولد الاختزال اللاحق في هذا المسار 2C-ميثيل-د- إريثريتول 2,4-سيكلوديفوسفات، عن طريق الوسيط الكيميائي 4-ديفوسفوسيتيديل-2-C- ميثيل- د- إريثريتول و 4-ديفوسفوسيتيديل-2C- ميثيل- د- إريثريتول -2 فوسفات
يُضاف لاحقًا ثلاث وحدات كربون C5 إلى وحدة C5 الوحيدة حتى يتم تخليق المولد المركزي ذا العشرين ذرة كربون، جيرانيل جيرانيل ثنائي الفوسفات. وتنتج التعديل الكيميائي للديتربين بواسطة ثنائي كلورودينيل ثنائي الفوسفات من الدرجة الثانية SdCPS2، وكاربوكاتيون إبدانيل ثنائي الفوسفات، والذي يعاد ترتيبه لاحقا من خلال تسلسلات من إذافة جزيئات الماء وتحولات الميثيل لتشكيل مركب كليرودينيل ثنائي فوسفات الوسيط.[28] SdCPS2 يحفز SdCPS2 أول تفاعل في عملية التخليق الحيوي لسالفينورين أ من خلال إنتاج التركيب الأساسي المميز لعائلة الكليرودان المميزة. وتحدث بعد ذلك سلسلة من تفاعلات الأكسدة، وإضافة مجموعات الأسيل والميثيل لاستكمال التخليق الحيوي لسالفينورين أ.
على غرار العديد من المركبات ذات التأثير النفساني المشتقة من النباتات، تفرز سالفينورين A عن طريق أوراق ذات شكل غضروفي غدي تقع خارج البشرة.[29][30]
التخليق الكيميائي
في عام 2007 استطاع إيفانز وزملائه في العمل النجاح في التخليق الانتقائي التماثلي لسافيتورين أ، والذي يعتمد على تفاعل مايكل) التسلسلي لتخليق الحلقة من خلال 30 خطوة.[31] في الآونة الأخيرة، نشرت مجموعة يابانية طريقة أخرى للتخليق الكيميائي لسالفينورين أ، تتطلب 24 خطوة.[32]
وقد وصفت فورسيث وآخرون نهجًا لتخليق حلقة سالفينورين أ باستخدام تفاعلات ديلز ألدر / استراتيجية تسوجي للأليلات داخل الجزيئات .[33]
وقد أفاد فورسيث وزملاؤه توليفة كلية حديثة من سالفينورين أ باستخدامتفاعلات ديلز ألدر/ استراتيجية تسوجي للأليلات داخل الجزيئات جنبًا إلى جنب مع إضافة غير متماثلة في مرحلة متأخرة من شدة الفوران.[34]
كما حاولت مجموعة في المعهد الملكي للتكنولوجيا في ملبورن نشر طريقة لتخليق سالفينورين أ، واعتماد توليفة متقاربة من حلقات الهكسانون مع لاكتون α، β غير المشبعة.[35]
السالفينورينات الأخرى
سالفينورين أ هو واحد من العديد من السالفينورينات المتصلة هيكليًا الموجودة في نبات سالفيا ديفينوروم. يمكن تخليق سالفينورين أ من خلال أستلة سالفينورين ب غير النشط، إذ لا يتمتع سالفينورين ب الخالي من الأسيتيل بأي تأثير يذكر في البشر. يتكهن الباحثون بأن سالفينورين ج قد يكون أكثر فعالية من سالفينورين أ، ولكن الاختبارات البشرية وفحوصات الارتباط بالمستقبلات لا يمكن أن تؤكد هذا.
لذا يبدو أن سالفينورين أ هو المركب النشط الوحيد حتى الآن.[26]
| الاسم | التركيب | R1 | R2 | النشاط | المصدر |
|---|---|---|---|---|---|
| سالفينورين أ | 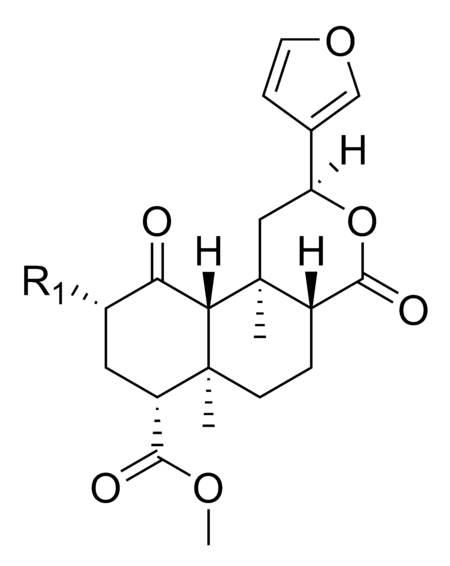
|
-OCOCH3 | − | نشط | |
| ثيوسيانات
سالفينورين أ-22 |
-OCOCH2SCN | − | (نشط)[36] |
شبه صناعي | |
| سالفينورين ب | -OH | − | غير نشط | ||
| سالفينورين ج | 
|
-OCOCH3 | -OCOCH3 | غير معروف
نشاطه |
|
| سالفينورين د | -OH | -OCOCH3 | غير نشط | ||
| سالفينورين ه | -OCOCH3 | -OH | غير نشط | ||
| سالفينورين و | -H | -OH | غير معروف
نشاطه |
يتشابه سالفينورين ك المكتشف حديثا إلى حد كبير مع سالفينورين ه في التركيب الهيكلي، مع وجود مجموعة كحول ثانوية عند ذرة الكربون C-17 بدلًا من مجموعة الكيتون.[37]
نظائر شبه اصطناعية
أنتجت البحوث عن مشتقات السالفينورين عددًا من المركبات شبه الاصطناعية، والتي يمكن أن يكون نتج العديد منها من سالفينورين ب. تعتبر معظم المشتقات منبهات انتقائية لمستقبلات كابا الأفيونية كما هو الحال مع سالفينورين أ، على الرغم من كون بعضها أكثر قوة من سالفينورين أ. يعتبر مركب 2-إيثوكسيمثيل سالفورينورين ب أقوى 10 مرات من سالفينورين أ. بعض المشتقات مثل هيركينورين ثبطت مستقبلات كابا الأفيونية وبدلًا من ذلك عملت كمنبهات لمستقبلات ميو الأفيونية. .[38][39][40][41][42][43][44][45]
التأثير الدوائي
لم يتم إعطاء سالفينورين أ للإنسان إلا في عدد قليل من الدراسات. ووجدت إحدى هذه الدراسات أن آثاره تصل إلى ذروتها في حوالي دقيقتين، وأن آثارها الذاتية تتداخل مع آثار مخدر السيروتونين، وأنها تعيق ذاكرة التعرف والاستدعاء بصورة مؤقتة.[46]
وتشير نتائج دراسة صغيرة قام بها أستاذ مساعد في جامعة أيوا إلى أن سالفيتورين أ فد تكون له بعض التأثيرات المسكنة للألم، وقد يمكن استخدامه كأداة علاجية لعلاج الإدمان على المخدرات.[47][48] تتمتع منبهات كابا الأفيونية بآثار ملحوظة جدًا على جميع أنواع الإدمان بما في ذلك الكحول والكوكايين، وتعاطي الأفيون.[49]
في نماذج تجريبية من التهاب القولون في الفئران، أظهر سالفينورين أ تأثيرًا مضادًا للالتهابات بوساطة تنبيه مستقبلات كابا الأفيونية ومستقبلات CB1.[50]
الحالة القانونية
تُشرع بعض القوانين الخاصة باستخدام سالفينورين أ ونبات السالفيا ديفينورم، نظرًا لتأثيراته الروحية والمخدرة.
الولايات المتحدة
لم يُدرج سالفينورين أ على المستوى الاتحادي في الولايات المتحدة.[51] يختلف الهيكل الجزيئي لسالفيتورين أ عن الهيكل الجزيئي لمركبات الجدول الأول أو الثاني للمخدرات، لذلك من غير المحتمل أن يُحاكم من يمتلك أو يبيع سالفينورين أ بموجب القانون التماثلي الاتحادي.
فلوريدا
يعتبر "سالفينورين أ" من المواد المدرجة في جدول الأول للمخدرات في ولاية فلوريدا مما يجعل من شراء أو بيع أو امتلاك سالفينورين أ في ولاية فلوريدا فعل يستوجب المسائلة القانونية. إلا أنه يوجد استثناء "أي من المنتجات الدوائية التي وافقت عليها إدارة الغذاء والدواء الأمريكية التي تحتوي على سالفينورين أ أو نظائره واستراته وإيثراته وأملاحه وأملاحه من الأيزومرات والاسترات والأثيرات، إذا كان وجود مثل هذه الأيزومرات، استرات، الإيثرات، والأملاح مضمن ضمن تركيب كيميائي محدد."[52]
أستراليا
يعتبر سالفينورين أ مادة محظورة في الجدول التاسع في أستراليا بموجب معيار السموم (أكتوبر 2015).[53] والمواد المدرجة في الجدول رقم 9 هي أي مادة يمكن أن يُساء استخدامها أو إدمانها، وينبغي أن يحظر صنعها أو حيازتها أو بيعها أو استخدامها بموجب القانون إلا إذا اقتضى الأمر ذلك لأغراض البحث الطبي أو العلمي أو لأغراض تحليلية أو تعليمية أو تدريبية بموافقة الكمنولث و / أو السلطات الصحية في الولاية أو الإقليم.[53]
السويد
صنف البرلمان السويدي ووزارة الصحة سالفينورين أ ونبات سالفيا ديفينورم كخطر صحي تحت قانون حظر بعض السلع الخطرة على الصحة اعتبارًا من 1 أبريل، 2006، في تشريعات SFS 167 لعام 2006 مما يجعل من غير القانوني بيع أو امتلاك سالفيتورين أ.[54]
مقالات ذات صلة
- عقار نفساني التأثير
- قائمة المواد الروحية
- نالفرافين
مراجع
- salvinorin A, PubChem, مؤرشف من الأصل في 16 أكتوبر 2014,23 نوفمبر 2012
- MacLean, Katherine; Johnson, Matthew; Reissig, Chad; Prisinzano, Thomas; Griffiths, Roland (March 2013). "Dose-related effects of salvinorin A in humans: dissociative, hallucinogenic, and memory effects". Psychopharmacology. 226 (2): 381–392. doi:10.1007/s00213-012-2912-9. PMC . PMID 23135605.
- Roth BL; Baner K; Westkaemper R; Siebert D; Rice KC; Steinberg S; Ernsberger P; Rothman RB (2002). "Salvinorin A: a potent naturally occurring nonnitrogenous κ opioid selective agonist". Proceedings of the National Academy of Sciences of the United States of America. 99 (18): 11934–9. doi:10.1073/pnas.182234399. PMC . PMID 12192085.
- Ortega A; Blount JF; Manchard PD. (1982). "Salvinorin, a new trans-neoclerodane diterpene from Salvia divinorum (Labiatae)". Journal of the Chemical Society, Perkins Transactions I: 2505–8. doi:10.1039/P19820002505.
- Valdés LJJ III (1983). The pharmacognosy of Salvia divinorum (Epling and Jativa-M): An Investigation of Ska Maria Pastora (Mexico) (PhD thesis). University of Michigan. مؤرشف من الأصل في 16 أكتوبر 2015.
- Valdés III LJJ; Butler WM; Hatfield GM; Paul AG; Koreeda M. (1984). "Divinorin A, a psychotropic terpenoid, and divinorin B from the hallucinogenic Mexican mint Salvia divinorum". Journal of Organic Chemistry. 49 (24): 4716–20. doi:10.1021/jo00198a026.
- Valdés III LJJ; Chang HM; Visger DC; Koreeda M. (2001). "Salvinorin C, a new neoclerodane diterpene from a bioactive fraction of the hallucinogenic Mexican mint Salvia divinorum". Organic Letters. 3 (24): 3935–7. doi:10.1021/ol016820d. PMID 11720573.
- Prisinzano TE (2005). "Psychopharmacology of the hallucinogenic sage Salvia divinorum". Life Sciences. 78 (5): 527–31. doi:10.1016/j.lfs.2005.09.008. PMID 16213533.
- Harding WW; Schmidt M; Tidgewell K; Kannan P; Holden KG; Gilmour B; Navarro H; Rothman RB; Prisinzano TE (2006). "Synthetic studies of neoclerodane diterpenes from Salvia divinorum: semisynthesis of salvinicins A and B and other chemical transformations of salvinorin A". Journal of Natural Products. 69 (1): 107–12. doi:10.1021/np050398i. PMC . PMID 16441078.
- Marushia, Robin (2002). "Salvia divinorum: The Botany, Ethnobotany, Biochemistry and Future of a Mexican Mint" ( كتاب إلكتروني PDF ). Ethnobotany. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في October 7, 200723 ديسمبر 2006.
- Greiner T; Burch NR; Edelberg R (1958). "Psychopathology and psychophysiology of minimal LSD-25 dosage; a preliminary dosage-response spectrum". AMA Archives of Neurology and Psychiatry. 79 (2): 208–10. doi:10.1001/archneurpsyc.1958.02340020088016. PMID 13497365.
- Lee D; Ma Z; Liu-Chen L; Wang Y; Chen Y; Carlezon W; Cohen B. (2005). "New neoclerodane diterpenoids isolated from the leaves of Salvia divinorum and their binding affinities for human K opioid receptors". Bioorganic and Medicinal Chemistry. 13 (19): 5635–9. doi:10.1016/j.bmc.2005.05.054. PMID 16084728.
- Zhang Y; Butelman ER; Schlussman SD; Ho A; Kreek MJ (2005). "Effects of the plant-derived hallucinogen salvinorin A on basal dopamine levels in the caudate putamen and in a conditioned place aversion assay in mice: agonist actions at kappa opioid receptors". Psychopharmacology (Berl.). 179 (3): 551–8. doi:10.1007/s00213-004-2087-0. PMID 15682306.
- Note: the Mowry et al. study used the following data: 1600 μg/kg (0.0016 mg/g) daily injections for 14 days on "Swiss-Webster mice, aged 4–6 months" of unknown weight (when purchasing mice, an estimated maximum mass is 25 g). Given that the average weight for males in the United States is 190.9 lbs (according to Wikipedia), or 86,590.7834 g, and that a single gram mixture of plain leaf contains roughly 3 mg/g of Salvinorin A (according to Daniel Siebert), this translates to the mice receiving an effective dose of roughly 6,494,309 times more than a human (human doses range from minimal, 200 μg, to upwards of 24 mg, and body weights for both humans and mice vary tremendously).
- Mowry M; Mosher M; Briner W (2003). "Acute physiologic and chronic histologic changes in rats and mice exposed to the unique hallucinogen salvinorin A" ( كتاب إلكتروني PDF ). Journal of Psychoactive Drugs. 35 (3): 379–82. doi:10.1080/02791072.2003.10400021. PMID 14621136. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 24 مارس 2018.
- Linda P. Dwoskin (29 January 2014). Emerging Targets & Therapeutics in the Treatment of Psychostimulant Abuse. Elsevier Science. صفحات 483–. . مؤرشف من الأصل في 07 ديسمبر 2019.
- Rao S. Rapaka; Wolfgang Sadée (19 June 2008). Drug Addiction: From Basic Research to Therapy. Springer Science & Business Media. صفحات 236–. . مؤرشف من الأصل في 07 ديسمبر 2019.
- Parker L. Mott (2 December 2011). A Literature Review on the Status and Effects of Salvia Divinorum on Cognitive, Affective, and Behavioral Functioning. Universal-Publishers. صفحات 27–. . مؤرشف من الأصل في 07 ديسمبر 2019.
- José Biller (2008). The Interface of Neurology & Internal Medicine. Lippincott Williams & Wilkins. صفحات 681–. . مؤرشف من الأصل في 17 يونيو 2016.
- Inan S, Lee DY, Liu-Chen LY, Cowan A (2009). "Comparison of the diuretic effects of chemically diverse kappa opioid agonists in rats: nalfurafine, U50,488H, and salvinorin A". Naunyn Schmiedebergs Arch. Pharmacol. 379 (3): 263–70. doi:10.1007/s00210-008-0358-8. PMID 18925386.
- Capasso R; Borrelli F; Capasso F; Siebert DJ; Stewart DJ; Zjawiony JK; Izzo AA (2006). "The hallucinogenic herb Salvia divinorum and its active ingredient salvinorin A inhibit enteric cholinergic transmission in the guinea-pig ileum". Neurogastroenterology and Motility. 18 (1): 69–75. doi:10.1111/j.1365-2982.2005.00725.x. PMID 16371085.
- Capasso R; Borrelli F; Zjawiony J; Kutrzeba L; Aviello G; Sarnelli G; Capasso F; Izzo AA (2007). "The hallucinogenic herb Salvia divinorum and its active ingredient salvinorin A reduce inflammation-induced hypermotility in mice". Neurogastroenterology and Motility. 20 (2): 142–8. doi:10.1111/j.1365-2982.2007.00994.x. PMID 17931335.
- "Salvia divinorum". European Monitoring Centre for Drugs and Drug Addiction. مؤرشف من الأصل في 6 أغسطس 201804 سبتمبر 2014.
Salvinorin A is unstable in basic solutions and is soluble in conventional organic solvents, including acetone, acetonitrile, chloroform, dimethyl sulfoxide and methanol, but is essentially insoluble in hexane and water.
- Pichini S; Abanades S; Farré M; Pellegrini M; Marchei E; Pacifici R; Torre Rde L; Zuccaro P (2005). "Quantification of the plant-derived hallucinogen salvinorin A in conventional and non-conventional biological fluids by gas chromatography/mass spectrometry after Salvia divinorum smoking". Rapid Communications in Mass Spectrometry. 19 (12): 1649–1656. doi:10.1002/rcm.1970. ISSN 1097-0231. PMID 15915477.
Salvinorin A was not detected in urine samples collected from 1.5–9.5 h after smoking, probably because of a dilution effect, which yielded concentrations below the LOD obtainable with this methodology.
- Bigham AK; Munro TA; Rizzacasa MA; Robins-Browne RM (2003). "Divinatorins A-C, new neoclerodane diterpenoids from the controlled sage Salvia divinorum". Journal of Natural Products. 66 (9): 1242–4. doi:10.1021/np030313i. PMID 14510607.
- Munro TA; Rizzacasa MA (2003). "Salvinorins D-F, new neoclerodane diterpenoids from Salvia divinorum, and an improved method for the isolation of salvinorin A". Journal of Natural Products. 66 (5): 703–5. doi:10.1021/np0205699. PMID 12762813.
- Kutrzeba L; Dayan FE; Howell J; Feng J; Giner JL; Zjawiony JK (2007). "Biosynthesis of salvinorin A proceeds via the deoxyxylulose phosphate pathway". Phytochemistry. 68 (14): 1872–81. doi:10.1016/j.phytochem.2007.04.034. PMC . PMID 17574635.
- Pelot, Kyle A.; Mitchell, Rod; Kwon, Moonhyuk; Hagelthorn, David M.; Wardman, Jacob F.; Chiang, Angela; Bohlmann, Jörg; Ro, Dae-Kyun; Zerbe, Philipp (2017-03-01). "Biosynthesis of the psychotropic plant diterpene salvinorin A: Discovery and characterization of the Salvia divinorum clerodienyl diphosphate synthase". The Plant Journal (باللغة الإنجليزية). 89 (5): 885–897. doi:10.1111/tpj.13427. ISSN 1365-313X. مؤرشف من الأصل في 27 فبراير 2017.
- Siebert DJ (2004). "Localization of salvinorin A and related compounds in glandular trichomes of the psychoactive sage, Salvia divinorum". Annals of Botany. 93 (6): 763–71. doi:10.1093/aob/mch089. PMID 15087301. "A peltate glandular trichome on the abaxial leaf surface", and "The fact that most of the salvinorin content of fresh leaves can be extracted into chloroform without the solvent penetrating the epidermis indicates that these compounds are secreted externally to the epidermis."
- Kunkle D (2007). "Leaf glandular trichome (Salvia divinorum)". Dennis Kunkel Microscopy, Inc. مؤرشف من الأصل في 3 مارس 201614 أكتوبر 2011.
- Scheerer JR; Lawrence JF; Wang GC; Evans DA (2007). "Asymmetric synthesis of salvinorin A, a potent kappa opioid receptor agonist". Journal of the American Chemical Society. 129 (29): 8968–9. doi:10.1021/ja073590a. PMID 17602636.
- Nozawa M; Suka Y; Hoshi T; Suzuki T; Hagiwara H (2008). "Total synthesis of the hallucinogenic neoclerodane diterpenoid salvinorin A". Organic Letters. 10 (7): 1365–8. doi:10.1021/ol800101v. PMID 18311991.
- Burns AC; Forsyth CJ. (2008). "Intramolecular Diels−Alder/Tsuji allylation assembly of the functionalized trans-decalin of salvinorin A". Organic Letters. 10 (1): 97–100. doi:10.1021/ol7024058. PMID 18062692.
- Line, N.; Burns, A. C.; Butler, S. C.; Casbohm, J.; Forsyth, C. J. (2016). "Total Synthesis of (−)-Salvinorin A". Chem. Eur. J. 22: 17983–17986. doi:10.1002/chem.201604853.
- Lingham AR; Hügel HM; Rook TJ (2006). "Studies towards the synthesis of salvinorin A". Australian Journal of Chemistry. 59 (5): 340–8. doi:10.1071/CH05338.
- White K, Robinson JE, Zhu H, et al. (2014). "The G-protein biased k-opioid receptor agonist RB-64 is analgesic with a unique spectrum of activities in vivo". J. Pharmacol. Exp. Ther. 352 (1): 98–109. doi:10.1124/jpet.114.216820. PMC . PMID 25320048.
- Kutrzeba L; Ferreira Z (2009). "Salvinorins J from Salvia divinorum: mutarotation in the neoclerodane system". Journal of Natural Products. 72 (7): 1361–3. doi:10.1021/np900181q. PMID 19473009.
- Lee DY; Karnati VV; He M; Liu-Chen LY; Kondaveti L; Ma Z; Wang Y; Chen Y; Beguin C; Carlezon WA; Cohen B (2005). "Synthesis and in vitro pharmacological studies of new C(2) modified salvinorin A analogues". Bioorganic & Medicinal Chemistry Letters. 15 (16): 3744–7. doi:10.1016/j.bmcl.2005.05.048. PMID 15993589.
- Munro TA; Duncan KK; Xu W; Wang Y; Liu-Chen LY; Carlezon WA; Cohen BM; Béguin C (2008). "Standard protecting groups create potent and selective κ opioids: salvinorin B alkoxymethyl ethers". Bioorganic & Medicinal Chemistry. 16 (3): 1279–86. doi:10.1016/j.bmc.2007.10.067. PMC . PMID 17981041.
- Harding WW; Tidgewell K; Byrd N; Cobb H; Dersch CM; Butelman ER; Rothman RB; Prisinzano TE (2005). "Neoclerodane diterpenes as a novel scaffold for mu opioid receptor ligands". Journal of Medicinal Chemistry. 48 (15): 4765–71. doi:10.1021/jm048963m. PMID 16033256.
- Tidgewell K; Harding WW; Lozama A; Cobb H; Shah K; Kannan P; Dersch CM; Parrish D; Deschamps JR; Rothman RB; Prisinzano TE (2006). "Synthesis of salvinorin A analogues as opioid receptor probes". Journal of Natural Products. 69 (6): 914–8. doi:10.1021/np060094b. PMID 16792410.
- Holden KG; Tidgewell K; Marquam A; Rothman RB; Navarro H; Prisinzano TE (2007). "Synthetic studies of neoclerodane diterpenes from Salvia divinorum: exploration of the 1-position". Bioorganic and Medicinal Chemistry Letters. 17 (22): 6111–5. doi:10.1016/j.bmcl.2007.09.050. PMC . PMID 17904842.
- Lee DY; He M; Liu-Chen LY; Wang Y; Li JG; Xu W; Ma Z; Carlezon WA; Cohen B (2006). "Synthesis and in vitro pharmacological studies of new C(4)-modified salvinorin A analogues". Bioorganic & Medicinal Chemistry Letters. 16 (21): 5498–502. doi:10.1016/j.bmcl.2006.08.051. PMID 16945525.
- Béguin C; Richards MR; Li JG; Wang Y; Xu W; Liu-Chen LY; Carlezon WA; Cohen BM (2006). "Synthesis and in vitro evaluation of salvinorin A analogues: effect of configuration at C(2) and substitution at C(18)". Bioorganic & Medicinal Chemistry Letters. 16 (17): 4679–85. doi:10.1016/j.bmcl.2006.05.093. PMID 16777411.
- A1 US 2007/0213394 A1, Beguin C, Carlezon WA, Cohen BM, He M, Lee D Y-W, Richards MR, Liu-Chen L-Y, "Salvinorin derivatives and uses thereof", published 2007-09-13, assigned to Temple University
- MacLean, K. A.; Johnson, M. W.; Reissig, C. J.; Prisinzano, T. E.; Griffiths, R. R. (2012). "Dose-related effects of salvinorin a in humans: Dissociative, hallucinogenic, and memory effects". Psychopharmacology. 226 (2): 381–392. doi:10.1007/s00213-012-2912-9. PMC . PMID 23135605.
- Masis, Julie (28 February 2007). "Mexican drug gains U.S. following". Reuters. مؤرشف من الأصل في 15 سبتمبر 2017.
- Prisinzano, Thomas; Kevin Tidgewell; Wayne W. Harding (2005). "k Opioids as potential treatments for stimulant dependence". The AAPS Journal. Springer New York. 7 (3): E592–E599. doi:10.1208/aapsj070361. ISSN 1550-7416. PMC . PMID 16353938. مؤرشف من الأصل في 01 يونيو 2018.
- Xuei X; Dick D; Flury-Wetherill L; Tian HJ; Agrawal A; Bierut L; Goate A; Bucholz K; Schuckit M; Nurnberger J Jr; Tischfield J; Kuperman S; Porjesz B; Begleiter H; Foroud T; Edenberg HJ (November 2006). "Association of the kappa-opioid system with alcohol dependence". Molecular Psychiatry. 11 (11): 1016–24. doi:10.1038/sj.mp.4001882. PMID 16924269.
- Fichna, Jakub; Dicay, Michael; Lewellyn, Kevin; Janecka, Anna; Zjawiony, Jordan K.; MacNaughton, Wallace K.; Storr, Martin A. (2012-06-01). "Salvinorin A has antiinflammatory and antinociceptive effects in experimental models of colitis in mice mediated by KOR and CB1 receptors". Inflammatory Bowel Diseases. 18 (6): 1137–1145. doi:10.1002/ibd.21873. ISSN 1536-4844. PMID 21953882.
- 21 CFR — SCHEDULES OF CONTROLLED SUBSTANCES §1308.11 Schedule I. - تصفح: نسخة محفوظة 16 يوليو 2017 على موقع واي باك مشين.
- Florida Statutes - Chapter 893 - DRUG ABUSE PREVENTION AND CONTROL - تصفح: نسخة محفوظة 01 ديسمبر 2017 على موقع واي باك مشين.
- Poisons Standard October 2015 https://www.comlaw.gov.au/Details/F2015L01534
- ( كتاب إلكتروني PDF ) https://web.archive.org/web/20130929062941/http://www.notisum.se/rnp/sls/sfs/20060167.pdf. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 29 سبتمبر 2013.
لمزيد من القراءة
- Chavkin, Charles; Sud, Sumit; Jin, Wenzhen; Stewart, Jeremy; Zjawiony, Jordan K.; Siebert, Daniel J.; Toth, Beth Ann; Hufeisen, Sandra J.; Roth, Bryan L. (2004). "Salvinorin A, an active component of the hallucinogenic sage Salvia divinorum is a highly efficacious κ-opioid receptor agonist: structural and functional considerations". Journal of Pharmacology and Experimental Therapeutics. 308 (3): 1197–203. doi:10.1124/jpet.103.059394. PMID 14718611. مؤرشف من الأصل في 29 يونيو 201924 مارس 2007.
- Munro, Thomas A.; Rizzacasa, Mark A.; Roth, Bryan L.; Toth, Beth A.; Yan, Feng (January 2005). "Studies toward the pharmacophore of salvinorin A, a potent kappa opioid receptor agonist". Journal of Medicinal Chemistry. 48 (2): 345–8. doi:10.1021/jm049438q. PMC . PMID 15658846.
- Baselt, Randall C. (2008). "Disposition of Toxic Drugs and Chemicals in Man" (الطبعة 8th). Foster City, CA: Biomedical Publications: 1405–6. .
روابط خارجية
- Salvia divinorum (2007) – EMCDDA drugs profile
- The Salvia divinorum – Research and Information Center (Daniel Siebert)
- Salvia divinorum – Erowid vault
- Lycaeum Salvinorin A
- Tryptamind Salvinorin A Downloadable salvinorin extraction photos.