كريسبر أو التكرارات العنقودية المتناظرة القصيرة منتظمة التباعد (CRISPR) هي نوع تسلسلات دنا توجد في بدائيات النوى كالبكتيريا والبكتيريا القديمة، فيها فواصل مقتطعة من بقايا الحمض النووي للفيروسات التي سبق أن هاجمت الكائن بدائي النواة. يحتفظ الكائن بدائي النواة بهذه البقايا في حمضه النووي كفواصل حتى يستخدمها لاحقاً في الكشف عن الدنا الخاص بتلك الفيروسات في هجماتها اللاحقة، ومن ثم تدميره بمساعدة بروتين cas9.
كاس9 أو البروتين المتعلق بكريسبر 9 (بالإنجليزية: cas9 or CRISPR-associated protein 9) هو أنزيم قاطع يستخدِم تسلسلات كريسبر كدليل للتعرف على سلاسل معينة من الدنا للكائنات الأخرى (مثل الفيروسات المهاجمة للبكتيريا) ومن ثم قصها. وبالتالي تشكل تسلسلات CRISPR مع بروتين cas9 آلية دفاع جزيئية مهمة في بدائيات النوى ضد الفيروسات المهاجمة لها.
وقد قام الإنسان حديثا بالاستفادة من هذا النظام البكتيري الطبيعي، واستخدامه في التعديل على جينومات الكائنات الحية عن طريق قص أجزاء من حمضها النووي بسهولة، في ما يعرف الآن بتقنية كريسبر-كاس9 التي تستخدم في مجال واسع من التطبيقات كالأبحاث العلمية الحيوية والطبية، وتطوير منتجات التقانة الحيوية وعلاج الأمراض.
تاريخ كريسبر
اكتشفت مناطق كريسبر لأول مرة من قبل علماء يابانيين من جامعة أوساكا عام 1987 حين كانو يدرسون جينات معينة في بكتيريا E. Coli، حيث قاموا دون قصد بتحديد تسلسل منطقة من الحمض نووي تقع بالقرب من جين شملته الدراسة، تحتوي على عدد كبير من تكرارات تسلسلات متناظرة بينها فواصل، لكن لم تكن الغاية منها معروفة حينها.[1] لاحقا تم اكتشاف هذا النمط في أنواع أخرى من البكتيريا الحقيقية والبكتيريا القديمة. ثم طُرِح عام 2005 أن CRISPR هي جزء من النظام المناعي البكتيري.[2] في عام 2007، كان العلماء يدرسون البكتيريا العقدية المنتجة لحمض اللبن Streptococcus thermophilus وآليات مقاومتها لهجمات الفيروسات، حيث كانت هجمات هذه الفيروسات من أكبر المشاكل التي تواجه صناعات الألبان والأجبان، فوجدوا أن كريسبر هي وسيلة مناعة تكيفية (مكتسبة) تستخدمها البكتيريا عند تعرضها للهجمات الفيروسية.
بعد البحث الدقيق عام 2011 في آلية عمل نظام كريسبر تبين للعلماء أنه من الممكن تركيب أي سلسلة من الحمض النووي guide RNA على إنزيم cas9. عندما فعلوا ذلك، وتحديدا في عام 2013، صار بالإمكان استخدام الإنزيم للبحث عن أي DNA له نفس تسلسل الـgRNA الذي يحمله، وليس فقط في الفيروسات. وبذلك أصبح بإمكان العلماء التعديل على جينوم أي كائن حي، بقص الحمض النووي الوراثي له بشكل مرن وأكثر سهولة من باقي تقنيات التعديل الوراثي، حتى أصبحت أكثر طرق تعديل الجينوم انتشارا. ويطلق الآن عادة اسم تقنية كريسبر على نظام القطع هذا والمكون من الجزأين: بروتين القطع cas9 والـgRNA.[3]
كريسبر في بدائيات النوى
كريسبر-كاس كآلية دفاع
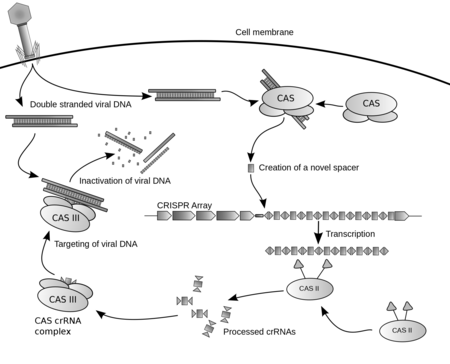
وُجد أن تسلسلات كريسبر هي وسيلة مناعية تكيفية تستخدمها بدائيات النوى كالبكتيريا ضد العناصر الجينية الدخيلة (مثل البلازميدات والفاجات) التي يتعرض لها الكائن بدائي النواة. فمثلا، عندما يصيب فيروس بكتيريوفاج بكتيريا فإنه يحقن حمضه النووي DNA داخل البكتيريا، ليتكاثر داخل البكتريا بأعداد كبيرة قد تقتلها. عندها تطلق البكتيريا أنزيمات لتقوم بجمع قطع من الحمض النووي لذلك لفيروس، ومن ثم تخزين تلك الشيفرة في كريسبر، عن طريق إضافة وحذف قطع من الحمض النووي الفاصل في منطقة كريسبر، الذي وُجد أنه يطابق أجزاء من الشيفرة الوراثية الخاصة بالفيروس. وبذلك، عند تعرض البكتيريا لفيروس مماثل مرة أخرى، تقوم البكتيريا بنسخ الحمض النووي المخزن في كريسبر على هيئة RNA، يسمى crRNA. يقترن crRNA ببروتين القطع cas9، حيث يستخدمه cas9 للتعرف على الفيروس. وعندما يلتقي إنزيم cas9 بفيروس، فإنه وبطريقة تبدو وكأنه يمتطي سلسلتي الـDNA الخاصة بالفيروس يبحث عن تطابق بين جزء من الـcrRNA الذي يحمله وبين الحمض النووي الخاص بالفيروس. هذا الجزء من crRNA الذي يستخدم في التعرف على الفيروس يكون طوله 20 نيوكلوتيد تقريبا. فإذا تطابقت الـ20 نيوكليوتايد التي يحملها cas9 مع 20 نيوكليوتايد من DNA الفيروس، تنفك سلسلتي الـDNA، ما يحفز cas9 لقطع سلسلتي DNA الخاصة بالفيروس، مسبباً تدميره.
تركيب منطقة كريسبر
تتكون منطقة كريسبر من تكرارات تسلسلات النيوكليوتيدات المتناظرة والمتباعدة بشكل منتظم، والتي يوجد بينها قطع صغيرة وفريدة من الحمض النووي الفاصل.
ويجدر الذكر أن هنالك عدة أنواع من أنظمة كريسبر تختلف باختلاف نوع البكتيريا، لذا فيمكن أن يختلف تركيب تسلسل كريسبر وأنزيماته وطريقة نسخ الـcrRNA من نوع لآخر.
تشتمل منطقة كريسبر على منطقة محفز promoter لضمان أن منطقة كريسبر يمكن قراءتها وترجمتها إلى CRISPR-RNA (أو crRNA) الذي تستخدمه الأنزيمات المتعلقة بكريسبر cas proteins في التعرف على الهدف.[4]
يتبع المحفز تكرارات قصيرة short repeats بينها فواصل فريدة spacers:
فأمّا التكرارات repeats تكون موجودة في الحمض النووي البكتيري أصلاً، ويتم نسخها كالجزء الثابت من الـcrRNA. هي أجزاء أطول، عادة ما يتراوح طولها ما بين 28 إلى 37 زوجاً قاعدياً، لكن يمكن أن تكون أقصر أو أطول من ذلك. بعض تكرارات كريسبر تكون على هيئة تسلسلات متناظرة (بالإنجليزية: Palindromic sequences) أي أن كل سلسلة من سلسلتي الـDNA تحتوي تسلسل من النيوكليوتيدات بحيث أنه إذا كان ذلك التسلسل يُقرأ من النهاية 5' إلى 3' في إحدى السلسلتين فإنه يكون متطابقا تماما إذا قُرئ من النهاية 5' إلى 3' في السلسلة المكلمة واللتان تشكلان معا اللولب المزدوج للـDNA. هذا التسلسل المتناظر يعني أنه ينسخ RNA ذو ترابط قاعدي، فيكون شريط RNA مطوياً ذو شكل ثابت فعال، على شكل حلقة جذعية stem-loop تساعد في تعرف أنزيمات cas عليه. بينما تركبت بعض تكرارات كريسبر بحيث يكون RNA الناتج غير مطوي على شكل محدد.
وأمّا الفواصل spacers فهي الأجزاء التي تمت إضافتها من الحمض النووي الفيروسي المهاجِم، ويتم نسخها كالجزء المتغير من الـcrRNA الذي يتصل بالأنزيم cas9، وهو الذي يستخدم في التعرف على DNA المطابق. طولها كـDNA عادة ما يقع بين 32 و 38 زوجاً قاعدياً (لكنه يتراوح ما بين 21 إلى 72 زوج قاعدي). وقد تظهر فواصل جديدة خلال مدة قصيرة كجزء من الاستجابة المناعية للهجوم الفيروسي على البكتيريا.[5]
وعادة ما يكون هنالك أقل من 50 وحدة من تسلسل "تكرار-فاصل" في منطقة كريسبر واحدة.
توجد جينات أخرى مجاورة لكريسبر معروفة باسم الجينات المتعلقة بكريسبر cas genes، والتي تحتوي على الشيفرة اللازمة لبناء البروتينات المتعلقة بكريسبر cas proteins - والتي من ضمنها أنزيم cas9. يتبع تسلسل CRISPR والفواصل منطقة لبناء جزيء RNA يعرف باسم tracrRNA، والذي يرشد جزيئات القطع وcrRNA إلى مواقعها المستهدفة على DNA.[4]
أي أنه، في الطبيعة، يتكون RNA الكلي الذي يتصل بأنزيم cas9 من هذين الجزأين: الجزء الثابت الذي لا يتغير بتغير الهدف، بحسب بعض المصادر يسمى tracrRNA، (وبعضها الآخر يعتبره جزءاً من crRNA) وله دور آخر في البكتيريا في تكوين الجزء المتغير والمشابه لحمض الفيروس النووي، والذي يسمى crRNA، وهذا الثاني يستخدمه الأنزيم في التعرف على الهدف ويتكون من 20 نيوكليوتيد تقريباً. عادة ما يكوّنان الجزء الثابت والجزء المتغير معاً guide RNA الدليل أو gRNA اختصارا، وهذه التسمية (gRNA) عادة ما تطلق على RNA المصنع لا البكتيري الذي يطلق عليه فقط crRNA.[6][7]
تقنية كريسبر-كاس في التعديل الوراثي
سخر العلماء نظام كريسبر الموجود في البكتيريا أصلا، للتعديل على الجينوم لأي نوع من الكائنات الحية، عن طريق قص جزء معين من الحمض الوراثي DNA الخاص بها بدقة لإزالة جينات مسؤولة عن إظهار صفة وراثية غير مرغوبة في الكائن الحي، أو استبدالها بجينات أخرى.
مكونات تقنية كريسبر
هناك مكونان رئيسيان في نظام كريسبر- كاس9 وهما:
- بروتين cas9، أو CRISPR associated protein 9 وهو نيوكلييز داخلي غير متخصص يقوم بقص سلسلتي الحمض النووي DNA مثل مقص جزيئي، ويتجه للمنطقة المراد القص عندها اعتمادا على gRNA الذي يحمله وعلى عوامل أخرى مثل توفر تسلسل خاص للتعرف في DNA يسمى PAM sequence.
- جزيء guide RNA، الحمض النووي الريبوزي الدليل (أو gRNA اختصارا)، يعمل كدليل لتوجيه أنزيم cas9 نحو تسلسل معين من الحمض النووي ليقوم بالقص عند تلك المنطقة. الجزء المتغير من gRNA يتكون من 20 نيوكليوتيدة تقريباً، هذا الجزء يكون مطابقاً للشيفرة الوراثية المراد القص عندها لذا يستخدمه أنزيم cas9 في التعرف على المنطقة الهدف من الجينوم.

كما تكمن الباحثون من إجراء إضافات إلى نظام كريسبر-كاس9 تمكنه من أداء وظائف أخرى مكملة غير القطع،[8] فأمكن أيضاً باستخدامها تركيب جينات جديدة مسوؤلة عن إظهار صفات مرغوبة لتحل محل التي تم قصها، وذلك عن طريق تسخير إنزيمات ترميم repair enzymes لتقوم ببناء الجين المرغوب بدلا من الترميم الطبيعي الذي تقوم به الخلية. لذلك، على سبيل المثال، يمكن للعلماء أن يمكّنوا إنزيم cas9 من أن يتخلص من الجين الذي يسبب مرض هنتنغتون ثم أن يستبدلوه بجين أفضل ليحل محله.[9] ويوجد أنزيمات قطع أخرى متعلقة بكريسبر غير cas9 لها ميزات أخرى.
شروط القطع عند تسلسل معين
- أن يكون التسلسل الهدف المكون من ~20 نيوكليوتايد فريداً لا يتكرر مقارنة بباقي الجينوم.
- أن تكون المنطقة المستهدفة للقطع موجودة مباشرة بالقرب من تتابع خاص مكون من 2-6 نيوكليوتيدات ويسمى (Protospacer Adjacent Motif :PAM). لن يقطع cas9 دون وجود هذا التتابع، وهو ذو دور مهم في البكتيريا؛ لأنه موجود في الحمض النووي الخاص بالفيروس أو البلازميد المهاجم وغير موجود في تسلسل كريسبر البكتيري، ما يجنب أنزيم cas9 من قطع التسلسل البكتيري.[10]
الفرق بين كريسبر-كاس وباقي أدوات التعديل الجيني
هنالك فرق رئيسي يميز استخدام تقنية كريسبر عن تقنيات الهندسة الوراثية الأخرى كـأنزيمات القطع: فكل إنزيم قطع يمكنه القص عند تتابع محدد واحد، كما في إنزيم EcoR1 الذي يتعرف فقط على التتابع GAATTC، ما يقيد التعديل الوراثي. بينما يمكن باستخدام تقنية كريسبر القطع عند أي منطقة مرغوبة من الجينوم، وذلك لأن الـ gRNA الذي يستخدمه إنزيم cas9 للتعرف على منطقة القطع قابل للتعديل والتركيب،[11] فعندما يريد العلماء القص عند تتابع معين من الـDNA فإنهم يصطنعون gRNA مماثل وفريد لهذا التتابع. هذا وفر دقة كبيرة وخيارات أكثر لمناطق قطع الجينوم والتعديل عليه. كذلك وجد أن تقنية كريسبر نجح تطبيقها على جينوم أي كائن حي تم تجريبها عليه، أما أنزيمات القطع تتعرف على تتابعات موجودة في عدد محدود من الكائنات الحية.
تطبيقات
ما زال العلماء يحاولون تطوير حل لمشكلة صعوبة التعديل الجيني على خلايا بشرية كاملة، لكن حتى الآن يمكن إجراء تعديلات بسهولة على الخلايا الجذعية وخلايا الدم الحمراء أو على خلايا نامية في أطباق بتري.[12]
- تستخدم تقنية كريسبر-كاس9 بكثرة في مجال البحث الطبي، حيث يمكن من خلال تعطيل جينات مختلفة اكتشاف كيف تؤثر هذه الجينات على مسار الأمراض المعقدة كالزهايمر أو السرطان، مثلا.[13]
- كريسبر-كاس9 أداة أساسية في تقنية الإجبار الجيني (بالإنجليزية: Gene Drive)، والتي يستخدمها الباحثون حاليا في خطة للقضاء على مرض الملاريا، وذلك بجعل البعوض المعدل وراثياً ليمتلك صفة مقاومة حمل المرض ينشر هذه الصفة بشكل كلي في الأجيال اللاحقة عند تزاوجه مع البعوض غير المقاوِم لحمل المرض، عن طريق جعل احتمال توريث صفة مقاومة المرض بنسبة 100% في الأجيال الناتجة بدلا عن قوانين مندل الطبيعية والتي يكون فيها احتمال توريث الصفة بنسبة 50% بالمتوسط.[14][15]
- تعمل معاهد علمية في سويسرا على استخدام كريسبر في علاج أمراض الدم الوراثية كمرض الأنيميا المنجلية والثلاسيميا، وقالت بأنها تمكنت من علاج مصاب بالثلاسيميا من نوع B باستخدام كريسبر.[16][17]
- بعدما تمت عمليات بنجاح في قص الجينات في الصين و الولايات المتحدة قام باحثون من بريطانيا بقص مورثات بأجنة بشرية بواسطة كريسبر- كاس9 وغيروا بعضها. أراد الباحثون من معهد فرانسيس كريك في لندن بهذه الطريقة استكشاف التطور المبدئي الذي يحدث في الأجنة وفهمها بطريقة أفضل؛ بحيث يتوصلون إلى نسبة نجاح أفضل عند القيام بالتخصيب الإصطناعي. يعتبر هذا تدخل من الإنسان في تغيير الخلق، ولهذا فإن العلماء لم يزرعوا خلاياهم التي قاموا بتغييرات فيها في ارحمام نساء، وإنما أهلكوها. هناك مناقشات كثيرة تجري بين الأطباء والباحثين والسياسيين والقانونيين والمفكرين في شأن بحوث مثل تلك على الإنسان؛ في ألمانيا تلك الأبحاث ممنوعة.
- عام 2018، ادعى عالم صيني يُدعى خه جيان كوي تطبيقه للتقنية على خلايا أجنة بشرية وزرعها في رحم الأم قبل أن تولد الأجنة التوأم "لولو" و"نانا"،[18] حيث قام بتعديل الشيفرة الوراثية الخاصة بهما لتصبحا مقاومتين لـفيروس HIV المسبب لمرض الإيدز وذلك عن طريق استخدامه تقنية كريسبر في تعطيل الجين المنتج للمستقبل البروتيني CCR5 الذي لوحظ أن الأشخاص الذين تفتقر بنيتهم الوراثية إلى الشكل الوظيفي لهذا المستقبل ينزعون ليكونوا مقاومين بشكل غير اعتيادي لمرض الإيدز وفيروس HIV، ما أحدث ضجة كبيرة في الأوساط العلمية لأسباب أخلاقية.[19]
مقالات ذات صلة
- دراسات كريسبر نتائج مشوشة من أبحاث الجينات القديمة
- محرك الجينات
- البروتين المرتبط بكريسبر 9
- تعديل كريسبر
مراجع
- ورقة بحثية نشرت من قبل علماء يابانيين تبرز نتائج دراسة جزء من الشيفرة الوراثية لبكتيريا E. Coli، حقوق النشر للجمعية الأمريكية للأحياء الدقيقة، ديسمبر 1987. نسخة محفوظة 10 يناير 2020 على موقع واي باك مشين.
- "The CRISPR Immune System in Bacteria and Archaea - microbewiki". microbewiki.kenyon.edu. مؤرشف من الأصل في 30 مارس 201921 مارس 2019.
- "CRISPR Timeline". Broad Institute (باللغة الإنجليزية). 2015-09-25. مؤرشف من الأصل في 26 يونيو 201924 مارس 2019.
- "تركيب تسلسل كريسبر - تناظرات باليندرومية في الجينوم". جمعية ماكس بلانك. مؤرشف من الأصل في 18 يونيو 2019.
- Gene W. Tyson; Jillian F. Banfield. Rapidly evolving CRISPRs implicated in acquired resistance of microorganisms to viruses (باللغة الإنجليزية) – عبر https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1462-2920.2007.01444.x.
- "molecular biology - What is the role of tracrRNA in CRISPR-cas9?". Biology Stack Exchange. مؤرشف من الأصل في 24 مارس 201926 أبريل 2019.
- "الفرق بين tracrRNA و crRNA". مؤرشف من الأصل في 13 ديسمبر 2019.
- nature video (2017-10-31), CRISPR: Gene editing and beyond, مؤرشف من الأصل في 17 نوفمبر 2019,30 مارس 2019
- Plumer, Brad (2018-07-23). "A simple guide to CRISPR, one of the biggest science stories of the decade". Vox. مؤرشف من الأصل في 28 يونيو 201924 مارس 2019.
- "Addgene: CRISPR Guide". www.addgene.org. مؤرشف من الأصل في 25 يونيو 201924 مارس 2019.
- "genetics - Can the "Cas9"(involved on the Crispr-cas9 mechanism) be considered as a restriction enzyme?". Biology Stack Exchange. مؤرشف من الأصل في 24 مارس 201924 مارس 2019.
- Jorgensen, Ellen, What you need to know about CRISPR (باللغة الإنجليزية), مؤرشف من الأصل في 10 سبتمبر 2019,24 مارس 2019
- Holley, Jason. "CRISPR is being used for research beyond gene therapy". Stanford Medicine (باللغة الإنجليزية). مؤرشف من الأصل في 5 مايو 201809 أبريل 2019.
- مقال بعنوان "Regulating Gene Drives" منشور في مجلة Science بتاريخ 16 مارس 2015 نسخة محفوظة 30 مارس 2019 على موقع واي باك مشين.
- Matthews, Dylan (2018-05-31). "A genetically modified organism could end malaria and save millions of lives — if we decide to use it". Vox. مؤرشف من الأصل في 16 مايو 201930 مارس 2019.
- AG, CRISPR Therapeutics (2019-02-25). "CRISPR Therapeutics and Vertex Announce Progress in Clinical Development Programs for the Investigational CRISPR/Cas9 Gene-Editing Therapy CTX001". GlobeNewswire News Room. مؤرشف من الأصل في 5 مايو 201924 مارس 2019.
- "CRISPR is being used to treat a patient with a dangerous blood disease". MIT Technology Review (باللغة الإنجليزية)24 مارس 2019.
- "فيديو: "عن لولو ونانا: الفتاتين التوأم اللتان ولدتا صحّيتين بعد عملية جينية أجريت على أجنّتيهما وحيدة الخلية". YouTube (باللغة الإنجليزية). قناة "مختبر هي" على اليوتيوب. مؤرشف من الأصل في 28 يونيو 201922 مارس 2019.
- Belluz, Julia (2018-11-30). "Is the CRISPR baby controversy the start of a terrifying new chapter in gene editing?". Vox. مؤرشف من الأصل في 11 يونيو 201922 مارس 2019.