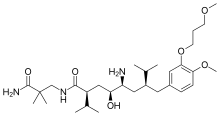
مثبطات الرينين هي مجموعة من الأدوية الصيدلانية المستخدمة بشكل أساسي لمعالجة ضغط الدم المرتفع. تعمل هذه الأدوية على تثبيط الخطوة الأولى والتي تعتبر المحددة لسرعة التفاعل في نظام الرينين– أنجيوتنسين – ألدوستيرون( (RAASو تحديدا تحول أنجيوتنسينوجين angiotensinogen))إلى أنجيوتنسين 1( (angiotensin 1. و يؤدي هذا إلى عدم وجود الأنيجوتنسين 2 angiotensin 2)) بناءا على كون مثبطات الرينين تعمل فقط لتثبيط هذه الخطوة على عكس الأنزيم المحول للأنجيوتنسين و الذي يلعب دورا في تفاعلات كيميائية حيوية أخرى. منذ السبعينيات بدأ العلماء بإجراء تجارب لتطوير مثبطات فعالة ذات توافر بيولوجي فموي.[2][3] كانت العملية صعبة و استغرقت ثلاثة عقود تقريبا. واجه الجيلان الأول و الثاني مشاكل مثل التوافر البيولوجي الفقير و قلة الفعالية. في النهاية تم اكتشاف الجيل الثالث. كانت هذه المركبات عبارة عن مثبطات رينين لا ببتيدية و التي كان لها توافر بيولوجي فموي مقبول و فعالة بما يكفي للاستخدام السريري. أول دواء من هذه المجموعة هو ألسكيرين(أليسكيرين) و الذي تلقى إذنا بالتسويق في عام 2007.[2] حتى يناير 2012 بقي هو المثبط الرينين الوحيد في الأسواق
| صنف أدوية | |
| الاستعمال | ارتفاع ضغط الدم |
|---|---|
| المستهدف الحيوي | كيموسين |
| رمز ATC | C09XA |
| روابط خارجية | |
| الجمعية الأمريكية لصيادلة النظام الصحي/Drugs.com | أصناف الدواء |
التاريخ
في عام 1896 قام الفسيولوجي الفنلندي روبرت تايجرستيدت و الطبيب السويدي بير بيرجمان بإجراء تجربة على الكلى و الجهاز الدوراني لدى الأرانب. لاحظا حدوث ارتفاع في ضغط الدم عندما تم حقن الأرانب في الأوردة الوداجية بمستخلص من الكلية.[4][5] و اكتشفا أيضا أن المادة المسؤولة عن رفع ضغط الدم مصنعة من قبل القشرة الكظرية للكلى و قاما بتسميتها بالرينين.[5] على الرغم من كون التجربة وضعت أسسا لبناء أبحاث مستقبلية حول سبيل الرينين- أنجيوتنسين- ألدوستيرون (RAAS) إلا أن تأثيرها في المجتمع العلمي كان قليلا في ذلك الوقت.[4][6] في عام 1934 عندما قام جولدبات بنشر أبحاثه حول نقص التروية الكلوية عاد الرينين محط انتباه مجددا. و لكن أهمية دور الرينين في الأمراض القلبية الوعائية لم تكن مفهومة حتى السبعينيات و بعد عشرين سنة تم إدخال أول مثبطات الرينين إلى التجارب السريرية.[2] بيبستاتين و الذي تم توصيفه في عام 1972 كان أول مثبط صناعي للرينين و لكن حرائكيته الدوائية الضعيفة منعته من الدخول في مرحلة الدراسات على الكائنات الحية.[3][7] الجيل الأول من مثبطات الرينين مثل H-142 كان مضاهيا ببتيديا للأنجيوتنسينوجين.[8] كانت هذه المثبطات أيضا محدودة في الخصائص الدوائية.[2][7] استعيد الأمل باكتشاف جديد في عام 1982 عندما بدأ تطوير الجيل الثاني من مثبطات الرينين.[2] احتوى هذا الجيل على مركبات شبيهة للبيبتيدات مثل ريميكيرين(ريميكيرين) و إينالكيرين(enalkiren) و زانيكيرين (zanikiren).[6]] كانت جميعها تتمتع بخصائص شبيهة بالدواء أكثر من الخصائص الشبيهة بالركائز. في عام 1990 توجه الجيل الثاني نحو التجارب السريرية. كان للجيل الثاني محددات منعت إكمال التجارب السريرية.[2] كان أليسكيرين مثبط الرينين الوحيد الذي وصل إلى المرحلة الثالثة من التجارب السريرية و هو ليس بيبتيدي البنية ولهذا تم اعتباره جيلا ثالثا من مثبطات رينين.[2][9] The first clinical trial was performed in 2000 in healthy volunteers.[10] تم تطبيق أول تجربة سريرية في عام 2000 على متطوعين أصحاء.[2] في 2007 تمت الموافقة على أليسكيرين من قبل إدارة الغذاء و الدواء الأمريكية و الوكالة الأوروبية للأدوية ((EMA كعلاج لارتفاع ضغط الدم.[11]
نظام الرينين- أنجيوتنسين- ألدوستيرن
يلعب نظام الرينين- أنجيوتنسين- ألدوسيرون (RAAS) دورا مهما في الإمراض المتعلق بالأمراض القلبية الوعائية وضغط الدمالمرتفع و السكري الكلوي و فشل القلب.[12] في الحالة الطبيعية يتم تحفيز نظام (RAAS) كاستجابة للتهديدات التي تخفض ثبات ضغط الدم مثل حالات ضغط الدم المنخفض و فقدان الدم و الفقدان الشديد للصوديوم و الماء. يعتمد ضغط الدم على المقاومة المحيطية الكلية و النتاج القلبي. يتم إفراز الأسبارتيك بروتياز رينين شديد الانتقائية من الجهازالمجاور للكبيبات والذي يشكل المصدر الوحيد للرينين الفعال[13] البرورينين و على الرغم من كونه السلف (الشكل الأولي) إلا أنه يتم إفرازه من أنسجة أخرى أيضا، مثل الغدد اللعابية و الدماغ و القلب و الأوعية الدموية.[13][14][15] رنين هوإنزيم يدور في الدم و يعمل على إعادة دوران البيبتايد وهو الأنجيوتينسينوجين. يكسر رينين البيبتايد في موقع الرابطة (لوسين10 – فالين11) وهذا التفاعل يعد خطوة محددة لسرعة التفاعل في نظام ( (RAAS.[16] و هذا يؤدي إلى الناتج أنجيوتنسين 1 (Ang I) وهو بيبتيد مكون من عشرة أحماض أمينية (ديكاببتايد). أنجيوتنسين 1 يتم تحطيمه بواسطة الإنزيم المحول للأنجيوتنسين (ACE) إلى البيبتايد الفعال المكون من ثماني أحماض أمينية (أوكتابيبتايد) أنجيوتينسين2 (Ang II) و الذي يشكل الفاعل الرئيسي في نظام (RASS). يحفز أنجيوتنسين 2 الاحتباس الكلوي للصوديوم و يحفز إفراز الألدوستيرون كما يسبب تضييق الأوعية الدموية و يزيد نشاط الجهازالعصبي الودي.[15][17] يقوم أنجيوتينسين أيضا بعمل ارتجاع سلبي للنظام من خلال تثبيط إفراز الرينين من الجهازالمجاور للكبيبات.[17] يتفاعل أنجيوتنسين 2 مع صنفان على الأقل من مستقبلات Ang II وهما AT1 وAT 2.[15] هذه الآلية التي تسير من الرينين عبر الأنجيوتنسين 2 إلى الألدوستيرون و تلك التي يعمل الأنجيوتنسين 2 على إفراز الرينين من خلال الارتجاع السلبي تعرف باسم RAAS[17].التأثير التحصيلي هو زيادة ضغط الدم و هذا أساسي في الفيسيولوجيا الطبيعية للحفاظ على حالة الاستتباب. من المحتمل أن ارتفاع ضغط الدم الأساسي -و هي حالة غير متجانسة تؤدي على المدى البعيد إلى تلف في الأجهزة- مرتبط بفرط نشاط هذا النظام و هذا ما تحاول أنواع متعددة من الأدوية معاكسته.يغلب ارتفاع تركيز الرينين في البلازما لدى الأشخاص الأصغر سنا المصابين بارتفاع ضغط الدم عندما يكون المسبب الأساسي لارتفاع الضغط هو تضيق الأوعية الدموية. يكون تركيز الرينين في الدم أقل لدى الأشخاص الأكبر سنا أو لدى العرقية الأفريقية الأمريكية أو الكريبية الأمريكية عندما يقترن احتباس الأملاح بصورة أكبر بارتفاع ضغط الدم. على الرغم من هذا فإن دور مستوى الرينين في البلازما في سبب و علاج ارتفاع ضغط الدم بقي جدليا.[18]
آلية العمل
ترتبط مثبطات الرينين بالمقر الفعال لإنزيم الرينين و تثبط بهذا ارتباط الرينين بالأنجيوتنسينوجين و التي تعد الخطوة المحددة للتفاعل في شلال تفاعل و بالتالي تمنع مثبطات الرينين تكوين الأنجيوتنسين1 و الأنجيوتنسين2. و قد تمنع مثبطات الرينين (Ang-(1-7 وAng-(1-9) وAng-(1-5).[19] على الرغم من أن الأهمية السريرية لذلك ليست معروفة. الرنين انتقائي فقط تجاه ركيزته الوحيدة الطبيعية وهي الأنجيوتنسين. واحتمالية حدوث تفاعلات جانبية غير مرغوب فيها قليل.[20] و مشابه لمضادات مستقبلات الأنجيوتنسين 2.[21] كذلك يعمل أنجيوتنسين 2 في نظام RAAS كارتجاع سلبي يثبط إفراز الرينين. إن تقليل كمية الأنجيوتنسين 2 أو انسداد مستقبلات الأنجيوتنسين 2 يؤدي إلى تثبيط خطوة الارتجاع السلبي و يؤدي إلى زيادة تركيز الرينين في البلازما (PRC) و فاعلية الرينين في البلازما (PRA). قد يسبب هذا مشاكل في العلاج بمثبطات الإنزيم المحول للأنجيوتنسين (ACE) و مضادات مستقبلات الأنجيوتنسين 2 طالما أن زيادة PRA قد تؤدي إلى تعويض التثبيط الدوائي لنظام RASS. لأن مثبطات رينين تؤثر بشكل مباشر على نشاط الرينين فإن النقص في PRA بالرغم من زيادة PRC – بسبب فقدان الارتجاع السلبي- قد يكون ذي فائدة سريرية.[22]
اكتشاف الدواء وتطوره
بيبستاتين: أول مثبط للرينين
بيبستاتين كان أول مثبط رينين صناعي. هو من أصل مايكروبي و هو N-acyl-pentapeptide و على وجه التحديد isovaleryl-L-valyl-L-valyl-statyl-L-alanyl-statine.[3][23]] وجد أن بيبستاتين هو مثبط تنافسي فعال لمعظم الأسبارتيك بروتيازات و لكنه مثبط ضعيف للرينين.[24] بالأصل اعتبرت فعالة في علاج القرحة الإثنا عشرية و تم إجراء التجارب السريرية لكنها لم تنجح.[25][26] ستاتين هو حمض أميني يظن بأنه المسؤول عن فعالية البيبستاتين لأنه يحاكي المرحلة الانتقالية الرباعية الأوجه لتحفيز البيبتايد.[27] بسبب خاصية الكراهية للماء التي يمتلكها الستاتين يكون للبيبستاتين ذائبية قليلة جدا في البيئة الفسيولوجية.[27] وطالما أن لديها فعالية قليلة و ذائبية فقيرة فلم يدخل في مرحلة الدراسات داخل الكائنات الحية.
الجيل الأول: مضاهيات البيبتايدات
يتكون هذا الجيل من مجموعتين من المركبات: إما مضاهي البيبتايد للبروسيجمنت (الجزء في نهاية البيبتايد الذي يساعد على الانثناء) للرينين أو مضاهيات البيبتايد للجزء الأميني الطرفي للركيزة أنجيوتنسينوجين.[8][28][29] الأدوية في المجموعة الأخيرة أبدت فاعلية في تثبيط نشاط الرينين و تقليل ضغط الدم في الحيوانات والإنسان.[30] ولسوء الحظ كان يجب إعطائها حقنا بسبب قلة التوافر الحيوي و اتضح كذلك أن لها فترة فعل قصيرة و فعالية قليلة و قدرتها على خفض ضغط الدم غير كافية. لم يكمل أي من هذه الأدوية الدراسات السريرية.[22]
الجيل الثاني: محاكيات البيبتايدات
المركبات في هذا الجيل كانت أكثر فعالية وثباتة و ذات فترة فعل أطول. واحد منها CGP2928 وهو مركب محاك للبيبتايد كان أول مثبط رينين تقبل فعاليته عندما أخذ فمويا. عند اختباره على قردة القشة كان فعال فقط على جرعات عالية.[7] تطوير أدوية جديدة في الجيل الثاني استمرت لرفع الخصائص الحرائكية الدوائية. و عندها تم اكتشاف ريميكيرين و إينالكيرين و زانكيرين. كانت هذه مثبطات محاكية للبيبتايدات ببنية مطورة جعلت منها أكثر انتقائية و فاعلية و ثباتا. لسوء الحظ تم إنهاء التطوير السريري لأن الأدوية كان لها وفرة حيوية فقيرة (تمتص بصورة فقيرة و تتأثر بالعمليات اليضية بسرعة) و القدرة على تقليل ضغط الدم ما زالت منخفضة.[2][16][22]
الجيل الثالث: اللابيبتايدات
كان أليسكيرين - وهو مثبط رينين لابيبتايدي فعال فمويا- أول دواء في السوق من هذه المجموعة. يستخدم لمعالجة ضغط الدم المرتفع وحده أو مع خافضات ضغط الدم الأخرى.[2] المفتاح لاكتشاف أليسكيرين كان في تقنية مبحث البلورات و تقنيات التمثيل الجزيئي و بهذا تم إيجاد حل للمشكلة التي عرقلت تطوير مثبطات الرينين في الأجيال السابقة. المواد اللابيبتايدية استطاعت حل مشكلة الخصائص الحرائكية الدوائية الفقيرة و الانتقائية الضعيفة. أدى هذا إلى تصميم جزيئات صغيرة ( المثبطات اللابيبتيدية) و التي كانت شديدة الفعالية و الانتقائية للرينين البشري.[16][31]
العلاقة بين الارتباط وفاعلية البنية لمثبطات الرينين
الرينين هو إنزيم أحادي الانتقائية وينتمي إلى عائلة الأسبارتيك بروتياز.[32] تتميز بنيته بالتعقيد و تتكون من فصين متطابقين ينثنيان في هيئة شرائح البيتاβ-sheets [16] وبين الفصين عميقا داخل الإنزيم يقع المقر الفعال و ترجع فعاليته التنشيطية إلى طرفي حمض الأسبارتيك (ASP32,ASP215 واحد من كل فص من جزيء الرينين).[16] هنالك سديلة مرنة من الأحماض الأمينية المكونة من النوع بيتا (β-hairpin) تغلق المقر الفعال عن طريق تغطية الشق.[33] يحتوي جزيء الرينين على أحماض أمينية كارهة و أخرى محبة للماء؛ المحبة للماء تكون على الجزء الخارجي للجزيء بينما الكارهة للماء فتكون نحوالداخل و تكون المقر الفعال و الذي يشكل تجويفا كبيرا كارها للماء[34] و الذي يلائم الربيطة بسبع بواق على الأقل. الرابطة الأساسية بين الربيطة و الإنزيم هي الرابطة الهايدروجينية. يتم تسمية البواقي اعتمادا على أماكنها في الربيطة؛ البواقي القريبة من التجويف تسمى P1 وP1` و يرتبطان بداخل جيوبS1 و S1` بالترتيب. يوجد أربعة جيوب من النوع S و ثلاثة جيوب من النوع S` (الجدول 1). تتبادل الجيوب على كلا جانبي الركيزة الأساسية للربيطة. يؤثر هذا التبادل على اتجاه الجيوب مما يجعل الجيبين S3 و S1 يصطفان معا و يقرب الجيب S2 إلى كلا الجيبين S4 وS1`.[35] تقترح الأدلة اندماج الجيبين المتقاربين S1 و S3 لتكوين جيب كبير.[36] تتمتع الربيطة التي تملأ الجيب الكبير بفاعلية أكبر من تلك التي لا تملؤه و هذا التمركز يزيد الفعالية مئتي ضعف. يمكن لهذه الربيطة أن تكون ذات بنية متنوعة و تشكل روابط فان ديرفالس مع سطح الجيب الكبير.[6] و يمتد من الجيب S3 موقع فعال لربط الرينين انتقائيا و المسمى بالجييب .S3sp [32] يستطيع هذا الجييب احتواء كلا البقايا الطرفية المحبة و الكارهة للماء فهو يستطيع احتواء ثلاثة جزيئات ماء إلا أن لديه طبيعة كارهة للماء أو محبة للدهن أيضا. لا يعد الجييب S3sp مرن الهيئة ولذلك يجب أن يكون للبقايا الطرفية التي تحتل الجييب خصائص محددة. إذ لا يمكن لها أن تكون متطلبة فراغيا و يجب أن تحتوى على عدد كبير من الروابط الدورانية و أن تستطيع الارتباط بروابط هيدروجينية. جيب S2 هو جيب كبير ذو قسمين و كاره للماء و لكنه يستطيع احتواء كلا من الربيطة الكارهة للماء و القطبية. إن هذا التنوع في القطبية توفر فرص متنوعة للبقية الطرفية P2 للارتباط بالإنزيم. إن S1-S3 و جييب S3sp هي الأهداف الأساسية للدواء عند تصميمه و لكن الاكتشافات الحديثة أظهرت مواقع أخرى مهمة. تفاعلات الجيوب في موقع S` أثبت أنها مهمة للتجاذب وخاصة بين S1` وS2` و أثبتت الدراسات المخبرية أن التفاعل مع منطقة السديلة قد يكون مهما للتجاذب.[6]
التفاعل بين حمض الأسبارتيك و المقر الفعال يؤدي إلى زيادة التجاذب. و يزداد التجاذب كنتيجة لاحتلال جيوب أكثر في المقر الفعال. على الرغم من هذا فإن بعض الجيوب تؤثر بصورة أكبرمن غيرها في زيادة التجاذب. التفاعل الكاره للماء مع الجييب S3sp و S1 و S3 ينتج فعالية وتجاذب أكبر[37] .بوجود طرف كبير و أروماتيكي في P3 تزيد من النشاط التثبيطي[38]. إن احتلال الجييب S3spقد يؤدي إلى ارتفاع الفاعلية بخمسين ضعف وإلى ارتباط قوي.[6]
| الجيب | الخصائص[6] | الموقع الفرعي | أهمية اللارتباط[6][39] |
|---|---|---|---|
| S4 | كاره للماء | P4 | مهم للارتباط نسبيا |
| S3 | كاره للماء | P3 | مهم جدا للارتباط |
| S3sp | محب وكاره للماء بشكل متساو | P3السلسلة الطرفية ل | يزيد جذب الارتباط بشكل عظيم |
| S2 | كبير الحجم وكاره للماء | P2 | مهم للارتباط |
| S1 | كبير الحجم وكاره للماء | P1 | لا يوجد معلومات |
| S1′ | كاره للماء بشكل أساسي | P1′ | مفصلي للارتباط القوي |
| S2′ | قطبي | P2′ | مفصلي للارتباط القوي |
| S3′ | لا يوجد معلومات | P3′ | البنية و الوجود ليس بتلك الأهمية |
مثال على الارتباط بمثبط الرينين: أليسكيرين هو مثبط رينين شبيه للبيبتايد وعلى عكس الغالبية فهو محب للماء. يثبط القدرة التنشيطية للإنزيم من خلال احتلال الجيوب من S3 إلى S2` ما عدا الجيب S2. يرتبط أليسكيرين أيضا بالجييب S3sp و لأن الجيب انتقائي للرينين. لا يثبط أليسكيرين أسبارتيك بروتيازات أخرى مثل الكاثبسين D (cathepsin d) و البيبسين (pepsin).[39] ترتبط السلسلة الطرفية للأليسكيرين بالجييب S3sp بمثالية و يؤدي إلى فعاليته كمثبط للرينين في الإنسان.[6] تشكل مجموعة الهايدروكسيل للأليسكيرين رابطة هيدروجينية مع كلا الأكسجين وال Asp32. مجموعة الأمين تشكل رابطة هايدروجينية مع مجموعة حمض الكاربوكسيل لل Gly217 و ذرة الأكسجين من الAsp32. تملأ مجموعة الميثوكسي على الحلقة الأروماتيكية الجيب S3 و يمكن أن تشكل رابطة هيدروجينية مع مجموعة أمين ثانوية من Tyr14. تشكل مجموعة الأميد رابطة هيدروجينية مع مجموعة الأمين الثانوية لل Ser79.[37] يتم احتلال الجيبين S1 و S1` من قبل مجموعتي بروبيل على الموقعين P1 و P1`.[36] موقع الأميد الطرفي في P2` يثبت ذيل الأميد في الموقع الفعال عن طريق تكوين رابطة هايدروجينية مع Arg74 في الجيب S2`.[40]
الوضعية الحالية
أليسكيرين فعال في خفض ضغط الدم[2][22] و لكن في 20 أبريل 2012 حذرت إدارة الغذاء والدواء الأمريكية من المخاطرالمحتملة لدى استخدام الأليسكسرين أو الأدوية الخافضة للضغط المحتوية على أليسكيرين مع مثبطات الإنزيم المحول للانجيوتنسين (ACE ) و مضاداتات مستقبلات الأنجيوتنسين (ARBs) لدى المرضى الذين يعانون من السكري أو اعتلال في الكلى. أصدرت النصح بأن هذه الأدوية مجتمعة يجب أن لا تستخدم من قبل مرضى السكري بسبب خطر حدوث اعتلال كلوي و انخفاض في ضغط الدم و ارتفاع البوتاسيوم و كذلك فإن أليسكيرين لا يجب استخدامه مع ARBs أو مثبطات ACE في المرضى المصابين باعتلال كلوي متوسط إلى خطير( عندما تكون سرعة الترشيح الكبيبي ((GRF أكبر من 60 ملي لتر/دقيقة) و مع ذلك فقد نصحت بعدم إيقاف أليسكيرين إلا عند استشارة متخصص بالرعاية الطبية.تمت الموافقة على أليسكيرين مع الهيدروكلوروثيازايد من قبل إدارة الغذاء والدواء في 2008 بالاسم التجاري تكتورنا
في عام 2007 أعلنت الشركات Actelion/Merck و Speedel أنها تقوم بالبحوث السريرية للجيل الجديد من مثبطات الرينين. المركب الأساسي من شركة Actelion/Merck دخل إلى المرحلة الثانية من التجارب. واحد من مركبات Speedel , SPP635 أكمل المرحلة الثانية IIa . أظهرت النتائج أنه كان آمنا و محتملا بشكل جيد لفترة 4 أسابيع و قلل ضغط الدم بمقدار 9,8 إلى 17,9 ملي متر زئبقي. في 2008, SPP635 استكمل المرحلة الثانية في التطوير لمرضى السكري ذوي ارتفاع ضغط الدم. مزيد من مثبطات الرينين من Speedel تحت التجارب السريرية. اثنان منها ؛ SPP1148 و SPP676 دخلت المرحلة الأولى. أما البقية فهي في مرحلة سابقة لمرحلة التجارب السريرية ؛ المركب SPP1234 والمركبات من سلسلة SPP800. الجيل التالي من مثبطات الرينين أظهرت تقدم مهما على الأجيال السابقة حيث زادت الوفرة الحيوية بنسبة تصل إلى 30% للبشر و لديها توزيع أفضل في الأنسجة.[مصدر غير معتمد]
مقالات ذات صلة
مراجع
- Gradman AH, Schmieder RE, Lins RL, Nussberger J, Chiang Y, Bedigian MP (March 2005). "Aliskiren, a novel orally effective renin inhibitor, provides dose-dependent antihypertensive efficacy and placebo-like tolerability in hypertensive patients". Circulation. 111 (8): 1012–8. doi:10.1161/01.CIR.0000156466.02908.ED. PMID 15723979. مؤرشف من الأصل في 1 مايو 2020.
- Jensen, C.; Herold, P.; Brunner, H. R. (2008). "Aliskiren: The first renin inhibitor for clinical treatment". Nature Reviews Drug Discovery. 7 (5): 399–410. doi:10.1038/nrd2550. PMID 18340340.
- Gross, F.; Lazar, J.; Orth, H. (1972). "Inhibition of the renin-angiotensinogen reaction by pepstatin". Science. 175 (22): 656. doi:10.1126/science.175.4022.656. PMID 4109853.
- Ferrario, C. M.; Iyer, S. N. (1998). "Angiotensin-(1-7): A bioactive fragment of the renin-angiotensin system". Regulatory peptides. 78 (1–3): 13–18. doi:10.1016/s0167-0115(98)00134-7. PMID 9879742.
- Phillips, M. I.; Schmidt-Ott, K. M. (1999). "The Discovery of Renin 100 Years Ago". News in physiological sciences : an international journal of physiology produced jointly by the International Union of Physiological Sciences and the American Physiological Society. 14: 271–274. PMID 11390864.
- Webb, R. L.; Schiering, N.; Sedrani, R.; Maibaum, J. R. (2010). "Direct Renin Inhibitors as a New Therapy for Hypertension". Journal of Medicinal Chemistry. 53 (21): 7490–7520. doi:10.1021/jm901885s. PMID 20731374.
- Wood, J. M.; Gulati, N.; Forgiarini, P.; Fuhrer, W.; Hofbauer, K. G. (1985). "Effects of a specific and long-acting renin inhibitor in the marmoset". Hypertension. 7 (5): 797–803. doi:10.1161/01.hyp.7.5.797. PMID 3928488.
- Szelke, M.; Leckie, B.; Hallett, A.; Jones, D. M.; Sueiras, J.; Atrash, B.; Lever, A. F. (1982). "Potent new inhibitors of human renin". Nature. 299 (5883): 555–557. doi:10.1038/299555a0. PMID 6750410.
- Segall, L.; Covic, A.; Goldsmith, D. J. A. (2007). "Direct renin inhibitors: The dawn of a new era, or just a variation on a theme?". Nephrology Dialysis Transplantation. 22 (9): 2435–2439. doi:10.1093/ndt/gfm363. PMID 17556409.
- Nussberger, J.; Wuerzner, G.; Jensen, C.; Brunner, H. R. (2002). "Angiotensin II suppression in humans by the orally active renin inhibitor Aliskiren (SPP100): Comparison with enalapril". Hypertension. 39 (1): E1–E8. doi:10.1161/hy0102.102293. PMID 11799102.
- Musini VM, Fortin PM, Bassett K, Wright JM. Blood pressure lowering efficacy of renin inhibitors for primary hypertension. Cochrane Database of Systematic Reviews 2008, Issue 4. Art. No.: CD007066. DOI: 10.1002/14651858.CD007066.pub2.
- Weir MR (September 2007). "Effects of renin-angiotensin system inhibition on end-organ protection: can we do better?". Clin Ther. 29 (9): 1803–24. doi:10.1016/j.clinthera.2007.09.019. PMID 18035185.
- Castrop H, Höcherl K, Kurtz A, Schweda F, Todorov V, Wagner C (April 2010). "Physiology of kidney renin". Physiol. Rev. 90 (2): 607–73. doi:10.1152/physrev.00011.2009. PMID 20393195.
- Tice, C. M.; Xu, Z.; Yuan, J.; Simpson, R. D.; Cacatian, S. T.; Flaherty, P. T.; Zhao, W.; Guo, J.; Ishchenko, A.; Singh, S. B.; Wu, Z.; Scott, B. B.; Bukhtiyarov, Y.; Berbaum, J.; Mason, J.; Panemangalore, R.; Cappiello, M. G.; Müller, D.; Harrison, R. K.; McGeehan, G. M.; Dillard, L. W.; Baldwin, J. J.; Claremon, D. A. (2009). "Design and optimization of renin inhibitors: Orally bioavailable alkyl amines". Bioorganic & Medicinal Chemistry Letters. 19 (13): 3541–3545. doi:10.1016/j.bmcl.2009.04.140. PMID 19457666.
- Ferrario, C. M. (2006). "Role of angiotensin II in cardiovascular disease therapeutic implications of more than a century of research". Journal of the renin-angiotensin-aldosterone system : JRAAS. 7 (1): 3–14. doi:10.3317/jraas.2006.003. PMID 17083068.
- Rahuel, J.; Rasetti, V.; Maibaum, J.; Rüeger, H.; Göschke, R.; Cohen, N. C.; Stutz, S.; Cumin, F.; Fuhrer, W.; Wood, J. M.; Grütter, M. G. (2000). "Structure-based drug design: The discovery of novel nonpeptide orally active inhibitors of human renin". Chemistry & biology. 7 (7): 493–504. doi:10.1016/S1074-5521(00)00134-4. PMID 10903938.
- Hsueh, W. A.; Wyne, K. (2011). "Renin-Angiotensin-Aldosterone System in Diabetes and Hypertension". The Journal of Clinical Hypertension. 13 (4): 224–237. doi:10.1111/j.1751-7176.2011.00449.x. PMID 21466617.
- Moser M, Izzo JL (2003). "Plasma renin measurement in the management of hypertension: the V and R hypothesis". J Clin Hypertens (Greenwich). 5 (6): 373–6. doi:10.1111/j.1524-6175.2003.02870.x. PMID 14688491.
- Müller, D. N.; Derer, W.; Dechend, R. (2008). "Aliskiren—mode of action and preclinical data". Journal of Molecular Medicine. 86 (6): 659–662. doi:10.1007/s00109-008-0330-6. PMID 18443751.
- Weir, M.; Bush, C.; Anderson, D.; Zhang, J.; Keefe, D.; Satlin, A. (2007). "Antihypertensive efficacy, safety, and tolerability of the oral direct renin inhibitor aliskiren in patients with hypertension: A pooled analysis". Journal of the American Society of Hypertension. 1 (4): 264–277. doi:10.1016/j.jash.2007.04.004. PMID 20409858.
- Gao D, Ning N, Niu X, Wei J, Sun P, Hao G (May 2011). "Aliskiren vs. angiotensin receptor blockers in hypertension: meta-analysis of randomized controlled trials". Am. J. Hypertens. 24 (5): 613–21. doi:10.1038/ajh.2011.3. PMID 21293386.
- Staessen, J. A.; Li, Y.; Richart, T. (2006). "Oral renin inhibitors". The Lancet. 368 (9545): 1449–1456. doi:10.1016/S0140-6736(06)69442-7. PMID 17055947.
- Umezawa, H.; Aoyagi, T.; Morishima, H.; Matsuzaki, M.; Hamada, M.; Takeuchi, T. (1970). "Pepstatin, a new pepsin inhibitor produced by Actinomycetes". The Journal of antibiotics. 23 (5): 259–262. doi:10.7164/antibiotics.23.259. PMID 4912600.
- Fisher, N. D. L.; Hollenberg, N. K. (2005). "Renin Inhibition: What Are the Therapeutic Opportunities?". Journal of the American Society of Nephrology. 16 (3): 592–599. doi:10.1681/ASN.2004100874. PMID 15703270.
- Bonnevie, O.; Svendsen, L. B.; Holst-Christensen, J.; Johansen, T. S.; Søltoft, J.; Christiansen, P. M. (1979). "Double-blind randomised clinical trial of a pepsin-inhibitory pentapeptide (pepstatin) in the treatment of duodenal ulcer". Gut. 20 (7): 624–628. doi:10.1136/gut.20.7.624. PMC . PMID 385457.
- Svendsen, L. B.; Christiansen, P. M.; Bonnevie, O. (1979). "Gastric ulcer therapy with a pepsin-inactivating peptide, pepstatin: A double-blind randomized clinical trial". Scandinavian journal of gastroenterology. 14 (8): 929–932. PMID 394302.
- Eid, M.; Evin, G.; Castro, B.; Menard, J.; Corvol, P. (1981). "New renin inhibitors homologous with pepstatin". The Biochemical journal. 197 (2): 465–471. PMC . PMID 7034718.
- Szelke, M., Leckie, B. J., Tree, M., Brown, A., Grant, J., Hallett, A., et al. (1982). H-77: a potent new renin inhibitor. In vitro and in vivo studies. Hypertension, 4(3 Pt 2), 59-69. http://hyper.ahajournals.org/content/4/3/59.abstract
- Tree, M.; Atrash, B.; Donovan, B.; Gamble, J.; Hallett, A.; Hughes, M.; Jones, D. M.; Leckie, B.; Lever, A. F.; Morton, J. J.; Szelke, M. (1983). "New inhibitors of human renin tested in vitro and in vivo in the anaesthetized baboon". Journal of hypertension. 1 (4): 399–403. doi:10.1097/00004872-198312000-00013. PMID 6398331.
- Webb, D. J.; Manhem, P. J.; Ball, S. G.; Inglis, G.; Leckie, B. J.; Lever, A. F.; Morton, J. J.; Robertson, J. I.; Murray, G. D.; Ménard, J.; Hallett, A.; Jones, D. M.; Szelke, M. (1985). "A study of the renin inhibitor H142 in man". Journal of hypertension. 3 (6): 653–658. doi:10.1097/00004872-198512000-00013. PMID 3910726.
- Claude Cohen, N. (2007). "Structure-Based Drug Design and the Discovery of Aliskiren (Tekturna): Perseverance and Creativity to Overcome a R&D Pipeline Challenge". Chemical Biology & Drug Design. 70 (6): 557–565. doi:10.1111/j.1747-0285.2007.00599.x. PMID 17999663.
- Winiecka, I.; Dudkiewicz-Wilczyńska, J.; Roman, I.; Paruszewski, R. (2010). "New potential renin inhibitors with dipeptide replacements in the molecule". Acta poloniae pharmaceutica. 67 (4): 367–374. PMID 20635532.
- Gradman, A. H., & Kad, R. (2008). Renin inhibition in hypertension. [Review]. J Am Coll Cardiol, 51(5), 519-528. http://content.onlinejacc.org/cgi/content/full/51/5/519 - تصفح: نسخة محفوظة 2012-03-27 على موقع واي باك مشين.
- Lunney, E. A.; Hamilton, H. W.; Hodges, J. C.; Kaltenbronn, J. S.; Repine, J. T.; Badasso, M.; Cooper, J. B.; Dealwis, C.; Wallace, B. A.; Lowther, W. T. (1993). "Analyses of ligand binding in five endothiapepsin crystal complexes and their use in the design and evaluation of novel renin inhibitors". Journal of Medical Chemistry. 36 (24): 3809–3820. doi:10.1021/jm00076a008. PMID 8254610.
- Matter, H.; Scheiper, B.; Steinhagen, H.; Böcskei, Z.; Fleury, V. R.; McCort, G. (2011). "Structure-based design and optimization of potent renin inhibitors on 5- or 7-azaindole-scaffolds". Bioorganic & Medicinal Chemistry Letters. 21 (18): 5487–5492. doi:10.1016/j.bmcl.2011.06.112. PMID 21840215.
- Yuan, J.; Simpson, R. D.; Zhao, W.; Tice, C. M.; Xu, Z.; Cacatian, S.; Jia, L.; Flaherty, P. T.; Guo, J.; Ishchenko, A.; Wu, Z.; McKeever, B. M.; Scott, B. B.; Bukhtiyarov, Y.; Berbaum, J.; Panemangalore, R.; Bentley, R.; Doe, C. P.; Harrison, R. K.; McGeehan, G. M.; Singh, S. B.; Dillard, L. W.; Baldwin, J. J.; Claremon, D. A. (2011). "Biphenyl/diphenyl ether renin inhibitors: Filling the S1 pocket of renin via the S3 pocket". Bioorganic & Medicinal Chemistry Letters. 21 (16): 4836–4843. doi:10.1016/j.bmcl.2011.06.043. PMID 21741239.
- Politi, A.; Durdagi, S.; Moutevelis-Minakakis, P.; Kokotos, G.; Mavromoustakos, T. (2010). "Development of accurate binding affinity predictions of novel renin inhibitors through molecular docking studies". Journal of Molecular Graphics and Modelling. 29 (3): 425–435. doi:10.1016/j.jmgm.2010.08.003. PMID 20855222.
- Akahane, K.; Umeyama, H.; Nakagawa, S.; Moriguchi, I.; Hirose, S.; Iizuka, K.; Murakami, K. (1985). "Three-dimensional structure of human renin". Hypertension. 7 (1): 3–12. doi:10.1161/01.hyp.7.1.3. PMID 3884499.
- Wood, J. M.; Maibaum, J.; Rahuel, J.; Grütter, M. G.; Cohen, N. C.; Rasetti, V.; Rüger, H.; Göschke, R.; Stutz, S.; Fuhrer, W.; Schilling, W.; Rigollier, P.; Yamaguchi, Y.; Cumin, F.; Baum, H. P.; Schnell, C. R.; Herold, P.; Mah, R.; Jensen, C.; O'Brien, E.; Stanton, A.; Bedigian, M. P. (2003). "Structure-based design of aliskiren, a novel orally effective renin inhibitor". Biochemical and Biophysical Research Communications. 308 (4): 698–705. doi:10.1016/S0006-291X(03)01451-7. PMID 12927775.
- Wu, Y.; Shi, C.; Sun, X.; Wu, X.; Sun, H. (2011). "Synthesis, biological evaluation and docking studies of octane-carboxamide based renin inhibitors with extended segments toward S3′ site of renin". Bioorganic & Medicinal Chemistry. 19 (14): 4238–4249. doi:10.1016/j.bmc.2011.05.059. PMID 21708467.