مصاوغة التريوز فسفات (Triosephosphate isomerase) (TPI) هي مصاوغة تحفز التفاعل التالي:
| مصاوغة التريوز فسفات | |
|---|---|
|
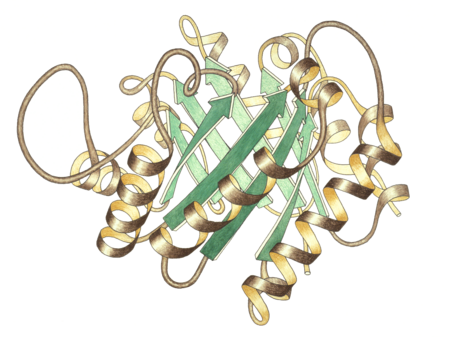
منظر جانبي لموحود مصاوغة التريوز فوسفات، الموقع النشط في المركز العلوي. | |
| أرقام التعريف | |
| رقم التصنيف الإنزيمي | 5.3.1.1 |
| رقم التسجيل CAS | 9023-78-3 |
| قواعد البيانات | |
| قاعدة بيانات الإنزيم | راجع IntEnz |
| قاعدة بيانات براونشفايغ | راجع BRENDA |
| إكسباسي | راجع NiceZyme |
| موسوعة كيوتو | راجع KEGG |
| ميتاسيك | المسار الأيضي |
| بريام | ملف التعريف |
| تركيب بنك بيانات البروتين | RCSB PDB PDBe PDBsum |
| الأونتولوجيا الجينية | AmiGO / EGO |
يتدخل هذا الإنزيم في المرحلة الخامسة من تحلل الجلوكوز من أجل تحفيز التصاوغ القابل للعكس لفسفات ثنائي هيدروكسي الأسيتون (DHAP) إلى D-جليسرألدهيد-3-فسفات (G3P). كل جزيء β-D-فراكتوز-6،1-ثنائي الفوسفات تحدث له عملية الأيض بواسطة تحلل الجلوكور ينتج عنه في نهاية المطاف D-جليسرألدهيد-3-فسفات .
يلعب إنزيم مصاوغة التريوز فوسفات دورا مهما في تحلل الجلوكوز وهو أساسي لإنتاج الطاقة الفعال، ويتواجد تقريبا لدى معظم الكائنات التي بُحِث عن هذا الإنزيم بها، بما في ذلك الحيوانات مثل الثدييات والحشرات وكذلك الفطريات والبكتيريا. إلا أن بعض البكتيريا التي لا تقوم بتحليل الجلوكوز مثل المفطورات لا تحتوي على المصاوغة.
لدى البشر، نقص مصاوغة التريوز فوسفات يصاحبه اضطراب عصبي حاد ازديادي يسمى عوز مصاوغة التريوز فوسفات، ويتميز بفقر دم انحلالي مزمن. توجد العديد من الطفرات التي تُحدث هذا المرض، وأهمها تطفر حمض الجلوتاميك في الوضعية 104 إلى حمض الأسبارتيك.[1]
مصاوغة فوسفات التريوز إنزيم فعال جدا، يقوم بالتفاعلات بمعدل أسرع بمليارت المرات من معدل حدوثها الطبيعي في المحلول. التفاعل فعال للغاية لدرجة يقال عنه أنه تفاعل تحفيزي مثالي: وهو محدود فقط بمعدل دخول المادة وخروجها من الموقع النشط للإنزيم.[2][3]
البنية
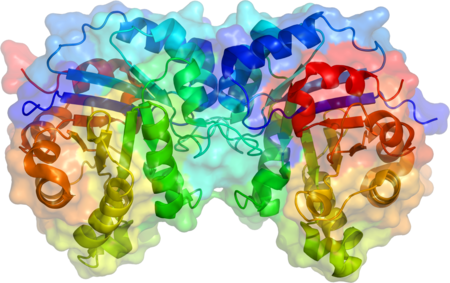
مصاوغة التريوز فسفات هي مثنوي متماثل الوحدتين الفرعيتين، تتكون كل وحدة منهما من 250 حمض أميني. تحتوي بنية الوحدة الفرعية ثلاثية الأبعاد على ثمانية لوالب ألفا في الخارج وثمان صحائف بيتا بالداخل، في الشكل المقابل شريط العمود الفقري لكل وحدة فرعية ملون بالألوان من الأزرق إلى الأحمر ابتداء من النهاية الأمينية إلى النهاية الكربوكسيلية، يسمى هذا النمط البنيوي برميل ألفا-بيتا (برميل αβ) أو برميل TIm وهي أكثر تطويات البروتين شيوعا لحد الآن. يتواجد الموقع النشط لهذا الإنزيم بمركز البرميل. يساهم جزيء حمض الجلوتاميك وجزيء هستيدين في آلية التحفيز. تسلسل الأحماض الأمينية في الموقع النشط محفوظ وهو متماثل في جميع مصاوغات التريوز فوسفات المعروفة.
تساهم بنية مصاوغة التريوز فوسفات في وظيفتها، ففضلا عن جزيئتي الغلوتامات والهستيدين المتموضعتين بدقة لتشكيل الإنيديول؛ يعمل عشر أو إحدى عشر حمضا أمينيا من المصاوغة كحلقة لتحقيق استقرار الوسيط. تُشكَّل الحلقة من الوحدات البنائية 166 حتى 176، حيث تنغلق وتشكل رابطة هيدروجينية مع مجموعة فوسفات الركيزة. هذه العملية تحقق استقرار وسيط الإنيديول والحالات الانتقالية الأخرى على مسار التفاعل.[4]
فضلا عن جعل التفاعل ممكن حركيا، تحتجز حلقة المصاوغة وسيط الإنيديول لمنع تفككه إلى ميثيل جليوكسال وفوسفات غير عضوي. تجعل الرابطة الهيدروجينية بين الإنزيم ومجموعة الفوسفات هذا التفكك غير مفضل حسب تأثير المجسم الإلكتروني .[4] مركب ميثيل جليوكسال سُمّي وُيزال -إذا تم تشكيله- عبر آلية الغليكولاز.[5] فقدان الرابطة الفوسفاتية الغنية بالطاقة والركيزة لبقية عملية تحليل الجلوكوز تجعل تكوين ميثيل جليوكسال غير فعال.
تقترح دراسات أن الليسين القريب من الموقع النشط (في الوضعية 12) أساسي أيضا لعمل الإنزيم، الليسين المبرتن في الأس الهيدروجيني الفيسيولوجي يمكن أن يساعد في تحييد الشحنات السالبة لمجموعة الفوسفات. حين يتطفر جزيء الليسين هذا إلى حمض أميني متعادل، تفقد المتصاوغة نشاطها بالكامل، لكن مع طفرات أخرى تكون أحماضا أمينية موجبة الشحنة تحافظ المصاوغة على بعض نشاطها.[6]
الآلية
يتوسط آلية التحويل تكوين بيني لجزيء إينول. تم تحديد الطاقة المتحررة النسبية لكل حالة أساسية وانتقالية تجريبيا، وهي موضحة في الشكل بالأسفل.[2]
تغيرات في الطاقة الحرة ΔG أثناء تحول فسفات ثنائي هيدروكسي الأسيتون (DHAP) إلى D-جليسرألدهيد-3-فسفات (GAP) بواسطة مصاوغة التريوز فوسفات (E).
تسهل بنية المصاوِغة التحويل بين فسفات ثنائي هيدروكسي الأسيتون (DHAP) وجليسرألدهيد-3-فسفات (GAP). يزيل جزيء الغلوتامات المحب للنواة رقم 165 في المصاوغة بروتونات الركيزة،[7] ويمنح الهستدين رقم 95 المحب للإلكترون بروتونا لتشكيل وسيط الإنيديول.[8][9] حين يتم نزع بروتون منه؛ يمتص جزيء الإنيديولات الوسيط بروتونا من جزيء الغلوتامات 165 المبرتن ليمنح جليسرألدهيد-3-فسفات. تحفيز العملية العكسية يبدأ بشكل مماثل بتشكيل نفس جزيء الإنيديول، لكن مع تفاعل مع ذرة الأكسجين في C2.[4]
مصاوغة التريوز فوسفات إنزيم محدود بمدى انتشار الركيزة أي أنه إنزيم مثالي. من وجهة نظر الديناميكا الحرارية تكوُّن فسفات ثنائي هيدروكسي الأسيتون مفضل 1:20 مقارنة بتكون جليسرألدهيد-3-فسفات.[10] يتم استهلاك هذا الأخير بواسطة نازعة هيدروجين جليسرألدهيد-3-فسفات أثناء تحليل الجلوكوز ويدفع استخدامه في مراحل لاحقة التفاعل نحو إنتاجه. تُثبَّط مصاوغة التريوز فوسفات بواسطة الكبريتات -2SO4 و الفوسفات -3PO4 والزرنيخات و-3AsO4 والتي ترتبط بموقعها النشط.[11] من المثبطات الأخرى نجد حمض 2-فوسفو جليكولات وهو مشابه مرحلة انتقالية، وغليسرول 1-فوسفات، وهو مشابه ركيزة.[12]
مراجع
- Orosz F, Oláh J, Ovádi J (December 2006). "Triosephosphate isomerase deficiency: facts and doubts". IUBMB Life. 58 (12): 703–15. doi:10.1080/15216540601115960. PMID 17424909.
- Albery WJ, Knowles JR (December 1976). "Free-energy profile of the reaction catalyzed by triosephosphate isomerase". Biochemistry. 15 (25): 5627–31. doi:10.1021/bi00670a031. PMID 999838.
- Rose IA, Fung WJ, Warms JV (May 1990). "Proton diffusion in the active site of triosephosphate isomerase". Biochemistry. 29 (18): 4312–7. doi:10.1021/bi00470a008. PMID 2161683.
- Knowles JR (March 1991). "Enzyme catalysis: not different, just better". Nature. 350 (6314): 121–4. doi:10.1038/350121a0. PMID 2005961.
- Creighton DJ, Hamilton DS (March 2001). "Brief history of glyoxalase I and what we have learned about metal ion-dependent, enzyme-catalyzed isomerizations". Archives of Biochemistry and Biophysics. 387 (1): 1–10. doi:10.1006/abbi.2000.2253. PMID 11368170.
- Lodi PJ, Chang LC, Knowles JR, Komives EA (March 1994). "Triosephosphate isomerase requires a positively charged active site: the role of lysine-12". Biochemistry. 33 (10): 2809–14. doi:10.1021/bi00176a009. PMID 8130193.
- Alber T, Banner DW, Bloomer AC, Petsko GA, Phillips D, Rivers PS, Wilson IA (June 1981). "On the three-dimensional structure and catalytic mechanism of triose phosphate isomerase". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 293 (1063): 159–71. doi:10.1098/rstb.1981.0069. PMID 6115415.
- Nickbarg EB, Davenport RC, Petsko GA, Knowles JR (August 1988). "Triosephosphate isomerase: removal of a putatively electrophilic histidine residue results in a subtle change in catalytic mechanism". Biochemistry. 27 (16): 5948–60. doi:10.1021/bi00416a019. PMID 2847777.
- Komives EA, Chang LC, Lolis E, Tilton RF, Petsko GA, Knowles JR (March 1991). "Electrophilic catalysis in triosephosphate isomerase: the role of histidine-95". Biochemistry. 30 (12): 3011–9. doi:10.1021/bi00226a005. PMID 2007138.
- Harris TK, Cole RN, Comer FI, Mildvan AS (November 1998). "Proton transfer in the mechanism of triosephosphate isomerase". Biochemistry. 37 (47): 16828–38. doi:10.1021/bi982089f. PMID 9843453.
- Lambeir AM, Opperdoes FR, Wierenga RK (October 1987). "Kinetic properties of triose-phosphate isomerase from Trypanosoma brucei brucei. A comparison with the rabbit muscle and yeast enzymes". European Journal of Biochemistry. 168 (1): 69–74. doi:10.1111/j.1432-1033.1987.tb13388.x. PMID 3311744.
- Lolis E, Petsko GA (July 1990). "Crystallographic analysis of the complex between triosephosphate isomerase and 2-phosphoglycolate at 2.5-A resolution: implications for catalysis". Biochemistry. 29 (28): 6619–25. doi:10.1021/bi00480a010. PMID 2204418.