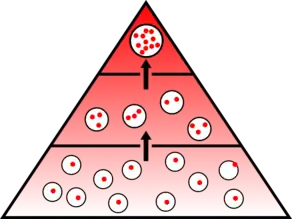
La bioaccumulation désigne la capacité de certains organismes (végétaux, animaux, fongiques, microbiens) à absorber et concentrer dans tout ou une partie de leur organisme (partie vivante ou inerte telle que l'écorce ou le bois de l'arbre, la coquille de la moule, la corne, etc.) certaines substances chimiques, éventuellement rares dans l'environnement (oligo-éléments utiles ou indispensables, ou toxiques indésirables)[1].
Chez un même organisme, cette capacité peut fortement varier selon l'âge et l'état de santé, ou selon des facteurs externes (saison, teneur du milieu en nutriments, pH ou cofacteurs variés (synergies ou symbioses avec une autre espèce par exemple)). Chez une même espèce, les individus peuvent pour des raisons génétiques être plus ou moins accumulateurs, mais de manière générale certains genres ou groupes sont connus pour être de très bons bioaccumulateurs. Chez les champignons (qui sont souvent de bons bioaccumulateurs[2]), c'est le cas par exemple des agarics[3] pour le mercure, plomb, cadmium et le sélénium. Le sélénium est également très bien accumulé par les champignons du genre Albatrellus [4] ou par l'amanite Amanita muscaria[5].
Des organismes apparemment proches dans leur mode d'alimentation (ex. : moules et huîtres), dans un même milieu et dans des conditions comparables accumulent très différemment les métaux. Par exemple, l'IFREMER a estimé en 2002 que pour les espèces courantes, le rapport de bioaccumulation entre les huîtres et les moules est d'environ 25 pour l'argent (ce qui signifie que l'huître en accumule 25 fois plus en moyenne), 0,5 pour le nickel et le cobalt et de 1 pour le vanadium[6].
Aspects éco-toxicologiques et de santé environnementale

Dans les environnements pollués ou naturellement riches en certains toxiques bioaccumulables, la bioaccumulation de produits toxiques peut affecter l'individu et l'espèce, mais pas nécessairement (par exemple les lichens et champignons peuvent accumuler de grandes quantités de radionucléides et de métaux toxiques pour les animaux sans apparemment eux-mêmes en souffrir significativement[7] ; en réalité, les métaux peuvent ensuite affecter la bonne germination des spores ou la qualité des symbioses développées avec les plantes[8]). Cette capacité peut être renforcée dans certains contextes (sols acides, sol pollué, pluies acides par exemple qui augmentent plus ou moins la mobilité et la biodisponibilité des radionucléides, des éléments traces métalliques[9],[10],[11] et métalloïdes toxiques comme l'arsenic[12]). Dans le milieu aquatique (eau douce, eau saumâtre, estuarienne ou de mer), c'est le sédiment qui joue le rôle du sol en piégeant plus ou moins ou en transformant les toxiques qu'il reçoit ou qu'il contient naturellement[13].
La forme chimique du produit importe aussi. Par exemple le mercure est différemment absorbé selon qu'il est sous forme de mercure métallique ou sous forme de mercure méthylé[9], et dans ce cas la nature du sol importe aussi (pH, capacité d'échange d'ions, complexes organohumiques, etc., comme on l'a montré dans l'environnement des mines de mercure[14].
Les espèces qui accumulent le plus à leur niveau trophique sont souvent des organismes filtreurs ou des champignons, qui par leur tissu souterrain prospectent un grand volume de sol. Ils peuvent aussi intercepter certains des produits chimiques ou éléments présents dans les pluies, issus du lessivage de l'atmosphère par ces dernières(radiocésium des retombées de Tchernobyl par exemple[15]). Ensuite un autre phénomène intervient dans le réseau trophique, c'est la bioconcentration.
Des problèmes de santé environnementale apparaissent quand il s'agit d'espèces consommées par le gibier, les ressources halieutiques, les animaux d'élevage ou l'homme.
Ainsi, la teneur en fer, en calcium ou en résidus des plastiques (phtalates) des tissus des poissons de la Seine, par exemple, est immensément plus importante (10, 100 ou 1000 fois plus) que les taux de fer, calcium ou phtalates mesurés dans l'eau de la Seine. Pour le fer ou le calcium, la bioaccumulation peut compter parmi les mécanismes physiologiques qui maintiennent les poissons en bonne santé ; c'est le cas notamment si les poissons arrivent bien à contrôler leur teneur en ces substances en les éliminant si elles sont trop présentes (homéostasie). La bioaccumulation des phtalates, elle, relève de la toxicité environnementale : ils ne servent en rien pour les organismes vivants, au mieux ils les gênent (il faut les éliminer), au pire ils l'intoxiquent ou affectent ses capacités de reproduction ou celles de sa descendance (perturbateur endocrinien).
Certaines substances non ou peu dégradables sont persistantes dans les organismes vivants (biopersistance) car elles ne sont pas métabolisées. Leur possibilité d'accumulation est d'autant plus importante que les organismes n'ont pas d'autres alternatives que de les éliminer (processus long) ou de les stocker.
La toxicité d'une substance dépend parfois de sa capacité à s'accumuler dans l'organisme. Certaines substances bioaccumulées par les plantes, les animaux et les humains sont connues pour être toxiques, cancérigènes, tératogènes ou induisant la mort, une stérilité, des malformations, etc. C'est le cas du benzo[a]pyrène (de la classe des hydrocarbures aromatiques polycycliques), des polychlorobiphényles, des perturbateurs endocriniens, du plomb et d'autres métaux présents dans l'environnement du fait de la pollution.
La bioaccumulation s'effectue par le biais de l'alimentation d'organismes, et via tout le réseau trophique. Naturellement, plus la chaîne trophique est longue, plus l’accumulation est importante et plus les effets délétères risquent d'être marqués. Les prédateurs, situés en parties terminales des chaînes alimentaires sont donc particulièrement vulnérables à ce type de pollution, et leur présence est le signe d’une qualité satisfaisante du milieu où ils ont effectué l'essentiel de leur croissance. Il n'est pas rare de constater un facteur de bioaccumulation de l'ordre de 100 000. Les moules et huîtres peuvent concentrer de 700 000 fois à 1 million de fois des substances quasi-indétectables dans la mer, oligoéléments dans le cas de l'iode ou toxiques dans le cas du plomb, du mercure ou du cadmium par exemple.
Le risque qu'un polluant bioassimilable soit bioconcentré par une espèce n'est généralement pas lié à l'importance quantitative de la présence du contaminant dans le milieu [16]. Il y a le plus souvent une relation inverse entre les facteurs de bioconcentration (FBC) et l'exposition d'un animal ou d'une plante à un élément (polluant ou oligoélément)[17].
Bioaccumulation et biotransformation
Tout en accumulant un composé, certains organismes peuvent aussi le transformer. Par exemple les macrochampignons peuvent accumuler des formes organiques du mercure (méthylmercure) mais aussi - comme les bactéries des sédiments transformer du mercure inorganique en mercure organique beaucoup plus toxique et bioassimilable [18].
Risques et dangers
Beaucoup d'animaux filtreurs (coquillages bivalves, dont huitres et moules) ou de bioconcentrateurs tels que les champignons sont des aliments recherchés ; quand ils sont récoltés dans des environnements naturellement riches en métaux ou pollués par l'homme, ils sont une source d'éléments indésirables ou toxiques dans l'alimentation humaine[19]. Les champignons peuvent concentrer presque tous les métaux et métalloïdes[20], avec des capacités de concentration variantes selon les espèces et le contexte.
Concernant les ETM toxiques, le risque est particulièrement élevé dans les régions industrielles, autour des fonderies et sur les friches industrielles héritées de la métallurgie et l'exploitation minière. Ceci a par exemple été montré pour l'exploitation du plomb, du cadmium, du mercure et du cuivre[21],[22]
La bioaccumulation de composés toxiques peut conduire à des catastrophes, comme dans le cas du syndrome de l'île de Guam (bioaccumulation et bioconcentration naturelle d'une toxine produite par une bactérie photosynthétique) et dans le cas de la maladie de Minamata (bioaccumulation et bioconcentration de mercure industriel méthylé) qui a touché des milliers d'humains ; morts ou gravement empoisonnés par du mercure. Ce dernier avait été méthylé par des bactéries puis fortement concentré dans la chaine alimentaire des poissons évoluant en aval des effluents pollués par l'usine de Minamata.
La bioaccumulation peut fortement exacerber les effets (positifs ou négatifs) de la bioturbation. Ces deux processus combinés jouent un rôle fondamental au sein de la biosphère et des cycles biogéochimiques.
Les POP (polluants organiques persistants) entrent dans la catégorie des substances bioaccumulées et très toxiques pour les organismes vivants et plus particulièrement l'homme.
Indicateur de pollution
Certains organismes connus pour accumuler des polluants sont utilisés ou pourraient l'être comme bioindicateurs ou pour la bioévaluation environnementale (biomonitoring). Par exemple :
- les lichens accumulant les polluants permettent une analyse rétrospective de leur exposition aux métaux lourds ou aux radionucléides ;
- la moule zébrée (moule d'eau douce) (Dreissena polymorpha) accumule des éléments métalliques dans les canaux ;
- le beluga, le dauphin et le cachalot concentrent les polluants du milieu marin.
- les champignons se prêtent aussi au biomonitoring, pour les métaux notamment[23],[24]
- les abeilles qui sont utilisées depuis les années 2011 à grande échelle (Europe) par le réseau de vigilance de l'environnement et de la biodiversité Bee Secured.
- la truite,
- le silure
Voir aussi
Articles connexes
- Pollution
- Biomagnification
- Bioturbation
- Écologie du paysage
- Bioconcentration
- Spéciation chimique
- Toxicologie
- Écotoxicologie
Liens externes
- Ifremer
- Greenpeace
- Directive REACH
- Exposition de la population française aux substances chimiques de l’environnement sur le site de l’Institut de veille sanitaire (InVS) :
Bibliographie
Notes et références
- ↑ Glossaire, sur le site de l'Institut supérieur d'ingénierie et de gestion de l'environnement (ISIGE).
- ↑ Laurent Jacquiot, Olivier Daillant, "Bioaccumulation des éléments traces et des radioéléments par les macromycètes, Revue bibliographique, partie II ; Observations mycologiques, Bulletin de l'observatoie mycologique no 17, décembre 2000
- ↑ Stijve, T., Besson, R., 1976. Mercury, cadmium, lead and selenium concentration of mushroom species belonging to the genus Agaricus. Chemosphere 51, 151–158
- ↑ Stijve, T., Noorloos, T., Byrne, A.R., Slejkovec, Z., Goessler, W., 1998. High selenium levels in edible Albatrellus mushrooms. Dtsch. Lebensm. Rdsch. 94, 275–279. US EPA, 1989. Health effects assessment. Office of Emerging and Remedial Response, US Environment Protection Agency, Washington, DC
- ↑ Watkinson, J.H., 1964. A selenuim-accumulating plant of the humid regions: Amanita muscaria. Nature 4928, 1239–1240.
- ↑ Surveillance du milieu marin, travaux du Réseau National d'Observation de la Qualité du Milieu Marin Ifremer, Le RNO : programmes actuels - L'argent, le cobalt, le nickel et le vanadium dans les mollusques du littoral français - Les carottes sédimentaires, mémoire de la contamination ; Bulletin Ifremer, 2002 Télécharger le pdf
- ↑ Allen, R.O., Steinnes, E., 1978. Concentrations of some potentially toxic metals and other trace elements in wild mushrooms from Norway. Chemosphere 4, 371–378.
- ↑ Influence des métaux lourds sur la germination des spores de champignons endomycorhiziens à arbuscules dans les sols LEYVAL C. ; WEISSENHORN I. ; GLASHOFF A. ; BERTHELIN J. (CNRS Univ. Nancy I) ; Journal Title Acta botanica gallica ; (ISSN 1253-8078) ; Congrès Mycorhizes. Journée d'étude, Paris, FRANCE (19/11/1993) 1994, vol. 141, no 4 (182 p.) (8 ref.), p. 523-528, Ed:Société botanique de France, Lille, France
- 1 2 Alonso, J., Salgado, M.J., Garcia, M.A., Melgar, M.J., 2000. Accumulation of mercury in edible macrofungi: influence of some factors. Arch. Environ. Contam. Toxicol. 38, 158–162.
- ↑ Gast, C.H., Jansen, E., Bierling, J., Haanstra, L., 1988. Heavy metals in mushrooms and their relationship with soil haracteristics. Chemosphere 17, 789–799.
- ↑ Falandysz, J., Chwir, A., 1997. The concentrations and bioconcentration factors of mercury in mushrooms from the Mierzeja Wislana sand-bar, Northern Poland. Sci. Total Environ. 203, 221–228.
- ↑ Slekovec, M., Irgolic, K.J., 1996. Uptake of arsenic by mushrooms from soil. Chem. Spec. Bioavalab. 8, 67–73.
- ↑ Kannan, K., Smith, R.G., Lee, R.F., Windom, H.L., Heitmuller, P.T., Macauley, J.M., Summers, J.K., 1998. Distribution of total mercury and methyl mercury in water, sediment and fish from South Florida estuaries. Arch. Environ. Contam. Toxicol. 34, 109–118.
- ↑ Bargagli, R., Baldi, T., 1984. Mercury and methyl mercury in higher fungi and their relation with the substrata in a cinnabar mining area. Chemosphere 13, 1059–1071.
- ↑ Bakken, L.R., Olsen, R.A., 1990. Accumulation of radiocaesium in fungi. Can. J. Microbiol. 36, 704–710.
- ↑ DeForest DK, Brix KV, Adams WJ (2007), Assessing metal bioaccumulation in aquatic environments : the inverse relationship between bioaccumulation factors, trophic transfer factors and exposure concentration. ; Aquat Toxicol. 2007 Aug 30; 84(2):236-46. Epub 2007 Jun 16 (résumé)
- ↑ McGeer JC, Brix KV, Skeaff JM, DeForest DK, Brigham SI, Adams WJ, Green A (2003), Inverse relationship between bioconcentration factor and exposure concentration for metals : implications for hazard assessment of metals in the aquatic environment ; Environ Toxicol Chem. 2003 May; 22(5):1017-37 (résumé)
- ↑ Fischer, R.G., Rapsomanikis, S., Andreae, M.O., Baldi, F., 1995. Bioaccumulation of methylmercury and transformation of inorganic mercury by macrofungi. Environ. Sci. Technol. 29, 993–999
- ↑ Falandysz, J., Szymczyk, K., Ichihashi, H., Bielawski, L., Gucia, M., Frankowska, A., Yamasaki, S., 2001. ICP/MS and ICP/AES elemental analysis (38 éléments) of edible wild mushrooms growing in Poland. Food Addit. Contam. 18, 503–513.
- ↑ Kalac, P., Svoboda, L., 2000. A review of trace element concentrations in edible mushrooms. Food Chem. 69, 273–281.
- ↑ Kalac, P., Burda, J., Staskova, I., 1991. Concentrations of lead, cadmium, mercury and copper in mushrooms in the vicinity of a lead smelter. Sci. Total Environ. 105, 109–119.
- ↑ Kalac, P., Niznanska, M., Bevilaqua, D., Staskova, I., 1996. Concentrations of mercury, copper, cadmium and lead in fruiting bodies of edible mushrooms in the vicinity of a mercury smelter and a copper smelter. Sci. Total Environ. 177, 251–258.
- ↑ Mejstrik, V., Lepsova, A., 1993. Applicability of fungi to the monitoring of environmental pollution by heavy metals. In: Markert, W.B. (Ed.), Plants as Biomonitors. Indicators for Heavy Metals in the Terrestrial Environment. VCH Weinheim, p. 365–378. Monitor Polski. No. 22, May 11, position 233, 1993.
- ↑ Wondratschek, I., R€oder, U., 1993. Monitoring of heavy metals in soils by higher fungi. In: Markert, W.B. (Ed.), Plants as Biomonitors. Indicators for Heavy Metals in the Terrestrial Environment. VCH Weinheim, p. 345–363.