| Cobalt | |||||||||||

| |||||||||||
| |||||||||||
| Position dans le tableau périodique | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Co | ||||||||||
| Nom | Cobalt | ||||||||||
| Numéro atomique | 27 | ||||||||||
| Groupe | 9 | ||||||||||
| Période | 4e période | ||||||||||
| Bloc | Bloc d | ||||||||||
| Famille d'éléments | Métal de transition | ||||||||||
| Configuration électronique | [Ar] 3d7 4s2 | ||||||||||
| Électrons par niveau d’énergie | 2, 8, 15, 2 | ||||||||||
| Propriétés atomiques de l'élément | |||||||||||
| Masse atomique | 58,933 194 ± 0,000 004 u[1] | ||||||||||
| Rayon atomique (calc) | 135 pm (152 pm) | ||||||||||
| Rayon de covalence | 126 ± 3 pm (bas spin)[2] 150 ± 7 pm (haut spin)[2] |
||||||||||
| État d’oxydation | +1, +2, +3, +4 | ||||||||||
| Électronégativité (Pauling) | 1,88 | ||||||||||
| Oxyde | Amphotère | ||||||||||
| Énergies d’ionisation[1] | |||||||||||
| 1re : 7,881 01 eV | 2e : 17,084 eV | ||||||||||
| 3e : 33,50 eV | 4e : 51,3 eV | ||||||||||
| 5e : 79,5 eV | 6e : 102,0 eV | ||||||||||
| 7e : 128,9 eV | 8e : 157,8 eV | ||||||||||
| 9e : 186,13 eV | 10e : 275,4 eV | ||||||||||
| 11e : 305 eV | 12e : 336 eV | ||||||||||
| 13e : 379 eV | 14e : 411 eV | ||||||||||
| 15e : 444 eV | 16e : 511,96 eV | ||||||||||
| 17e : 546,58 eV | 18e : 1 397,2 eV | ||||||||||
| 19e : 1 504,6 eV | 20e : 1 603 eV | ||||||||||
| 21e : 1 735 eV | 22e : 1 846 eV | ||||||||||
| 23e : 1 962 eV | 24e : 2 119 eV | ||||||||||
| 25e : 2 219,0 eV | 26e : 9 544,1 eV | ||||||||||
| 27e : 10 012,12 eV | |||||||||||
| Isotopes les plus stables | |||||||||||
| Propriétés physiques du corps simple | |||||||||||
| État ordinaire | solide (ferromagnétique) | ||||||||||
| Masse volumique | 8,9 g·cm-3 (20 °C)[1] | ||||||||||
| Système cristallin | Hexagonal compact | ||||||||||
| Dureté (Mohs) | 5 | ||||||||||
| Couleur | Blanc argenté, reflet gris | ||||||||||
| Point de fusion | 1 495 °C[1] | ||||||||||
| Point d’ébullition | 2 927 °C[1] | ||||||||||
| Énergie de fusion | 16,19 kJ·mol-1 | ||||||||||
| Énergie de vaporisation | 376,5 kJ·mol-1 | ||||||||||
| Volume molaire | 6,67×10-6 m3·mol-1 | ||||||||||
| Pression de vapeur | 175 Pa à 1 494,85 °C | ||||||||||
| Vitesse du son | 4 720 m·s-1 à 20 °C | ||||||||||
| Chaleur massique | 420 J·kg-1·K-1 | ||||||||||
| Conductivité électrique | 17,2×106 S·m-1 | ||||||||||
| Conductivité thermique | 100 W·m-1·K-1 | ||||||||||
| Solubilité | sol. dans HCl + H2O2[3] | ||||||||||
| Divers | |||||||||||
| No CAS | [4] | ||||||||||
| No ECHA | 100.028.325 | ||||||||||
| No CE | 231-158-0 | ||||||||||
| Précautions | |||||||||||
| SGH[5] - [6] | |||||||||||
 Danger |
|||||||||||
| SIMDUT[7] | |||||||||||
 D2A, D2B, |
|||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||
Le cobalt est l'élément chimique de numéro atomique 27, de symbole Co.
Généralités, histoire du cobalt, découverte du corps simple
Le cobalt de structure électronique [Ar] 4s2 3d7 est le second élément du huitième groupe secondaire, ce métal de transition fait partie du groupe du fer. Le corps simple cobalt a des propriétés physiques assez voisines de celles du fer et du nickel. D'un point de vue chimique, il est moins réactif que le fer. Le cobalt est aussi un élément du groupe 9, dont les trois premiers Co, Rh et Ir constituent le groupe du cobalt.
Des minéraux naturels de cobalt, sous forme de peintures, émaux ou vernis, sont utilisés depuis la plus haute Antiquité, en particulier vers 2600 av. J.-C. en Égypte ou dans les civilisations de Mésopotamie ayant donné naissance à Babylone. Ainsi l'archéologue retrouve des décors bleus sur des poteries ou vaisselles de terre cuite. Des perles de verre teinté au bleu de cobalt sont communes vers dans l'actuel Iran. Ces techniques pour colorer le verre d'un bleu intense ou obtenir des émaux sont communes dans le monde méditerranéen dès le IIIe siècle av. J.-C. Ce sont généralement des silicates et/ou aluminates de cobalt et de potassium, nommés autrefois safre ou smalt reconnus en Europe occidentale dans certains vitraux romans de luxe, ou plus tard d'oxydes de cobalt nommés "bleu de cobalt".
Das Kobold ou das Kobalt est le nom traditionnel que les mineurs saxons à la recherche de métaux précieux attribuent à ces dérivés trompeurs. Ces minerais généralement soufrés et/ou arséniés trop riches en cobalt donnent par traitement métallurgique des gaz malodorants ou des fumées d'oxydes toxiques à base de trioxyde d'arsenic, des émanations vénéneuses et, si on chauffe outre mesure, une coulée de matière fondue, cassante à froid, le speiss ou des métaux durs et cassants à hautes teneurs en sulfures ou en arsenic que les métallurgistes ne savent ni traiter ni forger. Les mineurs croyaient alors le quartier minier ensorcelé par des nains maléfiques et falsificateurs, facétieux et voleurs, les kobolds d'aspect bleuâtre et mortifères qui avaient dérobé le métal précieux, très souvent le cuivre, et remplacé par cette matière impropre et confuse [alpha 1].
Ces minerais sans valeur ou leurs sous-produits sont nommés en allemand vernaculaire par un substantif neutre Kobelet, Kobolt ou Kobelt. Paracelse mentionne le cobolt en 1522 avec une graphie plus latine. Le latin coboltum ou cobaltum s'impose ensuite dans l'Europe savante. Notons que le terme technique cobolt a aussi désigné en français l'arsenic métallique réduit en poudre [alpha 2].
Jusqu'au XVIIIe siècle et au siècle suivant, le terme de « cobalt » et sa variante cobolt, désigne le minerai ou son résidu autrefois la plupart du temps inutilisables. Pourtant, dès le XVIIe siècle avec la mode germanique du Blaufarbung, c'est-à-dire de la coloration en bleu, le minerai de cobalt retrouve une plus grande utilité car les hommes de l'art chymique et verrier fabriquent avec ce déchet d'excellents pigments bleus, notamment le smalt des verriers ou des céramistes, le "bleu des crayons de charron"... Georg Brandt, spécialiste des minéraux arséniés, s'efforce de reconnaître l'élément spécifique sous-jacent à ses minerais ou sous-produits miniers entre 1733 et 1738.
A Venise, les maîtres verriers de Murano sollicitèrent les nains de Venise pour s'approvisionner en minerai de cobalt et produire leurs fameuses œuvres teintées en bleu de Murano. Les nains rapportaient ce minerai des mines au nord des Alpes, où ils étaient affublés du terme de kobold (lutin, ou goblin, créature surnaturelle)[8].
En 1735, le chimiste suédois Georg Brandt (1694-1768) affirme avoir extrait de ce minerai un « semi-métal » blanc rougeâtre, dur et cassant, en réalité des échantillons de métal impur qu'il nomme « cobalt »[9]. En 1745, il démontre que le cobalt est la cause de la couleur bleue que le minerai de cobalt communique aux verres[10]. Cette précision n'est pas inutile car la communauté savante attribuait le plus souvent la couleur bleue soit au bismuth, soit au fer et à l'arsenic[11].
Mais ces travaux passent pour la plupart pratiquement inaperçus. Il faut attendre 1780 pour que Torbern Olof Bergman prépare le métal pur et reconnaisse tardivement le rôle pionnier de Georg Brandt dans la découverte d'un élément, alors confirmée. En 1798, les chimistes constatent que les solutions ammoniacales de chlorure de cobalt CoCl2 laissent précipiter des cristaux orangés stables à la chaleur, jusqu'à 180 °C, corps qui se transforme en un autre corps stable plus foncé au-delà de cette température[alpha 3]
Les pigments bleus de cobalt intéressent au XVIIIe siècle et XIXe siècle encore plus l'industrie de la céramique et surtout celle plus récente de la porcelaine. Ainsi est mis au point le « bleu de Sèvres » et plus tard le « bleu de Thénard », obtenu par calcination du phosphate de cobalt et de l'alumine gélatineuse. Mais le bleu de cobalt est le plus souvent un pigment à base d'oxyde de cobalt. Ce pigment est utilisé pour les verres et la pâte céramique, il sert toujours à l'émaillage et à la décoration des couvertes ou carreaux céramiques.

Pendant le XIXe siècle, le bleu cobalt est produit par la fabrique norvégienne Blaafarveværket (70-80 % de la production mondiale) dirigée par l'industriel prussien Benjamin Wegner.
Avant la Belle Époque, les applications directes se multiplient. Le cobalt, allié au fer et à l'acier, permet d'accroître la dureté des matériaux obtenus. Le revêtement d'une couche de métal cobalt, plus dure que celle du nickel, permet de protéger des métaux trop facilement oxydables, à commencer par le fer. Le « cobaltage » rivalise avec le nickelage pour certaines applications. Les sels de cobalt deviennent communs dans les laboratoires de chimie. Ils permettent de mettre au point des encres sympathiques de plus en plus sophistiquées, et plus prosaïquement des papiers indicateurs d'hygrométrie, c'est-à-dire d'humidité de l'air ou d'un mélange gazeux quelconque. Le papier hygrométrique ou papier cobalté vire du bleu au rose selon le degré d'humidité de l'air.
La chimie du cobalt en solution aqueuse et particulièrement la formation de complexes sont particulièrement riches. Les bases de la chimie de coordination sont posées avant 1893 par les travaux pionniers du chimiste mulhousien Alfred Werner au début du XXe siècle, essentiellement avec des complexes de cobalt[alpha 4]. Ce chimiste naturalisé suisse en 1895 fut le premier à proposer que les complexes soient constitués d'un ion métallique entouré de ligands, et non d'un ion métallique accroché à une chaîne de ligands, comme le soutenaient les chimistes de l'époque à la suite de Jorgensen.
En 1938, John Livingood et Glenn Seaborg découvrent le cobalt 60.
Lexique
Le mot de genre masculin, le cobalt, apparaît en français en 1549 sous la plume de Pierre Belon pour décrire le minerai cobaltifère et ses avatars métallurgiques[12].
L'adjectif cobaltifère qualifie les corps ou les matières qui contiennent l'élément cobalt. Les verbes cobaltiser ou cobalter signifient couvrir d'une couche de métal cobalt. Le cobaltage ou encore le cobaltisage est le dépôt protecteur de cobalt, en général une mince couche, sur la surface d'un autre métal plus fragile ou corrodable.
Les adjectifs cobalteux et cobaltique qualifient respectivement les sels et composés de Co(II) et Co(III).
La cobaltothérapie désigne l'emploi des rayonnements du cobalt 60 en thérapie du cancer.
Isotopes
Le cobalt est un élément monoisotopique et mononucléidique : il n'existe à l'état naturel que sous la forme d'un seul isotope, isotope stable, 59Co. On lui attribue une masse atomique standard de 58,933195(5) u. Cependant, 28 radioisotopes artificiels ont été caractérisés, le plus « stable » étant le 60Co avec une demi-vie 5,2714 ans, suivi de 57Co avec une demi-vie de 271,79 jours, de 56Co (77,27 jours) et 58Co (70,86 jours). Tous les autres isotopes ont une demi-vie inférieure à 18 heures et pour la majorité d'entre eux inférieure à une seconde. Le cobalt possède également 11 isomères nucléaires, tous ayant une demi-vie inférieure à 15 minutes.
Cobalt 60 (isotope radioactif)
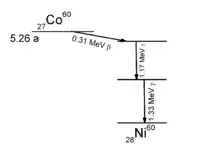
Le cobalt 60 a de nombreuses utilisations comme source de rayons gamma γ, en raison de sa demi-vie relativement courte (5,27 ans), donc plus facile à éliminer en comparaison d'autres isotopes émetteurs de telles particules. On retrouve ainsi les « bombes au cobalt 60 », sources de rayons γ de 1,17 et 1,33 MeV :
- en radiothérapie des unités de médecine spécialisées en cancérologie, où elles ont remplacé les techniques au radium mises au point par Marie Curie ;
- dans le traitement par radiation de la nourriture pour sa stérilisation ;
- dans le contrôle industriel des matériaux par radiographie pour repérer les défauts des pièces.
Toutefois, le cobalt 60 de synthèse (produit par exposition de cobalt « naturel », l'isotope 59, aux rayonnements neutroniques d'un réacteur nucléaire) n'est pas totalement pur, et contient toujours d'autres isotopes radioactifs à désintégration ε (epsilon), émetteurs de rayonnement gamma dangereux[alpha 5] car ce rayonnement hautement énergétique détruit les noyaux et les contamine en éléments radioactifs persistants.
De plus l'enrichissement et la purification du cobalt 60 nécessitent des techniques de centrifugation similaires à celles utilisées pour l'enrichissement des isotopes à usage militaire, techniques hautement surveillées car stratégiques sur le plan international.
Aussi, on préfère maintenant utiliser des accélérateurs d'électrons, semblables aux tubes cathodiques de nos moniteurs et téléviseurs mais à des niveaux d'accélération bien supérieurs, qui produisent des flux plus purs et mieux contrôlés de particules bêta. Mais leur utilisation nécessite un équipement beaucoup plus lourd qu'une simple capsule de cobalt 60. Cette méthode est de ce fait principalement utilisée en milieu industriel, et aujourd'hui aussi en milieu médical.
Occurrences de l'élément, extraction minière et purification
Le clarke s'élève entre 23 g et 25 g, voire au mieux 30 g par tonne selon les estimations[13]. Il s'agit d'un élément assez peu abondant sur la croûte terrestre. Il est souvent associé au Cu, Ni, Pb, Ag et Fe.
Le cobalt natif a été reconnu sur terre, mais il est très rare et n'est pas encore admis par l'IMA. Le cobalt natif est aussi présent dans les météorites.
Il entre dans la composition de nombreux silicates, comme l'augite, la biotite, l'hornblende, l'olivine... Il est ainsi beaucoup plus présent dans les roches magmatiques basiques et ultra-basiques que sont les gabbros et les péridotites.
On trouve aussi des composés de cobalt dans les nodules manganésifères, du plancher marin du l'océan Pacifique et surtout à faible profondeur marine dans les encroûtements cobaltifères caractéristiques de certains atolls polynésiens.
Minerais et extractions minières
_1_(18599849584).jpg.webp)
Ses principaux minerais se trouvent sous forme d'arséniures, d'arsénio-sulfures, de sulfures et d'oxydes, d'arséniates. Les teneurs en cobalt sont généralement faibles dans ces gisements spécifiques, mais ils sont parfois enrichis par des processus géochimiques ou concentrés par l'érosion naturelle.
Les principaux minéraux constitutifs de ces minerais sont la smaltite cubique CoAs2, autrefois smaltine, la cobaltite orthorhombique CoAsS, autrefois cobaltine ou "cobalt gris", ou le produits d'oxydation comme l'érythrite Co3(AsO4)2·8H2O, autrefois "fleur de cobalt". Citons encore la modderite CoAs orthorhombique, la safflorite orthorhombique CoAs2 et la clinosafflorite monoclinique CoAs2, la skuttérudite cubique CoAs3-x, l'alloclasite monoclinique CoAsS... . Les smaltines désignaient de manière générique les minerais arséniés de cobalt, alors que les cobaltines correspondaient aux minerais sulfo-arséniés.

Son extraction se fait surtout à partir de minerais de cuivre et de nickel, voire de plomb. La carrolite CuS.Co2S3 est un sulfure mixte de cuivre et de cobalt.
Les minerais les plus exploités ou les plus prometteurs sont en Afrique, notamment en République démocratique du Congo qui produit 65 % de la production mondiale[14], en Zambie et au Maroc, en Amérique du Nord, par exemple au Canada et aux États-Unis, mais aussi en Russie, en Australie et en Nouvelle-Calédonie, autrefois connue au XIXe siècle pour ses gisements de manganèses cobaltifères[alpha 6].
Les minerais concentrés des anciennes exploitations de cobalt gris, smaltines et de cobaltines, ou aujourd'hui les rares minerais sulfurés ou arséniés, permettent par grillage à l'air d'obtenir l'oxyde de cobalt, sous une forme généralement hydraté appelées asbolane. Celle-ci est réduite soit par le gaz hydrogène soit par le charbon de bois, en métal cobalt.
Au cours des années 1990, les minerais de sulfures cobaltifères devaient assurer une teneur de 0,1 à 0,03 % en masse. Mais la majeure partie du cobalt est un sous produit des traitements de l'industrie extractive du cuivre. L'enrichissement est réalisé par flottation à l'aide de lessives.
.jpg.webp)
Si l'extraction des sulfures passe par la pyrolyse, l'extraction des oxydes utilise les procédés de l'hydrométallurgie. La séparation du cuivre et du cobalt est réalisé lors des procédés d'électrolyse. 500 tonnes de minerais donnent une tonne de cobalt. La production annuelle de cobalt au début des années 1990 était de l'ordre de 40 000 tonnes.
40 000 enfants sont exploités dans des mines de cobalts uniquement dans la province du Katanga en RDC[15].
Propriétés physiques et chimiques du corps simple, préparation et alliages
Propriétés du corps simple

Le corps simple est un métal blanc brillant, gris acier ou blanc argent à reflet rouge, assez cassant, assez peu malléable, de densité entre 8,8 et 8,9 à 25 °C et de dureté Mohs avoisinant 5,5[alpha 7]. Il est plus dur et plus cassant que le fer. Mais le métal pur est suffisamment ductile et malléable pour pouvoir être forgé, laminé à chaud et à froid, étiré en fil.
Il existe deux variétés allotropiques de cobalt. Le Coα est un cristal métallique de maille hexagonale, avec les paramètres a = 2,507 Å et c = 4,069 Å, de densité 8,9 à 20 °C, le plus stable à température ambiante et le Coβ de maille cubique faces centrées, a = 3,544 Å, moins compacte et nettement moins stable en dessous de 400 °C. La transition de phase entre Coα et Coβ avec accroissement de volume de 0,3 % s'opère à 417 °C ± 7 °C, elle est sensible à certaines impuretés spécifiques[16]. Mais cette transition est lente, et il subsiste assez communément un mélange des deux variétés sur une large gamme de températures, ce qui explique les légères variations de propriétés physiques du matériau métal cobalt. Coβ est une forme métastable à température ambiante peut néanmoins être obtenue par trempe ou par certains procédés d'électrolyse. Il est probable que la transition différée joue un rôle dans l'éclatement de certains dépôts cathodiques de cobalt par électrolyse.
Ce corps est ferromagnétique (capable de conserver une forte aimantation) à température ordinaire. Le point de Curie avoisine 1 121 °C. La perméabilité relative est de l'ordre de 68, soit deux tiers de celle du fer, avec un maximum de 245. Le champ coercitif avoisine 707 A/m.
La conductivité électrique est 26 % IACS, c'est-à-dire un peu plus du quart de celle du cuivre pur.
Il est aussi peu fusible que le fer. Il fond au-dessus de 1 490 °C, pur à 1 495 °C. Il bout vers 2 927 °C, en pratique entre 2 600 °C et 3 100 °C.
L'eau et l'air sont sans action en pratique sur le métal cobalt. Le cobalt massif est inaltérable à l'air froid, il est stable à l'air et l'eau à température ambiante. Ce n'est pas le cas du cobalt finement divisé en poudre qui s'enflamme à l'air ou qui n'est pas insoluble dans l'eau, avec une solubilité atteignant 1,1 mg/L. Ce type de cobalt pyrophorique et pulvérulent est obtenu par chauffage au rouge de l'oxyde de cobalt (II) CoO dans un courant de gaz hydrogène. Il peut constituer des mousses de cobalt qui peuvent dissoudre 100 volumes de gaz hydrogène.
Toutefois le cobalt massif ne s'oxyde radicalement que chauffé au rouge :
- 3 Co solide chauffé au rouge + 2 O2 oxygène → Co3O4 oxyde mixte noir
ou
- Co solide chauffé au rouge + H2O vapeur → CoO oxyde solide noir + H2 gaz hydrogène
L'oxydation du cobalt en surface commence pourtant entre 300 °C et 900 °C de manière similaire à la première réaction. Au-delà de cette dernière température, l'oxyde mixte se transforme en oxyde divalent CoO.
Il est rapidement soluble dans les acides oxydants dilués, comme l'acide nitrique qui forme un abondant précipité rouge de nitrate de cobalt Co(NO3)2. L'attaque est plus lente dans les acides non oxydants, comme l'acide chlorhydrique, mais similaire, avec dégagement de gaz hydrogène.
- Co solide + 2 H3O+ aq ions hydronium en milieu non oxydant et dilués + 4 H2O eau → [Co(H2O)6]2+ cation cobalt hydraté rose pâle + H2 gaz
Elle est d'autant plus rapide que l'acide est concentré, comme c'est le cas avec l'acide sulfurique[alpha 8].
Mais, s'il est traité par des acides oxydants forts, comme l'acide nitrique fortement concentré de densité 1,5, une passivation de surface est constatée.
L'ammoniaque dissout le métal cobalt en présence d'air. Les bases fortes, comme les hydroxydes alcalins, sont pratiquement sans action.
Préparation du corps simple, production
Une technique ancienne permet de traiter les minerais arséniés au laboratoire :
- CoAs solide + 2 K2CO3potasse + 4 S eau → CoS sulfure de cobalt, solide + KSAs sulfoarséniure de potassium
Le sulfoarséniure de potassium est soluble dans l'eau, alors que le sulfure de cobalt précipite ou reste solide. Ce dernier est lavé puis traité par l'acide sulfurique. Le sulfate de cobalt est repris par la potasse caustique qui laisse un précipité d'oxyde de cobalt hydraté. Par chauffage, on obtient un oxyde de cobalt le plus souvent impur.
L'oxyde de cobalt, s'il est exempt d'impuretés, peut être calciné avec du charbon actif pour obtenir du cobalt métal. Néanmoins, pour séparer le nickel du cobalt NiO, l'oxyde de cobalt CoO est précipité de ces solutions aqueuses par l'acide oxalique. Une redissolution est obtenue dans l'ammoniaque pure. L'oxalate de nickel donne un précipité bleu verdâtre en premier lieu. L'oxalate de cobalt rose est décanté avec la liqueur restante, un oxalate de cobalt purifié bien rose est ensuite séché. Sa décomposition par la chaleur laisse du métal cobalt Co solide et du gaz dioxyde de carbone.

Le grillage des minerais sulfurés ou arséniés conduit à des oxydes, qui sont réduits par le charbon ou le gaz hydrogène, pour obtenir du métal cobalt impur. Il existe surtout des procédés d'extraction du cobalt lié à la métallurgie extractive du cuivre. Le procédé d'affinage du cobalt par électrolyse est aussi utilisé, à partir d'hydroxydes, d'oxyhydroxydes ou de sulfates de cobalt.
Alliages à base de cobalt
Ces alliages sont nombreux, citons les aciers spéciaux au cobalt, par exemple acier rapide au Co et molybdène Mo ou acier au Co et tungstène W, ou encore au Cr avec Co, Mo et V tel que l'acier martensitique N690Co, pour outil de coupe très rapide à températures élevées, ainsi que les multiples superalliages en passant par les aimants permanents à champ intense du type AlNiCo ou alliages dans lesquels entrent 66 à 12 % d'aluminium, 28 à 14 % de nickel, 35 à 5 % de cobalt, 6 à 0 % de cuivre ou 8 à 0 % de titane. Les alliages de cobalt au samarium du type Sm0,95Co0,05 figurent parmi les meilleurs aimants permanents.
Il existe également de nombreux outils de coupe (fraises, forets, etc.) HSS avec adjonction de cobalt. Ces outils sont plus résistants à l'usure et adaptés à l'usinage des matériaux durs tels que le titane. Les outils HSS-CO (M35) contiennent 5 % de cobalt tandis que les outils HSS-CO8 (M42) contiennent 8 % de cobalt.
Le cobalt est rendu malléable par alliage avec le magnésium. Il est rendu ductile par alliage avec le cuivre. Il améliore la dureté du nickel. La réalisation de revêtement par alliage nickel cobalt à 30 % de Co est possible par dépôt d'électrolyse, en présence d'additifs spécifiques à 50 °C à pH entre 3,5 et 5 et en maintenant environ 6,5 fois plus d'ions nickel que d'ions cobalteux. La présence d'ions cobalt dans les bains de nickel joue aussi un rôle « brillanteur », conférant aux pièces traitées un bel aspect. La tenue à la corrosion et la résistance à l'usure de ce revêtement sont grosso modo équivalentes à un revêtement métallique de « chrome dur », à partir de chrome (VI)[17].
.jpg.webp)
Les aciers au cobalt sont très solides et résistent à hautes températures. Ils peuvent être recherchés pour leur propriétés magnétiques. Ainsi les aciers à 72 % de fer, 17 % de cobalt, 8 % de tungstène, 2,5 % de chrome et 0,75 % de Cs sont des aimants permanents à champs intenses de l'ordre de 5000 à 10000 gauss.
Le cobalt est un métal relativement léger et dur, résistant à la rayure, prenant par polissage une brillance argentée et pour ces raisons, il est apprécié par les bijoutiers orfèvres et joailliers[alpha 9]. Les alliages cobalt chrome sont encore plus résistants à l'usure, tout en perdant les propriétés ferromagnétiques.
Citons encore des alliages ferreux, les FeNiCo, déclinés en Fernico ou en Kovar, le Permendur comportant 58 % de fer, 40 % de cobalt, 2 % de vanadium pour les électroaimants ou le Comol à 71 % de fer, 17 % de molybdène et à 12 % de cobalt pour fabriquer des aimants permanents à champ de moyenne intensité. L'alliage modèle FeNiCo Fe0,53Ni0,29Co0,18 présente un coefficient de dilatation très proche du verre des ampoules électriques classiques, ils étaient utilisés pour le passage des fils dans ces ampoules.
Les superalliages réfractaires peuvent des « fontes » HS-31 à 54 % de cobalt, 25,5 % de cuivre, 10,5 % de nickel, 7,5 % de tungstène, et seulement 2 % de fer et 0,5 % de carbone. Les stellites sont d'autres superalliages très durs, résistants à l'usure par les agents chimiques, soient comportant 66 % de cobalt, 26 % de chrome, 6 % de tungstène et 2 % de carbone. L'alliage « vitellium » conçu pour les prothèses et l'ostéosynthèse comporte 65 % de cobalt, 30 % de chrome et 5 % de molybdène.
Voir aussi les alliages de platine et cobalt.
Chimie, corps composés et complexes du cobalt
La chimie du cobalt fait place aux multiples états d'oxydations -I, 0, I, II, III, IV et V. Les sels et composés divalents et trivalents sont les plus communs, quoique le Co(III) soit déjà assez instable, en l'absence de complexation stabilisante.
Présentons quelques composés du cobalt. Le Co(-I) est représenté par des composés carbonylés Co(CO)3NO] et [Co(CO)4]−. Le Co(0), outre le corps simple métal, est illustré par les corps composés carbonyles Co2(CO)8] et Co4(CO)12]. Le Co(I) se présente le plus souvent sous forme de composés de coordination.
Le cation Co2+, peu acide et stable, confère une couleur rose à ses solutions[alpha 10]. Les composés cobalteux ou sels de Co(II), le plus souvent solubles dans l'eau, sont communément rose ou rouge à l'état hydraté, et bleu par chauffage. Citons les composés de coordination 4 tétraédrique [Co(Cl)4]2−, [Co(Br)4]2−, [Co(SCN)4]2−, [Co(NO)4]2− et les composés de coordination 6 octaédrique [Co(H2O)6]2+ rose, [Co(NH3)6]2+ jaune, [Co(NO2)6]4− jaune, [Co(CN)6]4− brun...
Les composés cobaltiques ou sels Co(III) sont difficiles à obtenir s'ils ne sont pas stabilisés. Il n'existe pas d'ion simple dans l'eau dans la mesure où l'ion oxydant fort, libère l'oxygène de l'eau. Ainsi CoF3 est un agent fluorant, mais la complexation le rend très stable. Pour obtenir un complexe précis de Co(III), il existe plusieurs techniques :
- l'ion Co2+ peut être oxydé par l'air ou un oxydant doux, en présence de coordinats convenables ;
- un complexe de coordination à base de Co2+ peut être oxydé directement ;
- un complexe de coordination déjà formé à base de Co3+ peut subir une substitution spécifique ou globale de coordinat(s).
Ainsi il existe un grand nombre de complexes de Co(III), notamment de coordination 6 en arrangement octaédrique avec les ions chlorure, iodure, cyanure, hydroxyde, carbonate, nitrite, oxalate... mais aussi l'ammoniac et les amines. Citons pour illustrer les cobaltiammines [Co(NH3)6]3+ jaune, [Co(NH3)5. H2O]3+ rose, [Co(NH3)5. Cl]2+ pourpre, [Co(NH3)5. CO3]+ pourpre, [Co(NH3)3. (NO2)3] jaune[alpha 11]. Pour terminer sur d'autres complexes, mentionnons [Co(CN)6]3− violet et l'ion cobaltihexanitrite [Co(NO2)6]3− jaune.
Les composés Co(IV) instable en milieu aqueux sont bien plus rares, il n'existe qu'à l'état d'oxydes supérieures par exemple K2[CoIVO3] et CoO2, ce dernier analogue de NiO2.
La présentation détaillée suivante des composés met l'accent sur quelques composés binaires puis présente un tableau récapitulatif des principaux composés communément connus. La chimie des ions en solution aqueuse est abordée, avec les complexes ; dans une approche plus spécifique, ces derniers complexes sont séparés d'une part en complexes de coordination, et d'autre part le composé bioinorganique emblématique qu'est la vitamine B-12.
Oxydes

Le cobalt a deux oxydes de maille cubique courants : CoIIO et Co3O4. Ce dernier corps est un composé oxyde de cobalt à valence mixte avec deux types d'ions cobalt, un au degré d'oxydation III et un au degré II. Cet oxyde possède une structure spinelle normale. Il est formé à partir de CoO par chauffage entre 600 et 700 °C. L'oxyde Co2O3 a une existence douteuse.
CoO anhydre est vert foncé ou brun vert. Hydraté, il devient rose. L'oxyde de cobalt fondu avec des oxydes métalliques engendre des corps de couleurs caractéristiques, rose, bleu et vert ("vert de Rinmann" ou vert de cobalt) respectivement avec l'oxyde de magnésium MgO, l'oxyde d'aluminium Al2O3, l'oxyde de zinc ZnO. L'oxyde de cobalt colore en bleu la silice et divers silico-aluminates, les verres et la porcelaine.
- Oxydes et sulfures de cobalt
 Bol à raser en porcelaine du XVIIIe siècle, d'origine japonaise, dont les décorations bleues résultent de la cuisson d'un dépôt d'oxyde de cobalt
Bol à raser en porcelaine du XVIIIe siècle, d'origine japonaise, dont les décorations bleues résultent de la cuisson d'un dépôt d'oxyde de cobalt-oxide-unit-cell-2006-CM-perspective-3D-balls.png.webp) Maille élémentaire de l'oxyde de cobalt(II,III) Co3O4
Maille élémentaire de l'oxyde de cobalt(II,III) Co3O4 Sulfure de cobalt et de nickel
Sulfure de cobalt et de nickel
Sulfures
Un grand nombre de sulfures existent, les plus courants et les plus simples sont :
- CoS2 noir qui possède une structure pyrite ;
- Co3S4 avec une structure spinelle ;
- et l'oxyde non-stœchiométrique Co1-xS qui possède la structure NiAs.
Les sulfures de cobalt se trouvent souvent dans la nature associés à d'autres sulfures (nickel, fer, cuivre, etc.). Ce sont la jaipurite CoS hexagonale, la cobaltpentlandite Co9S8, la cattiérite cubique CoS2, la linnaéite Co3S4.
Arséniures
L'arséniure de cobalt CoAs est polymorphe, il peut correspond à la modderite, gris acier de maille orthorhombique, ou à la langisite, rose de maille hexagonale.
Halogénures
_chloride.jpg.webp)
Les fluorures de cobalt existent à différents degrés d'oxydation : CoF2, CoF3 brun isomorphe de FeCl3 et CoF4 peu courant. Les autres halogénures n'existent qu'au degré d'oxydation II : CoCl2 bleu à l'état anhydre, CoBr2 vert et CoI2 bleu-nuit. Le cobalt est toujours entouré d'un octaèdre d'ions halogénure.
À part les fluorures qui sont peu solubles dans l'eau, les autres halogénures se dissolvent facilement et donnent des solutions rose-pâle. Ainsi le dichlorure de cobalt est utilisé pour détecter la présence d'eau ou déceler l'humidité. Une fois humecté, il vire au rose.
Principaux composés
- oxyde de cobalt (II) CoO cubique brun ou brun-vert
- oxyde mixte de cobalt Co3O4
- oxyde de cobalt (III) CoIII2O3 ou "noir de cobalt"
- Oxyde de chrome et de cobalt (turquoise)
- Dioxyde de cobalt et de lithium LiCoIIIO2
_oxide.JPG.webp)
- hydroxyde de cobalt (II) Co(OH)2 rose-rouge orthorhombique
- oxyhydroxyde de cobalt (III)
- CoIIIOOH ou hétérogénite
- hydroxyde de cobalt (III) Co(OH)3 blanc
- Sulfures de cobalt
- CoSα composé obtenu directement par précipitation de solutions et CoSβ orthorhombique moins soluble, correspondant à la syéporite en aiguilles brunes
- Disulfure de cobalt CoS2 cubique
- Sesquisulfure de cobalt Co3S4 en cristaux blancs
- Fluorures de cobalt
- Fluorure de cobalt (II) CoF2
- Fluorure de cobalt (III) CoIIIF3
- Chlorures de cobalt (II)
- CoCl2 bleu hexagonal
- CoCl2. 6 H2O rouge monoclinique, c'est-à-dire la forme commerciale[18]
- Chlorures de cobalt (III)
- CoIIICl3
- Bromures de cobalt
- Bromure de cobalt (II) CoBr2 hexagonal vert et déliquescent
- CoBr2. 6 H2O
- Iodure de cobalt
- Iodure de cobalt (II) anhydre bleu-noir
- Iodure de cobalt hexahydraté CoI2. H2O hexagonale, brun-rouge et hygroscopique
- Borure de cobalt (II)
- Cyanure de cobalt (II)
- Phosphure de cobalt
- Séléniure de cobalt
- Arséniates de cobalt (II)
- Arséniate de cobalt (II) octohydraté Co3(AsO4)2. 8 H2O monoclinique, ou minéral érythrite
- Carbonates de cobalt (II)
 Carbonate de cobalt naturel ou sphérocobaltite
Carbonate de cobalt naturel ou sphérocobaltite
- Carbonate de cobalt (II) CoCO3 triclinique rouge
- Carbonate basique de cobalt (II) monohydraté 2(CoCO3). Co(OH)2. H2O en prismes violet-rouge
- Chlorate de cobalt
- Molybdate de cobalt CoMoO4
- Nitrates de cobalt (II)
- Nitrate de cobalt (II) CoNO3
_phosphate.JPG.webp)
- Nitrate de cobalt (II) hexahydraté CoNO3. H2O rouge monoclinique
- Nitrites de cobalt
- cobalt (III)hexanitrite de sodium ou cobaltinitrite de Na
- Phosphates de cobalt (II)
- Phosphate de cobalt Co3(PO4)2 ou violet de cobalt
- Co3(PO4)2. 8 H2O en poudre rouge clair
- Phosphate de cobalt et de lithium LiCo(PO4) connu pour l'état de ferrotoroïdicité des ions cobalt.
- Silicate de cobalt Co2(SiO4) violet orthorhombique
- Stannate de cobalt Co(SnO3) ou bleu céruléen
- Sulfates de cobalt (II)
- Sulfate de cobalt(II) CoSO4 cubique
- Sulfate de cobalt (II) monohydraté CoSO4. H2O
- Sulfate de cobalt (II) heptahydraté CoSO4. 7 H2O rose-rouge ou bieborite monoclinique
- Sulfates de cobalt (III)
- CoIII2(SO4)3 bleu
- Sulfate de cobalt (III) hydraté CoIII2(SO4)3. 18 H2O
- Thiocyanates de cobalt (II)
- Thiocyanate de cobalt(II) Co(SCN)2
- Thiocyanate de cobalt trihydraté Co(SCN)2. 3 H2O violet orthorhombique
- Formiates de cobalt (II)
- Co(CHO)2. 2 H2O en cristaux rouges
- Acétates de cobalt
- Co (C2H3O2). 4 H2O monoclinique, rouge violet et déliquescent
- Oxalates de cobalt (II)
- K2Co(C2O4)
- Tartrates de cobalt (II)
- K2Co(C4H4O6)
- Carboxylates de cobalt (II)
- savons de cobalt
- dinaphténate de cobalt
- composés carbonyles
- tétracarbonyle de cobalt Co(CO)4 ou plutôt son dimère octocarbonyle de dicobalt [Co(CO)4]4
- Hydrocarbonyle de cobalt HCo(CO)4
- composés organocobalteux
- Cobaltocène ou bis(cyclopentadiényl)cobalt(II)
- Composés organocobaltiques
- Chloro(pyridine)cobaloxime
- corrinoïdes
- acide cobinique
- cobinamide
- cyanocobalamine
- Vitamine B12
Chimie en solution aqueuse
Les ions
En solution aqueuse, la forme stable du cobalt est l'ion Co2+ sous forme d'un composé de coordination 6 octaédrique [Co(H2O)6]2+. Les sels de cobalt divalent dissous dans une grande quantité d'eau sont le plus souvent rose fleur de pêcher ou rose grenat. Les dissolutions plus concentrées, une fois chauffées ou maintenues à la chaleur, deviennent bleues.
L'ion Co(III) existe en solution aqueuse mais généralement au sein de complexes (voir ci-dessous).
-carbonat.jpg.webp)
Précipitations des ions Co(II)
L'ion cobalt est précipité par les ions hydroxydes à froid vers pH = 7,5 pour une solution environ 0,01 M[19]. Ce n'est d'ailleurs pas Co(OH)2 qui précipite initialement pur, mais des sels basiques de couleur bleue. Il faut chauffer pour obtenir la formation de l'hydroxyde de cobalt Co(OH)2 rose.
- Co2+ ion cobalteux + 2 OH− aq ions hydroxyles → Co(OH)2 précipité d'hydroxyde de cobalt réarrangé après chauffage
Notons qu'en grand excès d'alcalis ou de bases concentrées, l'hydroxyde de cobalt se redissout, notamment avec l'ion cobaltite bleu.
- Co(OH)2 + OH−aq ions hydroxyles → CoO2H− ion cobaltite + H2O eau
De plus, les sels basiques obtenus à froid deviennent roses par excès d'alcalis à froid, ces compositions complexes s'oxydent à l'air en brunissant[20].
Les précipités d'hydroxydes de cobalt, comme les premiers précipités d'hydroxyde de cobalt bleu-verdâtre obtenus en milieu légèrement ammoniacal, sont solubles dans un excès d'ammoniaque, car en milieu ammoniacal plus concentré il y a formation d'amminocomplexes.
L'ammoniaque précipite les solutions neutres de l'ion cobalteux. Par exemple :
- Co2+ ion cobalteux + OH−aq ions hydroxyles + Cl− aq ions chlorures → Co(OH)Cl précipité d'hydroxychlorure de cobalt
Mais en excès de réactif ammoniaque,
- Co2+ ion cobalteux repris au précipité + 6 NH3 aq ammoniac dilué dans l'eau → [Co(NH3)6]2+ complexe amminé jaunâtre de Co(II) (i)
Le complexe cobaltiammine jaunâtre est rapidement oxydable à l'air, et laisse un complexe amminé de cobalt (III) [Co(NH3)6]3+ brun-rouge, stable vis-à-vis de l'action de la soude ou de la potasse.
- [Co(NH3)6]2+ complexe amminé de Co(II) + 1/2 O2 gaz oxygène dissous + H2O eau → 2 [Co(NH3)6]3+ complexe amminé de Co(III) + 2 OH−aq
Les sulfures alcalins précipitent les sels de cobalt, laissant un précipité noir.
- Co2+ aq + S2− aq solutions neutres ou alcalines → CoSα précipité noir initialement amorphe, qui se transforme en variété cristallisé β, moins soluble et plus stable.
La formation du précipité peut être améliorée par tampon du milieu aqueux à l'acétate de sodium[alpha 12]. Il n'y a ni suspension stables ni formations colloïdales comme c'est le cas avec Ni2+. Notons que l'acide tartrique empêche la précipitation de CoS en formant des complexes solubles. CoSβ est très peu soluble dans les solutions acides diluées. Sa formation, sa purification, puis son attaque par l'eau régale ou l'acide nitrique concentré peut être une méthode de séparation des ions cobalteux.
- 3 CoS solide + 8 H+ + 2 NO3− acide nitrique ou eau régale → 3 Co2+ aq + 3 S précipité de corps simple soufre + 2 NO gaz + 4 H2O eau
L'ion carbonate des carbonates alcalins laisse précipiter également les sels basiques de cobalt roses, en particulier le solide rose-rouge CoCO3. En présence de carbonate d'ammonium, il y a redissolution suivant l'équation précédente (i).
Les ions Co(II) précipitent aussi en présence d'ions phosphates, oxalates, ferrocyanures et mercurithiocyanates notamment.
- 3 Co2+ ion cobalteux en milieu aqueux neutre + 2 PO43− aq solution de Na2H PO4 → Co3(PO4)2 précipité de phosphate de cobalt mauve [alpha 13]
Complexation
Les ions Co(II) forment avec les ions thiocyanates SCN− un complexe caractéristique de couleur bleu [Co(SCN)4]2−. C'est une façon de les mettre en évidence. Le changement de coloration (rose → bleu) est dû à un changement de coordination : octaédrique (rose), tétraédrique (bleu). Cette bicoloration des complexes de cobalt intervient avec de nombreux autres ligands et sert de repère analytique.
Co(II) et Co(III) donnent avec l'ammoniac et les amines de nombreux complexes colorés, les cobaltiammines.
Les complexes permettent également de titrer les ions cobalt dans l'eau. Par exemple l'edta vers pH 10 (ajusté avec de l'ammoniac), le titrage se fait avec du noir ériochrome T (NET) comme indicateur de fin de réaction.
Oxydoréduction
Le potentiel standard du couple Co(III)/Co(II) dans l'eau, donc de l'aquacomplexe, est E° = 1,83 V/ESH. La valeur du potentiel standard étant supérieure à celle de l'oxydation de l'eau, le complexe [Co(H2O)6]3+ n'est pas stable dans l'eau. Le potentiel standard du couple Co(II)/Co est - 0,28 V/ESH. Il est possible de déposer le cobalt par électrolyse. C'est une façon en chimie analytique de le séparer d'autres ions, voire de le titrer par gravimétrie.
L'oxydation de Co(II) en Co(III) peut être utilisée comme méthode de titrage par exemple par le cérium(IV). Cependant comme le potentiel standard d'oxydation du cobalt est supérieur à celui du couple Ce(IV)/Ce(III), on ne peut pas titrer directement une solution de Co(II). Pour abaisser le potentiel standard, on stabilise le Co(III) en le complexant par exemple en utilisant l'ortophénantroline. L'indicateur de fin de titrage est l'ortophénantroline ferreuse[21] On peut aussi choisir de suivre ce titrage par potentiométrie[22].
Chimie de coordination
La chimie de coordination est née des travaux du chimiste Alfred Werner portant sur l'étude de complexes de colbalt. C'est à leur sujet que la célèbre compétition avec Jorgensen intervint, aux dépens de ce dernier. Aujourd'hui les composés de coordination sont décrits par la théorie du champ des coordinats, qui allie les propriétés magnétiques, spectroscopiques, structurales et thermodynamiques.
Bien qu'il existe des composés de coordination du cobalt à tous les degrés d'oxydation entre (-I) et (+V), la plupart des complexes sont aux degrés II et III. De par son nombre impair d'électrons, les complexes mononucléaires au degré (II) sont forcément paramagnétiques.
Géométrie des complexes
Les ligands anioniques monodentates (Cl−, Br−, I−, SCN−, N3−) : les complexes sont souvent tétraédriques, donc bleus ; c'est aussi le cas avec les complexes bidentates encombrés : salicylate, bétadicétonate substitué.
Quelques ligands donnent des complexes plan-carré, comme le diméthylglyoximate (ligand d'importance analytique), les porphyrines, les bases de Schiff, etc.
De nombreux ligands donnent des complexes octaédriques (eau, ammoniac, éthylènediamine, cyanure...).
- Différentes géométries de complexes du cobalt
 Complexe plan-carré
Complexe plan-carré.png.webp) Complexe octaédrique trans
Complexe octaédrique trans.png.webp) Complexe octaédriques cis
Complexe octaédriques cis
Spectroscopie des complexes
Les solutions aqueuses de cobalt sont rose pâle. Dans le visible, trois bandes apparaissent sur le spectre :
- 8 000 cm−1 ; ε = 1,3 ; 4T1 g(F) → 4T2 g(F) ;
- 19 000 cm−1 ; ε = 4,8 ; 4T1 g(F) → 4A2 g(F) ;
- 21 000 cm−1 ; ε = 2,1 ; 4T1 g(F) → 4T1 g(P)[23].
Les coefficients d'absorbance ε sont faibles, traduisant des transitions interdites de symétrie (transition entre niveaux d).
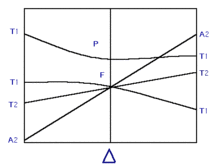
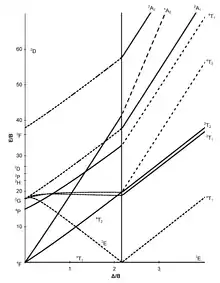
Ces données s'interprètent à l'aide du diagramme d'Orgel ou du diagramme de Tanabe-Sugano.
Les différents niveaux du diagramme d'orgel ci-contre sont issus du terme 4F (fondamental de l'ion libre Co2+ ou de son premier niveau excité 4P). Ce sont donc tous des quadruplets de spin entre lesquels les transitions électroniques sont permises (de spin, elle reste interdite de symétrie).
Que ce soient des complexes tétraédriques ou octaédriques, tous sont censés présenter trois bandes d'absorption dans la gamme d'énergie UV-visible. Dans les faits, la transition de plus haute énergie est l'élément le plus caractéristique du spectre. C'est donc 4A2 → 4T1(P) pour les complexes tétraédriques, et 4T1 g(F) → 4T1 g(P) pour les complexes octaédriques. L'enveloppe des bandes de ces transitions est généralement compliquée par la présence, dans la même gamme d'énergies, de transitions interdites de spin, mais dont l'intensité est renforcée par l'existence d'un couplage spin orbite[24].
Les autres transitions sont dans le proche infrarouge. Elles s'analysent bien avec le diagramme de Tanabe-Sugano. Pour Co(H2O)62+, B = 980 cm−1 et Δo = 9 300 cm−1. La valeur de B est égale à 80 % de la valeur B* = 1 120 cm−1 de l'ion libre Co2+.
Magnétisme
Cas du cobalt(II)
Les complexes octaédriques à bas champ et tétraédriques du cobalt(II) diffèrent dans leur propriétés magnétiques à cause de la contribution du moment orbital non nul dans le cas octaédrique, puisque le fondamental est un triplet d'orbital (terme T), alors que le fondamental des complexes tétraédriques est un singulet d'orbital (terme A).
Le moment magnétique pour les complexes de niveau fondamental 4T1 g(F) est généralement entre 4,7 et 5,2 M.B., alors qu'il devrait être de 3,89 si la seule contribution du spin était présente.
Dans le cas des complexes tétraédriques, la situation est compliquée pour une autre raison. Bien que le fondamental soit un singulet d'orbitale (terme A), une contribution orbitalaire intervient aussi, mais indirectement, par l'intermédiaire du premier niveau excité 4T2. Ainsi, les moments magnétiques des tétrahalogénocobaltates(II) sont :
- CoCl42− : 4,59 M.B. ;
- CoBr42− : 4,69 M.B. ;
- CoI42− : 4,77 M.B.
Peu de complexes octaédriques à haut champ ont été étudiés.
Cas du cobalt(III)
À l'exception de quelques rares complexes comme CoF63−, les très nombreux complexes octaédriques du cobalt(III) sont des complexes à bas spin, et sont donc paramagnétiques. Leurs 6 électrons remplissent le niveau électronique t2 g en s'appariant, et le terme fondamental est 1A1 g.
Chimie organométallique
De nombreux composés organométalliques du cobalt ont été préparés. Le plus célèbre d'entre eux, la vitamine B12, est présente dans la nature et est détaillée dans la section bioinorganique plus loin.
Composés carbonyles
Le cobalt étant dans la 9e colonne, il possède, au degré d'oxydation zéro, un nombre impair d'électrons. Il ne peut donc satisfaire la règle des 18 électrons (qui s'applique bien pour les composés carbonylés) qu'en créant au moins une liaison cobalt-cobalt. C'est le cas de Co2(CO)8, Co4(CO)12 ou Co6(CO)16 qui peuvent être formés. Les ponts entre cobalts existent sous plusieurs structures géométriques en équilibre, par exemple, pour le composé dinucléaire Co2(CO)8.

4-3D-balls.png.webp)
La réduction de Co2(CO)8 par un amalgame de sodium dans le benzène conduit à Co(CO)4−, qui est un cobalt au degré d'oxydation (-I). En milieu acide, celui-ci donne l'hydrure jaune pâle HCo(CO)4. Dans des conditions plus drastiques, il est même possible de former un cobalt au degré d'oxydation (-III). Les éléments chimiques de la même colonne (rhodium et iridium) se comportent de la même façon.
Les composés cobalt-carbonyles possèdent des applications industrielles puisqu'ils constituent le catalyseur des réactions d'hydroformylation.
Composés cyclopentadiényles
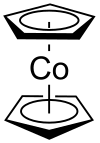
Le cobaltocène Co(II)(C5H5)2 est un composé violet sombre, sensible à l'air, homologue du ferrocène. Il est préparé à partir de cyclopentadiénure de sodium et de CoCl2. Il est stable (à l'abri de l'air) jusqu'à 250 °C, mais sa grande réactivité par rapport à son homologue ferreux vient du fait qu'il possède 19 électrons dans sa sphère de coordination. Son nombre impair d'électrons lui confère une propriété paramagnétique avec un moment magnétique de 1,76 M.B., en conformité avec la formule du spin seul. Il s'oxyde assez facilement en ion cobalticinium, de couleur jaune : Co(III)(C5H5)2+. Ce dernier résiste à une autre oxydation, il est même stable dans l'acide nitrique concentré.
Il existe aussi de nombreux composés semi-sandwich du cobalt de formule Co(II)(C5H5)L2, L étant un ligand phosphine, carbonyle, etc.
Vitamine B12 ou l'ion cobalt en chimie bio-inorganique
Le principal composé biologique du cobalt est la vitamine B12. Celle-ci fut extraite pour la première fois depuis des résidus de foie. Elle a été trouvée responsable de l'efficacité des traitements au fer, contre l'anémie, qui étaient d'autant plus efficaces qu'ils contenaient des impuretés à base de colbalt[25].
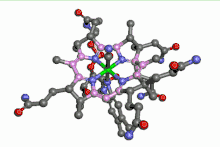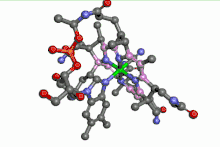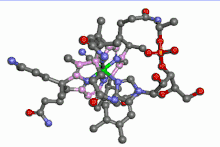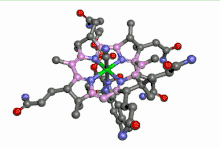
La vitamine B12 est un complexe organométallique du cobalt. L'ion cobalt y est au centre d'un noyau porphyrine. Une telle situation ressemble à celle du fer dans l'hémoglobine. En plus des 4 atomes d'azote du noyau porphyrine, le cobalt est entouré d'un atome d'azote appartenant à un résidu imidazole d'une désoxyadénosine. La 6e position est occupée par un groupe alkyle lié au cobalt par une liaison sigma. Cela fait de cette vitamine le seul composé organométallique de cobalt existant dans la nature.
La vitamine B12 peut être isolée sous forme de cyanocobalamine, dans laquelle un groupe CN− remplace la désoxyadénosyl sur la sixième position de coordination. D'autres substitutions de ce sixième ligand peuvent être effectuées (CH3-, OH).
L'incorporation du cobalt dans le noyau porphyrine donne à cet élément des propriétés rédox originales puisque trois formes existent suivant les conditions :
- Co(I), vitamine B12s sous sa forme bleu-vert ;
- Co(II), vitamine B12r sous sa forme marron ;
- Co(III)-OH, hydroxocobalamine violette.
- Différentes formes de la vitamine B12
 Vitamine B12
Vitamine B12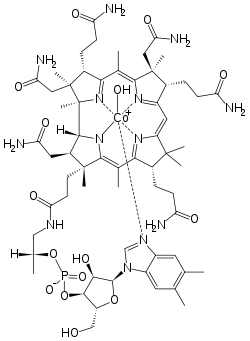 Hydroxocobalamine
Hydroxocobalamine
Ces différents états d'oxydation sont accessibles naturellement. Des composés modèles contenant du cobalt(II) complexé par une base de Schiff peuvent reproduire ce comportement.
Le rôle biochimique de la vitamine B12 est de permettre l'isomérisation du type

Elle permet en particulier la production d'érythrocytes ou globules rouges.
Analyse
Les composés minéraux de cobalt colorent en bleu les perles de phosphore. Les sels de cobalt sont oxydés en oxyde de cobalt, le borax corps dissolvant d'oxydes, une fois imprégné à chaud, donne des "perles de verres bleues" après chauffage au chalumeau.
Le thiocyanate de potassium donne avec les ions cobalteux un complexe de cobalt de couleur bleu, déjà décrit ci-dessus. Les solutions neutres ou peu acides d'ions cobalteux donnent avec le composé α-nitroso β-naphtol un précipité rouge-vineux de cobalt (III) de formule CoIII[C10H6(OH)(NO)]3, soluble dans les solutions basiques et les acides dilués. Elles réagissent aussi avec les ions mercurithiocyanates, laissant un précipité bleu caractéristique CoHg(SCN4)[alpha 14].
L'analyse quantitative peut être conduite par précipitation d'oxyde de cobalt Co3O4. L'électrolyse est également une technique pour les sels de cobalt.
Utilisations
Historiquement, le cobalt a été utilisé principalement en métallurgie (70% du cobalt produit depuis 1920), dont 11% pour les aimants, le second secteur dominant est la chimie (20%) dont la pétrochimie (14%). En 2006, environ 33 % de la production est utilisée pour les superalliages (22 %) et les alliages durs (11 %). La fabrication d'accumulateurs, secteur en pleine évolution à partir de 1995 devient prédominant au début de la décennie 2010, avant de décliner à la fin de cette même décennie. Avec la demande pour les batteries de l'industrie automobile électrique, les prix du cobalt ont culminé en 2017 (30$/livre) avant de chuter de moitié en 2019 avec l'abandon progressif dans la fabrication des batteries. En 2017, la production de batteries a représenté près de 50 % de la consommation de cobalt, alors que les superalliages en représentaient 18 % et les alliages durs 8 %[26].
On retrouve le cobalt dans divers alliages, tels que :
- les super-alliages réfractaires résistants à la corrosion, pour certaines pièces de réacteurs ou les turbines à gaz ;
- les alliages résistants à la corrosion, comme les stellites ;
- les aciers rapides (pour la réalisation des outils de coupe) ;
- les alliages pour prothèse dentaire (couronne par exemple) ;
- Les aimants et médias d'enregistrement magnétique, les aimants pour haut-parleurs.
En dehors des alliages, les céramiques très dures comportent du cobalt, par exemple les carbures ou composés frittés de carbures métalliques dits métaux durs, par exemple pour des forets ou des fraises dentaires[alpha 15]. Il existe des matériaux composites ou céramique à matrice métallique à base de cobalt, comme les cermets.
L'utilisation du cobalt dans les accumulateurs du type accumulateur lithium-ion, une des deux électrodes est constituée de LiCoO2 a connu une croissance rapide jusqu'en 2019. Panasonic, principal fabricant mondial de batteries lithium-ion et partenaire de Tesla dans la Gigafactory, annonce en 2018 l'aboutissement du développement de batteries sans cobalt pour ne plus dépendre de ce métal relativement rare, coûteux, et dont l'approvisionnement est problématique à plus d'un titre. Selon Kenji Tamura, responsable chez Panasonic du secteur des batteries automobiles, cette recherche a bénéficié du plus haut niveau de priorité chez le géant japonais : « Nous visons le zéro cobalt dans un proche avenir ». En juillet 2019, le fabricant chinois de cellules pour batteries SVOLT Energy Technology annonce avoir mis au point une nouvelle technologie de batteries lithium-ion sans cobalt, dénommée « NMx »[27]. Des annonces ont été faites par Tesla et Volkswagen sur l'utilisation d'accumulateur lithium-fer-phosphate (LFP) pour leurs voitures électriques de gamme standard[28]. En septembre 2020, Tesla a présenté ses plans pour fabriquer ses propres piles de batterie sans cobalt[29], et utilise dans ses modèles les plus vendus (entrée de gamme des model 3 et Y) des batteries LFP sans cobalt provenant d'autres fournisseurs comme CATL et BYD[30]. Tesla annonce que tous les modèles d'entrée de gamme des Model 3 et Y utiliseraient la technologie LFP à compter de 2021, cette technologie équiperait donc plus de 50 % des véhicules de la marque dès 2022[31]. Le marché global des batteries électriques s'est inversé en 2021. Les batteries LFP ont officiellement dépassé les batteries ternaires avec 52 % de la capacité installée, avec un taux de croissance beaucoup plus rapide que celui des batteries ternaires (parmi lesquelles on trouve les batteries contenant du cobalt)[32].
Le cobalt et surtout certains composés sont également utilisés dans des secteurs non métallurgiques comme la catalyse notamment dans le secteur des hydrocarbures, en particulier le procédé Fischer-Tropsch qui permet de transformer du charbon en carburant liquide pour les moteur à explosion, les pigments (9 %), les pneus, les colles, les savons…
Le cobalt est bien représenté parmi les catalyseurs de l'industrie chimique et pétrolière. Le métal cobalt, souvent associé au Fe et au Ni, est un catalyseur de la réaction de Bosch. Le molybdate de cobalt figure parmi les catalyseurs de conversion et de désulfuration pour obtenir de l'essence et d'autres produits pétroliers. Les carboxylates de Cobalt(II) sont des catalyseurs communs. L'oxyde de cobalt (III) monohydraté est un catalyseur d'oxydation. Le fluorure de cobalt(III) permet la perfluoration des hydrocarbures. L'acétate de cobalt(III) catalyse la décomposition du peroxyde de cumène, par exemple dans la fabrication industrielle du phénol et de l'acétone.
Les oxydes de cobalt(II) et (III) sont des produits de frittage, employés avec les carbures de titane et de tungstène, pour fabriquer des outils de coupe toujours efficaces à grande vitesse malgré un échauffement élevé. Présents dans divers matériaux semi-conducteurs, ces oxydes sont en outre utilisés comme pigments colorés des céramiques et des verres. Les hydroxydes de cobalt à structure lamellaire peuvent être utilisés dans les supercondensateurs.
Le carbonate de cobalt(II) est un pigment rouge pour céramiques. Le chlorure de cobalt(II) est un pigment pour vernis minéraux, il est employé en peinture sur verre et céramiques.
L'acétate de cobalt(II) et les carboxylates de cobalt(II) sont des corps siccatifs ou agents séchants pour les laques et vernis, les peintures et les encres. Le chlorure de cobalt(II) (anhydre bleu pâle et rose hydraté) est présent dans les encres sympathiques, il peut être employé dans les indicateurs d'humidité, avec les dessicateurs classiques.
L'ion cobalt complexé à des molécules organiques peut être utilisé comme absorbeur d'oxygène, mais aussi de chlore, de soufre, d'arsenic.
L'élément cobalt est un additif alimentaire pour les animaux d'élevage, principalement les ruminants (bovins, ovins et caprins) et les lapins, pour permettre la production par leur flore digestive de vitamine B12[33]. Le cobalt est un facteur de croissance des bactéries du rumen[alpha 16]. L'administration du cobalt passe par l'ingestion de granules d'argiles, le besoin journalier pour un bovin adulte avoisine 1 mg et 0,08 mg pour un mouton[34]. Toutefois, le fourrage traditionnel de nombreuses régions agricoles satisfait généralement ce besoin minimal. Si ce n'est pas le cas, une autre stratégie consiste à répandre 1 à 2 kilogrammes de sulfate de cobalt ou carbonate de cobalt par ha sur les prairies artificielles ou les cultures fourragères.
Il sert aussi comme matière première pour la production par fermentation bactérienne de vitamine B12 destinée à servir d'additif alimentaire pour animaux d'élevage ou pour l'alimentation humaine.
En 2012, les résultats[35],[36] des premiers essais de catalyseur bio-inspirés (ici imitant le fonctionnellement d'enzymes naturelles) montrent qu'il pourrait éventuellement se substituer au platine pour la production d'hydrogène et/ou la production d'oxygène par électrolyse de l'eau[37] ; Deux composés sont proposés (en 2012), le premier utilisable en solutions aqueuses de pH neutre sous forme de « nanoparticules de cobalt enrobées d’un oxo-phosphate de cobalt » ; et l'autre étant « le premier matériau catalytique "commutable" et sans métaux nobles jamais créé capable d’intervenir dans les deux réactions chimiques essentielles à l’électrolyse de l'eau : la production d’hydrogène et la production d’oxygène »[37] (des catalyseurs bio-inspirés, à base de nickel sur nanotubes de carbone étaient déjà proposés, mais efficaces uniquement en milieu fortement acide). Ce nanocatalyseur est commutable, ceci signifie qu'il « peut se transformer de manière réversible d’une forme chimique à une autre, chacune correspondant à une activité catalytique spécifique ». Reste à industrialiser le processus.
-nitrate-photo.jpg.webp)
Toxicité et écotoxicité du cobalt
Cet élément trace est surtout retrouvé dans les sols et les sédiments. À très faible dose, c'est un oligoélément utile à quelques rares plantes qui savent fixer l'azote, et indispensable à un plus grand nombre de bactéries fixatrices associées à la sphère racinaire (rhizobium de nombreux végétaux).
Les tissus animaux vivants n'en contiennent que de très faibles doses (quelques milligrammes pour cent grammes). L'ion cobalt est associé à certaines protéines et surtout à la vitamine B12. Les ruminants (décrits précédemment) sont vulnérables à la carence en cobalt qui cause une baisse de l'appétit et fait chuter la production de lait et le poids des veaux et génisses d'élevage. Cette carence a été observée dans des cas rares de certaines régions agricoles (Vosges granitiques et secteurs similaires de l'Ouest de la France)[alpha 17]. La carence en cobalt (II) favorise aussi l'action toxique du sélénium et sa pénétration dans l'organisme[alpha 18].
Le besoin journalier en cobalt ne dépasse pas 0,6 à 0,15 mg chez l'Homme ; encore faut-il que ce soit uniquement sous forme de vitamine B12. Chez les ruminants, la microflore du rumen transforme l'ion cobalt divalent en cyanocobalamine ou vitamine B12.
Sources d'exposition et de risques pour la santé
Une exposition aiguë au cobalt avoisinant 25 à 30 mg par jour est toxique.
On n'a pas noté d'affections cardiaques chez les patients anémiques ou les femmes enceintes ayant été médicamentés au cobalt, mais des anomalies fœtales sont provoquées chez des animaux exposés en laboratoire à des taux élevés de cobalt lors de la grossesse.
Dès les années 1960, certaines brasseries américaines ont commencé à ajouter du sulfate de cobalt, comme stabilisateur de la mousse de la bière ; ceci a provoqué chez les grands buveurs de bière des nausées, vomissements et graves affections cardiaques (mort avérée de quarante grands buveurs qui ingéraient ainsi 6 à 8 mg de cobalt par jour dans plus de 12 litres de bière[alpha 19]. Cette bière aujourd'hui interdite par la US FDA contenait 1,2 à 1,5 mg par litre.
Une source émergente d'exposition humaine la pose de certaines prothèse (prothèses de hanche notamment)[38] ; elles sont sources - par usure - de particules nanométriques qui diffusent systémiquement dans le corps via la lymphe et le système vasculaire, avec des réactions locales indésirables dans les tissus mous entourant la prothèse, et avec une toxicité systémique[39]. Il est démontré que les particules nanométriques de cobalt (et d'autres métaux) sont bien plus toxiques que les particules micrométriques[39]. Dans ce cas il faut faire appel à la nanotoxicologie pour l'évaluation des risques[39] ; Un des indices (à interpréter avec prudence toutefois) est une augmentation du taux de cobalt sanguin après insertion de la prothèse[40].
Ce produit ne figurant pas sur la liste des produits interdits aux sportifs, il a été suspecté que certains athlètes aient pu utiliser des sels de cobalt pour se doper, comme « alternative » à l'injection d'EPO pour améliorer leur performance aérobie en échappant aux contrôles antidopage[41], bien qu'avec de graves risques pour leur santé[39] (Il a été utilisé comme anti-anémique en médecine, efficacement mais avec des « effets médicaux indésirables graves »)[42]; il pourrait ainsi être recherché dans le sang complet, le sérum, le plasma ou l'urine[43].
Toxicité
Elle est restée longtemps mal connue ; si le mot cobalt provient de l'allemand kobalt ou kobold, véritable esprit maléfique qui hantait les mines dans la tradition germanique, le métal a été fabriqué tardivement et la toxicité du métal a longtemps été considérée comme faible. Il fallait toutefois, pour les métallurgistes prudents, que les poussières fines de métal cobalt soient inférieures à 0,5 mg/m3. L'inhalation de ces poussières provoque en effet des troubles pulmonaires et le contact avec la peau provoque des irritations. Son ingestion entraîne souvent nausées et vomissement.
Effets
C'est un oligoélément nécessaire à dose infime à certaines cellules et processus biologiques[39] ; il est présent dans la vitamine B12 et utilisé contre l'anémie, car favorisant la constitution des globules rouges. À des doses plus élevées, il est « hautement toxique »[39]. Les tests faits in vitro avec des ions cobalt sur des cellules de mammifères montrent qu'il est cytotoxique et induit l'apoptose et la nécrose cellulaire à des concentrations plus élevées que celle induisant une réponse inflammatoire[39].
L'ingestion de chlorure de cobalt (II) provoque aussi rapidement nausées et vomissement voire la mort.
La dose létale est facilement atteinte, surtout chez l'enfant. Des effets cardiaques et pulmonaires indésirables sont démontrés pour une exposition au cobalt proche ou légèrement inférieures aux limite d'exposition professionnelle actuelle[39].
L'exposition au cobalt peut induire des affections pulmonaires (difficultés respiratoires évoluant éventuellement en asthme, ou pneumonie chez des travailleurs ayant respiré un air chargé en cobalt), et il peut gravement affecter le tractus gastro-intestinal, la thyroïde (voir perturbation endocrinienne), le cœur et les systèmes sensoriels[42].
Cette toxicité est due :
- à ses propriétés chimiques ;
- à la radiotoxicité de certains de ses isotopes radioactifs dont le cobalt 60, utilisés pour la recherche et en médecine nucléaire, par exemple sous forme d'aiguilles pour tuer des cellules cancéreuses ;
- à des actions synergiques avec d'autres métaux qui l'accompagnent souvent dans la nature (arsenic, et moindrement cuivre, nickel, manganèse).
Dans tous les cas, il est plus toxique sous forme de nanoparticules, mais la recherche est encore lacunaire dans ce domaine.
Génotoxicité
Le cobalt et ses sels sont génotoxiques, principalement en raison des dommages oxydatifs sur l'ADN par des espèces réactives de l'oxygène[39], et peut être en raison d'une inhibition de certains processus de réparation de l'ADN[39].
Cancérogénicité
Le cobalt est classé comme "cancérogène possible" par le Centre international de recherche sur le cancer ; car il provoque un cancer lorsqu'il est introduit dans un muscle ou sous la peau, mais il ne semble pas être cancérogène lorsqu'il est inhalé par des animaux exposés via l'air, la nourriture ou l'eau. Les preuves de cancérogénicité du cobalt métallique et du sulfate de cobalt sont considérées comme suffisantes chez l'animal de laboratoire, mais encore jugées insuffisantes chez l'humain[39].
Métabolisme
Il est encore incomplètement cerné, mais on comprend mieux ses liens avec la carence en oxygène (hypoxie) dans les cellules animales : le Cobalt sous forme d'ion Co++ stabilise les dégâts cellulaires dus à l'hypoxie et stimule la production d'érythropoïétine (EPO) et semble (par le même mécanisme) contribuer à coordonner et réguler d'autres réponses adaptatives à l'hypoxie, mais pour la plupart de ces réponses avec des effets cancérogènes potentiels (avérés dans le modèle animal)[39]. Une hypothèse récemment proposée est que certains des effets toxiques de l'ion Co++ sont dus à une interférence négative (à confirmer) avec la pompe à Ca++ des cellules[39].
Cinétique corporelle ; rétention/excrétion
Sa cinétique dans le corps (Co++) et son temps de séjour ont surtout été étudiés chez l'animal de laboratoire et un peu chez l'Homme.
Il est principalement accumulé dans le foie, le rein, le pancréas et le cœur, et la teneur relative du squelette et du muscle squelettique augmentent lentement avec le temps après l'administration de cobalt[39].
Chez l'homme, l'excrétion rénale d'abord rapide, diminue en quelques jours. Ensuite dans une seconde phase qui dure quelques semaines, elle est ralentie, et une partie du cobalt reste piégé dans les tissus durant plusieurs années[39] (notamment dans le derme en cas de tatouage).
Dans le sérum, l'ion Co++ se lie à l'albumine outre des ions libres (5 à 12 % de la concentration totale de cobalt). Dans les globules rouges humains, il semble utiliser la même voie trans membranaire que le calcium, avec une absorption essentiellement irréversible quand il est effectivement engagé dans le cytosol (il n'est alors plus expulsé par la pompe à calcium)[39].
Imprégnation des populations humaines
Elle semble presque systématique dans les pays riches (dont France) mais en des proportions encore mal connue, et elle varie vraisemblablement selon de nombreux paramètres (environnementaux et alimentaires notamment).
En 2018 en France le « Volet périnatal » du programme national de biosurveillance a publié une évaluation de l'imprégnation des femmes enceintes notamment par le cobalt (et par 12 autres métaux ou métalloïdes et quelques polluants organiques). Ce travail a été fait à l'occasion du suivi d'une cohorte de 4 145 femmes enceintes (« Cohorte Elfe »). Cette cohorte comprenait des femmes ayant accouché en France en 2011 hors Corse et TOM)[44]. Le dosage urinaire de 990 femmes enceintes arrivant à la maternité a confirmé l'omniprésence du Cobalt dans l'environnement[44] ; il a été retrouvé dans 100% des échantillons d’urine analysées[44] (moyenne géométrique : 0,85 μg/L avec comme taux de créatinine : 1,16 μg/g [44] relativement similaires à ceux cités hors de France pour les femmes en fin de grossesse. - Ils sont cependant très supérieurs aux taux mesurés chez les femmes non-enceintes (en France notamment). La littérature cite cette différence, peut être explicable par des modifications métaboliques liées au manque de fer fréquent chez la femme enceinte[44]. Dans l'étude française de 2018 dans le contexte périnatal, l'excrétion urinaire de cobalt est plus élevée en cas de tabagisme, et de consommation plus élevée de produits chocolatés et de thé, et elle tend par ailleurs à diminuer avec l’âge et la consommation de poisson. Les auteurs évoquent une possible corrélation avec le statut en fer de la femme (cf associations avec le thé et poisson) mais le bilan martial n'étant pas connu pour toutes les femmes de la cohorte Elfe cela reste une hypothèse[44].
Hormis pour les travailleurs ou personnes exposées à des sources industrielles ou naturelles importantes, 99 % du cobalt que nous absorbons proviendraient de la nourriture, plutôt que de l'eau ou de l'air[45].
Dissémination environnementale

Sources naturelles
Sols, érosion, volcans, eau de mer et feux de forêt. Le taux moyen dans le sol, dans le monde, est de huit ppm (parties par million), mais variant de presque zéro à 6 450 ppm voire plus à proximité de mines (en Ontario, 16 et 17 ppm de cobalt ont été mesurées respectivement dans des parcs ruraux et de vieux parcs urbains[45]).
Sources anthropiques
Eau, air, sol et écosystèmes sont pollués par les mines et l'industrie du cobalt, les fumées des incinérateurs et issues de la combustion du charbon et du pétrole qui en contiennent une faible proportion, de même que les gaz d'échappement des véhicules et avions. Des contaminations accidentelles surviennent parfois (ex : 61 boutons d'ascenseurs suisse, d'origine française (produits avec un acier indien contaminé par du cobalt radioactif), émettaient environ 7000 Bq chacun ; le transport de 14 de ces boutons suffisait à imposer d'appliquer l'accord européen relatif au transport international des marchandises dangereuses par route (ADR)[46]).
Globalement, les sources principales sont les retombées des essais nucléaires, puis de l'accident de Tchernobyl. Leur radioactivité varie selon les lieux et diminue globalement progressivement avec le temps (voir figure 21 du rapport 2008 de la Division Radioprotection suisse ; « Césium 137 (en Bq/kg de matière sèche) dans les échantillons de sol de différentes stations de Suisse (1964–2008) »[46], et la figure 22 (« Strontium 90 dans divers échantillons prélevés entre 1950 et 2008 »)) mais localement par lessivage, ruissellement puis bioconcentration les taux peuvent augmenter (dans les champignons, et les sangliers qui les mangent par exemple.
Écotoxicologie
Dans les écosystèmes : Le cobalt a été peu tracé dans les environnements aquatiques. Selon Ifremer, on en trouve de 1 à 5 ng.L−1 en mer et les fleuves pollués en amènent des quantités significatives (de 200 ng.L−1 ont été mesurées à faible salinité dans la Seine et son estuaire). La chair des bivalves en contient ; par exemple de 3 à 3,5 mg.kg−1 (poids sec) en hiver et de 0,8 à 1,2 mg.kg−1 en été chez des moules du Devon en 1977 et 1978. Des huîtres du lagon de Navachiste au Mexique en contenaient de 0,3 à 1,9 mg.kg−1 (p.s.) en 1991[47]. La moule zébrée (moule d'eau douce) peut aussi en accumuler d'importantes quantités dans sa coquille.
Son écotoxicité varie selon les organismes, les individus, le contexte et l'espèce chimique considérée (cobalt pur, ion, nanoparticule, cobalt II ou cobalt III, radioactif ou non, ou encore type de sels organiques et/ou inorganiques). Sa toxicité et sa mobilité environnementale (pour les plantes, animaux, champignons) augmentent avec l'acidité du sol.
Les pluies acides peuvent en accentuer la mobilité et la biodisponibilité, avec risque de bioaccumulation et bioturbation par certaines plantes, champignons et animaux.
Normes ? seuils ?
En 2020, il n'existe toujours pas de norme réglementaire de qualité de l'eau de surface, de nappe ou potable pour le cobalt dans l'Union européenne ni aux États-Unis[48].
Une étude s'est basée sur des algues, une plante aquatique et quelques espèces d'invertébrés et de poissons classiquement utilisées pour les tests de toxicité aiguë et chronique, afin de proposer des seuils pour une future norme[48].
- Toxicité aiguë : La CL50 (ou CE50) variaient de 90,1 µg Co/L pour la lentille d'eau (Lemna minor) à 157000 µg Co/L pour la cécidomyie (Chironomus tentans)[48] ;
- Toxicité chronique : l'EC10 variait de 4,9 µg Co/L pour la lentille d'eau à 2 170 µg Co/L pour la truite arc-en-ciel (Oncorhynchus mykiss). L'EC20 variait de 11,1 µg Co/L pour la puce d'eau (Ceriodaphnia dubia) à 2 495 µg Co / L pour la truite[48].
En suivant l'approche européenne, un concentration dangereuse médiane pour 5% des organismes (HC5,50%) serait de 1,80 µg Co/L. Une approche de type US EPA, serait sept fois plus tolérante (7,13 µg Co/L)[48].
Certains invertébrés et les algues/plantes aquatiques se montrent bien plus sensibles aux expositions chroniques au Co que les poissons[48].
Dépollution
Pour extraire la forme ionique (dissoute) du cobalt d'un liquide on peut utiliser des chélateurs, des résines échangeuses d'ions, du charbon de bois activé, des techniques de nanofiltration, et peut-être bientôt des polymères susceptibles d'absorber ce polluant des systèmes de refroidissement des centrales nucléaires sont à l'étude.
Des chercheurs allemands et indiens[alpha 20] cherchent à développer des polymères capables de concentrer des isotopes de cobalt radioactifs pour traiter l'eau de refroidissement de centrales nucléaires : un nouveau procédé pour réduire les déchets radioactifs[49].
Ce cobalt provient de l'alliage d'acier spécial qui compose des tubes dans lesquels circule sous pression l'eau bouillante. Ce cobalt est bombardé de neutrons quand il passe dans le cœur du réacteur, ce qui donne des isotopes radioactifs (Co 60 ; dont la période de demi-vie radioactive dépasse 5 ans).
La nanostructure de ce polymère forme une « empreinte moléculaire », c'est-à-dire que les vides contenus par le polymère sont exactement à la forme d'un ion de cobalt. Ce polymère est en fait un produit antérieurement riche en ions cobalt qui a été passé à l'acide pour extraire le cobalt de la matrice ; Quand on place cette matrice dans un environnement contenant du cobalt, celui-ci tendrait à s'insérer dans les vides laissés par le passage à l'acide. Ainsi, une grande quantité d'isotopes radioactifs de cobalt en solution pourrait être piégée et éliminée avec ce polymère.
Économie et production

La bourse du marché du cobalt est gérée par le London Metal Exchange.
| Pays | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|---|---|---|
| 54 000 | 63 000 | 63 000 | 64 000 | 73 000 | 104 000 | 100 000 | 95 000 | |
| 6 300 | 6 300 | 6 200 | 5 500 | 5 900 | 6 100 | 6 300 | 6 300 | |
| 6 400 | 5 980 | 6 000 | 5 500 | 5 030 | 4 880 | 5 740 | 5 700 | |
| - | - | 4 300 | 4 100 | 4 600 | 4 600 | 5 100 | 4 700 | |
| 4 200 | 3 700 | 4 300 | 4 200 | 5 000 | 3 500 | 3 800 | 3 600 | |
| - | 3 100 | 3 700 | 3 800 | 3 500 | 3 300 | 3 400 | 700 | |
| - | - | - | 2 190 | 3 310 | 3 280 | 2 910 | 2 800 | |
| 6 920 | 6 570 | 6 900 | 4 250 | 3 870 | 3 520 | 3 340 | 3 200 | |
| 3 000 | 3 000 | 3 000 | 2 300 | 2 300 | 2 300 | 2 100 | 1 800 | |
| 2 100 | - | - | - | 2 200 | 2 100 | 2 300 | 1 900 | |
| 7 200 | 7 200 | 7 700 | 7 700 | 3 100 | 2 000 | 2 500 | 2 300 | |
| - | - | 760 | 690 | 640 | 490 | 500 | 600 | |
Considéré comme un minerai stratégique et non-renouvelable, sa consommation en 2014 faisait que les réserves connues (de 7,1 millions de tonnes) en République du Congo (50 %), en Australie (15 %) et à Cuba (7 %)) seront épuisées en 60 ans. Les nodules polymétalliques et encroûtements cobaltifères sous-marins en contiennent néanmoins beaucoup (dont en Polynésie française[52]) mais on ignore encore si on pourra les exploiter sans trop dégrader le milieu marin[53],[54].
Selon le webzine Illuminem, les principaux producteurs sont des sociétés constituées au Royaume-Uni et en Suisse (Glencore et Eurasian Natural Resources) et en Chine (China Molybdenum et Metorex). Des actionnaires chinois contrôlent ces deux sociétés qui représentent 13,8 % de la production mondiale et environ 24 % de la production réalisée par de grandes entreprises bien connues et actives. Les entreprises constituées en République démocratique du Congo, en revanche, ne contrôlent que 3,5 % de la production mondiale. La famille sud-africaine Glasenberg est le principal actionnaire de Glencore (19,3 % de la production mondiale)[55].
Ressources planétaires, enjeux stratégiques, écologiques et éthiques
L'Afrique détient l'essentiel des ressources mondiale connues de cobalt. Environ 50% se trouveraient en République démocratique du Congo (principalement dans la région de Kolwezi) qui vise à redevenir leader mondial en termes de production de minerai de cobalt[56]. La Zambie est le premier producteur de cobalt mais le minerai peut être fondu et raffiné ailleurs dans le monde, dont en Europe. Le Cameroun en possède peut-être le plus grand gisement au monde (sous la zone forestière de l'est du pays), qui devrait être mis en exploitation dans quelques années par le groupe américain Geovic[57].
À la fin du XXe siècle, le belge Umicore (devenu Nyrstar après avoir fusionné avec Zinifex qui détient 60 % des parts) était leader mondial dans ce domaine.
Dans les années 1980, il est l'une des huit matières premières stratégiques jugées indispensables (en temps de guerre comme en temps de paix)[alpha 21].
En 1993, 63 % de tout le minerai de cobalt venait de trois pays : Russie (32 %), Zambie (20 %) et Canada (11 %) ;
En 2006, 55 000 tonnes[58] ont été produits (contre 19 700 tonnes en 1994, et alors répartie de manière équilibrée entre Russie 3 300 tonnes, Zaïre 3 200 tonnes, Finlande 3 000 tonnes, Canada 2 900 tonnes, Norvège 2 800 tonnes, Zambie 2 600 tonnes distançant la Chine 800 tonnes).
En 2018 le cobalt, plus convoité que jamais (pour les batteries de véhicules électriques notamment) est classé "rouge"[59] par le BRGM et le WMF (« World Materials Forum ») car combinant un risque de rupture d'approvisionnement et une importance très haute pour l'industrie[60] car il pourrait manquer "entre 2025 et 2030" et la République démocratique Congo qui possède la moitié des ressources pourrait être politiquement instable. Son prix a quadruplé en 2 ans et à ce rythme, en 10 ans "les 70 ans de réserves actuelles de cobalt tomberont à 25 ans si elles ne sont pas renouvelées"[61]. Tesla a réussi à produire des batteries (LFP) pour la Model 3 n'utilisant pas de cobalt[30] là où les autres constructeurs n'arrivent pas encore à descendre sous 8 %. Par ailleurs, dans le futur, de nouveaux gisements sous-marins pourraient être découverts et exploités[62].
En 2018 (novembre) la Commission européenne estime que la demande mondiale en cobalt pourrait tripler en moins de 15 ans (avant 2030), malgré une chimie optimisant le minerai. La part du véhicule électrique (6 650 tonnes soit 9 % de la demande mondiale en cobalt) pourrait passer en 2030 à 300 000 à 400 000 tonnes ; une pénurie serait possible dès 2025 : la consommation mondiale pourrait atteindre alors 203 000 tonnes pour une production de 196 000 tonnes. L'Europe dispose de 239 gisements identifiés, mais sa production annuelle de cobalt est d’environ 2 300 tonnes/an pour une demande neuf fois supérieure. Avec un recyclage efficace et l'accélération de ses gisements l'Europe pourrait couvrir 15 % de sa demande en 2030. Des batteries innovantes (substituant par exemple le cobalt par du nickel, pourraient réduire la demande mondiale de 30 % d'ici 2030[63].
Après une envolée en 2017 pour atteindre au printemps 2018 des sommets inconnus depuis dix ans, dépassant 90 000 $/tonne, du fait des craintes de pénurie due au boom attendu des ventes de voitures électriques, les cours du cobalt ont plongé à 33 000 $/tonne début février 2019. Les producteurs miniers ont en effet massivement investi pour répondre à cette demande, multipliant les projets en République démocratique du Congo[64] ; l'engouement pour ce minerai et la situation politique instable de la République démocratique du Congo a entraîné la création de nombreuses mines artisanales où travailleraient, fin 2018, de 110 000 à 150 000 clandestins, dont des enfants[65] qui extraient, souvent à la main, environ 20 % du cobalt alors exporté hors de la RDC, surtout vers la Chine, pour y produire des batteries pour au moins 26 entreprises ne respectant pas les normes internationales de devoir de diligence en matière de droits humains (Huayou Cobalt notamment), ce qu'a dénoncé un rapport d'Amnesty International et d'African Resources Watch (Afrewatch) en 2016 [66]. Un nouveau rapport, Le temps est venu de recharger des batteries « propres » !, (2017) insiste sur tous ces points et fait le bilan de l'inertie générale[67].
En octobre 2022, la société australienne Jervois Global inaugure une nouvelle mine de cobalt aux États-Unis, dans l'Idaho, dont la production devrait s'élever à 2 000 tonnes par an. Les États-Unis n'ont pas produit de cobalt depuis 1994. Le gouvernement américain accorde une ristourne pouvant aller jusqu'à 7 500 dollars sur les véhicules dont au moins 40 % des métaux de la batterie sont produits ou recyclés aux États-Unis ou dans un pays ayant un accord de libre-échange avec Washington[68].
Après avoir culminé à 81 000 $/t au début de 2022, les cours du cobalt ont reculé de 58 % à 35 750 $/t au début mars 2023. Le décrochage des prix s'explique d'abord par une chute de la demande en Chine de la part des constructeurs automobiles, du fait du recul des ventes de voitures électriques ou hybrides rechargeables causé par la fin du programme de subventions de Pékin à l'achat de véhicules électriques en décembre 2022. Or la Chine représente 64 % des ventes mondiales de voitures électriques. De plus, la popularité des batteries lithium-fer-phosphate (LFP), un peu moins performantes, a fortement progressé, notamment en Chine, car elles sont beaucoup moins coûteuses. Enfin, la production minière de cobalt devrait progresser de 33 % en 2023, selon Rystad Energy[69].
Recyclage
Le cobalt étant une ressource stratégique et non renouvelable, face à l'envolée des cours et malgré les difficultés techniques pour passer à des méthodes industrielles, recycler le cobalt devient un enjeu stratégique[70],[71].
Le rapport de l'UNEP de 2011[72] fait état pour le cobalt des données suivantes[73] :
- taux de métal fonctionnel recyclé (EOL-RR, pour end of life recycling rate) : 68 % ;
- proportion de métal recyclé entrant dans la production de métal (RC, pour recycled content) : 32 % ;
- proportion de vieux déchets métalliques dans le flux de déchets métalliques introduits dans le processus de recyclage (OSR, pour old scrap ratio) : 50 %.
Transformation / produits chimiques à base de cobalt
En matières de raffinage, transformation et commercialisation de Chimie fine spécialités chimiques (produits chimiques, poudres, pigments à base de cobalt), depuis 1912, le leader mondial est "Cobalt & Specialty Materials" (CSM), filiale d'Umicore (devenu Nyrstar). Ce groupe contrôle toute la chaîne d'approvisionnement et de production pour le cobalt, via des unités réparties sur plusieurs continents[74]. Les composés de cobalt, sous forme organique et inorganique produit et mis sur le marché par CSM, sont notamment utilisés comme pigment pour le verre, la céramique, les peintures, les encres, etc. et - avec le nickel - dans les batteries et piles rechargeables, ou comme catalyseurs ainsi que pour divers usages dans le domaine de l'électronique ou des alliages et du traitement de surface.
En Europe, la principale usine (Umicore - Cobalt & Specialty Materials au sein de Umicore Specialty Materials Bruges (USMB)), active depuis 1907 est celle de Bruges en Belgique ; elle produit des composés inorganiques et organiques du cobalt, rachetée par Umicore en 2007.
Des particules, nanopoudres et nanoparticules stables[75] de cobalt (nanoparticules superparamagnétiques) ou à base de cobalt (ex : particules magnétiques de cobalt-nickel[76]) sont produits depuis quelques années, et par exemple intégrées à de nouveaux catalyseurs au palladium[77]
Notes et références
Notes
- ↑ Aujourd'hui, en allemand, le substantif « der Kobold » au singulier, « die Kobolde » au pluriel, correspond grosso modo au lutin. Pourtant, par respect pour la tradition paysanne minière, il ne faut pas confondre ces petits êtres miniers avec les lutins homonymes, kobolds ou gobelins, qui hantent les pays de forêts ou de prairies marécageuses. Ce ne sont pas non plus des nains nickels, facétieux et verdâtres. Rappelons la même logique du folklore nordique à l’œuvre dans les appellations du quartz, nickel, wolfram.
- ↑ En réalité, il s'agit du corps simple As dont les surfaces sont déjà largement oxydées en oxydes arsénieux au contact de l'air.
- ↑ Le premier corps précipité, composé de Co(II) est plus tard décrit par la formule [CoCl3. 6 (NH3)] et le second corps composé de cobalt (III) bien plus tard du temps d'Alfred Werner, découvreur de leur structure complexe, par [CoIII(NH3)6] Cl3, soit le chlorure d'hexa-ammine cobalt (III).
- ↑ Alfred Werner reçoit le prix Nobel de chimie en 1913, mais sa « théorie de la coordination » est proposée en 1893. Elle est basée sur l'aspect structural, en particulier l'isomérie et l'activité optique des complexes minéraux.
- ↑ En toute rigueur ce n'est pas l'isotope qui subit la désintégration ε qui émet le rayonnement gamma, mais la fraction de l'isotope produit dans un état excité. Mais comme la désexcitation (du nouvel isotope) suit la transformation radioactive, elle y est liée.
- ↑ Le premier producteur de minerai de cobalt était la République du Congo, suivi par la Zambie, le Canada et les États-Unis.
- ↑ La densité avoisine en moyenne 8,86 à 25 °C.
- ↑ L'attaque du cobalt est plus facile que celle du nickel.
- ↑ Beaucoup de bagues sont néanmoins réalisées avec du cobalt légèrement impur, contenant du nickel allergène. Le cobalt pur est quatre fois plus dur que le platine, et pratiquement cinq fois plus que l'or et sept fois plus que l'argent. Aussi un bijou en cobalt une fois fabriqué ne peut plus être à nouveau déformé.
- ↑ Une analogie avec Cu2+, Fe2+, Mn2+, Ni2+ ou Zn2+ est souvent proposée.
- ↑ Ces composés complexes de Co(II) et Co (III) se nomment aussi cobaltoam(m)ines ou cobaltoam(m)ines. Les nombreux composés de chlorures cobaltiques, solides à température ambiante, décrits sous forme de complexes amminés et parfois hydraté reçoivent souvent des dénominations latines relatives à leur couleur, ainsi le dichro Co(NH3)3Cl3. H2O, le luteo Co(NH3)6Cl3 orange monoclinique, le praseo Co(NH3)4Cl3. H2O vert rhomboédrique, le purpureo Co(NH3)5Cl3 rhomboédrique ou le roseo Co(NH3)5Cl3. H2O rouge-brique. Ils se nomment aussi Cobaltoam(m)ines.
- ↑ L'hydrogène sulfuré ne provoque la précipitation des ions cobalteux que dans les solutions aqueuses de pH > 4 pour des concentrations centimolaires en ions cobalteux.
- ↑ Le phosphate de cobalt est soluble en milieu acide, à pH < 4 pour des concentrations centimolaires en ions cobalteux.
- ↑ La réaction-test est surtout plus sensible en présence d'ions zinc divalent, le précipité mixte CoHg(SCN4). ZnHg(SCN4 plus abondant et toujours bleu.
- ↑ Il apparaît à hauteur de 6 % en masse dans un des premiers carbures de tungstène préparé par frittage à l'échelle industrielle, dénommé widia.
- ↑ Les micro-organismes de la panse des ruminants sont à l'origine de la synthèse de la vitamine B12
- ↑ Les bovidés progressivement adaptés à ces secteurs pauvres étaient plus petits et donc plus résistants à ces troubles de carences, qui pouvaient autrefois affaiblir un gros animal importé.
- ↑ Le Co et surtout la vitamine B12 préserve de la toxicité du sélénium
- ↑ La mauvaise nourriture et l'alcool sont des facteurs aggravants de l'hypertension. Mais le cobalt joue un évident rôle néfaste au niveau cardiaque.
- ↑ Börje Sellergren, de l'Institut de recherche environnementale (INFU) à l'Université technique de Dortmund,avec Sevilimedu Narasimhan du Centre de recherche nucléaire Bhaha de Kalpakkam (Inde)
- ↑ Avec le germanium (électronique avancée), le titane (sous-marins de chasse, alliage extrêmement résistant), le magnésium (explosifs), le platine (catalyseur, et contacts aussi efficace que l'or pour l'aviation, circuits avec contacts rapides), le mercure (chimie nucléaire, instruments de mesure), le molybdène (acier) et le niobium (alliages spéciaux extrêmement rares). (Christine Ockrent, comte de Marenches, Dans le secret des princes, éd. Stock, 1986, p; 193.)
Références
- 1 2 3 4 5 (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- 1 2 (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832-2838 (DOI 10.1039/b801115j)
- ↑ (en) Metals handbook, vol. 10 : Materials characterization, ASM International, , 1310 p. (ISBN 0-87170-007-7), p. 344
- ↑ Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ SIGMA-ALDRICH
- ↑ « Cobalt » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ « Le mystère des Nains (les chasseurs de trésors de Venise) » (consulté le )
- ↑ G. Brandt, "Dissertatio de Semi-Metallis", Acta literaria et scientiarum Sueciae, vol. IV, 1735, p. 1-12. Uppsala, 1742.
- ↑ G. Brandt, Cobalti nova species examinata et descripta, Acta Societatis regiae scientiarum upsaliensis, 1742, p. 33-41. Stockholm, 1748.
- ↑ F. Delamare, Saffre, smalt, bleu d'esmail et azur, in Bleus en poudres, de l'Art à l'Industrie, Mines Paris, ParisTech, Les Presses, 2008, p. 71-122.
- ↑
- ↑ Alain Foucault, opus cité.
- ↑ Jean-Philippe Rémy, La chute paradoxale du cours du cobalt, Le Monde, 15 août 2019.
- ↑ « https://institutnr.org/40-000-enfants-travaillent-toujours-dans-les-mines-pour-nos-batteries », (consulté le )
- ↑ Roger Rumbu, Métallurgie extractive du cobalt, opus cité, en particulier pp 36-40
- ↑ Robert Lévêque, Traitements et revêtements de surface des métaux, édition Dunod, 2013, 472 p. (ISBN 9782100599370), en particulier chap. 10 sur les revêtements obtenus en voie liquide, p. 178.
- ↑ Si on chauffe ce corps rouge, on obtient un corps bleu soit CoCl2. L'opération est réversible, avec addition d'eau. La déshydratation est ici l'équivalent d'une décomposition thermique, l'hydratation est une recomposition du corps de départ, par exemple dans cette vidéo sans commentaire.
- ↑ Il faut procéder évidemment en absence de complexants, comme l'ion tartrate ou les sels ammoniacaux, qui empêchent toute précipitation.
- ↑ Charlot G. (1963). L'analyse qualitative et les réactions en solution. Ed. Masson et Cie. p.263.
- ↑ Charlot G. (1966). Les méthodes de la chimie analytique. Ed Masson et Cie.
- ↑ Martinand-Lurin E., Grüber R. (2012). 40 expériences illustrées de chimie générale et organique. Éd. De Boeck.
- ↑ Figgis B.N. (1966). Introduction to Ligand Fields. Ed. Interscience Publishers, John Willey & Son, p.223.
- ↑ Cotton A. & Wilkinson G. (1972). Advanced inorganic chemistry. 3e éd, éd. Willey interscience. p.880.
- ↑ Greenwook N.N., & Earnshaw A. (1997). Chemistry of the element. Ed Elsevier p.1138.
- ↑ « Benchmark launches cobalt industry's first ever battery metal price », sur Benchmark Minerals,
- ↑ Le fabricant chinois SVOLT présente la première batterie Li-Ion sans cobalt, automobile-propre.com, 16 juillet 2019.
- ↑ (en) Global EV Outlook 2022 (page 180-181), Agence internationale de l'énergie, mai 2022.
- ↑ Justine Calma, « Tesla to make EV battery cathodes without cobalt », theverge.com, (lire en ligne, consulté le )
- 1 2 « Les premières Tesla Model 3 « made in China » débarquent en France », sur Automobile Propre (consulté le ).
- ↑ (en) Jonathan M. Gitlin, « Tesla made $1.6 billion in Q3, is switching to LFP batteries globally », sur Ars Technica,
- ↑ (en) « EV Lithium Iron Phosphate Battery Battles Back », energytrend.com, (lire en ligne, consulté le )
- ↑ «Avis scientifique sur l'utilisation de composés du cobalt en tant qu'additifs dans l'alimentation animale», European Food Safety Authority, 2009.
- ↑ Larousse agricole, 1991, article cobalt. Une dose trop importante est toxique. Ainsi la limite toxique bovine ne dépasse pas 100 mg par jour et par 100 kilogrammes de masse corporelle vive, la limite ovine 300 mg par jour et par 100 kilogrammes de masse théorique.
- ↑ E. S. Andreiadis, P.-A. Jacques, P. D. Tran, A. Leyris, M. Chavarot-Kerlidou, B. Jousselme, M. Matheron, J. Pécaut, S. Palacin, M. Fontecave, V. Artero, Molecular Engineering of a Cobalt-based Electrocatalytic Nano-Material for H2 Evolution under Fully Aqueous Conditions, Nature Chemistry (2012) in press. DOI: 10.1038/NCHEM.1481
- ↑ S. Cobo, J. Heidkamp, P.-A. Jacques, J. Fize, V. Fourmond, L. Guetaz, B. Jousselme, R. Salazar, V. Ivanova, H. Dau, S. Palacin, M. Fontecave, V. Artero, A Janus cobalt-based catalytic material for electro-splitting of water, Nature Materials 11 (2012) 802. DOI: 10.1038/nmat3385
- 1 2 Communiqué de recherche de l'université Joseph-Fourrier, Production d'hydrogène : si le cobalt remplaçait le platine, 2012-10-31
- ↑ Pizon AF, Abesamis M, King AM, Menke N. (2013), Prosthetic hip-associated cobalt toxicity ; J Med Toxico,. déc 2013 ;9(4):416-7. doi:10.1007/s13181-013-0321-z
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Simonsen LO, Harbak H, Bennekou P (2012), Cobalt metabolism and toxicology--a brief update. ; Sci Total Environ. 2012-08-15; 432:210-5. Epub 2012 Jun 23 (résumé)
- ↑ Paustenbach DJ, Galbraith DA, Finley BL (2013), Interpreting cobalt blood concentrations in hip implant patients ; Clin Toxicol (Phila). 2013-11-20 ; Epub 2013 Nov 20.
- ↑ Lippi G, Franchini M, Guidi GC (2005), Cobalt chloride administration in athletes: a new perspective in blood doping ? ; Br J Sports Med. 2005 Nov; 39(11):872-3.
- 1 2 Ebert B, Jelkmann W (2013), Intolerability of cobalt salt as erythropoietic agent ; Drug Test Anal. 2013-08-30, Doi:10.1002/dta.1528. (résumé)
- ↑ Blood doping by cobalt. Should we measure cobalt in athletes? Lippi G, Franchini M, Guidi GC. J Occup Med Toxicol. 2006 Jul 24; 1:18. Epub 2006 Jul 24.
- 1 2 3 4 5 6 : métaux et métalloïde des recherches de la cohorte Elfe ; Décembre 2016 ; SANTÉ PUBLIQUE France / Imprégnation des femmes enceintes par les polluants de l’environnement en France en 2011]. Volet périnatal du programme national de biosurveillance|PDF, 224p|aussi disponible à partir de l’URL : www.santepubliquefrance.fr
- 1 2 Page du Gvt. canadien sur le cobalt
- 1 2 http://www.bag.admin.ch/themen/strahlung/00043/00065/02236/index.html?lang=fr&download=M3wBUQCu/8ulmKDu36WenojQ1NTTjaXZnqWfVp7Yhmfhnapmmc7Zi6rZnqCkkId6f3uBbKbXrZ2lhtTN34al3p6YrY7P1oah162apo3X1cjYh2+hoJVn6w== Rapports annuels 2008 de la Division Radioprotection, Suisse (PDF, consulté 2009 05 26 ; 4866 kB
- ↑ Ifremer, Surveillance du milieu marin, travaux du Réseau National d'Observation de la Qualité du Milieu Marin ; Le RNO : programmes actuels - L'argent, le cobalt, le nickel et le vanadium dans les mollusques du littoral français - Les carottes sédimentaires, mémoire de la contamination ; Bulletin Ifremer, 2002 Télécharger en Pdf
- 1 2 3 4 5 6 William A. Stubblefield (2020) Acute and Chronic Toxicity of Cobalt to Freshwater Organisms: Using a Species Sensitivity Distribution Approach to Establish International Water Quality Standards ; Environmental Toxicology and Chemistry (ETC) ; 06 janvier 2020 ; https://doi.org/10.1002/etc.4662 (résumé)
- ↑ BE Allemagne numéro 462 (4/12/2009) - Ambassade de France en Allemagne / ADIT
- ↑ (en) « MINERAL COMMODITY SUMMARIES 2022 »
 [PDF], sur USGS, (consulté le )
[PDF], sur USGS, (consulté le ) - ↑ « Cobalt produit par pays du monde », sur Statista (consulté le )
- ↑ Bougault H & Saget P (2011) Les encroûtements cobaltifères de Polynésie française. Mines & Carrières, (185), 70-75.
- ↑ Lenoble J.P (2000) Les conséquences possibles de l’exploitation des nodules polymétalliques sur l’environnement marin. New technologies and the law of the marine environment. Kluwer Law International, The Hague/London/Boston, 95-109.
- ↑ Sarradin P.M, Sarrazin J & Lallier F.H (2017) Les impacts environnementaux de l’exploitation minière des fonds marins : un état des lieux des connaissances. In Annales des Mines-Responsabilité et environnement (No. 1, pp. 30-34). FFE.
- ↑ Adnan Mazarei, « Who controls the world’s minerals needed for green energy? », sur illuminem
- ↑ ACP, La RDC déterminée à reprendre sa place de leader mondial dans la production du cuivre et du cobalt, Kinshasa, 17 septembre 2013 (ACP)
- ↑ Geovic Mining Corp
- ↑ Vigne J.L., ANDRE G, KAPALA, (2009). Données industrielles, économiques, géographiques sur les principaux produits chimiques, métaux et matériaux. 8e éd. SFC Eds. http://www.societechimiquedefrance.fr/extras/Donnees/acc.htm
- ↑ Delamarche M (2018) Le tableau de Mendeleïev des métaux critiques ; L'Usine nouvelle / Matières premières , métaux précieux , Métaux non ferreux , Cuivre| 28/06/2018
- ↑ . Cette année une étude (McKinsey, CRU et BRGM) a ré-évalué la disponibilité d’une cinquantaine d'éléments (dans les conditions techniques et économiques du moment, et en tenant mieux compte du besoin de minerai de « qualité », du temps d'épuisement des réserves connues, mais aussi du risque géopolitique et du faible nombre d’acteurs de la chaine d’approvisionnement, etc.). Ce travail est réalisé dans le cadre du « World Materials Forum »
- ↑ Novethic (2018) Six matières premières essentielles mettent la transition énergétique en danger , 04 juillet 2018
- ↑ Usine nouvelle (2018)Les mines du futur seront sous l’océan Mines | article publié le 02/04/2018
- ↑ Voiture électrique : la question du cobalt au cœur d’un rapport européen, automobile-propre.com, 20 novembre 2018.
- ↑ Cobalt : la fin de l'euphorie sur le métal « électrique », Les Échos, 6 février 2019.
- ↑ Ian Hamel, « Le cobalt de nos téléphones portables est-il extrait par des enfants en Afrique ? », sur Le Point, (consulté le )
- ↑ Rapport : Voilà pourquoi on meurt : les atteintes aux droits humains en République démocratique du Congo alimentent le commerce mondial du cobalt
- ↑ Le temps est venu de recharger des batteries « propres » ! : rapport d'Amnesty International du 15 novembre 2017.
- ↑ Les États-Unis relancent l'extraction de cobalt après une pause de 30 ans, Les Échos, 11 octobre 2022.
- ↑ Après une flambée spectaculaire, les cours du lithium et du cobalt s'affaissent, Les Échos, 2 mars 2023.
- ↑ Face à l'envolée des cours du cobalt, le recyclage fait son chemin, Claire Fages, vendredi 16 février 2018 (Chronique des Matières Premières)
- ↑ Un nouveau procédé pour recycler les cartes électroniques, Mathilde Gaudechoux, 25/10/2017
- ↑ Recycling Rates of Metals report, UNEP, 2011, Appendix D: Review of Non-Ferrous Metal Recycling Statistics, p.31
- ↑ L’efficacité du recyclage d’un métal peut être mesurée aux 3 niveaux, fournis dans les tableaux du rapport de l'UNEP 2011 :
- EOL-RR (end of life recycling rate) : le taux de métal fonctionnel recyclé (g) par rapport à la quantité de métal introduit dans le flux de recyclage ;
- RC (recycled content) : la proportion de métal recyclé entrant dans la production de métal ;
- OSR (old scrap ratio) : la proportion de vieux déchets métalliques dans le flux de déchets métalliques introduits dans le processus de recyclage.
- ↑ carte des unités d'Umicore ; Cobalt & Specialty Materials (CSM)
- ↑ HT Yang, CM Shen, YG Wang, YK Su, TZ Yang et HJ Gao (2003), Stable cobalt nanoparticles passivated with oleic acid and triphenylphosphine, 2003-11-10
- ↑ Diane Ung (2005), thèse de doctorat intitulée Nanoparticules métalliques anisotropes synthétisées par voie chimique : fils, plaquettes et particules hybrides de cobalt-nickel, propriétés structurales et magnétiques ; fils d'argent auto-organisés, soutenue à l'université Paris-Diderot - Paris-VII (04/11/2005), sous la direction de Fernand Fiévet (résumé)
- ↑ Carine Diebold (2012), thèse de doctorat Développement de nouveaux catalyseurs au palladium supporté sur polymères ou nanoparticules de cobalt : application à la formation de liaisons carbone-carbone soutenue à l'université de Haute-Alsace - Mulhouse (12/10/2012), Claude Le Drian (dir.) (résumé)
Bibliographie
- Joseph R. Davis, Nickel, cobalt and their alloys, ASM International / Handbook Committee, 2000, 442 pages. (ISBN 9780871706850)
- Alain Foucault, Jean-François Raoult, Fabrizio Cecca, Bernard Platevoet, Dictionnaire de Géologie - 8e édition, Français/Anglais, édition Dunod, 2014, 416 pages. Avec la simple entrée "nickel" p. 237.
- Jean Meunier, "Cobalt et nickel", douzième cahier du tome 3, "Métaux" in Edmond Frémy (dir.), Encyclopédie Chimique, Dunod, Paris, 1889.
- Paul Pascal, Nouveau traité de chimie minérale, Paris, Masson, (réimpr. 1966), 32 vol.
« 18. Complexes du fer, du cobalt et du nickel ; 20.1. Alliages métalliques ; 20.2. Alliages métalliques (suite) ; 20.3 Alliages métalliques (suite) »
Voir aussi
Articles connexes
- Acide cobinique
- Bleu
- Bleu de cobalt
- Cæruleum
- Cermet
- Cobalt natif
- Cobaltocène
- Élément-trace métallique (ETM)
- Intoxication au cobalt (maladie professionnelle)
- Isotopes du cobalt
- Jaune de cobalt
- Métal
- Métaux lourds
- Métaux de transition
- Papier de dichlorure de cobalt
- Salcomine
- Toxicologie
- Turquoise (couleur)
- Vert de cobalt
Liens externes
- Ressources relatives à la santé :
- DrugBank
- (en) Medical Subject Headings
- (en) National Drug File
- (en) NCI Thesaurus
- (cs + sk) WikiSkripta
- Ressource relative aux beaux-arts :
- (en) Grove Art Online
- Notices dans des dictionnaires ou encyclopédies généralistes :
En français
- Fiche synthétique sur le site planetoscope
- Production minière par pays
- Page sur toxicologie du cobalt (relativement à son usage dans les céramiques notamment).
- (fr) Présentation sur Futura-Sciences
- (fr) Le cobalt par la SCF
- [PDF] Fiche de criticité du cobalt (11/01/2018) sur Mineralinfo, le portail français des matières premières minérales primaires et secondaires non énergétiques, co-édité par plusieurs ministères et publié par le Ministère de l'économie, de l'industrie et du numérique chargé des mines et des matières premières minérales.
- [PDF] Fiche n°128 - Cobalt et composés minéraux, INRS, 2015, incluant les classifications et étiquetages du cobalt et de ses composés minéraux, harmonisés selon les réglementations en vigueur.
En anglais
- (en) Co par la Royal Society of Chemistry
- (en) Cobalt par le laboratoire nationale US de Los Alamos
- (en) Petite initiation à la chimie aqueuse du cobalt et à ses complexes en solution
- ARC, monographie Volume 86 (2006) Cobalt in Hard Metals and Cobalt Sulfate, Gallium Arsenide, Indium Phosphide and Vanadium Pentoxide
- (en) « Technical data for Cobalt » (consulté le ), avec en sous-pages les données connues pour chaque isotope
- (en) Principaux tests de reconnaissance et d'identification de l'ion cobalt,Université indienne d'Amrita.
- (en) Mise en évidence du principe de Le Chatelier avec des complexes colorés de cobalt, en particulier l'équilibre réversible entre l'ion hexaaquacobalteux rose et de l'ion tétrachlorocobalteux bleu, d'abord en milieu solvant aqueux, puis en milieu solvant alcool 95 (Illustration des équilibres chimiques dans le cycle secondaire américain US)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux alcalins | Métaux alcalino-terreux | Lanthanides | Métaux de transition | Métaux pauvres | Métalloïdes | Non-métaux | Halogènes | Gaz nobles | Éléments non classés |
| Actinides | |||||||||
| Superactinides |