
| Règne | Animalia |
|---|---|
| Embranchement | Arthropoda |
| Sous-embr. | Crustacea |
| Classe | Malacostraca |
| Sous-classe | Eumalacostraca |
| Super-ordre | Eucarida |
| Ordre | Decapoda |
| Sous-ordre | Pleocyemata |
Les Brachyura (du grec βραχύς / brachys , « court » et οὐρά / οura, « queue »[1]) est un infra-ordre de l'ordre des crustacés décapodes (cinq paires de pattes dont la première est modifiée pour former une paire de pinces) dotés d'une carapace plutôt plate et d'un abdomen court et large placé sous le thorax. On distingue les Brachyura, les vrais crabes, des Anomura, qui comprennent plusieurs autres crustacés également appelés crabes.
Noms vernaculaires
On utilise le terme crabe comme nom vernaculaire générique pour désigner ces espèces, cependant ce terme est utilisé également pour nommer plusieurs espèces de la super-famille des Paguroidea de l'infra-ordre des Anomura à cause de leur forme similaire tels que les crabes ermites, les crabes porcelaines, les crabes royaux ou encore le crabe de cocotiers
Si plusieurs espèces ont des noms vernaculaires spécifiques qui n'utilisent pas le terme crabe comme les araignées de mer, le tourteau, le terme crabe se retrouve dans le nom de très nombreuses espèces comme crabe bleu, crabe violoniste ou crabe flèche.
La carcinologie, l'étude des crustacés, est un mot qui dérive de la famille des Cancridae.
Origine
Plus de 6 800 espèces actuelles et près de 1 800 fossiles ont été décrites à ce jour (De Grave & al., 2009), réparties sur l'ensemble de la planète. En France sont recensées 4 000 espèces de crustacés dont 400 crustacés décapodes et une centaine de crabes[2]. Les crabes colonisent une grande variété de milieux : aquatiques évidemment mais aussi continentaux, certaines espèces réalisant la quasi-totalité de leur cycle en dehors de l'eau. C'est surtout en zone tropicale que l'on trouve indifféremment des crabes marins, des crabes d'eau douce (850 espèces dont beaucoup ont une adaptation à une vie semi-terrestre[3], certaines espèces des familles de Potamonautidae ou Sesarmidae vivant dans la canopée[4]) et des crabes terrestres.
L'apparition des crabes remonte à l'ère secondaire, le plus ancien fossile de crabe connu datant du jurassique moyen, il y a environ 170 Ma.
Une étude a été menée par Wang et al (2019) [2] concernant l’évolution adaptative au niveau des gènes codants des protéines mitochondriales chez des espèces de Brachyura. Les résultats de cette étude démontrent qu'une série d'événements de sélection positive se sont produits spécifiquement sur les protéines (PCG) mitochondriales et sur les lignées ancestrales et intérieures des Bythograeidae. Cela suggère que l'évolution adaptative de ces gènes était nécessaire pour que les crabes Bythograeidae s'adaptent à l'environnement des cheminées hydrothermales.
Description
Morphologie et anatomie

.jpeg.webp)

Le corps des brachyoures a les caractéristiques principales de l'anatomie des décapodes, mais la spécificité d'être divisé en deux tagmes : le céphalothorax (fusion de la tête et du thorax) très grand, déprimé, constituant le tagme antérieur qui porte les organes sensoriels, les pièces buccales et les pattes ambulatoires ; le pléon (l'abdomen) constituant le tagme postérieur qui porte les organes reproducteurs (pléopodes modifiées en gonopodes). Une partie du succès évolutif des brachyoures peut s'expliquer par la modularité du corps segmenté, l'exosquelette et les appendices articulés[6].
Ils possèdent deux squelettes : un squelette externe (la carapace ou bouclier céphalothoracique constituée d'un plastron sternal et d'un bouclier dorsal) qui protège la totalité de leur corps, et un squelette interne qui soutient leurs organes et supporte leurs muscles. Ces deux squelettes n'ayant pas la faculté de grandir de façon continue, les brachyoures doivent donc muer pour pouvoir se développer en taille[7].
Le céphalothorax est formé de la tête (lobe préoral + 4 segments) et du péréion (du grec πέράίόω, « se transporte au-delà de, traverser ») (8 segments), l'ensemble est enveloppé d'une carapace continue formée par les pleurites du dernier segment céphalique et les tergites du péréion.
Le pléon (du grec πλέω, « naviguer, voguer » à cause de l'idée de déplacement) correspondant à l'abdomen (7 segments fusionnés en une lame où les pleurites se trouvent sur le même plan que les tergites), est réduit et rabattu sous la face inféropostérieure du céphalothorax où il se loge dans une dépression : ce rabat chez la plupart des mâles est attaché par un système de bouton-pression grâce à deux crochets qui se « pressionnent » sur deux fossettes, protégeant ainsi sa première paire de pléopodes copulateurs[8].
Les 3 premiers segments du péréion ont fusionné avec la tête ; leurs appendices articulés sont les pattes-mâchoires ou maxillipèdes associées aux pièces buccales (mandibules, maxillules, maxilles). Les appendices des 5 derniers segments du péréion sont les péréiopodes qui sont au nombre de cinq paires, dont une à trois, appelées chélipèdes, portent une griffe en forme de pince utilisée pour saisir la nourriture, se défendre et parader. Les espèces isochèles ou homochèles ont des pinces égales (« isochélie » ou « homochélie »), soit d'un côté ou de l'autre, soit toujours du même côté ; les espèces hétérochèles ont des pinces inégales (« hétérochélie » avec une pince broyeuse épaisse et courte, et une pince coupante plus allongée, la dominance d'un des chélicères pouvant se traduire par une latéralisation droite ou gauche, c'est-à-dire un côté préférentiel pour la grosse pince)[9]. La dernière paire est généralement très développée. La pince comprend plusieurs articles : merus (appelé familièrement « bras »), carpus (appelé « poignet »), propodus (propode appelé familièrement « paume » ou « main ») sur lequel s'articulent deux « doigts », un dactyle mobile et un polex fixe[10]. Les chélipèdes offrent des particularités spécifiques, non seulement dans leur ornementation (crêtes, dents, granules, épines, tubercules), mais aussi dans la forme et les proportions de la main, particularités qui correspondent à des adaptations à un mode d'alimentation. Les autres péréiopodes, appelés pattes ambulatoires, sont locomoteurs. Chez les crabes nageurs tels que l'étrille, les derniers articles de la cinquième paire de pattes sont modifiés en une « rame » et le dernier (le dactyle) est aplati en palette natatoire arrondie, ce qui leur permet de nager plutôt efficacement, si bien que certaines espèces mènent une vie à peu près exclusivement pélagique[11]. Les appendices des arthropodes sont, en principe, biramés formés d'un endopodite ventral plus puissant et d'un exopodite dorsal plus délicat, souvent foliacé et à rôle respiratoire. Ces deux branches sont portées par un segment basilaire, le protopodite qui, chez les crustacés, est subdivisé en précoxopodite, coxopodite et basipodite (portant l'exo- et l'endopodite). Chez les brachyoures, les exopodites des péréiopodes sont branchiaux et abrités dans les cavités branchiales situées dans les portions du céphalothorax[12].
Leur tête porte deux yeux composés mobiles qui peuvent se loger au repos dans deux orbites profondes de part et d'autre du rostre (deux grandes encoches orbitaires de la carapace). Leur structure particulière leur permet de reconnaître les formes, les dimensions, voire la couleur des objets[13]. Ils sont généralement au bout de pédoncules oculaires (tiges coniques plus ou moins effilées, articulées au céphalon, souvent rétractiles), ce qui leur donne un large champ visuel (en moyenne 180°, mais 360° chez les crabe-fantômes)[14].
L'estomac, souvent subdivisé en deux parties appelées estomac cardiaque et estomac pylorique, est prolongé par l'intestin moyen et accompagné d'un important hépatopancréas, glande qui synthétise les principales enzymes digestives. L'estomac cardiaque comporte un appareil masticateur (moulin gastrique) formé de pièces chitineuses épaissies très mobiles[15].
Leur carapace peut être garnie d'épines dorsales et latérales (par exemple épine supraorbitaire ou épistomienne), de spinules, tubercules, crêtes et carènes qui participent à l'endosquelette servant à l'insertion des muscles et sont des éléments de diagnose[16].
La plus petite espèce décrite à ce jour est le Nannotheres moorei (taille d'1,5 mm) de la famille des Pinnotheridae[17], la plus grande est le crabe-araignée géant du Japon qui peut atteindre jusqu'à 3,5 m d'envergure, pattes étendues, dont 37 cm pour le corps, et un poids d'environ 20 kg, ce qui en fait le plus grand arthropode vivant[18].
L'évolution morphologique vers une forme de crabe est un processus évolutif chez les crustacés, appelé carcinisation ou brachyourisation. Il correspond à l'acquisition d'une carapace entièrement calcifiée[19], d'un plastron sternal résultant de la fusion des sternites au niveau ventral, d'une réduction du pléon (l'abdomen) atrophique replié sous le céphalothorax, et l'acquisition de la brachygnathie (en) (cadre buccal large et limité en avant)[20].
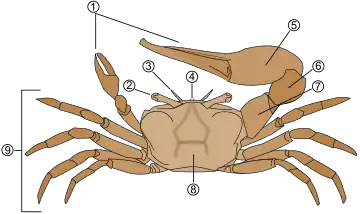 Représentation schématique de l'anatomie d'un crabe.
Représentation schématique de l'anatomie d'un crabe.
1. Pince des chélipèdes 2. Pédoncules oculaires et yeux 3. Antennes et antennules 4. Rostre 5. Propodus 6. Carpus 7. Merus 8. Carapace 9. Pattes ambulatoires.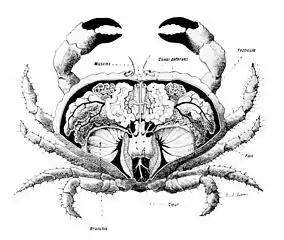
Anatomie d'un crabe .
Comportement alimentaire

La majorité des espèces de brachyoures sont prédatrices et/ou nécrophages. Il existe également chez ce crustacé opportuniste des espèces herbivores, omnivores et détritivores (filtreurs de planctons, algues sur rochers, etc.). Chez les macrophages, la nourriture est prélevée à l’aide des chélipèdes qui la transfèrent à la 3e paire de maxillipèdes ; les maxillipèdes poussent la nourriture plus loin vers les mandibules et les maxilles qui la déchiquètent avant l’ingestion. Chez les microphages, le prélèvement alimentaire se fait par filtration. Celle-ci peut être assurée par les peignes de soies situés au niveau de certains appendices, par exemple au niveau des maxillipèdes dans le cas des Pinnotheridae. Les particules filtrées sont ensuite rabattues vers la bouche. La filtration est soit active (pièces buccales), due aux battements de l’un de ses appendices (scaphognathite), ou passive, utilisant un courant d’eau naturel ou généré par l’hôte si le crabe est symbiotique. En fonction du comportement alimentaire des crabes, les chélipèdes peuvent présenter des morphologies variables. Ainsi, les crabes se nourrissant d’algues encroûtantes présentent des pinces en forme de cuillère pour gratter et récolter la nourriture. Les crabes carnivores/nécrophages, comme Cancer pagurus (Linnaeus, 1758), qui se nourrit de coquillages, ont des pinces à mors émoussés, rappelant la face broyeuse des molaires, adaptées au broyage des coquilles. D’autres présentent des pinces à mors tranchants, en lame, permettant la découpe de chair.
Des cas de cannibalisme sont répertoriés : certains mâles mangent la femelle molle qui vient de muer (cette mue est à l'origine de l'émission d'une phéromone qui déclenche l'accouplement), le crabe-violoniste Uca tangeri (en) mange ses enfants lorsqu'il ne trouve plus de ressources sur terre[21].
Les crabes ont de nombreux prédateurs : mérous, rascasse, murènes, pieuvres, crocodiles, oiseaux, ratons, iguanes, ocelots, singes[22].
Une centaine d'espèces de Xanthidae ingèrent des Dinoflagellés lorsqu'ils s'alimentent, ce qui les rend toxiques[23].
Reproduction et cycle vital
_Figure_1.jpg.webp)
(B) Le mâle (m) est couché sur la femelle (f) renversée, les deux restant en position d'accouplement entre quelques minutes et plusieurs heures[24].

La plupart des brachyoures sont gonochoriques, seules quelques rares espèces sont hermaphrodites.
L'accouplement est précédé par une série de préliminaires et de parades encore mal connues. Lors de la promenade nuptiale, le mâle porte la femelle entre ses pattes de devant en attendant que cette dernière mue (mue de puberté) et soit féconde[25].
Chez de nombreuses espèces de crabes, la copulation, n’est possible qu’après la mue de la femelle. Lors de l'accouplement ventre à ventre (la femelle se renverse sur le dos, tandis que le mâle la couvre), ce dernier introduit ses deux stylets copulateurs (correspondant au pléopode de la première paire, modifié en un organe copulateur cylindrique, à l'intérieur duquel le pléopode de la deuxième paire coulisse comme un piston) dans les orifices génitaux de la femelle (vulves qui s'ouvrent sur le sternum thoracique au niveau de la troisième paire de pattes) et y injecte ses spermatophores contenant les spermatozoïdes. Lors de cette fertilisation interne, le sperme est amené dans le réceptacle séminal, qui correspond à une dilatation de l'oviducte. La fécondation externe donne des œufs qui, au moment de la ponte (frai), s'enveloppent d'un produit blanc et visqueux, durcissant à l'eau, qui les fixe aux cinq paires de pléopodes femelles, et qui est sécrété par des glandes cémentaires. Les œufs fécondés restent ainsi collés (et accrochés en grappes aux soies de l'endopodite des pléopodes) à l'abdomen de la femelle qui est dite « ovigère » (qui signifie "porteuse d'œuf) ou « grainée ». L’abdomen est alors « décollé » du céphalothorax et fournit un espace de protection pour la ponte[26].
« Le nombre des œufs pondus en une seule fois dépend de la taille de la mère mais il est toujours impressionnant. 200 000 environ d’un diamètre de 0,3 mm pour Carcinus maenas, 920 000 pour Eriocheir sinensis, 2 à 3 millions pour Calinecles sapidus. Le nombre baisse de manière frappante dans les espèces d’eau douce mais corrélativement leur taille augmente. Polamon edule par exemple ne porte que 200 à 350 œufs d’un beau orangé, mais leur diamètre atteint 2 mm »[27].
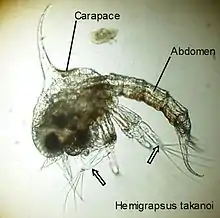
Les œufs sont couvés pendant un temps qui varie selon les espèces (généralement plusieurs mois), puis éclosent au stade protozoé ou zoé (biologie) ; il y a un nombre variable de stades zoés selon les espèces. Après le dernier stade zoé, le crabe passe par un dernier stade larvaire, lui aussi pélagique, la mégalope; sa morphologie est intermédiaire entre la forme zoé et la forme crabe. Après un certain laps de temps, cette larve migre vers le substrat où elle effectue sa dernière mue larvaire qui la conduit au stade 1er crabe. La durée de la vie larvaire est très variable ; par exemple elle est de 65 ± 11 jours en moyenne chez les crabes Cancridae et de 29 ± 16 pour les Ocypodidae. Cependant, il existe des durées de développement larvaire beaucoup plus longues, de 4 - 12 mois chez Cancer magister, ou beaucoup plus courtes comme chez Tunicotheres moseri où le développement ne dure qu’entre 3 et 7 jours. Enfin, le développement direct, où l’individu sortant de l’œuf ressemble à un adulte en miniature, est rare. Ce cas se rencontre, par exemple, chez des crabes de la famille des Xanthidae : Pilumnus lumpinus, P. novaezelandiae, P. vestitus.
Un crabe « mou » (le crabe en mue est un mets que l'homme juge très raffiné) est un crabe qui fait sa mue et dévagine sa carapace, devenue trop petite, ce qui le rend non seulement vulnérable, mais lui enlève toute possibilité de défense. Pendant les quelques jours qu'il lui faut pour que sa nouvelle carapace durcisse, il se réfugie à la limite des eaux de marée moyenne et se cache sous les rochers, les algues, s'ensable ou même retourne dans son exuvie. Après la mue, il lui arrive de manger son exuvie pour restaurer ses réserves calciques[28].
Taxonomie et systématique
Les Brachyura sont un infra-ordre de décapodes, créé par Carl von Linné en 1758. Ce terme a été créé à partir des racines grecques brachy qui signifie court et ura qui signifie queue, allusion à leur abdomen réduit[29]. Ceci les distingues des autres sous-ordres de Pleocyemata. On dénombre plus de 3 500 espèces vivants qui se répartissent en trois groupes : familles à carapace plus large que longue (tourteaux, étrilles), celles à carapace quadrangulaire (Grapsidae, Ocypodidae) et celles à carapace triangulaire (araignées de mer)[14].
Synonymie


- Brachyura Kuhl & van Hasselt, 1822 est synonyme de Brachyorrhos Kuhl, 1826
Liste des super-familles


|
Selon World Register of Marine Species (16 février 2016)[31] :
|
Classification selon Ng, Guinot, & Davie, 2008 :
|
Classification selon De Grave & al., 2009 :
|
Selon World Register of Marine Species (16 février 2016)[31] :
- Section Eubrachyura
- Subsection Heterotremata -- Crabes
- super-famille Aethroidea Dana, 1851
- famille Aethridae Dana, 1851
- super-famille Bythograeoidea Williams, 1980
- famille Bythograeidae Williams, 1980
- super-famille Calappoidea De Haan, 1833 (crabes honteux)
- famille Calappidae De Haan, 1833
- famille Hepatidae Stimpson, 1871
- famille Matutidae De Haan, 1835
- super-famille Cancroidea Latreille, 1802
- famille Atelecyclidae Ortmann, 1893
- famille Cancridae Latreille, 1802
- super-famille Carpilioidea Ortmann, 1893
- famille Carpiliidae Ortmann, 1893
- super-famille Cheiragonoidea Ortmann, 1893
- famille Cheiragonidae Ortmann, 1893
- super-famille Corystoidea Samouelle, 1819
- famille Corystidae Samouelle, 1819
- super-famille Dairoidea Serène, 1965
- famille Dacryopilumnidae Serène, 1984
- famille Dairidae Ng & Rodríguez, 1986
- super-famille Dorippoidea MacLeay, 1838
- famille Dorippidae MacLeay, 1838
- famille Ethusidae Guinot, 1977
- super-famille Eriphioidea MacLeay, 1838
- famille Dairoididae Števčić, 2005
- famille Eriphiidae MacLeay, 1838
- famille Hypothalassiidae Karasawa & Schweitzer, 2006
- famille Menippidae Ortmann, 1893
- famille Oziidae Dana, 1851
- famille Platyxanthidae Guinot, 1977
- super-famille Gecarcinucoidea Rathbun, 1904
- famille Gecarcinucidae Rathbun, 1904
- super-famille Goneplacoidea MacLeay, 1838
- famille Acidopsidae Števčić, 2005
- famille Acidopsidae Števčić, in Martin & Davis, 2001
- famille Carcinoplacidae (famille actuellement vide)
- famille Chasmocarcinidae Serène, 1964
- famille Conleyidae Števčić, 2005
- famille Euryplacidae Stimpson, 1871
- famille Goneplacidae MacLeay, 1838
- famille Litocheiridae Kinahan, 1856
- famille Mathildellidae Karasawa & Kato, 2003
- famille Progeryonidae Števčić, 2005
- famille Scalopidiidae Števčić, 2005
- famille Sotoplacidae Castro, Guinot & Ng, 2010
- famille Vultocinidae Ng & Manuel-Santos, 2007
- super-famille Hexapodoidea Miers, 1886
- famille Hexapodidae Miers, 1886
- super-famille Hymenosomatoidea MacLeay, 1838
- famille Hymenosomatidae MacLeay, 1838
- super-famille Leucosioidea Samouelle, 1819
- famille Iphiculidae Alcock, 1896
- famille Leucosiidae Samouelle, 1819
- super-famille Majoidea Samouelle, 1819 – araignées de mer
- famille Epialtidae MacLeay, 1838
- famille Hymenosomatidae MacLeay, 1838
- famille Inachidae MacLeay, 1838
- famille Inachoididae Dana, 1851
- famille Majidae Samouelle, 1819
- famille Mithracidae Balss, 1929
- famille Oregoniidae Garth, 1958
- famille Pisidae Dana, 1851
- super-famille Orithyioidea Dana, 1852
- famille Orithyiidae Dana, 1852
- super-famille Palicoidea Bouvier, 1898
- famille Crossotonotidae Moosa & Serène, 1981
- famille Palicidae Bouvier, 1898
- super-famille Parthenopoidea MacLeay, 1838
- famille Parthenopidae Macleay, 1838
- super-famille Pilumnoidea Samouelle, 1819
- famille Galenidae Alcock, 1898
- famille Pilumnidae Samouelle, 1819
- famille Tanaochelidae Ng & Clark, 2000
- super-famille Portunoidea Rafinesque, 1815
- famille Carcinidae MacLeay, 1838
- famille Geryonidae Colosi, 1923
- famille Pirimelidae Alcock, 1899
- famille Polybiidae Ortmann, 1893
- famille Portunidae Rafinesque, 1815
- famille Thiidae Dana, 1852
- super-famille Potamoidea Ortmann, 1896
- famille Deckeniidae Ortmann, 1897
- famille Potamidae Ortmann, 1896
- famille Potamonautidae Bott, 1970
- super-famille Pseudothelphusoidea Ortmann, 1893
- famille Pseudothelphusidae Ortmann, 1893
- super-famille Pseudozioidea Alcock, 1898
- famille Christmaplacidae Naruse & Ng, 2014
- famille Pilumnoididae Guinot & Macpherson, 1987
- famille Planopilumnidae Serène, 1984
- famille Pseudoziidae Alcock, 1898
- super-famille Retroplumoidea Gill, 1894
- famille Retroplumidae Gill, 1894
- super-famille Trapezioidea Miers, 1886
- famille Domeciidae Ortmann, 1893
- famille Tetraliidae Castro, Ng & Ahyong, 2004
- famille Trapeziidae Miers, 1886
- super-famille Trichodactyloidea H. Milne Edwards, 1853
- famille Trichodactylidae Milne Edwards, 1853
- super-famille Trichopeltarioidea Tavares & Cleva, 2010
- famille Trichopeltariidae Tavares & Cleva, 2010
- super-famille Xanthoidea MacLeay, 1838
- famille Linnaeoxanthidae Števčić, 2005
- famille Melybiidae Števčić, in Martin & Davis, 2001
- famille Panopeidae Ortmann, 1893
- famille Pseudorhombilidae Alcock, 1900
- famille Speocarcinidae Števčić, in Martin & Davis, 2001
- famille Xanthidae MacLeay, 1838
- super-famille Aethroidea Dana, 1851
- Subsection Raninoida (vide)
- Subsection Thoracotremata -- Crabes terrestres
- super-famille Cryptochiroidea Paul'son, 1875
- famille Cryptochiridae Paulson, 1875
- super-famille Grapsoidea MacLeay, 1838
- famille Gecarcinidae MacLeay, 1838
- famille Glyptograpsidae Schubart, Cuesta & Felder, 2002
- famille Grapsidae MacLeay, 1838
- famille Percnidae Števcic, 2005
- famille Plagusiidae Dana, 1851
- famille Sesarmidae Dana, 1851
- famille Varunidae H. Milne Edwards, 1853
- famille Xenograpsidae Ng, Davie, Schubart & Ng, 2007
- super-famille Ocypodoidea Rafinesque, 1815
- famille Camptandriidae Stimpson, 1858
- famille Dotillidae Stimpson, 1858
- famille Heloeciidae H. Milne Edwards, 1852
- famille Macrophthalmidae Dana, 1851
- famille Mictyridae Dana, 1851
- famille Ocypodidae Rafinesque, 1815
- famille Ucididae Števčić, 2005
- famille Xenophthalmidae Stimpson, 1858
- super-famille Pinnotheroidea De Haan, 1833
- famille Aphanodactylidae Ahyong & Ng, 2009
- famille Pinnotheridae De Haan, 1833
- super-famille Cryptochiroidea Paul'son, 1875
- Subsection Heterotremata -- Crabes
- Section Podotremata -- Crabes irréguliers
- super-famille Cyclodorippoidea Ortmann, 1892
- famille Cyclodorippidae Ortmann, 1892
- famille Cymonomidae Bouvier, 1898
- famille Phyllotymolinidae Tavares, 1998
- super-famille Dromioidea De Haan, 1833
- famille Dromiidae De Haan, 1833
- famille Dynomenidae Ortmann, 1892
- super-famille Homolodromioidea Alcock, 1899
- famille Homolodromiidae Alcock, 1900
- super-famille Homoloidea De Haan, 1839
- famille Homolidae De Haan, 1839
- famille Latreilliidae Stimpson, 1858
- famille Poupiniidae Guinot, 1991
- super-famille Raninoidea De Haan, 1839
- famille Lyreididae Guinot, 1993
- famille Raninidae De Haan, 1839
- super-famille Cyclodorippoidea Ortmann, 1892
Il n'y a pas de consensus sur les relations des super-familles et familles. Le cladogramme proposé ci-dessous est issu de l'analyse de Tsang et al, 2014[32] :
| Brachyura |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Galerie
 Hepatus epheliticus (Aethridae)
Hepatus epheliticus (Aethridae).jpg.webp) Gandalfus yunohana (Bythograeidae)
Gandalfus yunohana (Bythograeidae) Calappa calappa (Calappidae)
Calappa calappa (Calappidae) Matuta victor (Matutidae)
Matuta victor (Matutidae) Atelecyclus rotundatus (Atelecyclidae)
Atelecyclus rotundatus (Atelecyclidae) Cancer pagurus (Cancridae)
Cancer pagurus (Cancridae) Carpilius convexus (Carpiliidae)
Carpilius convexus (Carpiliidae)_(15257759149).jpg.webp) Erimacrus isenbeckii (Cheiragonidae)
Erimacrus isenbeckii (Cheiragonidae) Corystes cassivelaunus (Corystidae)
Corystes cassivelaunus (Corystidae) Daira perlata (Dairidae)
Daira perlata (Dairidae) Dorippe sinica (Dorippidae)
Dorippe sinica (Dorippidae) Eriphia sebana (Eriphiidae)
Eriphia sebana (Eriphiidae) Hypothalassia armata (Hypothalassiidae)
Hypothalassia armata (Hypothalassiidae) Menippe mercenaria (Menippidae)
Menippe mercenaria (Menippidae) Ozius truncatus (Oziidae)
Ozius truncatus (Oziidae) Platyxanthus crenulatus (Platyxanthidae)
Platyxanthus crenulatus (Platyxanthidae) Parathelphusa convexa (Gecarcinucidae)
Parathelphusa convexa (Gecarcinucidae) Eucrate crenata (Euryplacidae)
Eucrate crenata (Euryplacidae) Goneplax rhomboides (Goneplacidae)
Goneplax rhomboides (Goneplacidae) Beuroisia major (Mathildellidae)
Beuroisia major (Mathildellidae).jpg.webp) Leucosia anatum (Leucosiidae)
Leucosia anatum (Leucosiidae) Hoplophrys oatesi (Epialtidae)
Hoplophrys oatesi (Epialtidae).jpg.webp) Limnopilos naiyanetri (Hymenosomatidae)
Limnopilos naiyanetri (Hymenosomatidae) Macrocheira kaempferi (Inachidae)
Macrocheira kaempferi (Inachidae) Pyromaia cuspidata (Inachoididae)
Pyromaia cuspidata (Inachoididae) Maja squinado (Majidae)
Maja squinado (Majidae) Hyas coarctatus (Oregoniidae)
Hyas coarctatus (Oregoniidae) Parthenope sinensis (Parthenopidae)
Parthenope sinensis (Parthenopidae) Pilumnus hirtellus (Pilumnidae)
Pilumnus hirtellus (Pilumnidae) Geryon longipes (Geryonidae)
Geryon longipes (Geryonidae) Pirimela denticulata (Pirimelidae)
Pirimela denticulata (Pirimelidae) Liocarcinus holsatus (Polybiidae)
Liocarcinus holsatus (Polybiidae) Callinectes sapidus (Portunidae)
Callinectes sapidus (Portunidae) Thia scutellata (Thiidae)
Thia scutellata (Thiidae) Potamon fluviatile (Potamidae)
Potamon fluviatile (Potamidae) Potamonautes sidneyi (Potamonautidae)
Potamonautes sidneyi (Potamonautidae) Guinotia dentata (Pseudothelphusidae)
Guinotia dentata (Pseudothelphusidae) Pilumnoides rubus (Pilumnoididae)
Pilumnoides rubus (Pilumnoididae) Trapezia flavopunctata (Trapeziidae)
Trapezia flavopunctata (Trapeziidae) Goyazana Rotundicauda (Trichodactylidae)
Goyazana Rotundicauda (Trichodactylidae) Lophopanopeus bellus (Panopeidae)
Lophopanopeus bellus (Panopeidae) Etisus splendidus (Xanthidae)
Etisus splendidus (Xanthidae) Gecarcinus lateralis (Gecarcinidae)
Gecarcinus lateralis (Gecarcinidae)%252C_Cerro_Brujo%252C_isla_de_San_Crist%C3%B3bal%252C_islas_Gal%C3%A1pagos%252C_Ecuador%252C_2015-07-24%252C_DD_149.JPG.webp) Grapsus grapsus (Grapsidae)
Grapsus grapsus (Grapsidae) Percnon gibbesi (Percnidae)
Percnon gibbesi (Percnidae).jpg.webp) Euchirograpsus americanus (Plagusiidae)
Euchirograpsus americanus (Plagusiidae) Perisesarma bidens (Sesarmidae)
Perisesarma bidens (Sesarmidae) Hemigrapsus nudus (Varunidae)
Hemigrapsus nudus (Varunidae) Xenograpsus testudinatus (Xenograpsidae)
Xenograpsus testudinatus (Xenograpsidae) Scopimera globosa (Dotillidae)
Scopimera globosa (Dotillidae) Heloecius cordiformis (Heloeciidae)
Heloecius cordiformis (Heloeciidae) Macrophthalmus japonicus (Macrophthalmidae)
Macrophthalmus japonicus (Macrophthalmidae) Mictyris longicarpus (Mictyridae)
Mictyris longicarpus (Mictyridae) Uca leptodactyla (Ocypodidae)
Uca leptodactyla (Ocypodidae) Ucides cordatus (Ucididae)
Ucides cordatus (Ucididae) Pinnotheres pisum (Pinnotheridae)
Pinnotheres pisum (Pinnotheridae)%252C_800_metres_de_profondeur.jpeg.webp) Cymonomus granulatus (Cymonomidae)
Cymonomus granulatus (Cymonomidae) Pseudodromia latens (Dromiidae)
Pseudodromia latens (Dromiidae).JPG.webp) Hirsutodynomene spinosa (Dynomenidae)
Hirsutodynomene spinosa (Dynomenidae)%252C_peche_a_1%252C190_metres%252C_dans_le_golfe_de_Gascogne.jpeg.webp) Dicranodromia Mahyeuxi (Homolodromiidae)
Dicranodromia Mahyeuxi (Homolodromiidae) Paromola cuvieri (Homolidae)
Paromola cuvieri (Homolidae) Eplumula phalangium (Latreilliidae)
Eplumula phalangium (Latreilliidae) Ranina ranina (Raninidae)
Ranina ranina (Raninidae)
 Crabes bleus
Crabes bleus Vente de crabes bleus
Vente de crabes bleus Callinectes sapidus (Crabes bleus sur le marché du Pirée)
Callinectes sapidus (Crabes bleus sur le marché du Pirée) Tourteau (dessus)
Tourteau (dessus) Tourteau (dessous)
Tourteau (dessous) Tourteau (de face)
Tourteau (de face) Macrocheira kaempferi, Crabes-araignées géants à l'aquarium Kaiyukan
Macrocheira kaempferi, Crabes-araignées géants à l'aquarium Kaiyukan Crabe fantôme des Seychelles
Crabe fantôme des Seychelles Carcinus maenas, Crabe vert
Carcinus maenas, Crabe vert Cardisoma guanhumi
Cardisoma guanhumi Liocarcinus depurator, Étrille à pattes bleues
Liocarcinus depurator, Étrille à pattes bleues Liocarcinus holsatus, Crabe nageur
Liocarcinus holsatus, Crabe nageur Liocarcinus marmoreus, Portune marbré
Liocarcinus marmoreus, Portune marbré Liocarcinus pusillus, petit Portune
Liocarcinus pusillus, petit Portune Liocarcinus vernalis, Étrille lisse
Liocarcinus vernalis, Étrille lisse Necora puber
Necora puber Ocypode quadrata, Crabe fantôme atlantique
Ocypode quadrata, Crabe fantôme atlantique Portumnus latipes, Étrille élégante
Portumnus latipes, Étrille élégante Hemigrapsus takanoi
Hemigrapsus takanoi Crabe rouge d'Hawaii
Crabe rouge d'Hawaii Accouplement ventre à ventre
Accouplement ventre à ventre Carcinus maenas, Crabe vert
Carcinus maenas, Crabe vert Crabe-éponge dévorant un oursin
Crabe-éponge dévorant un oursin Crabe de Wellington
Crabe de Wellington Cardisoma armatum
Cardisoma armatum
Références taxinomiques
- (en) Référence World Register of Marine Species : Brachyura Linnaeus, 1758 (+ liste familles + liste genres)
- (en) Référence Paleobiology Database : Brachyura Latreille 1802
- (fr+en) Référence ITIS : Brachyura Latreille, 1802
- (en) Référence Tree of Life Web Project : Brachyura
- (en) Référence Animal Diversity Web : Brachyura
- (en) Référence Fauna Europaea : Brachyura (consulté le )
- (en) Référence NCBI : Brachyura (taxons inclus)
Sources
- Ng, Guinot, & Davie, 2008 : Systema Brachyurorum: Part 1. An Annotated checklist of extant Brachyuran crabs of the world. Raffles Bulletin of Zoology, vol. 17, p. 1-286 (texte original)
- De Grave & al., 2009 : A classification of living and fossil genera of decapod crustaceans. Raffles Bulletin of Zoology, 2009, vol. 21, p. 1-109 (texte original)
- [2] Wang, Z., Tang, D., Shi, X., Guo, H., Chen, X., Zhang, D., & Tang, B. (2019). Genetic basis of hydrothermal vent adaptation in bythograeidae crabs: Insights from adaptive evolution of mitochondrial protein coding genes. Pakistan Journal of Zoology, 51(5), 1721. https://doi.org/10.17582/journal.pjz/2019.51.5.1721.1731
Notes et références
- ↑ Adrien Bauchau, La Vie des crabes, P. Lechevalier, , p. 6.
- ↑ Marc Giraud, Calme plat chez les soles, Robert Laffont, , p. 55
- ↑ (en) Richard von Sternberg & Neil Cumberlidge, « On the heterotreme-thoracotreme distinction in the Eubrachyura De Saint Laurent », Crustaceana, vol. 74, no 4, , p. 321–338 (DOI 10.1163/156854001300104417)
- ↑ (en) « Tree-climbing crabs (Potamonautidae and Sesarmidae) from phytotelmic microhabitats in rainforest canopy in Madagascar », Journal of Crustacean Biology, vol. 25, no 2, , p. 302-308
- ↑ Ces appendices sont des paires de pléopodes qui portent les œufs entre le céphalothorax et l'abdomen. Certains genres de crabes développent une cavité sterno-abdominale qui peut former une chambre incubatrice écartée de la carapace.
- ↑ Peter Hamilton Raven, George Brooks Johnson, Kenneth A. Mason, Susan R. Singer, Jonathan B. Losos, Biologie, , p. 681-691.
- ↑ Catherine Vadon, « Le crabe mue-t-il au cours de sa vie ? », sur Futura sciences,
- ↑ Maurice Caullery, Organisme et Sexualité, Doin, , p. 184
- ↑ (de) Hans Przibram, « Die Heterochelie bei decapoden Crustaceen (zugleich: Experimentelle Studien Über Regeneration. Dritte Mitteilung », Archiv für Entwicklungsmechanik der Organismen, vol. 19, , p. 181–247 (DOI 10.1007/BF02162149).
- ↑ Pierre-Paul Grassé, Andrée Tétry, Zoologie. Les Arthropodes, Gallimard, , p. 269.
- ↑ Lucia Falciai, Roberto Minervini, Paolo Bernucci, Cécile Maddalena-Feller, Guide des homards, crabes, langoustes, crevettes et autres crustacés décapodes d'Europe, Delachaux et Niestlé, , p. 18.
- ↑ Adrien Bauchau, La Vie des crabes, anatomie, physiologie, développement croissance, systématique, écologie, comportement, P. Lechevalier, , p. 6
- ↑ Lucia Falciai, Roberto Minervini, Paolo Bernucci, Cécile Maddalena-Feller, Guide des homards, crabes, langoustes, crevettes et autres crustacés décapodes d'Europe, Delachaux et Niestlé, , p. 23
- 1 2 François Ramade, Dictionnaire encyclopédique des sciences de la nature et de la biodiversité, Dunod, (lire en ligne), p. 80
- ↑ (en) D.R. Khanna, Biology of Arthropoda, Discovery Publishing House, , p. 6
- ↑ Gérard Houdou, Pêche à pied en bord de mer, Editions Artemis, , p. 191-193
- ↑ (en) R.B. Manning, D.L. Felder, « Nannotheres moorei, a new genus and species of minute pinnotherid crab from Belize, Carribean Sea », Proceedings of the Biological Society of Washington, no 109, , p. 311–317
- ↑ (en) Peter K. L. Ng, Danièle Guinot & Peter J. F. Davie, « Systema Brachyurorum: Part I. An annotated checklist of extant Brachyuran crabs of the world », Raffles Bulletin of Zoology, vol. 17, , p. 1–286 (lire en ligne [PDF])
- ↑ Chitine calcifiée par des sels de calcium et de magnésium puisés dans l'eau.
- ↑ (en) Gary Poore, Shane Ahyong et Joanne Taylor, The Biology of Squat Lobsters, Csiro Publishing, , p. 78
- ↑ Frédéric Lewino, Tuez-vous les uns les autres : La vie et la mort chez nos amies les bêtes, Grasset, , 378 p.
- ↑ Coûts de gestion des pêcheries, OECD Publishing, , p. 147
- ↑ Raoul Serène et Alain Crosnier, Xanthoidea, Xanthidae et Trapeziidae, IRD Editions, , p. 23
- ↑ (en) Elene Mente, Reproductive Biology of Crustaceans. Case Studies of Decapod Crustaceans, CRC Press, , p. 230-235.
- ↑ M. Duteurtre, « La promenade nuptiale chez les Crabes », Bulletin de la Société d'Océanographique de France, no 9, , p. 841-843
- ↑ André Fontana, Milieu marin et ressources halieutiques de la République populaire du Congo, IRD Editions, , p. 271
- ↑ « Les crabes », sur blog.cpi-plongee.fr (consulté le ).
- ↑ Jean Arrachart, Pêches faciles en mer, Editions Artemis, , p. 33
- ↑ Roger Husson, Glossaire de biologie animale, Gauthier-Villars, , p. 44
- ↑ (en) Hultgren, Kristin & Jay Stachowicz, « Camouflage in decorator crabs : integrating ecological, behavioural and evolutionary approaches », In Martin Stevens & Sami Merilaita. Animal Camouflage. Cambridge University Press, p. 215, 2011, (ISBN 978-0-521-19911-7)
- 1 2 World Register of Marine Species, consulté le 16 février 2016
- ↑ Ling Ming Tsang, Christoph D. Schubart, Shane T. Ahyong, Joelle C.Y. Lai, Eugene Y.C. Au, Tin-Yam Chan, Peter K.L. Ng et Ka Hou Chu, « Evolutionary History of True Crabs (Crustacea: Decapoda: Brachyura) and the Origin of Freshwater Crabs », Oxford University Press , vol. 31, no 5, , p. 1173–1187 (PMID 24520090, DOI 10.1093/molbev/msu068
 )
)