| Chitine | |
| |
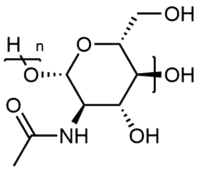
| Motif de chitine. | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.014.313 |
| No CE | 215-744-3 |
| SMILES | |
| Propriétés chimiques | |
| Formule | (C8H13NO5)n |
| Masse molaire[1] | 203,192 5 ± 0,009 g/mol C 47,29 %, H 6,45 %, N 6,89 %, O 39,37 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
La chitine (prononciation : /ki.tin/) est une molécule de la famille des glucides et de formule (C8H13NO5)n. La chitine est un polysaccharide azoté issu de la polymérisation de N-acétylglucosamine, avec formation de liaisons osidiques du type β-1,4.
La chitinisation est la formation de chitine.
La chitine est le principal composant structurel de soutien des parois cellulaires des champignons, des exosquelettes d'arthropodes comme ceux des crustacés et des insectes, ou encore des becs de céphalopodes. La chitine est le polysaccharide aminé naturel le plus abondant. Sa production annuelle est comparable à celle de la cellulose. Avec une bonne biocompatibilité, biodégradabilité, non toxicité, activité antimicrobienne et faible immunogénicité, la chitine est un matériau de grande valeur pour les applications biomédicales[2].
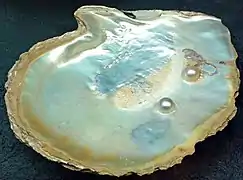
La chitine est un matériau résistant et souple (ou dur lorsqu'elle est associée à du carbonate de calcium). Elle est synthétisée par des glandes spéciales (glandes à chitines) de nombreuses espèces animales ou fongiques. Elle joue un rôle structural essentiel chez plusieurs taxons d'eucaryotes, notamment les champignons macroscopiques et levures[3], chez les mycorhizes[4] et les lichens[5] et chez les arthropodes. À ce titre, elle est considérée comme une des synapomorphies du groupe des Opisthochontes. Elle constitue notamment les cuticules externes des insectes[6] et les carapaces des crustacés, ou encore dans la coquille de céphalopodes (Nautile par exemple) et de nombreux mollusques (c'est aussi un des composants de la nacre[7]) et des pseudonacres qui constituent l'intérieur de certaines coquilles et les perles des huîtres perlières ou de la moule perlière d'eau douce[7]. Chez les bivalves, elle est cependant présente en proportion très variable selon l'espèce[7]. On la trouve aussi chez de nombreux micro-organismes, par exemple dans la cuticule qui protège les œufs de rotifères[8].

.jpg.webp)

.jpg.webp)
Étymologie
La chitine a été découverte par le chimiste français Henri Braconnot (1780-1855), en 1811[9],[10]. Chitine vient du mot grec χιτών signifiant « tunique », par analogie entre la coquille des arthropodes et le vêtement. Le terme a été inventé par le chimiste français Auguste Odier[11].
Biochimie
La chitine est blanche, souple, perméable à l'air et à l'eau. Ce n'est donc pas elle qui rend dure ni imperméable la cuticule des arthropodes, ni lui donne sa couleur.
Historiquement, les scientifiques ont d'abord remarqué la présence de « substances amylacées »[12] chez certains animaux puis ils ont constaté que la chitine semblait remplacer la cellulose (des végétaux) chez les champignons.
La cellulose peut être chimiquement découpée en molécules de glucose et par des réactifs, et avec presque les mêmes réactifs, la chitine peut être découpée en molécules de glucosamines. C’est effectivement le même type de liaison que celui qui relie les groupes de glucoses dans la molécule de cellulose.
Certains biologistes, dans les années 1930, en ont déduit qu'il devait exister une sorte de parallélisme physico-chimique entre ces deux molécules[13], voire pour leurs rôles fonctionnel dans les organismes.
Biosynthèse et rôle biologique
La chitine est très commune dans le monde animal[14]. C'est l'un des constituants de la cuticule des insectes, des araignées et des crustacés, elle a ainsi un rôle protecteur. Associée à du carbonate de calcium, elle devient rigide et forme alors l'exosquelette des Crustacés.
La chitine retrouvée dans la cuticule des Arthropodes est la chitine alpha dans laquelle les chaînes de chitine sont reliées de manière antiparallèle par des liaisons hydrogène. Chez les Brachiopodes, les Céphalopodes et les Annélides, on retrouve de la chitine bêta dans laquelle les chaînes de chitine sont cette fois reliées de manière parallèle par les liaisons hydrogène. La chitine gamma est plus rare, on la retrouve chez les Brachiopodes.
Chez les champignons, la chitine est un constituant essentiel de la paroi latérale qui entoure et protège les cellules fongiques vis-à-vis de l'environnement. La chitine participerait notamment à la rigidité de la paroi fongique. Le polymère de chitine d'origine biologique est synthétisé avec la participation d'un enzyme dit « chitine synthase » (CHS), lequel peut être utilisé comme marqueur biologique de la biomasse fongique[15]. Chez la levure du boulanger (Saccharomyces cerevisiae), plusieurs activités CHS synthétisent de la chitine à des localisations intracellulaires différentes et à des étapes particulières du bourgeonnement de ce champignon unicellulaire.
La chitine est synthétisée par divers animaux unicellulaires ou métazoaires, surtout dans les groupes zoologiques de la lignée des Cœlomates Spiralia et principalement en milieu marin[16]. Les crustacés marins semblent en être la première source.
Productivité marine : dans les années 1980, des scientifiques ont cherché à estimer et comparer la quantité de chitine produite par le plancton de la baie de Calvi[17], en Corse, le krill de l'arctique et de l'antarctique, une population de langoustes des côtes de l'Afrique du Sud, et « les communautés benthiques infralittorales à algues photophiles des côtes rocheuses de la Corse »[16] ; curieusement pour chacune de ces situations écologiquement et géographiquement très différentes, la quantité a été estimée à peu près identique : environ 1 g de chitine par an et par mètre carré de substrat rocheux ou de surface d'océan[16].
Si l'on extrapole ces chiffres, les crustacés produiraient à eux-seuls environ 2,3 milliards de tonnes de chitine par an dans les océans[16].
Écologie, cycle
Notamment en mer, elle joue un rôle dans les cycles biogéochimiques du carbone et de l'azote.
La chitine des champignons est facilement dégradée, mais la chitine polymérisée et associée à certains minéraux et métaux constitue un polymère très résistant, par exemple dans les coquilles de bivalves.
Certaines enzymes (chitinases[18]) du tractus digestif de certains prédateurs la digèrent (oiseaux et mammifères par exemple[19]). Ces enzymes peuvent aussi être produites par la flore intestinale de l'hôte, par exemple par la flore intestinale bactérienne de l'escargot Helix pomatia[20] qui peut ainsi digérer les champignons.
Le fait de détecter de la chitine dans un organisme ne signifie pas toujours qu'il l'ait produite lui-même ; elle peut provenir de sa nourriture[21] ou d'une flore intestinale (endoflore)[20] qui en sécrète.
La chitine des cadavres d'insectes ou crustacés est plus ou moins rapidement dégradée dans les écosystèmes, par des communautés de microorganismes et de bactéries[22].
Les observations faites au microscope électronique montrent que certains polluants (métaux lourds tels que cadmium, cuivre, chrome, zinc et plomb) peuvent interférer avec la biosynthèse de la chitine et dégrader la nacre de bivalves (phénomène étudié chez l’anodonte du cygne de la famille des unionidae)[23]. Ceci pourrait laisser penser que certaines parasitoses affectant les huîtres et leurs coquilles pourraient être facilitées par une contamination des coquilles par certains métaux lourds (contamination effectivement constatée).
Utilisation
En raison de ses qualités, cette molécule intéresse les industriels ; pour des usages actuels et attendus dans le futur[24].
Ce composé organique étant généralement bien supporté par les tissus biologiques, il est utilisé en cosmétique et pour soigner des brûlures car il a des propriétés cicatrisantes. Il peut se présenter sous la forme d'une peau artificielle qui agit comme un tissu qui est appliqué sur la plaie et n'a pas besoin d'être renouvelé car il est biodégradé jusqu'à la formation d'un nouvel épiderme. Il peut être appliqué pour les pansements cornéens. En chirurgie, il est utilisé pour les fils chirurgicaux en raison de sa résistance et de sa flexibilité.
La chitine est également utilisée comme adsorbant pour capter certains éléments (le cadmium en solution dans l'eau par exemple[25], plus ou moins bien selon le pH[25]) ou filtrer les eaux usées[26] : elle forme des chaînes ionisables qui permettent de fixer les éléments métalliques ou organiques en suspension (voir chitosan).
Elle est aussi insérée dans l'alimentation industrielle en tant qu'auxiliaire technologique (notamment comme « agents de clarification/adjuvants de filtration » pour la « fabrication de jus » de fruit, ou comme « agents floculants »)[27].
La chitine peut être filée[28] ou moulée, pure ou modifiée.
La molécule de chitine est aussi utilisée dans les laboratoires comme support de culture cellulaire car elle confère au milieu des propriétés similaires à celles rencontrées in vivo.
Le processus de biosynthèse de cette macromolécule par les insectes est la cible de certains pesticides chimiques dits inhibiteurs de la synthèse de la chitine, comme le flucycloxuron (andalin)[29] ou le triflumuron (alsystine) notamment utilisés contre le moustique Culex pipiens[30] ou le diflubenzuron, non sans risques d'effets secondaires sur des espèces non-cibles[31] (crustacés aquatiques par exemple)[32].
Comme le collagène[33] et la cellulose, la chitine pourrait intéresser le secteur des nanotechnologies et ceux qui cherchent à créer des membranes polymères piézoélectriques souples pour un usage biomédical[34] car c'est un matériau légèrement piézoélectrique. Mais le collagène serait selon Camille Thevenot (2017) plus intéressant pour cela[35],[36].
Quantités disponibles
La chitine serait le second polymère le plus synthétisé dans le monde vivant derrière la cellulose.
Sa production annuelle mondiale par les crustacés marins est estimée à 2,3 Gt (~1 g an−1 m−2)[16] dont :
- 90 % est imputée au zooplancton et au krill ;
- 2 Mt/an aux grands décapodes (crabes et langoustes).
On estime que 75 000 t/an de chitine pourraient être fournies par les captures de crustacés à l’échelle mondiale[37].
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) « Chitin », sur guidechem.com.
- ↑ Moulki, H. et Bonaly, R. (1974), Étude des parois de levures du genre rhodotorula ; IV. variation de la teneur en chitine, Biochimica et Biophysica Acta (BBA)-General Subjects, 338 (1), 120-134.
- ↑ Vignon C., Plassard C., Mousain D. et Salsac L. (1986), Assay of fungal chitin and estimation of mycorrhizal infection, Physiologie végétale, 24(2), 201-207 (résumé Inist-CNRS.
- ↑ Boissière, J. C. (1967), La chitine chez quelques lichens: mise en évidence, localisation. In Mémoires Société Botanique de France. Colloque sur les lichens et la symbiose Lichénique. Paris (p. 141-150).
- ↑ Meyer, K. H. et Pankow, G. W. (1935), Sur la constitution et la structure de la chitine, Helvetica Chimica Acta, 18 (1), 589-598.
- 1 2 3 Goffinet, G. et Jeuniaux, Ch. (1979), Distribution et importance quantitative de la chitine dans les coquilles de mollusques (Distribution and quantitative importance of chitin in mollusc shells), Cah. Biol. Mar., 20 (3), 341-349, dans Cahiers de Biologie Marine, Station biologique de Roscoff (ISSN 0007-9723) (résumé).
- ↑ Depoortere, H. et Magis, N. (1967), Mise en évidence, localisation et dosage de la chitine dans la coque des œufs de Brachionus leydigii Cohn et d’autres rotifères, dans Annales de la Société Royale Zoologique de Belgique, vol. 97, p. 187-195.
- ↑ A. Domard, « Du crustacé au tissu », Pour la science, no 266, , p. 124.
- ↑ (en) Feisal Khoushab et Montarop Yamabhai, « Chitin Research Revisited », Marine Drugs, vol. 8, no 7, , p. 1988–2012 (ISSN 1660-3397, PMID 20714419, PMCID PMC2920538, DOI 10.3390/md8071988, lire en ligne, consulté le )
- ↑ Alphonse Chevallier et A. Richard, Dictionnaire des drogues simples et composées, vol. 2, Paris, Béchet, (lire en ligne), « Chitine. M. Auguste Odier a nommé ainsi la substance solide des élytres et autres parties cornées des insectes. Elle forme à peu près le quart de ces enveloppes, que l'on avait considérées comme analogues à la matière cornée des animaux vertébrés. Elle est obtenue en traitant à chaud les élytres par la potasse, dans laquelle elle est insoluble, ce qui la distingue au premier abord de la corne, des cheveux et de l'épiderme. […]. M. Auguste Odier a retrouvé la chitine dans la carapace des Crustacés ».
- ↑ C. Rouget (1859), Des substances amylacées dans le tissu des animaux, spécialement les articules (Chitine), Compt Rend, 48, 792.
- ↑ Kurt H. Meyer et H. Wehrli (1937), Comparaison chimique de la chitine et de la cellulose, mis en ligne le , DOI 10.1002/hlca.19370200156, Verlag, Weinheim, Helvetica Chimica Acta, vol. 20, no 1, p. 353–362.
- ↑ Jeuniaux, C. (1982), La chitine dans le règne animal, Société zoologique de France, Institut océanographique.
- ↑ Gay L., Hebraud M., Girard V. et Fevre M. (1988), La chitine synthase de Neocallimastix frontalis, un marqueur enzymatique de la biomasse fongique, Reproduction Nutrition Développement, 28 (suppl. 1), 69-70, lien vers l'article (payant).
- 1 2 3 4 5 Jeuniaux, C., Voss-Foucart, M. F. et Bussers, J. C. (1993), La production de chitine par les crustacés dans les écosystèmes marins, Aquatic Living Resources, 6 (04), 331-341 (résumé).
- ↑ Gervasi, E., Jeuniaux, C. et Dauby, P., Production de chitine par les crustacés du zooplancton de la baie de Calvi (Corse), dans Aspects récents de la biologie des crustacés, Concarneau (France), 6 juin 1987.
- ↑ Jeuniaux, C. (1951), Une méthode de dosage des chitinases, Archives of Physiology and Biochemistry, 59(2), 242-244.
- ↑ Jeuniaux, C. (1962), Digestion de la chitine chez les oiseaux et les mammifères, Ann. Soc. Zool. Belg., 92, 27-45.
- 1 2 Jeuniaux, C. (1950), « Mise en évidence d'une flore bactérienne chitinolytique dans le tube digestif de l'esgargot (Helix pomatia L) », Archives of Physiology and Biochemistry, 58 (3), 350-351.
- ↑ Dauby, P. et Jeuniaux, C. (1986), Origine exogène de la chitine décelée chez les Spongiaires, Cah. Biol. Mar., 28, 121-129.
- ↑ Graham W. Gooday (1990), « The ecology of chitin degradation », Advances in Microbial Ecology (ISSN 0147-4863), vol. 11, p. 387-430 (44 p.), lien INIST-CNRS.
- ↑ Moura G., Vilarinho L, Guedes R. et Machado J. (1999), The action of some heavy metals on the calcification process of Anodonta cygnea (Unionidae): nacre morphology and composition changes, Haliotis, 29, 43-53 (résumé Inist-CNRS).
- ↑ Seng, J. M. (1988), Chitine, chitosane et dérivés : de nouvelles perspectives pour l'industrie, Biofutur, 71, 40-44.
- 1 2 Benguella, B. et Benaissa, H. (2001), Sorption du cadmium en solution par une chitine : effet du pH, Récents Progrès en Génie des Procédés, 15 (86), 451-458.
- ↑ Benguella, B. (1999), thèse de magister intitulée Élimination du cadmium en solution aqueuse par un matériau biosorbant : la chitine, soutenue à l'université de Tlemcen.
- ↑ Commission du codex Alimentarius, « RÉPERTOIRE DES SUBSTANCES UTILISÉES EN TANT QU’AUXILIAIRES TECHNOLOGIQUES, LISTE ACTUALISÉE » [PDF], sur codexalimentarius.net, (consulté le ).
- ↑ Tokura S., Nishi N., Nishimura S.I. et Somorin O. (1983), Lysozyme-accessible fibers from chitin and its derivatives, Sen'i Gakkaishi, 39 (12), T507-T511 (résumé Inist/CNRS).
- ↑ N. Soltani et N. Rehimi, Laboratory Evaluation of Andalin, A New Insecticide Interfering with Cuticle Deposition, against Culex pipiens, Journal Algérien de Médecine, vol. 11, 2001, p. 28-33.
- ↑ N. Rehimi et N. Soltani, Laboratory Evaluation of Alsystine. A Chitin Synthesis Inhibitor, against Culex pipiens L. (Diptera Culicidae): Effects on Development and Cuticle Secretion, Journal of Applied Entomology, vol. 123, no 7, 1999, p. 437-441, DOI 10.1046/j.1439-0418.1999.00388.x.
- ↑ N. Zaidi et N. Soltani (2011), Environmental Risks of Two Chitin Synthesis Inhibitors on Gambusia affinis: Chronic Effects on Growth and Recovery of Biological Responses, Biological Control, vol. 59, p. 106-113, DOI 10.1016/j.biocontrol.2011.04.001.
- ↑ Morsli, M. S. et Soltani, N. (2003), Effets d’un insecticide inhibiteur de la synthèse de la chitine, le diflubenzuron, sur la cuticule de la crevette Penaeus kerathurus, J. Rech. Oceanogr., 28 (1-2), 85-88.
- ↑ (en) C. Halperin, S. Mutchnik, A. Agronin et M. Molotskii, « Piezoelectric Effect in Human Bones Studied in Nanometer Scale », Nano Letters, vol. 4, no 7, , p. 1253–1256 (ISSN 1530-6984 et 1530-6992, DOI 10.1021/nl049453i, lire en ligne, consulté le )
- ↑ (en) Sujoy Kumar Ghosh et Dipankar Mandal, « Bio-assembled, piezoelectric prawn shell made self-powered wearable sensor for non-invasive physiological signal monitoring », Applied Physics Letters, vol. 110, no 12, , p. 123701 (ISSN 0003-6951 et 1077-3118, DOI 10.1063/1.4979081, lire en ligne, consulté le )
- ↑ Camille Thevenot, « Élaboration de membranes polymères piézoélectriques souples en vue d’applications biomédicales », Polymères, université de Lorraine, 2017, NNT : 2017LORR0197, lire en ligne (consulté le 19 juillet 2022).
- ↑ Michel Fontanille et Yves Gnanou, « 13. Rhéologie, élaboration et mise en forme des polymères »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), Dunod, (consulté le ), p. 415–438
- ↑ Nanotechnologies for Bio-inspired polySaccharides: biological 'decoys' designed as knowledge-based, multifunctional biomaterials, NanoBioSaccharides (consulté le ).
Voir aussi
Bibliographie
- Jeanloz R. et Forchielli E. (1950), Recherches sur l'acide hyaluronique et les substances apparentées III. La détermination de la structure de la chitine par oxydation avec l'ion periodate, Helvetica Chimica Acta, 33(6), 1690-1697 (résumé).
- Bussers J.C. et Jeuniaux, C. (1974), Recherche de la chitine dans les productions métaplasmatiques de quelques ciliés, Protistologica, 10, 43-46.
- Jeuniaux C. (1964), Chitine libre et chitine masquée dans les structures squelettiques d'invertébrés, Archives internationales de physiologie.
- Quillet M. et Priou M.L. (1963), Sur la présence de la chitine dans les membranes de quelques Algues rouges : Céramiacées et Lomentariacées, Compt. Rend. Hebd. Séances Acad. Sci., 256, 2903-2905.
Articles connexes
- Chitosane