La curiethérapie, parfois appelée brachythérapie (du mot grec ‘Brachy’ qui signifie « distance courte ») ou radiumthérapie, est une technique de radiothérapie mise au point à l'Institut Curie où la source radioactive scellée est placée à l'intérieur ou à proximité immédiate de la zone à traiter. La curiethérapie est couramment utilisée comme un traitement efficace pour soigner le cancer du col de l'utérus, de la prostate, du sein ou de la peau. Elle peut également être utilisée pour traiter des tumeurs dans beaucoup d'autres endroits du corps[1]. La curiethérapie peut être utilisée toute seule ou en combinaison avec d'autres traitements comme la chirurgie, la radiothérapie externe et la chimiothérapie.
Différente de la radiothérapie externe, où les rayons à haute énergie sont dirigés sur la tumeur à partir de l'extérieur du corps, la curiethérapie implique le positionnement précis des sources de rayonnements directement sur le site de la tumeur cancéreuse[1],[2]. Une caractéristique importante de la curiethérapie est que l'irradiation affecte seulement une zone très localisée autour des sources de rayonnement. Il y a donc une réduction de l'exposition aux radiations des tissus sains à proximité de ces sources de rayonnement. Aussi, si le patient bouge ou s'il y a quelque mouvement de la tumeur dans le corps pendant le traitement, les sources de rayonnement conservent leur position correcte par rapport à la tumeur. Les caractéristiques de la curiethérapie sont avantageuses par rapport à la radiothérapie externe car les tumeurs peuvent être traitées avec des doses très élevées de radiations localisées, avec une technique qui permet de réduire la probabilité de dommages pour les tissus sains environnants[1],[2].
Grâce à la curiethérapie une dose peut être délivrée en moins de temps qu'avec d'autres techniques de radiothérapie. Cela peut aider à réduire la possibilité pour les cellules cancéreuses de survivre, de se diviser et de se développer entre chaque séance de radiothérapie[2]. Normalement, les patients doivent faire moins de visites à la clinique par rapport à une radiothérapie externe, et le traitement est souvent effectué en ambulatoire. Cela rend le traitement accessible et pratique pour de nombreux patients[3],[4]. Grâce à ces caractéristiques, la curiethérapie est généralement bien tolérée par les patients.
La curiethérapie présente un traitement efficace pour de nombreux types de cancer. Les résultats de ce traitement ont montré que le taux de guérison du cancer par la curiethérapie est comparable à celui de la chirurgie ou de la radiothérapie externe, ou amélioré quand utilisé en combinaison avec ces techniques[5],[6],[7],[8],[9],[10],[11],[12]. Également, la curiethérapie est associée à un faible risque d'effets secondaires indésirables et graves[13],[14].
Histoire
La curiethérapie de contact a commencé en 1901, peu après la découverte de la radioactivité par Henri Becquerel en 1896, quand Pierre Curie a suggéré à Henri-Alexandre Danlos qu'une source radioactive peut être insérée dans une tumeur[15],[16]. Il a été constaté que le rayonnement rétrécissait la tumeur[16]. Indépendamment, Alexandre Graham Bell a également proposé l'utilisation du rayonnement de cette manière[16]. Au début du XXe siècle, les techniques d'application de la curiethérapie ont été initiées à l'Institut Curie à Paris par Danlos et à Saint-Luke's au Memorial Hospital de New York par Robert Abbe[1],[16]. Dans les années 1920 est développée la télécuriethérapie, technique qui éloigne la source radioactive des parties à irradier dans le but d'augmenter l'efficacité du traitement en profondeur[17].
Après un intérêt initial pour la curiethérapie en Europe et aux États-Unis, son utilisation a diminué au milieu du XXe siècle en raison des problèmes d'irradiation des opérateurs dus à l'application manuelle des sources radioactives[16],[18].
Cependant le développement des systèmes à distance et l'utilisation de nouvelles sources radioactives dans les années 1950 et 1960, ont réduit le risque d'exposition aux radiations inutiles pour l'opérateur et pour les patients[15]. De plus, avec les avancées les plus récentes dans les techniques d'imagerie en trois dimensions, dans les systèmes informatiques de planification dans le traitement et dans les équipements de prestation a fait que la curiethérapie est devenue un traitement sûr et efficace pour de nombreux types de cancer aujourd'hui[1].
Types
Différents types de curiethérapie peuvent être définis selon le placement des sources de rayonnement dans la zone du traitement, selon le débit ou « l'intensité » de la dose d'irradiation délivrée à la tumeur, et selon la durée de la dose délivrée.
Placement de la source
.jpg.webp)
Les deux principaux types de traitement de curiethérapie en termes de placement de la source radioactive sont interstitielle et endocavitaire.
- Dans le cas de la curiethérapie interstitielle, les sources sont implantées à l'intérieur des tissus, comme la prostate[19] ou le sein[20].
- Le contact en curiethérapie implique le placement de la source de rayonnement dans un espace à côté du tissu cible. Cet espace peut être une cavité du corps (curiethérapie endocavitaire), comme le col de l'utérus[21], l'utérus ou le vagin ; ou une lumière du corps (curiethérapie intraluminale), telles que la trachée ou l'œsophage ; ou encore en externe (curiethérapie de surface) comme la peau[22]. Une source de rayonnement peut aussi être placée dans les vaisseaux sanguins (curiethérapie intravasculaire) pour le traitement des resténose coronaire intra-stent.
Débit de dose
Le débit de dose de la curiethérapie se réfère au niveau ou à “l'intensité” avec laquelle le rayonnement est délivrée vers le milieu environnant et est exprimée en grays par heure (noté Gy/h).
- Le bas débit de dose de la curiethérapie consiste à implanter des sources de rayonnement qui émettent des radiations à un débit pouvant aller jusqu'à 2 Gy h−1[23]. La curiethérapie bas débit de dose est couramment utilisée pour les cancers de la cavité buccale[24], oropharynx[24], des sarcomes[25] ou de la prostate[19],[26].
- Le moyen débit de dose de la curiethérapie est caractérisé par un débit moyen de diffuser la dose qui se situe entre 2 Gy h−1 et 12[23].
- Le haut débit de dose de la curiethérapie correspond à un débit de délivrée de dose est supérieure à 12[23]. Les applications les plus communes de la curiethérapie haut débit de dose sont dans les tumeurs du col de l'utérus[21], de l'œsophage[27], des poumons[28], des seins[20] et de la prostate[19]. La plupart des traitements haut débit de dose se font en ambulatoire, mais cela dépend du site de traitement[29].
- Le pulsé de bas débit de dose de la curiethérapie consiste à délivrer de courtes impulsions de rayonnement, généralement une fois par heure, pour simuler le débit global et l'efficacité du traitement bas débit de dose. La curiethérapie pulsée de bas débit de dose est utilisée pour traiter les tumeurs d'ordre gynécologiques[21] ainsi que pour les cancers de la tête et du cou[24].
Durée de la dose
Le placement des sources de rayonnement dans la zone cible peut être temporaire ou permanente.
- La curiethérapie temporaire implique le placement des sources radioactive pour une durée déterminée, en minutes ou en heures, puis leur retrait[1]. La durée du traitement spécifique dépend de nombreux facteurs, notamment le débit de dose requis délivré et le type, la taille et la localisation du cancer. En cas de bas débit de dose et de pulsé de bas débit de dose de curiethérapie, la source reste en place généralement jusqu'à 24 heures avant d'être retirée. Dans la curiethérapie haut débit de dose ce temps est généralement de quelques minutes[30].
- La curiethérapie permanente, consiste à placer de petits grains, d'environ la taille d'un grain de riz, radioactifs bas débit de dose, dans la tumeur ou le site de traitement et de les laisser là en permanence à se dégrader progressivement. Dans une période de quelques semaines à un mois, le niveau de la radiation émise par les sources diminue pour s'établir à un niveau voisin zéro. Les graines inactives restent alors dans la zone de traitement sans effet durable[31]. La curiethérapie permanente est utilisée couramment dans le traitement du cancer de la prostate[26].
Applications cliniques
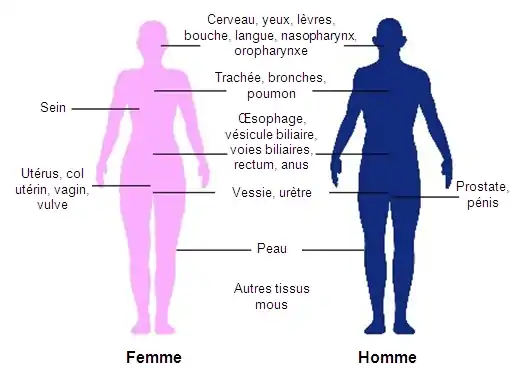
La curiethérapie est couramment utilisée pour traiter les cancers du col de l'utérus[21] de la prostate[19], du sein[20], et de la peau[22]. Elle peut également être utilisé dans le traitement des tumeurs du cerveau[32], de l'œil[33], de la tête et du cou (lèvre, le plancher de la bouche, la langue, du nasopharynx et de l'oropharynx)[24], des voies respiratoires (la trachée et les bronches)[28], des voies digestives (œsophage, de la vésicule biliaire, voies biliaires, du rectum, anus)[27],[34],[35],[36], des voies urinaires (vessie, l'urètre, du pénis)[37],[38],[39], de l'appareil reproducteur féminin (utérus, du vagin, vulve)[40],[41], et des tissus mous[25].
Comme les sources radioactives peuvent être positionnées précisément sur le site de traitement des tumeurs, la curiethérapie permet d'appliquer une forte dose de rayonnements sur une petite zone. Par ailleurs, parce que les sources radioactives sont placées dans ou à côté de la tumeur cible, elles peuvent maintenir leur position par rapport à cette dernière quand le patient se bouge ou s'il y a un mouvement de la tumeur dans le corps. Ainsi, les sources de rayonnements restent bien ciblées. Cela permet aux cliniciens d'atteindre un niveau élevé de conformité aux doses : ils s'assurent que la totalité de la tumeur reçoit un niveau optimal de radiation. Cette technique permet également de réduire le risque de dommages collatéraux des tissus ou des organes sains situés autour de la tumeur[29]. On peut donc espérer augmenter les chances de guérison et préserver la fonction de l'organe.
L'utilisation de la curiethérapie HDD permet de diminuer les temps de traitement par rapport à la radiothérapie externe[42],[43]. Les patients traités par curiethérapie généralement ont besoin de moins de visites pour la radiothérapie qu'avec une radiothérapie externe, et le traitement est souvent prévue pour être réalisé en moins de temps[44]. Plusieurs protocoles de curiethérapie peuvent être effectués dans un service ambulatoire. Cette procédure est particulièrement adaptée pour les patients en activité, les patients âgés, ou pour les patients qui vivent à quelque distance de centres de traitement. La réduction des temps de traitement en ambulatoire et les procédures adaptées peuvent aussi contribuer à améliorer l'efficacité des cliniques de radiothérapie[45],[46].
La curiethérapie peut principalement être utilisée pour guérir les cancers dans de petites tumeurs ou des tumeurs avancées localement à la condition qu'il n'y ait pas de métastases (tumeurs étendues à d'autres endroits du corps). Dans des cas précis de tumeurs primaires, la curiethérapie pour les tumeurs primaires représente souvent une approche comparable à la chirurgie, avec la réalisation de la même probabilité de guérison et avec des effets secondaires similaires[47],[48]. De plus, dans les cancers que sont avancés localement la chirurgie ne fournit pas toujours les meilleures chances de guérison et reste souvent techniquement impossible à réaliser. Dans ces cas, la radiothérapie et en particulier la curiethérapie, offre la seule chance de guérison[49],[50]. Enfin, dans les stades plus avancés de la maladie, la curiethérapie peut être utilisée comme traitement palliatif pour soulager les symptômes de douleur et de saignement. Dans les cas où la tumeur n'est pas accessible facilement ou est trop grande pour assurer une distribution optimale de l'irradiation de la zone de traitement, la curiethérapie peut être combinée à d'autres traitements, comme la radiothérapie externe et / ou la chirurgie. La combinaison des traitements de la curiethérapie exclusivement et de chimiothérapie est rare.
Cancer du col de l'utérus
La curiethérapie est couramment utilisée dans le traitement du cancer du col de l'utérus aux premiers stades ou confinées localement. C'est une norme de soins dans de nombreux pays[21],[51],[52],[53],[54]. Le cancer du col de l'utérus peut être traités soit par BDD, PDD ou HDD[7],[53],[55]. Utilisée en combinaison avec la radiothérapie externe, la curiethérapie peut fournir de meilleurs résultats que la radiothérapie externe toute seule[5]. La précision de la curiethérapie permet une dose forte de radiations ciblées au col de l'utérus, tant que cette technique minimise l'exposition des radiations aux tissus et aux organes adjacents[52],[53],[56],[57]. Les chances de rester sans maladie (survie sans maladie) et de rester de survie (survie total) sont identiques pour les traitements BDD, PDD et HDD[50],[58]. Cependant, un avantage important du traitement HDD est que chaque dose peut être délivrée sur une base externe avec un temps d'administration court[5] qui fournit une plus grande commodité pour de nombreux patients.
Cancer de la prostate
La curiethérapie pour traiter le cancer de la prostate peut être appliquée soit par l'implantation permanente de grains BDD soit par curiethérapie HDD temporaire[19],[59],[60]. L'implantation permanente des grains est adaptée aux patients qui ont une tumeur localisée et de bon pronostics de guérison[8],[59],[61],[62]. Il a été démontré que c'est un traitement très efficace contre la récidive[6],[8]. La taux de survie est similaire à celui observé avec la radiothérapie externe ou la chirurgie (prostatectomie radicale), mais avec moins d'effets secondaires tels que l'impuissance et l'incontinence[14]. La procédure peut être réalisée rapidement. Les patients sont généralement en mesure de rentrer chez eux le jour même du traitement et de retourner à leurs activités normales après 1 à 2 jours[3]. L'implantation permanente de grains est souvent une option moins invasive du traitement par rapport à l'ablation chirurgicale de la prostate[3].
La curiethérapie temporaire HDD est une approche nouvelle pour traiter le cancer de la prostate, mais reste moins fréquemment utilisée, moins fréquente que l'implantation permanente de grains. Cette technique (également appelée boost thérapie) est employée de manière à offrir une dose supplémentaire par rapport à la radiothérapie externe. En effet, elle offre une méthode alternative pour délivrer une dose élevée de radiothérapie adaptée au type de tumeur de la prostate, tout en épargnant les tissus environnants de l'exposition aux rayonnements[9],[10],[60],[61],[11],[63]. La curiethérapie HDD comme amélioration pour le traitement du cancer de la prostate signifie aussi que les séances de radiothérapie externe peuvent être plus courtes que quand la radiothérapie externe est utilisé seule[9],[10],[63],[64].
Cancer du sein
La radiothérapie est le type de soins normalisé pour les femmes ayant subi une ablation de tumeur ou une mastectomie. C'est aussi est une composante intégrante de la thérapie pour conserver le sein[20],[65]. La curiethérapie peut être utilisée après une chirurgie, avant la chimiothérapie ou palliatif dans le cas de la maladie avancée[66]. La curiethérapie pour traiter le cancer du sein est généralement réalisée avec la méthode de curiethérapie HDD temporaire. Après une chirurgie, la curiethérapie du sein peut être utilisée comme un boost à la suite d'une irradiation du sein entier par radiothérapie externe[65],[67]. Plus récemment, la curiethérapie tout seule est appliquée dans une technique appelée AIPS (Irradiation Accélérée Partielle du Sein), qui a pour but de cibler les rayonnements seulement à la région immédiate entourant la tumeur d'origine[12],[65],[67].
L'avantage de la curiethérapie du sein par rapport à la radiothérapie externe est qu'une dose forte de radiation peut être appliquée avec précision vers la tumeur tout en épargnant les tissus du sein sains et les structures sous-jacentes telles que les côtes et les poumons[66]. L'AIPS peuvent généralement être complétée en cours d'une semaine[12]. L'option de la curiethérapie permet aux femmes qui travaillent, aux personnes âgées ou aux femmes n'ayant pas facilement accès à un centre de traitement de bénéficier d'une chirurgie conservatrice du sein en raison du traitement court par rapport à la radiothérapie externe (qui exige souvent plus de visites pendant 1 à 2 mois)[4]. La curiethérapie a démontré un contrôle local excellent du cancer du sein au moment du suivi d'un maximum de 6 ans après traitement[12],[68],[69].
Pour la curiethérapie du sein, les radio-oncologues placent un tube plastique et flexible appelé cathéters ou un ballon dans le sein. Deux fois par jour pour un nombre de jours déterminé, les cathéters ou le ballon seront reliés à un appareil de curiethérapie, aussi appelé un « haut-débit-de-dose projecteur » (assisté par ordinateur) afin de délivrer de façon sûre et efficace le rayonnement vers le site tumoral. Le rayonnement dure quelques minutes à chaque fois. À la fin de la durée du traitement, le cathéter ou le ballon est enlevé[70]. Ce traitement est encore à l'étude. L'objectif est de savoir s'il est aussi efficace que trois à huit semaines de radiothérapie externe.
Cancer de la peau
La curiethérapie HDD des cancers de la peau non mélanique, tels que le carcinome basocellulaire et le carcinome spinocellulaire, offre une thérapie alternative à la chirurgie. Cette technique s'avère essentielle particulièrement pour les cancers du nez, des oreilles, des paupières ou des lèvres, où la chirurgie pourrait causer défiguration ou nécessiter une reconstruction importante[22]. Divers applicateurs peuvent être utilisés pour assurer un contact étroit entre la source de radiation et la peau. Ils s'adaptent à la courbure de la peau et aident à administrer précisément la dose d'irradiation optimale[22].
La curiethérapie pour le cancer de la peau donne de bons résultats esthétique et d'efficacité clinique ; les études avec jusqu'à 5 ans de suivi ont montré que la curiethérapie est très efficace en termes de contrôle local, et est comparable à radiothérapie externe[71],[72],[73]. Les délais de traitement sont généralement courts, et offrent une grande commodité pour les patients[74]. Il a été suggéré que la curiethérapie pourrait bientôt devenir une norme de traitement pour le cancer de la peau[74].
Autres applications
La curiethérapie peut être utilisée dans le traitement des resténoses intra-stent des artères coronaires. Un cathéter est placé à l'intérieur des vaisseaux sanguins et les sources y sont insérées ou supprimées[75]. La thérapie a été étudiée aussi pour une utilisation dans le traitement de la vasculaire périphérique sténose[76] et examinée pour le traitement de la fibrillation auriculaire[77].
Effets secondaires
La probabilité et la nature des éventuels effets secondaires aigus, sub-aigus ou à long terme liés à la curiethérapie dépendent de la localisation de la tumeur traitée et du type de curiethérapie utilisée.
Aigus
Les effets secondaires liés à la curiethérapie comprennent des ecchymoses localisés, des œdèmes, des saignements, un écoulement ou une gêne dans la région implantée. Normalement, ils disparaissent en quelques jours après la fin du traitement[78]. Certains patients peuvent aussi se sentir fatigués pendant une période courte suivant le traitement[78],[79].
Les traitements par curiethérapie pour le cancer du col de l'utérus ou la prostate peuvent provoquer des douleurs aiguës et des symptômes urinaires transitoires tels que la rétention urinaire, l'incontinence urinaire ou miction douloureuse (dysurie)[14],[80],[81]. Augmentation de la fréquence du transit, diarrhée, constipation ou saignements rectaux mineurs peuvent aussi survenir[14],[80],[81]. Les effets secondaires aigus ou sous-aigus disparaissent généralement après quelques jours ou quelques semaines. Dans le cas de curiethérapie permanente (semences) pour le cancer de la prostate, il existe une faible probabilité que certaines semences migrent hors de la région de traitement, passent dans la vessie ou dans l'urètre et soient éliminées avec l'urine.
La curiethérapie pour le cancer de la peau peut entraîner une chute des couches supérieures de l'épiderme (desquamation) autour de la zone de traitement dans les semaines qui suivent la thérapie. Cet effet est guéri généralement en 5-8 semaines[22]. Si le cancer est localisé sur la lèvre, une ulcération peut arriver à la suite de la curiethérapie, mais disparaît généralement après 4-6 semaines[82].
La plupart des effets secondaires aigus liés à la curiethérapie peuvent être traités avec des médicaments ou par des changements alimentaires, et disparaissent habituellement au cours du temps (généralement en quelques semaines) une fois que le traitement est terminé. Les effets secondaires aigus de la curiethérapie HDD sont largement similaires à radiothérapie externe[79].
Long terme
Dans un petit nombre de cas, la curiethérapie peut causer des effets secondaires à long terme en raison des dommages causés sur les tissus adjacents ou les organes. Les effets secondaires à long terme sont généralement d'intensité légère ou modérée dans la nature. Par exemple, des problèmes urinaires et digestifs peuvent persister à la suite de la curiethérapie du cancer de la prostate ou du col de l'utérus. Ce type de problème nécessite un suivi médical continu[14],[80],[81].
La curiethérapie du cancer de la prostate peut produire des dysfonctionnements de l'érection chez environ 15-30 % des patients masculins[19],[31]. Toutefois, ce type de risque de dysfonction érectile est liée à l'âge (les hommes plus âgés courent un risque plus élevé que les hommes plus jeunes) et aux troubles de l'érection avant de recevoir la curiethérapie. Chez les patients qui souffrent de tels troubles, la majorité des cas peuvent être traités avec succès à l'aide des médicaments comme le Viagra[19]. Il est important de souligner que le risque de dysfonction érectile après curiethérapie est inférieur à celui après une prostatectomie radicale[47],[80].
La curiethérapie du cancer du sein ou du cancer de la peau peut produire des tissus cicatriciels formés autour de la zone de traitement. Dans le cas de la curiethérapie du sein, la nécrose adipeuse peut survenir à la suite de la pénétration d'acides gras dans les tissus du sein. Cela peut entraîner une douleur et un gonflement du tissu mammaire. La nécrose adipeuse est une affection bénigne et survient en général 4-12 mois après le traitement. Elle touche environ 2 % des patientes[83],[84].
Sécurité de l'entourage
Les patients demandent souvent s'ils ont besoin de prendre des précautions particulières de sécurité avec l'entourage après avoir subi une curiethérapie. Si la curiethérapie temporaire est utilisée, aucune source radioactive ne reste dans le corps après le traitement. Dans ce cas, il n'y a pas de risque d'irradiation de l'entourage proche des patients[85].
Si la curiethérapie permanente est utilisée, les sources radioactives à faible dose (graines) sont laissées dans le corps après le traitement mais les niveaux de rayonnement sont très faibles et diminuent avec le temps. En outre, l'irradiation affecte uniquement les tissus à l'intérieur de quelques millimètres des sources radioactives (la tumeur traitée). Par mesure de précaution, il est conseillé aux jeunes enfants et aux femmes enceintes de se tenir à l'écart des patients ayant reçu une curiethérapie permanente pendant une courte période après traitement. Les radio-oncologues et les infirmières peuvent fournir des instructions précises aux patients et à conseiller sur le temps pendant lequel ils doivent faire attention[85].
Procédure
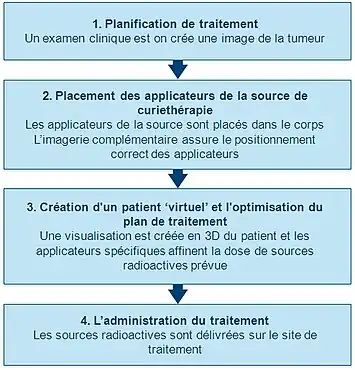
Planification initiale
Afin de planifier avec précision la procédure de curiethérapie, un examen clinique approfondi est effectuée afin de comprendre les caractéristiques de la tumeur. En outre, une gamme de modalités d'imagerie peut être utilisée pour visualiser la forme et la taille de la tumeur et sa relation avec les tissus environnants et les organes. Il s'agit notamment de la radiographie, de l'échographie, de la tomographie axiale par ordinateur (CT ou CAT) et de l'analyse et l'imagerie par résonance magnétique (IRM). Les données de plusieurs de ces sources peuvent être utilisées pour créer une visualisation 3D de la tumeur et des tissus environnants.
En utilisant cette information, un plan de la répartition optimale des sources de rayonnement peut être développé : les supports de sources (instruments), qui sont utilisés pour apporter le rayonnement au site de traitement sont placés et positionnés. Les applicateurs qui sont non radioactifs et sont généralement des aiguilles ou cathéters en plastique. Le type spécifique de l'applicateur utilisé dépendra du type de cancer traité et des caractéristiques de la tumeur cible. Cette planification initiale permet de garantir que les « points froids » (trop peu irradiés) et des « points chauds » (trop irradiés) sont évités pendant le traitement. Ils pourraient se traduire respectivement par l'échec du traitement ou des effets secondaires.
Imagerie et insertion de l'applicateur
Avant que les sources radioactives ne soient délivrées sur le site de la tumeur, les applicateurs doivent être insérés et positionnés correctement en fonction du planning initial.
Les techniques d'imagerie, telles que les rayons X, la fluoroscopie et l'échographie sont généralement utilisées pour aider au placement des applicateurs sur leurs positions exactes et de pour affiner le plan de traitement. Les scans CAT et l'IRM peuvent aussi être utilisés. Une fois que les applicateurs sont insérés, ils sont maintenus contre la peau en utilisant des sutures ou du ruban adhésif pour les empêcher de se déplacer. Une fois que les applicateurs sont bien positionnés, l'imagerie complémentaire peut être réalisée pour orienter la planification du traitement détaillé.
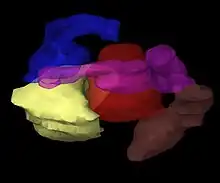
Création d'un patient virtuel
Les images du patient portant les applicateurs in situ sont importées dans un logiciel de planification du traitement. Le patient est alors amené dans une salle spéciale et blindée pour le traitement. Le logiciel de planification du traitement permet l'acquisition de multiples images 2D du site de traitement. Ces images sont traduites en un « patient virtuel » 3D, dans lequel la position des applicateurs peuvent être définis. Les relations spatiales entre les applicateurs, le site de traitement et les tissus environnants sains sont dans ce « patient virtuel », une copie des relations dans le patient réel.
Optimisation du plan d'irradiation
Pour identifier la optimale répartition spatiale et temporelle des sources de rayonnement dans les applicateurs sur ses cibles, le logiciel de planification du traitement place dans un premier temps les sources de rayonnement virtuelles à l'intérieur du patient virtuel. Le logiciel montre une représentation graphique de la distribution de l'irradiation. Cette étape sert de guide à l'équipe de curiethérapie pour affiner la répartition des sources et de fournir un plan de traitement qui est parfaitement adaptée à l'anatomie de chaque patient. Ensuite, la radiation du patient réel peut commencer. Cette approche est parfois appelée « peinture de la dose ».
Les sources de rayonnement utilisées pour la curiethérapie sont toujours enfermées dans une capsule protectrice non radioactive. Les sources peuvent être délivrées manuellement, mais sont plus souvent délivrées à travers une technique appelée afterloading, effectué par le biais d'un projecteur de source.
La délivrance manuelle de la curiethérapie est limitée à certaines applications BDD, en raison du risque d'exposition aux rayonnements des personnels cliniques[30].
À l'opposé, l’afterloading permet le positionnement précis des applicateurs au site du traitement non radioactifs. Une fois en place, les applicateurs sont chargés avec les sources de rayonnement. En afterloading manuel, la source est délivrée à l'applicateur par un opérateur.
Les systèmes d’afterloading à distance assurent une protection contre l'exposition aux rayonnements des professionnels de santé puisque la source de rayonnement reste confinée. Une fois que les applicateurs sont positionnés correctement dans le patient, ils sont reliés au projecteur de source (afterloader qui contient les sources radioactives) par une série de tubes de liaison qui guide. Le plan de traitement est envoyé à l’afterloader, qui après contrôle libère les sources le long des tubes de guidage jusqu'à l'applicateur. Cette procédure ne démarre que lorsque le personnel a quitté la salle de traitement. Les sources restent en place pour une période définie selon le plan de traitement. Ensuite, elles retournent à l’afterloader par les tubes de liaison.
Quand le traitement radioactif est terminé, les applicateurs sont soigneusement retirés du corps. En temps normal, les patients récupèrent rapidement après un traitement par curiethérapie, ce qui leur permet d'être soignés en service ambulatoire[29].
Sources radioactives
Radioéléments utilisés
Le radioélément de base utilisé en curiethérapie est actuellement l'iridium 192[86] noté 192Ir. Il se présente sous forme de fils souples et sécables entourés d'une gaine en platine dont le diamètre varie entre 0,3 et 0,6 millimètre ou sous forme d'épingle simple ou double dont le diamètre extérieur est de 0,5 millimètre[87]. Les branches de l'épingle ont une longueur comprise entre 30 et 50 millimètres pour un écartement de 12 millimètres.
L'iode 125[86] est quant à lui utilisé pour le traitement des prostates. Il est conçu sous forme de grains de titane de 4,5 millimètres pour 0,8 millimètre qui renferment deux sphères d'iode[87]. Ces grains sont implantés directement à l'intérieur de la masse tumorale en implant permanent.
D'autres éléments[86] sont beaucoup moins utilisés comme le césium 137, le cobalt 60, le palladium 103 ou encore le strontium 90.
| Radionucléides | Type | Demi-vie | Énergie |
|---|---|---|---|
| Césium 137 (137Cs) | Rayons γ | 30,17 ans | 0,662 MeV |
| Cobalt 60 (60Co) | Rayons γ | 5,26 ans | 1,17 ; 1,33 MeV |
| Iridium 192 (192Ir) | Rayons γ | 74,0 jours | 0,38 MeV (milieu) |
| Iode 125 (125I) | Rayons X | 59,6 jours | 27,4 ; 31,4 et 35,5 keV |
| Palladium 103 (103Pd) | Rayons X | 17,0 jours | 21 keV (milieu) |
| Ruthénium 106 (106Ru) | Rayons β | 1,02 an | 3,54 MeV |
Gaines
Les sources radioactives ne sont jamais mises en contact direct du patient. Les grains radioactifs sont encapsulés dans des gaines insérées à l'intérieur du patient à proximité directe de la zone à traiter[86].
Deux types de gaines protectrices sont utilisées. Il s'agit des simples enrobages entourant les billes radioactives pour les éléments à bas débit de dose et des projecteurs qui sont des capsules métalliques contenant les éléments à haut débit de dose et permettant le contrôle du temps d'irradiation de la tumeur. Cette dernière permet de rentrer et sortir mécaniquement l'élément radioactif afin de protéger le personnel lors de sa manipulation et de contrôler la dose apportée au patient. Cette capsule absorbe la plupart du rayonnement émis[86].
Curiethérapie électronique
La curiethérapie électronique implique le placement de tubes miniatures, contenant des sources de rayon X à faible énergie, dans un applicateur prépositionné sur la tumeur. Cette technique permet de délivrer rapidement des doses élevées aux tissus cibles tout en préservant les tissus sains alentour.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Brachytherapy » (voir la liste des auteurs).
- 1 2 3 4 5 6 (en) A Gerbaulet, Pötter R (éditeur), Mazeron J (éditeur), Limbergen EV (éditeur), Gerbaulet A (éditeur) et al., The GEC ESTRO handbook of brachytherapy, Belgium, ACCO, , « General aspects »
- 1 2 3 (en) AJ Stewart, « Radiobiological concepts for brachytherapy », dans P Devlin, Brachytherapy. Applications and Techniques, Philadelphia, LWW,
- 1 2 3 (en) BMJ Group, « Prostate cancer: internal radiotherapy (brachytherapy) », Guardian.co.uk, (consulté le )
- 1 2 (en) JR Kelley, Devlin P (éditeur) et al., Brachytherapy. Applications and Techniques, Philadelphia, LWW, , « Breast brachytherapy »
- 1 2 3 (en) AN Viswanathan, Devlin P (éditeur) et al., Brachytherapy. Applications and Techniques, Philadelphia, LWW, , « Gynecologic brachytherapy »
- 1 2 (en) T Pickles et al., « Brachytherapy or Conformal External Radiotherapy for Prostate Cancer: A Single-Institution Matched-Pair Analysis », International Journal of Radiation OncologyBiologyPhysics,
- 1 2 (en) C Haie-Meder et al., « DVH parameters and outcome for patients with early-stage cervical cancer treated with preoperative MRI-based low dose rate brachytherapy followed by surgery », Radiotherapy and Oncology, vol. 93, no 2, , p. 316
- 1 2 3 (en) J Battermann et al., « Results of permanent prostate brachytherapy, 13 years of experience at a single institution », Radiotherapy and Oncology, vol. 71, no 1, , p. 23-28
- 1 2 3 (en) R Galalae et al., « Long-term outcome by risk factors using conformal high-dose-rate brachytherapy (HDR-BT) boost with or without neoadjuvant androgen suppression for localized prostate cancer », International Journal of Radiation Oncology, vol. 58, , p. 1048–1055
- 1 2 3 (en) PJ Hoskin et al., « High dose rate brachytherapy in combination with external beam radiotherapy in the radical treatment of prostate cancer: initial results of a randomised phase three trial », Radiotherapy and Oncology, vol. 84, no 2, , p. 114–120
- 1 2 (en) BR Pieters et al., « Comparison of three radiotherapy modalities on biochemical control and overall survival for the treatment of prostate cancer: A systematic review », Radiotherapy and Oncology, vol. 93, no 2, , p. 168
- 1 2 3 4 (en) JC Nelson et al., « Four-year clinical update from the American Society of Breast Surgeons MammoSite brachytherapy trial », The American Journal of Surgery, vol. 198, , p. 83–91
- ↑ (en) M Ferrer et al., « Health-Related Quality of Life 2 Years After Treatment with Radical Prostatectomy, Prostate Brachytherapy, or External Beam Radiotherapy in Patients with Clinically Localized Prostate Cancer », International Journal of Radiation OncologyBiologyPhysics, vol. 72, , p. 421
- 1 2 3 4 5 (en) S Frank et al., « An Assessment of Quality of Life Following Radical Prostatectomy, High Dose External Beam Radiation Therapy and Brachytherapy Iodine Implantation as Monotherapies for Localized Prostate Cancer », The Journal of Urology, vol. 177, no 6, , p. 2151–2156
- 1 2 (en) VK. Gupta, « Brachytherapy – past, present and future », Journal of Medical Physics, vol. 20, , p. 31-38
- 1 2 3 4 5 (en) S Nag, « A brief history of brachytherapy », sur americanbrachytherapy.org (consulté le )
- ↑ « Le radium, pour le meilleur et pour le pire », La Recherche, no 315, , p. 76
- ↑ (en) J. Aronowitz, « The “Golden Age” of prostate brachytherapy: A cautionary tale », Brachytherapy, vol. 7, no 1, , p. 55-59
- 1 2 3 4 5 6 7 (en) D Ash, Pötter R (éditeur), Mazeron J (éditeur), Limbergen EV (éditeur), Gerbaulet A (éditeur) et al., The GEC ESTRO handbook of brachytherapy, Belgium, ACCO, , « Prostate cancer »
- 1 2 3 4 (en) E Van Limbergen, Pötter R (éditeur), Mazeron J (éditeur), Limbergen EV (éditeur), Gerbaulet A (éditeur) et al., The GEC ESTRO handbook of brachytherapy, Belgium, ACCO, , « Breast cancer »
- 1 2 3 4 5 (en) A Gerbaulet, Pötter R (éditeur), Mazeron J (éditeur), Limbergen EV (éditeur), Gerbaulet A (éditeur) et al., The GEC ESTRO handbook of brachytherapy, Belgium, ACCO, , « Cervix carcinoma »
- 1 2 3 4 5 (en) E Van Limbergen, Pötter R (éditeur), Mazeron J (éditeur), Limbergen EV (éditeur), Gerbaulet A (éditeur) et al., The GEC ESTRO handbook of brachytherapy, Belgium, ACCO, , « Skin cancer »
- 1 2 3 (en) Thomadsen BR et al., Brachytherapy Physics, Medical Physics Publishing,
- 1 2 3 4 (en) JJ Mazaron et al., « GEC-ESTRO recommendations for brachytherapy for head and neck squamous cell carcinomas », Radiotherapy and Oncology, vol. 91, no 2, , p. 150-156
- 1 2 (en) E Lartigau, Pötter R (éditeur), Mazeron J (éditeur), Limbergen EV (éditeur), Gerbaulet A (éditeur) et al., The GEC ESTRO handbook of brachytherapy, Belgium, ACCO, , « Soft tissue sarcomas of the extremities in adults »
- 1 2 (en) G Koukourakis et al., « Brachytherapy for prostate cancer: A systematic review », Adv Urol, (PMID 19730753)
- 1 2 (en) R Pötter, Pötter R (éditeur), Mazeron J (éditeur), Limbergen EV (éditeur), Gerbaulet A (éditeur) et al., The GEC ESTRO handbook of brachytherapy, Belgium, ACCO, , « Oesophageal cancer »
- 1 2 (en) E Van Limbergen, Pötter R (éditeur), Mazeron J (éditeur), Limbergen EV (éditeur), Gerbaulet A (éditeur) et al., The GEC ESTRO handbook of brachytherapy, Belgium, ACCO, , « Bronchus cancer »
- 1 2 3 (en) S. Nag, « High dose rate brachytherapy: its clinical applications and treatment guidelines », Technology in Cancer Research and Treatment, vol. 3, , p. 269-87 (PMID 15161320)
- 1 2 (en) A Flynn, Hoskin P (éditeur), Coyle C (éditeur) et al., Radiotherapy in practice: brachytherapy, New York, Oxford University Press, , « Isotopes and delivery systems for brachytherapy »
- 1 2 (en) RN Moule et al., « Non-surgical treatment of localised prostate cancer », Surgical Oncology, vol. 18, no 3, , p. 255-267
- ↑ (en) Mazeron JJ, Gerbaulet A (éditeur), Pötter R (éditeur), Mazeron J (éditeur), Limbergen EV (éditeur) et al., The GEC ESTRO handbook of brachytherapy, Belgium, ACCO, , « Brain cancer »
- ↑ (en) R Pötter, Gerbaulet A (éditeur), Pötter R (éditeur), Mazeron J (éditeur), Limbergen EV (éditeur) et al., The GEC ESTRO handbook of brachytherapy, Belgium, ACCO, , « Uveal melanoma »
- ↑ (en) Dvorák et al., « Intraluminal high dose rate brachytherapy in the treatment of bile duct and gallbladder carcinomas », Hepato-gastroenterology, vol. 49, no 46, , p. 916–7
- ↑ (en) D Ash, Gerbaulet A (éditeur), Pötter R (éditeur), Mazeron J (éditeur), Limbergen EV (éditeur) et al., The GEC ESTRO handbook of brachytherapy, Belgium, ACCO, , « Bile duct cancer »
- ↑ (en) Mazeron JJ, Gerbaulet A (éditeur), Pötter R (éditeur), Mazeron J (éditeur), Limbergen EV (éditeur) et al., The GEC ESTRO handbook of brachytherapy, Belgium, ACCO, , « Anorectal cancer »
- ↑ (en) Van Limbergen E, Gerbaulet A (éditeur), Pötter R (éditeur), Mazeron J (éditeur), Limbergen EV (éditeur) et al., The GEC ESTRO handbook of brachytherapy, Belgium, ACCO, , « Urinary bladder cancer »
- ↑ (en) Gerbaulet A, Gerbaulet A (éditeur), Pötter R (éditeur), Mazeron J (éditeur), Limbergen EV (éditeur) et al., The GEC ESTRO handbook of brachytherapy, Belgium, ACCO, , « Urethral cancer »
- ↑ (en) Gerbaulet A, Gerbaulet A (éditeur), Pötter R (éditeur), Mazeron J (éditeur), Limbergen EV (éditeur) et al., The GEC ESTRO handbook of brachytherapy, Belgium, ACCO, , « Penis cancer »
- ↑ (en) Pötter R, Gerbaulet A (éditeur), Pötter R (éditeur), Mazeron J (éditeur), Limbergen EV (éditeur) et al., The GEC ESTRO handbook of brachytherapy, Belgium, ACCO, , « Endometrial cancer »
- ↑ (en) Gerbaulet A, Gerbaulet A (éditeur), Pötter R (éditeur), Mazeron J (éditeur), Limbergen et al., The GEC ESTRO handbook of brachytherapy, Belgium, ACCO, , « Primary vaginal cancer »
- ↑ (en) KJ Joseph et al., « Analysis of health related quality of life (HRQoL) of patients with clinically localized prostate cancer, one year after treatment with external beam radiotherapy (EBRT) alone versus EBRT and high dose rate brachytherapy (HDRBT) », Radiation Oncology, vol. 3, no 20,
- ↑ (en) P Holmboe et al., « Treatment decisions for localized prostate cancer: asking men what's important », Journal of general internal medicine, vol. 15, no 10, , p. 694–701
- ↑ (en) Hoskin P (éditeur) et Coyle C (éditeur), Radiotherapy in practice: brachytherapy, New York, Oxford University Press,
- ↑ (en) F Guedea et al., « Patterns of Care for Brachytherapy in Europe: Facilities and resources in brachytherapy in the European area », Brachytherapy, vol. 7, no 3, , p. 223–230
- ↑ (en) TS Quang et al., « Technological evolution in the treatment of prostate cancer », Oncology, vol. 21, (lire en ligne)
- 1 2 (en) F Guedea et al., « Quality of life two years after radical prostatectomy, prostate brachytherapy or external beam radiotherapy for clinically localised prostate cancer: the Catalan Institute of Oncology/Bellvitge Hospital experience », Clinical & translational oncology : official publication of the Federation of Spanish Oncology Societies and of the National Cancer Institute of Mexico, vol. 11, no 7, , p. 470–8
- ↑ (en) Litwin et al., « Quality of life after surgery, external beam irradiation, or brachytherapy for early-stage prostate cancer », Cancer, vol. 109, no 11, , p. 2239–2247
- ↑ (en) F Pistis et al., « External beam radiotherapy plus high-dose-rate brachytherapy for treatment of locally advanced prostate cancer: the initial experience of the Catalan Institute of Oncology », Brachytherapy, vol. 9, no 15,
- 1 2 (en) P Lertsanguansinchai et al., « Phase III randomized trial comparing LDR and HDR brachytherapy in treatment of cervical carcinoma », International Journal of Radiation OncologyBiologyPhysics, vol. 59, , p. 1424
- ↑ (en) P Gaffney et al., « Practice Patterns of Radiotherapy in Cervical Cancer Among Member Groups of the Gynecologic Cancer Intergroup (GCIG) », International Journal of Radiation OncologyBiologyPhysics, vol. 68, , p. 485–490
- 1 2 National Institute for Health and Clinical Excellence, « High dose rate brachytherapy for carcinoma of the cervix », NICE, (consulté le )
- 1 2 3 AN Viswanathan et al., « American Brachytherapy Society cervical cancer brachytherapy task group », American Brachytherapy Society (consulté le )
- ↑ (en) AN Viswanathan et al., « Three-Dimensional Imaging in Gynecologic Brachytherapy: A Survey of the American Brachytherapy Society », International Journal of Radiation OncologyBiologyPhysics,
- ↑ (en) Kim et al., « High–Dose Rate Brachytherapy Using Inverse Planning Simulated Annealing for Locoregionally Advanced Cervical Cancer: A Clinical Report with 2-Year Follow-Up », International Journal of Radiation OncologyBiologyPhysics, vol. 75, , p. 1329
- ↑ (en) Pötter et al., « Present status and future of high-precision image guided adaptive brachytherapy for cervix carcinoma », Acta Oncologica, vol. 47, no 7, , p. 1325–1336
- ↑ (en) Pötter et al., « Recommendations from gynaecological (GYN) GEC ESTRO working group (II): Concepts and terms in 3D image-based treatment planning in cervix cancer brachytherapy—3D dose volume parameters and aspects of 3D image-based anatomy, radiation physics, radiobiology », Radiotherapy and Oncology, vol. 78, no 1, , p. 67–77
- ↑ (en) SK Hareyama et al., « High-dose-rate versus low-dose-rate intracavitary therapy for carcinoma of the uterine cervix: a randomized trial », Cancer, vol. 94, no 1, , p. 117–24
- 1 2 GS Merrick et al., « American Brachytherapy Society prostate low-dose rate task group », American Brachytherapy Society (consulté le )
- 1 2 I-C Hsu et al., « American Brachytherapy Society prostate high-dose rate task group », American Brachytherapy Society (consulté le )
- 1 2 (en) Hoskin P (éditeur), Coyle C (éditeur), Ash D et al., Radiotherpay in practice: brachytherapy, New York, Oxford University Press, , « Prostate Cancer »
- ↑ (en) WJ Morris et al., « Evaluation of Dosimetric Parameters and Disease Response After 125Iodine Transperineal Brachytherapy for Low- and Intermediate-Risk Prostate Cancer », International Journal of Radiation OncologyBiologyPhysics, vol. 73, , p. 1432–1438
- 1 2 (en) Pisansky et al., « High-dose-rate brachytherapy in the curative treatment of patients with localized prostate cancer », Mayo Clinic proceedings. Mayo Clinic, vol. 83, no 12,
- ↑ (en) Pistis et al., « External beam radiotherapy plus high-dose-rate brachytherapy for treatment of locally advanced prostate cancer: the initial experience of the Catalan Institute of Oncology », Brachytherapy, vol. 9, , p. 15
- 1 2 3 (en) Keisch et al., « American Brachytherapy Society breast brachytherapy task group », American Brachytherapy Society, (consulté le )
- 1 2 (en) Hoskin P (éditeur), Coyle C (éditeur), Hoskin P et al., Radiotherapy in practice: brachytherapy, New York, Oxford University Press, , « Breast Brachytherapy »
- 1 2 (en) C Polgár et al., « Current status and perspectives of brachytherapy for breast cancer », International Journal of Clinical Oncology, vol. 14, , p. 7
- ↑ (en) King et al., « Long-term results of wide-field brachytherapy as the sole method of radiation therapy after segmental mastectomy for T(is,1,2) breast cancer », American journal of surgery, vol. 180, no 4, , p. 299–304
- ↑ (en) A Go´mez-Iturriaga et al., « Early breast cancer treated with conservative surgery, adjuvant chemotherapy, and delayed accelerated partial breast irradiation with high-dose-rate brachytherapy », Brachytherapy, vol. 7, no 4, , p. 310–315
- ↑ http://www.rtanswers.com/treatmentinformation/cancertypes/breast/accelerated.aspx
- ↑ (en) Guix et al., « Treatment of skin carcinomas of the face by high-dose-rate brachytherapy and custom-made surface molds », International journal of radiation oncology, biology, physics, vol. 47, no 1, , p. 95–102
- ↑ (en) AF Sedda et al., « Dermatological high-dose-rate brachytherapy for the treatment of basal and squamous cell carcinoma », Clinical and Experimental Dermatology, vol. 33, no 6, , p. 745–749
- ↑ (en) E Rio et al., « Interstitial brachytherapy of periorificial skin carcinomas of the face: A retrospective study of 97 cases », International Journal of Radiation OncologyBiologyPhysics, vol. 63, , p. 753–757
- 1 2 (en) J Musmacher et al., « High dose rate brachytherapy with surface applicators: Treatment for nonmelanomatous skin cancer », Journal of Clinical Oncology, vol. 24, , p. 15543
- ↑ (en) A Members et al., « Guidelines for Percutaneous Coronary Interventions: the Task Force for Percutaneous Coronary Interventions of the European Society of Cardiology », European Heart Journal, vol. 26, no 8, , p. 804
- ↑ (en) Sidawy et al., « Peripheral vascular brachytherapy », Journal of vascular surgery : official publication, the Society for Vascular Surgery [and] International Society for Cardiovascular Surgery, North American Chapter, vol. 35, no 5, , p. 1041–7
- ↑ (en) N Pérez-Castellano et al., « Pathological Effects of Pulmonary Vein beta-Radiation in a Swine Model », Journal of Cardiovascular Electrophysiology, vol. 17, no 6, , p. 662–669
- 1 2 (en) Macmillan Cancer Support, « Brachytherapy », sur macmillan.org.uk (consulté le )
- 1 2 (en) Fieler, « Side effects and quality of life in patients receiving high-dose rate brachytherapy », Oncology nursing forum, vol. 24, no 3, , p. 545–53
- 1 2 3 4 (en) Doust et al., « A systematic review of brachytherapy. Is it an effective and safe treatment for localised prostate cancer? », Australian family physician, vol. 33, no 7, , p. 525–9
- 1 2 3 (en) N Magné et al., « Patterns of care and outcome in elderly cervical cancer patients: A special focus on brachytherapy », Radiotherapy and Oncology, vol. 91, no 2, , p. 197–201
- ↑ (en) AR Casino et al., « Brachytherapy in lip cancer », Medicina Oral, vol. 11, , E223-9
- ↑ (en) F Vicini et al., « Three-year analysis of treatment efficacy, cosmesis, and toxicity by the American Society of Breast Surgeons MammoSite Breast Brachytherapy Registry Trial in patients treated with accelerated partial breast irradiation (APBI) », Cancer, vol. 112, no 4, , p. 758–766
- ↑ (en) Department of Human Oncology, University of Wisconsin School of Medicine and Public Health, « Breast brachytherapy »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- 1 2 http://www.rtanswers.com/treatmentinformation/treatmenttypes/brachytherapy.aspx
- 1 2 3 4 5 Syllabus : page 374
- 1 2 Syllabus : page 375
Voir aussi
Bibliographie
- (en) Ervin B. Podgorsak, Review of Radiation Oncology Physics : A Handbook for Teachers and Students, International Atomic Energy Agency, , 530 p. (présentation en ligne, lire en ligne), p. 371 à 396
Liens internes
Radiothérapie à l'iode 131