
La destruction (ou dégradation) de la couche d'ozone est un amincissement voire une disparition de cette couche qui résulte d'un déséquilibre entre la production et la destruction de l’ozone dans la stratosphère[1],[2].
Évolutions de la couche d'ozone
Épaisseur
L'épaisseur de la couche d'ozone est mesurée en unité Dobson (DU), 1 DU correspondant à 2 686 100 molécules d'ozone par mètre carré. Elle varie autour du globe en fonction de la latitude et des saisons. La couche est mince au niveau de l’équateur (environ 270 DU) et plus épaisse au niveau des pôles (environ 300 DU), elle est plus mince en automne et plus épaisse au printemps. Ces variations ont pour causes les courants atmosphériques et l'énergie radiative venue du soleil[3],[4].
Appauvrissement
Il existe deux types d’appauvrissement de la couche d’ozone :
- Le premier est global, et désigne un appauvrissement lent et régulier de l’ozone stratosphérique : il est de l’ordre de 4 % par décennie, et se produit constamment depuis les années 1970.
- Le second est une perte très importante de l’ozone au niveau des pôles ; ce phénomène est saisonnier et est appelé « trou d’ozone ».
Dans les deux cas, l’appauvrissement est essentiellement dû à la destruction catalytique de l’ozone par des halogènes (chlore atomique et brome). Ces halogènes proviennent surtout de la dissociation des chlorofluorocarbures (CFC), appelés aussi fréons, par le rayonnement solaire. Les CFC sont des molécules de synthèse chimiquement très stables, inoffensives pour les êtres vivants dans l’atmosphère et ininflammables, ce pourquoi elles ont été très utilisées en réfrigération et conditionnement d'air, comme constituants des mousses synthétiques, comme gaz propulseurs pour bombes aérosols, comme extincteurs d'incendie , etc.
Ces gaz persistent des décennies dans l’atmosphère (20 à 100 ans) ; temps durant lequel ils atteignent la stratosphère où, dégradés sous l’action des ultraviolets (UV) solaires, ils détruisent la couche d'ozone qui retient la composante dangereuse du rayonnement solaire[5],[6],[7].
Histoire du phénomène
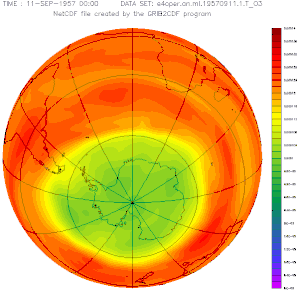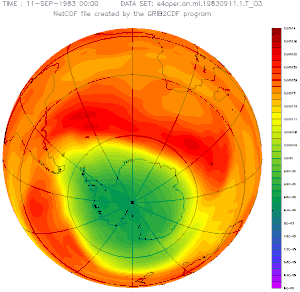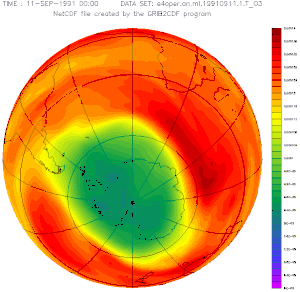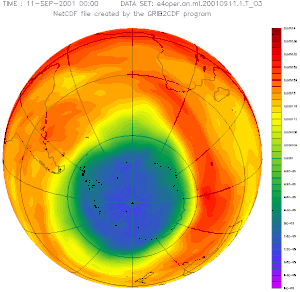
Plus la couleur est froide (vers le bleu), moins il y a d'ozone dans la stratosphère et plus les UV solaires peuvent traverser l'atmosphère.
Dégradation
L'analyse de relevés au sol réalisés dans les années 1950 a mis en évidence un trou dans la couche d'ozone, puis, dans les années 1960 à 1980, des analyses de la colonne d'air atmosphérique, jusqu'à la stratosphère — dans ce cas faites grâce aux ballons-sondes — montrent des anomalies de plus en plus importantes et saisonnières de régression de la couche d'ozone, surtout au-dessus du pôle sud[8].
- 1985 : Au milieu des années 1980, alors que des travaux scientifiques cherchant à évaluer l'impact des effets des activités anthropiques sur l'ozone stratosphérique (O3) venaient de suggérer que les perturbations saisonnières sur l’ozone devraient rester faibles pour au moins la prochaine décennie, les résultats des mesures faites in situ contredisent leurs conclusions[9].
Au vu de la réalité, c’est-à-dire des observations in situ qui montrent que les valeurs printanières pour l’ozone total en Antarctique sont au contraire alors en forte diminution, ces conclusions sont remises en question : les modèles jusqu'alors utilisés étaient très simplificateurs (à une dimension), sous-estimant la complexité des réactions photochimiques à l’œuvre dans l'atmosphère polaire.
Comme la circulation atmosphérique basse était a priori restée apparemment inchangée, des réactions chimiques complexes ont dû être envisagées pour expliquer cette persistance du trou au printemps.
En 1985, Farman et al.[10] suggèrent que les températures très basses qui règnent au cœur de l'hiver et jusqu’à plusieurs semaines après l'équinoxe de printemps montrent que la stratosphère antarctique est uniquement (selon eux) sensible à l’augmentation saisonnière du taux de composés inorganiques du chlore (CLx), principalement via l'effet de cette augmentation sur le ratio NO2/NO. Ce phénomène, combiné avec le fait que l’irradiation UV est particulièrement élevée dans la stratosphère polaire, pourrait expliquer la perte d’ozone observée. - 1987 : La signature du protocole de Montréal est l'occasion d'une prise de conscience générale.
- 1988 : Un rapport de l'Organisation météorologique mondiale confirme le problème[11].
- 1989 : Un nouveau rapport confirme le problème[12].
- 1990 : Les mesures du protocole font l'objet d'ajustements à Londres (London Amendment and adjustment).
- 1991 : Un nouveau rapport confirme l'appauvrissement de la couche d'ozone[13].
- 1992 : Sous l'égide de l'ONU, les États acceptent de prendre en compte (progressivement) le bromure de méthyle[14],[15].
Amélioration durant deux décennies
Les 20 ans qui suivent 1992 voient la situation lentement et globalement s'améliorer, mais les suivis scientifiques pointent encore des anomalies périodiques : la concentration d’ozone de la stratosphère arctique s’est par exemple réduite de 40 % pendant l'hiver 2011 (un record, expliqué par des températures inhabituellement froides en Antarctique et, sans doute, par la persistance dans l'atmosphère de gaz destructeurs d'ozone[16]), mais la tendance globale semble être à l'amélioration :
- En 2008, des indices laissent penser que la formation du trou est ralentie ou stabilisée[17].
- 2011 : les niveaux d'ozone tendent à se rapprocher de la normale dans la haute atmosphère[18] puis diminuent à nouveau lors d'une période froide
- 2014[19]/2015 : un rapport de l'Organisation météorologique mondiale confirme l'amélioration à haute altitude, et moindrement dans les latitudes moyennes et basses[20].
- En 2022, un rapport de l'Organisation météorologique mondiale estime que le protocole de Montréal permet la reconstitution de la couche d'ozone. Le rapport conclut que la couche d'ozone retrouvera son état de 1980 vers 2066 pour l'Antarctique, 2045 pour l'Arctique et 2040 pour le reste du monde[21].
Nouvelles inquiétudes
.jpg.webp)
- En 2015, les mesures au sol et spatiales de l'ozone et du rayonnement ultraviolet, complétées de réanalyses météorologiques montrent que « le trou d'ozone de 2015 a été l'un des plus graves jamais enregistrés en ce qui concerne la superficie maximale, et le déficit intégré et a été particulièrement durable, avec de nombreuses valeurs supérieures aux extrêmes précédents en octobre, novembre et décembre »[22]. Ceci a été postérieurement (en 2019) attribué à des conditions très froides en altitude, et aux effets d'aérosols issus de l'éruption du volcan Calbuco (Chili) en avril 2015[22]. En 2016, la situation s'améliorait avec des mesures toutes égales ou inférieures aux valeurs médianes enregistrées pour les 37 années observées depuis 1979 avec des observations satellites adéquates[22].
- En 2016, dans la revue Science, en juin, un article signale que le trou d'ozone antarctique a depuis qu'il existe « provoqué des changements importants dans le climat estival de l'hémisphère sud (…) avec ses répercussions sur la température de surface, les précipitations et les océans. Dans l'hémisphère Nord, aucun lien solide n'a été trouvé entre appauvrissement d'ozone stratosphérique et le climat troposphérique ». Les auteurs confirment la tendance à la réduction du trou antarctique (de plus de 4 millions de km2 entre depuis 2000 et 2016).
Au rythme des modélisations prospectives, sur la majeure partie du globe, le total de la couche d'ozone devrait aux latitudes moyennes et en Arctique retrouver avant 2050 des niveaux comparables à ceux de 1980, et un peu plus tard sur l'Antarctique, à condition que le Protocole de Montréal soit pleinement respecté. Plus de la moitié de la réduction constatée résulte alors de la diminution des CFC dans l’atmosphère[8] et la plupart des produits délétères pour l'ozone sont en forte diminution. Cependant les hydrochlorofluorocarbures (HCFCs) et l'halon-1301 continuent à anormalement augmenter.
En 2016, on constate — en particulier à partir de sources tropicales — une augmentation préoccupante de nouvelles émissions anthropiques de produits chlorés et bromés à très courte vie (VSV) qui deviennent un problème émergent pour l'ozone stratosphérique ; le taux de dichlorométhane a doublé dans l'air entre 2004 et 2014[24]. De même les émissions de HFC-23 (sous-produit du HCFC-22) se sont poursuivies « en dépit des efforts d'atténuation »[20].
La couche d'ozone reste vulnérable alertent les auteurs du rapport de 2016 ; ainsi une grande éruption volcanique (ou une opération de géoingénierie) introduisant une grande quantité de soufre dans l'atmosphère « se traduirait par une diminution chimique importante de l'ozone sur une grande partie du globe »[20]. Depuis 1995 environ, le taux de trichlorofluorométhane (CFC-11) dans l'air (second CFC le plus abondant) a continué à décliner mais moins vite depuis 2012[25], laissant penser que des sources industrielles persistent et même augmentent[26],[27] quelque part en Asie orientale[26].
- En 2019, les données atmosphériques collectées à Gosan (Corée du Sud) et Hateruma (Japon), les données de surveillance mondiales, et les simulations issues de modèles de transport de substances chimiques dans l'air montrent toutes que des CFC-11 sont émis en Asie orientale (plus de 7,0 ± 3,0 [± 1 d'écart-type] par an pour la période 2014-2017 par rapport à celles de 2008-2012, surtout du côté des provinces du Shandong et de Hebei dans le nord-est de la Chine). Cette augmentation compte pour au moins 40 à 60 % de la hausse mondiale des émissions de CFC-11. Selon les données disponibles les autres pays (y compris de l'est de l'Asie) semblent respecter le protocole de Montréal, mais le manque de mesures locales de CFC dans une grande partie du monde empêche encore de détecter les autres sources d'augmentation de CFC-11. Des indices font au moins évoquer une nouvelle production et utilisation en Chine, contrevenant au Protocole de Montréal qui visait l'interdiction totale d'émissions de chlorofluorocarbones avant 2010[28],[29].
- le protoxyde d'azote (N2O), autre gaz destructeur de la couche d'ozone, augmente aussi dans l'air depuis le début des années 1970, inquiétant météorologues et scientifiques[30]. Au début du XXIe siècle, il est devenu le premier ennemi de la couche d'ozone selon plusieurs articles scientifiques, notamment en 2002[31], 2009[32] et 2013. Et le GIEC prévoit qu'il devrait continuer à s'accumuler dans l'air, tendance confirmée par un article publié près de dix ans plus tard, en 2018 dans Science, et il devrait le rester durant tout le XXIe siècle[32] car la part de protéines animales dans alimentation humaine ne cesse de croître, associée à une production de fumier et de soja également croissante, source d'oxyde nitreux. Selon un article de la revue Nature Geoscience, le lisier et le fumier perdent dans l'air 2 % environ de l'azote qu'ils contenaient et les engrais azotés 2,5 % ; ces deux sources introduisent dans l'atmosphère 2,8 millions de tonnes de N2O pour les lisiers et 2,2 millions de tonnes pour les engrais de synthèse (dont la production et le transport et l'épandage produisent aussi par ailleurs du CO2 qui aggrave l'effet de serre qui lui-même freine la restauration de la couche d'ozone). L'industrie rejette officiellement bien moins de N2O (0,8 million de t/an environ) que l'agriculture et que la combustion de la biomasse (0,5 million de t/an), mais elle produit une quantité croissante de N2O vendu comme gaz servant d'après l'étiquette à faire des mousses en cuisine, mais en réalité essentiellement consommé comme drogue dite « récréative » à inhaler (non-interdite).
- En 2021, selon l'observatoire européen de l'atmosphère Copernicus, l'étendue du trou de la couche d'ozone est désormais supérieure à celle de l'Antarctique, et supérieure de 75 % à celle relevée à la même période de l'année en 1979[33].
Restauration (XXIe siècle)
En Antarctique, le trou de l'hémisphère sud avait refroidi l'atmosphère, le climat au sol et engendré des vents d'ouest stratosphériques plus forts (vers le 60e parallèle sud)[34].
Depuis 2001, la restauration de l'ozone antarctique tend à inverser ces changements ; on observe dans cette région un réchauffement de la basse stratosphère polaire sud et un affaiblissement du vortex polaire stratosphérique. De 2001 à 2020, la température et de la circulation dans la stratosphère ont décliné (−50 à −75 % par rapport au moment de l'appauvrissement de la couche d'ozone), de manière conforme à ce qu'annonçaient les modélisations[34].
Étapes de la destruction de la couche d'ozone
Les principales phases de la destruction de la couche d'ozone sont[7] :
- émission des (CFC) et autres composés halogènes par les activités humaines et les processus naturels à la surface de la terre ;
- accumulation de ces composés chimiques dans l’atmosphère inférieure (troposphère) car ils sont très stables et non réactifs ;
- transport de ces composés chimiques vers la stratosphère par la circulation atmosphérique ;
- conversion de ces composés en composés réactifs dans la stratosphère par des réactions chimiques impliquant les rayons ultraviolets, ces composés réactifs étant responsables de la destruction de l'ozone stratosphérique ;
- élimination de ces composés par l'humidité dans les nuages et la pluie au niveau de la troposphère.
Causes de la destruction de la couche d'ozone
Causes naturelles
Trois grands processus naturels peuvent affecter la couche d'ozone (en pouvant parfois combiner leurs effets) :
Taches solaires et rayonnement cosmique
Les taches solaires contribuent à 1 à 2 % de la dégradation de la couche d'ozone mondiale, temporairement ;
Des astrophysiciens ont supputé dans les années 1970 que le rayonnement gamma d'une supernova se produisant à quelques dizaines de parsecs de la Terre pourrait dégrader la couche d'ozone au point de peut-être pouvoir déclencher une extinction de masse. La chimie atmosphérique est maintenant mieux comprise, et on en sait plus sur les occurrences de supernovae ainsi que sur leurs spectres d'émission de rayons gamma. Des simulations laissent penser que ceci est possible, mais avec un risque faible et précédemment surestimé : pour doubler le flux UV "biologiquement actif" au sol, il faudrait que la supernova ait lieu à moins de 8 pc. ce qui risque peu de se produire (1,5 Gyr-1)[35].
Vents stratosphériques
En agissant sur les vortex polaires, notamment ; ils contribuent pour 1 à 2 % de la dégradation de la couche d'ozone mondiale, et toujours temporairement.
Grandes éruptions volcaniques explosives
Ces évènements géologiques injectent dans la stratosphère d'énormes masses d'aérosols incluant des halogènes, qui se dispersent dans le monde via la circulation atmosphérique à grande échelle[36].
Ainsi les deux éruptions majeures d'El Chichón (1982) puis du Pinatubo (1991) ont respectivement injecté dans l'atmosphère 1,8[37] et 3 à 4,5[38],[39],[40] mégatonnes de chlore (d'après les estimations pétrologiques) ; des prélèvements faits in situ en avion qui ont montré qu'El Chichón a émis d'au moins 0,04 Mt de HCl (9 % environ de tout le chlore stratosphérique à ce moment)[41].
Du NaCl particulaire (halite), libérant du HCl au contact d'acide sulfurique en aérosol, a aussi été trouvé dans le panache stratosphérique d'El Chichón[42].
Le panache du Pinatubo en 1991 contenait en altitude bien moins de HCl que celui d'El Chichón[43], probablement parce qu'il a été "lessivé" par le typhon qui balayait les Philippines à ce moment[44],. Il a cependant appauvri l'ozone mondial (~ 2,5 % de l'ozone mondial)[45].
La comparaison des émissions de ces deux éruptions montrent qu'au moins quatre facteurs vont coinfluer sur l'impact d'une grande éruption explosive sur la couche d'ozone (et par suite sur le rayonnement et le climat)[36] :
- les conditions météo sur le lieu de l'éruption[46],[43],[47] et au niveau stratosphérique ;
- le contexte spatiotemporel (latitude, saison et hauteur du panache)[48],[49],[50] ;
- la teneur initiale en halogène de la stratosphère[51] ;
- la teneur du magma en soufre et en halogènes[52] (brome notamment[53]) ;
La quantité de soufre et d'halogènes émis par une éruption varie de quelques tonnes à des mégatonnes (1 MT=1 million de tonnes)[46],[54],[55],[56],[57].
Presque tout ce soufre atteint la stratosphère, alors que les halogènes « volcaniques » (Chlore, brome) sont plus aisément piégés par l'eau météoritique, la vapeur d'eau ou de la glace, au fur et à mesure que le panache du volcan gagne la stratosphère. Au début des années 2000 on en ignorait encore la part de ces halogènes qui atteint vraiment la stratosphère[58]. On sait maintenant que des halogènes atteignent la troposphère supérieure et la stratosphère inférieure, avec le dioxyde de soufre. Le chlore forme dans la stratosphère de l'acide chlorhydrique, le soufre y forme de l'acide sulfurique (persistant un mois environ), ce qui catalyse[59] les réactions chimiques détruisant la couche d'ozone[60],[7],[61],[62].
Dès les années 1970 on a compris que le chlore volcanique pouvait interférer avec des processus de chimie stratosphériques[63]. Une première évaluation simplifiée (1978) de l'injection et de la dispersion de chlore volcanique[64] a conclu que lors d'éruptions majeures il peut dégrader la couche d'ozone de plusieurs pour cent ; l'éruption du Krakatoa (1883) aurait ainsi détruit environ 7 % de l'ozone stratosphérique, et l'éruption d'Agung (1963) en aurait détruit 1 %[36].
En 2019, une étude a combiné des données de rejets de soufre, de chlore et de brome « volcaniques » en zone tropicale à des simulations prenant en compte les rétroactions radiatives-dynamiques-chimiques. Les simulations d'un modèle halogène considérant les éruptions connues en Amérique sur les derniers 200 000 ans, révèlent un impact global sur la couche d'ozone et affectant la composition atmosphérique et la circulation pour une décennie[36]. L'ozone dans la colonne atmosphérique chute sous les 220 DU (seuil d'apparition des trous d'ozone) dans les tropiques, dans l'Arctique et en Antarctique[36]. Il s'ensuit une hausse (+80 à +400 %) des UV biologiquement actifs. Il s'agit d'une modélisation, dont les résultats pourraient être confirmés par des données fournies par les carottes de glace et la palynologie[36].
Causes anthropiques
L'équilibre naturel entre la production et la destruction d'ozone est perturbé par la libération excessive dans l'atmosphère de produits de synthèse provenant des activités humaines tels que les chlorofluorocarbures (CFC), les halons, les hydrochlorofluorocarbures, le bromure de méthyle, le tétrachlorure de carbone, etc., dites substances appauvrissant la couche d'ozone (SAO). Ces SAO stagnent longtemps dans l'atmosphère : chimiquement stables, elles y sont transportées vers la stratosphère, où leur dégradation intervient pour 90 % environ dans l'appauvrissement total de la couche d'ozone[60],[7].
Dans les années 2010 on a montré que certains composés halogénés, à très courte durée de vie mais émis en grande quantité par les pays industrialisés, ont aussi un effet de destruction de la couche d'ozone. Il s'agit notamment du chloroforme CHCl3, du dichlorométhane CH2Cl2, du perchloroéthylène C2Cl4 et du 1,2−dichloroéthane C2H4Cl2[65]. Ces composés sont préoccupants car leur concentrations dans l'atmosphère n'ont pas cessé d'augmenter depuis leur invention jusqu'en 2017[66].
Le dérèglement climatique pourrait aussi accroître les émissions naturelles de gaz destructeurs d'ozone (notamment CH3Cl et CH3Br), de même que le taux atmosphérique de certains gaz à effet de serre (N2O et CH4). Il pourrait encourager des tentatives de géoingénierie stratosphérique basées sur des aérosols soufrés ; autant de paramètres susceptibles de nuire à la couche d'ozone.
Causes de l'augmentation du trou de la couche d'ozone
La couche d'ozone est naturellement plus fine au-dessus des pôles, mais elle a commencé dans les années 1950 à saisonnièrement disparaître sur une étendue de plus en plus importante (phénomène plus connu sous le nom de trou de la couche d'ozone).
Cycle de Chapman
Le processus naturel de formation et de destruction de l'ozone stratosphérique est comme suit :
| Réaction | Durée de vie du réactif | Bilan enthalpique |
|---|---|---|
| O2 + hν → 2 O | 111 kcal/mol | |
| O2 + O + M → M + O3 | O : 1s | -25 kcal/mol |
| O3 + hν → O + O2 | O3 : 100-1000s | 39 kcal/mol |
| O3 + O → 2 O2 | O : 100-1000s
O3 : 100 000-1 000 000s |
-94 kcal/mol |
| O + O + M → M + O2 | O : 100-1000s | -111 kcal/mol |
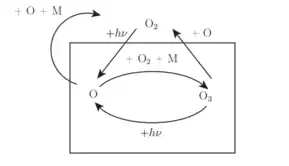
Le dioxygène est photodissocié suivant la première réaction. L'oxygène atomique en résultant va ensuite s'associer le plus souvent avec une autre molécule de dioxygène pour former de l'ozone, la tierce molécule M permettant de désexciter la nouvelle molécule par collision. L'oxygène atomique peut également, mais beaucoup plus rarement, s'associer avec un autre atome d'oxygène ou une molécule d'ozone.
L'ozone ainsi créé peut être détruit de deux manières : soit il est dissocié par rayonnement UV (dissociation la plus probable), soit il s'associe avec un atome d'oxygène pour former du dioxygène.
Le cycle de Chapman est ainsi fermé.
Ce processus explique comment l'ozone absorbe les UV lorsqu'il est détruit. Par ailleurs, cette réaction exothermique participe donc au réchauffement de la stratosphère. Enfin, on comprend pourquoi l'ozone connaît un cycle annuel très marqué aux pôles. En effet, durant la nuit hivernale (resp. estivale), il n'y a aucun rayonnement UV au pôle nord (resp. pôle sud) ce qui explique que des quantités importantes d'ozone se forment. Au contraire, en été (resp. en hiver), le fort rayonnement UV détruit cette couche d'ozone qui protège néanmoins la surface terrestre des rayons UV.
Mécanisme de la destruction de la couche d'ozone par les CFC
Les CFC flottent vers la stratosphère qui est riche en ozone, le contact des CFC avec le rayonnement ultraviolet provoque la libération d'un atome de chlore, ce chlore libre réagit avec une molécule d'ozone et forme le monoxyde de chlore (ClO) et une seule molécule de dioxygène O2 (Cl + O3 ↔ ClO + O2). Un seul atome d'oxygène réagit avec la molécule de monoxyde de chlore provoquant la formation d'une molécule de dioxygène et un seul atome de chlore (ClO + O ↔ Cl + O2), cet atome de chlore menaçant continue alors le cycle et entraîne une destruction supplémentaire de la couche d'ozone donc le même atome de chlore peut détruire plusieurs molécules d'ozone, un atome de chlore peut détruire plus de 100 000 molécules d'ozone[60],[7].
Causes chimiques
Plusieurs facteurs sont à l'origine de la diminution (photochimique et catalytique) de la couche d'ozone, notamment un grand nombre de substances naturelles ou artificielles présentes dans l'atmosphère ou résultant de réactions chimiques.
Ces molécules sont regroupées sous le vocable SAO (Substances appauvrissant la couche d'ozone).
Il s'agit principalement des CFC, des halons, du bromure de méthyle et des HCFC, mais les oxydes d'azote (NOx) contribuent également à cette destruction.
Voici comment se décompose cette réaction, pour X l'agent chimique responsable de la destruction d'ozone.
| Réaction | Effet de la réaction |
|---|---|
| O3 + X → XO + O2 | Le réactif X détruit les molécules d'ozone |
| O3 + hν → O + O2 | D'autres molécules d'ozone sont détruites par le rayonnement UV |
| O + XO → X + O2 | Le réactif XO réagit également avec l'atome O et X se libère de sa liaison avec l'oxygène |
Le bilan net de cette réaction est 2 O3 + hν → 3 O2, c'est pourquoi on peut dire que X agit comme un catalyseur.
Paul Crutzen a montré que les oxydes d'azote NO et NO2 sont les plus importants dans ces réactions, mais ils sont très rares dans la stratosphère. En revanche, les CFC, libèrent du chlore sous l'effet du rayonnement UV au-dessus de 25 km d'altitude sous forme de Cl et de ClO, très efficaces pour détruire l'ozone.
Causes climatiques
Le froid en altitude est un facteur aggravant, car il rend les CFC (chlorofluorocarbures) présents plus destructeurs pour la couche d'ozone[67].
En hiver dans les régions polaires, les températures très basses provoquent une formation de nuages dans la basse stratosphère, ces nuages favorisent des réactions chimiques qui transforment des composés stables issus de la réaction des atomes de chlore des CFC avec d'autres substances en composés actifs, au printemps le retour de soleil provoque une destruction rapide et importante de l'ozone par ces composés actifs[68].
Or, l'effet de serre modifie l'albédo de l'atmosphère et sa température et y contribue en réchauffant les basses couches de l'atmosphère à priver les hautes couches d'une partie des calories normalement renvoyées du sol vers l'espace. Paradoxalement, le réchauffement global peut se traduire par un refroidissement des hautes couches de l'atmosphère et ce froid intensifie les réactions chimiques de destruction de l'ozone[67].
Il est à noter que certains gaz destructeurs de la couche d'ozone sont aussi des gaz à effet de serre, le bromure de méthyle par exemple.
Conséquences de la dégradation de la couche d'ozone
La dégradation de la couche d'ozone engendre une augmentation des rayons ultraviolets qui vont atteindre la Terre, ces rayons sont nocifs pour tous les êtres vivants sur Terre[69].
Conséquences sur la santé humaine
Au début des années 1990 on s'inquiète des effets de la perte d'ozone stratosphérique en termes d'augmentation de l’exposition aux rayonnements ultraviolets[70], qui peut provoquer plusieurs types de cancer de la peau chez l’homme dont le carcinome basocellulaire et le cancer épidermoïde. Ils sont aussi dangereux sur les yeux (cause de cataracte et de photokératite).
Les rayons (UV) affaiblissent en outre la réponse du système immunitaire et provoquent aussi son altération[69],[71].
Dans les années 2010 on cherche à mieux modéliser ces effets en lien avec ceux du réchauffement climatique[72].
Conséquences sur les écosystèmes
Les rayons UV affectent également les plantes en réduisant la photosynthèse et peuvent altérer le temps de floraison de certaines espèces végétales. Ils peuvent également affecter directement la croissance des plantes en modifiant les processus physiologiques et de développement des plantes. Les principales espèces de cultures qui sont particulièrement vulnérables à l'augmentation des UV sont : le blé, le riz, l'orge, l'avoine, le maïs, le soja, les pois, les tomates, les concombres, le chou-fleur, le brocoli et les carottes.
Les rayons ultraviolets affectent également d'autres formes de vie, c'est l'une des principales raisons du déclin de nombre d'espèces d'amphibiens dont ils affectent chaque étape du cycle de vie. Ils gênent la croissance et le développement depuis le stade larvaire, diminuent l'immunité chez certaines espèces et provoquent même des dommages rétiniens et la cécité chez certaines espèces.
Les rayons UV ont également des effets néfastes sur l'écosystème marin, en particulier le plancton qui joue un rôle vital dans la chaîne alimentaire et le cycle du carbone océanique[71],[69].
Conséquences sur l’environnement
L'appauvrissement de la couche d'ozone entraîne une diminution de l'ozone dans la stratosphère et une augmentation de l'ozone présent dans la basse atmosphère. L'ozone dans la basse atmosphère est un polluant et un gaz à effet de serre[71],[69],[73].
Conséquences sur les cycles biogéochimiques
L'augmentation du rayonnement UV-B pourrait affecter les cycles biogéochimiques terrestres et aquatiques, ce qui modifie les sources et les puits de gaz à effet de serre et chimiquement importants (par exemple, le dioxyde de carbone, le monoxyde de carbone, le sulfure de carbonyle, l'ozone et éventuellement d'autres gaz). Ces changements potentiels contribueraient aux rétroactions biosphère-atmosphère qui atténuent ou amplifient les concentrations atmosphériques de ces gaz[74].
Conséquences sur le climat
Le trou dans la couche d'ozone pourrait contribuer de plusieurs manières au réchauffement climatique.
La première raison, qui conduit à une contribution faible au réchauffement climatique, c'est que le rayonnement UV qui n'est pas arrêté par la couche d'ozone est absorbé par la surface terrestre et contribue donc à la réchauffer. Mais la raison la plus importante est que l'ozone, en se dissociant et en absorbant les UV, contribue à réchauffer la stratosphère. Par conséquent, la stratosphère étant plus froide au niveau du trou de la couche d'ozone, cela a des conséquences sur la circulation atmosphérique et sur la hauteur de la tropopause.
Le bilan de toutes ces contributions n'est pas évident à déterminer, mais selon les experts du GIEC, la reconstruction de la couche d'ozone au-dessus de l'Antarctique à la suite du protocole de Montréal devrait freiner le réchauffement climatique global, même si elle participera à réchauffer le pôle Sud en agissant comme un gaz à effet de serre[75].
La destruction de la couche d'ozone est la cause d'une perturbation de la circulation atmosphérique[76]. Néanmoins, cette perturbation a tendance à s'estomper au fur et à mesure que la couche d'ozone se reconstitue[77],[21].
Protocole de Montréal
Le , les Nations unies ont adopté le protocole de Montréal sur les substances qui dégradent la couche d’ozone, il est considéré comme un accord de protection de l'environnement. Il impose aux pays développés et en développement des obligations d'élimination progressive pour toutes les principales substances appauvrissant la couche d'ozone, y compris les CFC, les halons et les produits chimiques de transition moins nocifs comme les HCFC. Le protocole vise 96 produits chimiques dans des milliers d'applications dans plus de 240 secteurs industriels.
Le protocole a été renforcé par six amendements - Londres 1990, Copenhague 1992, Vienne 1995, Montréal 1997, Pékin 1999 et Kigali en 2016 - qui ont présenté des calendriers d'élimination et ajouté de nouvelles substances appauvrissant la couche d'ozone à la liste des substances contrôlées par le protocole de Montréal.
Le protocole de Montréal a également produit d'autres avantages environnementaux importants. Plus particulièrement, l'élimination des substances appauvrissant la couche d'ozone est responsable de retarder le forçage climatique jusqu'à 12 ans.
Les dommages causés à la couche d'ozone protectrice de la Terre ont suscité une préoccupation et une action mondiales sans précédent. Depuis qu'il a été convenu en 1987 de supprimer progressivement les substances qui appauvrissent la couche d'ozone (aussi connues sous le nom de SAO), 196 pays ont ratifié le Protocole de Montréal. En , le Timor oriental a ratifié le protocole de Montréal, ce qui en fait le premier traité international sur l'environnement à parvenir à une ratification complète - un effort vraiment remarquable qui reflète l'acceptation et le succès universel de l'accord[78],[3].
Prospective
En 2008, certains experts s'inquiètent en outre de projets de géoingénierie du climat visant à injecter des aérosols sulfatés dans l'atmosphère pour refroidir le climat ; ce qui pourrait avoir comme conséquence négative d'affecter la couche d'ozone au-dessus des zones polaires, comme l'ont montré les études sur les effets sur l'ozone des grands panaches d'éruptions volcaniques majeures. Selon Tilmes & al. en 2008 : « Une injection de soufre suffisamment importante pour compenser le réchauffement de la surface terrestre causé par le doublement du CO2 atmosphérique augmenterait fortement l'étendue de l'appauvrissement de la couche d'ozone dans l'Arctique au cours du siècle en cours pour les hivers froids et entraînerait un retard considérable, de 30 à 70 ans, dans le récupération du trou d'ozone antarctique »[79]
Peu après, on s'inquiète aussi du retour de certains CFC dans l'industrie (voir plus haut).
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Ozone depletion » (voir la liste des auteurs).
- ↑ (en) Narayan Singh, Amit Kumar Thakur, P. L. Sharma et Pankaj Sharma, Climate Change and Environmental Issues, The Energy and Resources Institute (TERI), , 254 p. (ISBN 978-81-7993-590-3, lire en ligne).
- ↑ Gouvernement du Canada, Environnement et Changement climatique Canada, « Environnement et Changement climatique Canada - Air - Appauvrissement de la couche d'ozone », sur ec.gc.ca (consulté le ).
- 1 2 (en) Shagoon Tabin, Global Warming : The Effect Of Ozone Depletion, APH Publishing, , 194 p. (ISBN 978-81-313-0396-2, lire en ligne).
- ↑ Marc Joubert, « Amincissement de la couche d'ozone », sur Planet Terre - ENS Lyon, (consulté le ).
- ↑ (en) Shagoon Tabin, Global Warming : The Effect Of Ozone Depletion, APH Publishing, , 194 p. (ISBN 978-81-313-0396-2, lire en ligne).
- ↑ (en-US) « Causes Of Ozone Depletion - Universe Today », Universe Today, (lire en ligne, consulté le ).
- 1 2 3 4 5 (en-US) US Department of Commerce, NOAA, Earth System Research Laboratory, Chemical Sciences Division, « Scientific Assessment of Ozone Depletion 2014: Twenty Questions and Answers About the Ozone Layer: Introduction », sur www.esrl.noaa.gov (consulté le ).
- 1 2 « Le trou dans la couche d’ozone est en train de se résorber », sur lemonde.fr, (consulté le ).
- ↑ Vienna Convention Atmospheric Ozone 1985. WMO No. 16.
- ↑ (en) Farman, J. C., Gardiner, B. G., & Shanklin, J. D. (1985). Large losses of total ozone in Antarctica reveal seasonal ClOx/NOx interaction (résumé).
- ↑ International Ozone Trends Panel Report 1988. WMO No. 18.
- ↑ Scientific Assessment of Stratospheric Ozone: 1989. WMO No. 20.
- ↑ Scientific Assessment of Ozone Depletion: WMO No. 25.
- ↑ UNEP (1992) Methyl Bromide: Its Atmospheric Science, Technology, and Economics (Assessment Supplement).
- ↑ UNEP (1992), Copenhagen Amendment and adjustments.
- ↑ Goudet JL ; « Et l’on reparle du trou dans la couche d’ozone », Futura science, 5 avril 2011.
- ↑ Yang, E.-S. et al. J. Geophys. Res. Atmos. 113, D20308 (2008).
- ↑ Salby, M., Titova, E. & Deschamps, L. Geophys. Res. Lett. 38, L09702 (2011).
- ↑ Scientific Assessment of Ozone Depletion: 2014. WMO No. 55.
- 1 2 3 WMO (2016) Scientific Assessment of Ozone Depletion: 2014 35 MByte)[PDF], présentation (en) ; World Meteorological Organization.
- 1 2 (en) Organisation météorologique mondiale, Scientific assessment of ozone depletion : 2022, Genève, (ISBN 978-9914-733-99-0, lire en ligne)
- 1 2 3 4 Tully M.B, Klekociuk A.R, Krummel P.B, Gies H.P, Alexander S.P, Fraser, P.J, … & Stone K.A (2019) The Antarctic ozone hole during 2015 and 2016. Journal of Southern Hemisphere Earth System Science, 1-32 (résumé).
- ↑ Evtushevsky, O., Klekociuk, A. R., Kravchenko, V., Milinevsky, G., & Grytsai, A. (2019) The influence of large amplitude planetary waves on the Antarctic ozone hole of austral spring 2017. Journal of Southern Hemisphere Earth Systems Science, 1-12 (résumé).
- ↑ cf.« Une autre menace sur la couche d'ozone », Pour la Science, no 479, , p. 12
- ↑ Carpenter L.J & Reimann S (2014) in Scientific Assessment of Ozone Depletion : 2014 Ch.1 (OMM : World Meteorological Organization)
- 1 2 Montzka S.A et al. (2018) An unexpected and persistent increase in global emissions of ozone-depleting CFC-11. Nature 557, 413–417.
- ↑ Prinn R.G et al. (2018) History of chemically and radiatively important atmospheric gases from the Advanced Global Atmospheric Gases Experiment (AGAGE). Earth Syst. Sci. Data 10, 985–1018.
- ↑ « Un gaz néfaste pour la couche d'ozone, pourtant interdit, repéré en Chine », sur Sciences et Avenir, (consulté le ).
- ↑ Tristan Vey, « Couche d’ozone : la Chine émet en toute illégalité un gaz destructeur », sur lefigaro.fr, (ISSN 0182-5852, consulté le ).
- ↑ (en) Crutzen P.J. (1970), The influence of nitrogen oxides on the atmospheric ozone content [PDF], Quarterly Journal of the Royal Meteorological Society, 96(408), 320-325.
- ↑ Randeniya, L. K., Vohralik, P. F. et Plumb, I. C. (2002), Stratospheric ozone depletion at northern mid latitudes in the 21st century: The importance of future concentrations of greenhouse gases nitrous oxide and methane. Geophysical research letters, 29(4).
- 1 2 (en) Ravishankara A.R, Daniel J.S et Portmann R.W (2009), Nitrous oxide (N2O): the dominant ozone-depleting substance emitted in the 21st century [PDF], Science, 326(5949), 123-125.
- ↑ « Comment le trou de la couche d’ozone est devenu plus grand que l’Antarctique », sur leparisien.fr, (consulté le ).
- 1 2 (en) Brian Zambri, Susan Solomon, David W. J. Thompson et Qiang Fu, « Emergence of Southern Hemisphere stratospheric circulation changes in response to ozone recovery », Nature Geoscience, vol. 14, no 9, , p. 638-644 (ISSN 1752-0894 et 1752-0908, DOI 10.1038/s41561-021-00803-3, lire en ligne, consulté le ).
- ↑ Gehrels, N., Laird, C. M., Jackman, C. H., Cannizzo, J. K., Mattson, B. J., & Chen, W. (2003). Ozone depletion from nearby supernovae. The Astrophysical Journal, 585(2), 1169 (résumé).
- 1 2 3 4 5 6 Brenna H, Kutterolf S & Krüger K (2019) Global ozone depletion and increase of UV radiation caused by pre-industrial tropical volcanic eruptions. Sci Rep 9, 9435 | doi:10.1038/s41598-019-45630-0 |URL=https://www.nature.com/articles/s41598-019-45630-0
- ↑ Varekamp J.C, Luhr J.F & Prestegaard K.L (1984) The 1982 eruptions of El Chichon volcano (Chiapas, Mexico): character of the eruptions, ash-fall deposits and gas phase. J. Volcanol. Geotherm. Res. 23, 39–68
- ↑ Westrich H.R & Gerlach T.M (1992) Magmatic gas source for the stratospheric SO2 cloud from the June 15,1991, eruption of Mount Pinatubo. Geology 20, 867.
- ↑ Gerlach, T. M., Westrich, H. R. & Symonds, R. B. (1996) Preeruption Vapor in Magma of the Climactic Mount Pinatubo Eruption: Source of the Giant Stratospheric Sulfur Dioxide Cloud. In FIRE and MUD: Eruptions and Lahars of Mount Pinatubo, Philippines
- ↑ Self, S., Zhao, J. -X., Holasek, R. E., Torres, R. C. & King, A. J. (1996) The Atmospheric Impact of the 1991 Mount Pinatubo Eruption. in FIRE and MUD: Eruptions and Lahars of Mount Pinatubo, Philippines (eds Newhall, C. G. & Punongbayan, R. S.).
- ↑ Mankin W.G & Coffey M.T (1984) Increased Stratospheric Hydrogen Chloride in the El Chichon Cloud. Science. 226, 170–172.
- ↑ Woods, D. C., Chuan, R. L. & Rose, W. I. (1985) Halite Particles Injected into the Stratosphere by the 1982 El Chichon Eruption. Science. 230, 170–172
- 1 2 Mankin W.G, Coffey M.T & Goldman A (1992) Airborne observations of SO2, HCl, and O3 in the stratospheric plume of the Pinatubo Volcano in July 1991. Geophys. Res. Lett. 19, 179–182.
- ↑ von Glasow, R., Bobrowski, N. & Kern, C. (2009) The effects of volcanic eruptions on atmospheric chemistry. Chem. Geol. 263, 131–142.
- ↑ Telford, P., Braesicke, P., Morgenstern, O. & Pyle, J. Reassessment of causes of ozone column variability following the eruption of Mount Pinatubo using a nudged CCM. Atmos. Chem. Phys. 9, 4251–4260 (2009)
- 1 2 Krüger, K., Kutterolf, S. & Hansteen, T. H. (2015) Halogen release from Plinian eruptions and depletion of stratospheric ozone. in Volcanism and Global Environmental Change (eds Schmidt, A., Fristad, K. E. & Elkins-Tanton, L. T.) 244–259 (Cambridge University Press), https://doi.org/10.1007/9781107415683.017
- ↑ Self S & King A.J (1996) Petrology and sulfur and chlorine emissions of the 1963 eruption of Gunung Agung, Bali, Indonesia. Bull. Volcanol. 58, 263–285.
- ↑ Toohey, M., Krüger, K., Niemeier, U. & Timmreck, C. (2011) The influence of eruption season on the global aerosol evolution and radiative impact of tropical volcanic eruptions. Atmos. Chem. Phys. 11, 12351–12367.
- ↑ Toohey, M., Krüger, K. & Timmreck, C. (2013) Volcanic sulfate deposition to Greenland and Antarctica: A modeling sensitivity study. J. Geophys. Res. Atmos. 118, 4788–4800.
- ↑ Toohey, M., Krüger, K., Sigl, M., Stordal, F. & Svensen, H. (2016) Climatic and societal impacts of a volcanic double event at the dawn of the Middle Ages. Clim. Change 136, 401–412.
- ↑ Tie X.X & Brasseur G (1995) The response of stratospheric ozone to volcanic eruptions : Sensitivity to atmospheric chlorine loading. Geophys. Res. Lett. 22, 3035–3038.
- ↑ Kutterolf S & al. (2015) Bromine and chlorine emissions from Plinian eruptions along the Central American Volcanic Arc: From source to atmosphere. Earth Planet. Sci. Lett. 429, 234–246
- ↑ Cadoux A & al. (2018) The role of melt composition on aqueous fluid vs. silicate melt partitioning of bromine in magmas. Earth Planet. Sci. Lett. 498, 450–463.
- ↑ Kutterolf, S. et al. (2013) Combined bromine and chlorine release from large explosive volcanic eruptions: A threat to stratospheric ozone? Geology 41, 707–710.
- ↑ Metzner, D. et al. (2014) Radiative forcing and climate impact resulting from SO2 injections based on a 200,000-year record of Plinian eruptions along the Central American Volcanic Arc. Int. J. Earth Sci. 103, 2063–2079.
- ↑ Kutterolf, S. et al. (2015) Bromine and chlorine emissions from Plinian eruptions along the Central American Volcanic Arc: From source to atmosphere. Earth Planet. Sci. Lett. 429, 234–246.
- ↑ Platt, U. & Bobrowski, N. (2015) Quantification of volcanic reactive halogen emissions. in Volcanism and Global Environmental Change (eds Schmidt, A., Fristad, K. E. & Elkins-Tanton, L. T.) 115–132 (Cambridge University Press), https://doi.org/10.1017/CBO9781107415683.011.
- ↑ Textor C, Graf H-F, Timmreck C & Robock A (2004) Emissions from volcanoes. Emiss. Atmos. trace Compd, 269–303, https://doi.org/10.1007/978-1-4020-2167-1_7.
- ↑ Solomon S (1999) Stratospheric ozone depletion: A review of concepts and history. Rev. Geophys. 37, 275.
- 1 2 3 (en) Narayan Singh, Amit Kumar Thakur, P. L. Sharma et Pankaj Sharma, Climate Change and Environmental Issues, The Energy and Resources Institute (TERI), , 254 p. (ISBN 978-81-7993-590-3, lire en ligne)
- ↑ von Glasow R, Bobrowski N & Kern C (2009) The effects of volcanic eruptions on atmospheric chemistry. Chem. Geol. 263, 131–142.
- ↑ Bobrowski N et al. (2007) Reactive halogen chemistry in volcanic plumes. J. Geophys. Res. Atmos. 112.
- ↑ Stolarski R.S & Cicerone R.J (1974) Stratospheric Chlorine: a Possible Sink for Ozone. Can. J. Chem. 52, 1610–1615.
- ↑ Stolarski R.S & Butler D.M (1978) Possible effects of volcanic eruptions on stratospheric minor constituent chemistry. Pure Appl. Geophys. PAGEOPH 117, 486–497.
- ↑ (en) Claxton, T., Hossaini, R., Wild, O., Chipperfield, M. P., & Wilson, C., « On the regional and seasonal ozone depletion potential of chlorinated very short‐lived substances] », Geophysical Research Letters, vol. 46, no 10, (2019, p. 5489-5498 (lire en ligne).
- ↑ (en) Fang, X., Pyle, J. A., Chipperfield, M. P., Daniel, J. S., Park, S., & Prinn, R. G., « Challenges for the recovery of the ozone layer », Nature Geoscience, vol. 12, no 8, , p. 592-596 (lire en ligne).
- 1 2 Un trou dans la couche d'ozone observé en Arctique, sur le site du journal Le Monde, lemonde.fr.
- ↑ « Trou dans la couche d'ozone », sur awac.be (consulté le )
- 1 2 3 4 « The Impacts of Ozone Depletion », sur bcairquality.ca (consulté le ).
- ↑ Kerr, J. B., & McElroy, C. T. (1993) Evidence for large upward trends of ultraviolet-B radiation linked to ozone depletion. Science, 262(5136), 1032-1034.
- 1 2 3 (en-US) « Ozone Layer Depletion - Causes, Effects and Solutions », The 7 Continents and 5 Oceans of the World, (lire en ligne, consulté le ).
- ↑ Martens P (2013) Health and climate change: modelling the impacts of global warming and ozone depletion. Routledge. URL=https://content.taylorfrancis.com/books/download?dac=C2011-0-06446-9&isbn=9781134066667&format=googlePreviewPdf
- ↑ (en-US) Rinkesh, « Ozone Layer and Causes of Ozone Depletion - Conserve Energy Future », Conserve Energy Future, (lire en ligne, consulté le ).
- ↑ (en) US EPA,OAR,OAP,SPD, « Health and Environmental Effects of Ozone Layer Depletion », sur epa.gov (consulté le ).
- ↑ (en) Seok-Woo Son, « Ozone hole and Southern Hemisphere climate change », Geophysical Research Letters, (lire en ligne).
- ↑ (en) Lorenzo M. Polvani, Darryn W. Waugh, Gustavo J. P. Correa et Seok-Woo Son, « Stratospheric Ozone Depletion: The Main Driver of Twentieth-Century Atmospheric Circulation Changes in the Southern Hemisphere », Journal of Climate, vol. 24, no 3, , p. 795–812 (ISSN 0894-8755 et 1520-0442, DOI 10.1175/2010JCLI3772.1, lire en ligne, consulté le )
- ↑ (en) Antara Banerjee, John C. Fyfe, Lorenzo M. Polvani et Darryn Waugh, « A pause in Southern Hemisphere circulation trends due to the Montreal Protocol », Nature, vol. 579, no 7800, , p. 544–548 (ISSN 1476-4687, DOI 10.1038/s41586-020-2120-4, lire en ligne, consulté le )
- ↑ (en) Department of the Environment and Energy, « Montreal Protocol on Substances that Deplete the Ozone Layer », sur environment.gov.au, (consulté le ).
- ↑ Tilmes, S., Müller, R., & Salawitch, R. (2008). The sensitivity of polar ozone depletion to proposed geoengineering schemes. Science, 320(5880), 1201-1204.
Voir aussi
Bibliographie
Livres de vulgarisation
- (en) Philip Dray et Seth Cagin, Between earth and sky : how CFCs changed our world and endangered the ozone layer, New York, Pantheon Books, (ISBN 0-679-42052-5)
- (en) Sharon Roan, Ozone Crisis : The 15-Year Evolution of a Sudden Global Emergency, New York, Wiley, , 270 p. (ISBN 0-471-52823-4)
- (en) Harold Schiff et Lydia Dotto, The Ozone war, Garden City, N.Y, Doubleday, (ISBN 0-385-12927-0)
Sur les actions des pouvoirs publics
- (en) Richard Elliot Benedick, Ozone diplomacy : New directions in safeguarding the planet, Cambridge, Harvard University Press, (ISBN 0-674-65001-8)
- (en) Karen Litfin, Ozone Discourses : Science and Politics in Global Environmental Cooperation, New York, Columbia University Press, , 257 p. (ISBN 0-231-08137-5)
Articles et ouvrages scientifiques
- (en) Jack G. Calvert, John J. Orlando, William R. Stockwell et Timothy J. Wallington, The Mechanisms of Reactions Influencing Atmospheric Ozone, New York (New York), Oxford University Press, , 589 p. (ISBN 978-0-19-023302-0, lire en ligne).
- (en) S.V. Krupa et R.N. Kickert, « The Greenhouse effect: impacts of ultraviolet-B (UV-B) radiation, carbon dioxide (CO2), and ozone (O3) on vegetation », Environmental Pollution, vol. 61, no 4, , p. 263-393.
- (en) Stephen R. Wilson, Keith R. Solomon et Xiaoyan Tang, « Changes in tropospheric composition and air quality due to stratospheric ozone depletion and climate change », University of Wollongong Research Online, (lire en ligne [PDF]).
- Barnes P.W, Williamson C.E, Lucas R.M, Robinson S.A, Madronich S, Paul N.D, … & Andrady A.L (2019) Ozone depletion, ultraviolet radiation, climate change and prospects for a sustainable future. Nature Sustainability, 2(7), 569-579.
Articles connexes
- Convention de Vienne sur la protection de la couche d'ozone
- Protocole de Montréal
- Couche d'ozone
- Stratosphère
Liens externes
- (en) UN Chronicle Unlayering of the Ozone: An Earth Sans Sunscreen, sur le site un.org
- (en) « Ozone Depletion » et (en) « NOAA Ozone Depleting Gas Index », sur esrl.noaa.gov, le site du Earth System Research Laboratory