| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| 1 | H | He | ||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| 6 | Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| 8 | Uue | Ubn | ⁂ | Uth | Uts | Uto | Ute | Uqn | Uqu | Uqb | ||||||||
| ↓ | ||||||||||||||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||
| ⁂ | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs | Ubo | Ube | Utn | Utu | Utb | Utt | Utq | Utp | |||
| Li | Métaux alcalins | Al | Métaux pauvres | |||||||||||||||
| Be | Métaux alcalino-terreux | B | Métalloïdes | |||||||||||||||
| La | Lanthanides | Non-métaux : | ||||||||||||||||
| Ac | Actinides | H | « CHNOPS » et sélénium | |||||||||||||||
| Sc | Métaux de transition | F | Halogènes | |||||||||||||||
| Mt | Nature chimique inconnue | He | Gaz nobles | |||||||||||||||
| Uue | Éléments hypothétiques (dont les superactinides) | |||||||||||||||||
Les halogènes sont les éléments chimiques du 17e groupe (colonne) du tableau périodique, anciennement appelé groupe VIIA : ce sont le fluor 9F, le chlore 17Cl, le brome 35Br, l’iode 53I, l’astate 85At et le tennesse 117Ts. Ces deux derniers éléments étant très radioactifs, le tennesse étant même synthétique, seuls les quatre premiers sont bien caractérisés, et forment une famille d'éléments chimiques homonyme aux propriétés très homogènes : particulièrement électronégatifs, ils sont chimiquement très réactifs, leur réactivité décroissant lorsque leur numéro atomique augmente ; le fluor est ainsi le plus réactif d'entre eux, formant des composés avec tous les autres éléments chimiques connus hormis l'hélium et le néon. L'astate appartient au groupe des halogènes, mais il peut être vu comme appartenant à la fois à la famille des halogènes et à celle des métalloïdes,compte tenu de ses propriétés physiques davantage métalliques. Quant au tennesse, il n'a été produit qu'à raison de quelques atomes à la durée de vie très brève — la période radioactive des isotopes 293Ts et 294Ts est de l'ordre de 22 ms et 51 ms respectivement — de sorte que ses propriétés physiques et chimiques macroscopiques sont inconnues : il n'est donc rangé dans aucune famille d'éléments.
À 0 °C et à pression atmosphérique, les corps simples de cette famille sont formés de molécules diatomiques. Leur état standard est gazeux pour le difluor F2 et le dichlore Cl2, liquide pour le dibrome Br2, et solide pour le diiode I2. Ils ne se trouvent généralement pas dans la nature sous cette forme, bien que le difluor ait été identifié dans l'antozonite[1]. Dans la mesure où leur couche de valence contient sept électrons, ils forment facilement des anions, appelés halogénures : fluorure F−, chlorure Cl−, bromure Br− et iodure I−. À l'exception du fluorure d'hydrogène (acide fluorhydrique) HF, leurs composés avec l'hydrogène sont tous des acides forts : l'acide chlorhydrique (solution aqueuse du chlorure d'hydrogène HCl), notamment.
Le mot « halogène » est issu du grec ἅλς (hals) signifiant « sel », et γεννᾶν (gennân) signifiant « engendrer ». Il a été introduit par Schweigger (en) en 1811 pour désigner le dichlore Cl2, qui était connu pour attaquer les métaux et donner des sels, et Berzelius en a étendu l'usage à l'ensemble de la famille en 1848. Compte tenu de leur très grande réactivité, les halogènes se présentent naturellement essentiellement sous forme de sels comprenant un anion halogénure, comme le fluorure de calcium CaF2, le chlorure de sodium NaCl (sel de table), le bromure d'argent AgBr et l'iodure de potassium KI. On peut cependant également les rencontrer dans des composés non ioniques, voire dans des molécules biologiques, comme l'iode dans les hormones thyroïdiennes, thyroxine et triiodothyronine.
Corps purs
Propriétés physiques
À température ambiante et sous pression atmosphérique, tous les halogènes forment des molécules diatomiques ; le fluor est un gaz jaune, le chlore est un gaz vert pâle, le brome est un liquide rouge et l'iode est un solide violet. L'astate, radioactif avec une demi-vie de quelques heures, n'est connu qu'en toutes petites quantités.
Le tableau ci-dessous résume quelques propriétés physiques des halogènes. Ces dernières évoluent de manière continue le long de la 17e colonne du tableau périodique. Ainsi, leur polarisabilité croît avec le numéro atomique, ce qui accroît parallèlement les forces de London dans les corps simples. Leur température de fusion et leur température d'ébullition croissent donc de −220 °C et −188 °C pour le fluor jusqu'à 113,7 °C et 184,3 °C pour l'iode. À l'inverse, leur énergie d'ionisation et leur électronégativité décroissent de 1 681 et 3,98 kJ/mol pour le fluor à 1 008 et 2,66 kJ/mol pour l'iode.
| Élément | Masse atomique |
Température de fusion |
Température d'ébullition |
Masse volumique |
Rayon de covalence |
Configuration électronique[2] |
Énergie d'ionisation |
Électronégativité (Pauling) |
|---|---|---|---|---|---|---|---|---|
| Fluor | 18,998 403 16 u | −219,67 °C | −188,11 °C | 1,696 g/l | 64 pm | [He] 2s2 2p5 | 1 681 kJ/mol | 3,98 |
| Chlore | 35,451 5 u | −101,5 °C | −34,04 °C | 3,2 g/l | 102 ± 4 pm | [Ne] 3s2 3p5 | 1 251,2 kJ/mol | 3,16 |
| Brome | 79,904(3) u | −7,2 °C | 58,8 °C | 3,102 8 g/cm3 | 120 ± 3 pm | [Ar] 4s2 3d10 4p5 | 1 139,9 kJ/mol | 2,96 |
| Iode | 126,904 47 u | 113,7 °C | 184,3 °C | 4,933 g/cm3 | 139 ± 3 pm | [Kr] 5s2 4d10 5p5 | 1 008,4 kJ/mol | 2,66 |
Molécules d'halogène
Les halogènes forment des molécules homonucléaires diatomiques X2 dont la géométrie peut être résumée de la façon suivante :
Halogène Molécule Structure Représentation Longueur de la liaison X–X État gazeux État solide Fluor F2 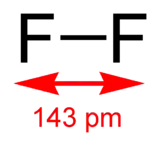

143 pm 149 pm Chlore Cl2 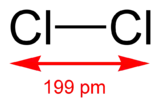

199 pm 198 pm Brome Br2 

228 pm 227 pm Iode I2 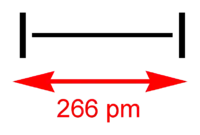

266 pm 272 pm
L'existence de la molécule de diastate At2 n'est pas formellement établie : les données relatives à son observation sont souvent discutées et ne permettent pas de conclure, certaines sources considérant que cette molécule n'existe pas ou n'a jamais été observée[3] tandis que d'autres laissent entendre qu'elle doit exister[4].
Réactivité chimique
L'énergie de liaison des halogènes décroît de haut en bas de la 17e colonne du tableau périodique, avec une exception pour la molécule de difluor F2, ce qui signifie que la réactivité chimique de ces éléments décroît lorsque leur numéro atomique croît, car la taille de leurs atomes croît également. Le fluor suit cette tendance dans ses liaisons avec d'autres éléments, tandis que la molécule F2 présente au contraire une énergie de liaison relativement faible.
| X | X2 | HX | BX3 | AlX3 | CX4 |
|---|---|---|---|---|---|
| F | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Br | 193 | 363 | 368 | 360 | 272 |
| I | 151 | 294 | 272 | 285 | 239 |
La réactivité chimique des halogènes les rend dangereux voire létaux pour les êtres vivants lorsqu'ils sont présents en quantité importante. Cette réactivité élevée est une conséquence de leur électronégativité élevée, qui provient de leur charge nucléaire effective (en) élevée. Le fluor est l'un des éléments chimiques les plus réactifs, susceptible de former des composés avec un grand nombre de substances généralement inertes, ainsi qu'avec tous les autres éléments chimiques connus, y compris les gaz nobles, à l'exception de l'hélium et du néon. Il se présente sous la forme d'un gaz corrosif et très toxique. Sa réactivité est telle qu'il attaque le verre en présence de la moindre trace d'humidité pour former du tétrafluorure de silicium SiF4. C'est la raison pour laquelle le fluor doit être manipulé à l'aide d'instruments en verre en l'absence totale d'humidité, en polytétrafluoroéthylène (PTFE) ou en métaux tels que le cuivre et l'acier, lesquels forment une couche de passivation en fluorure à leur surface.
La forte réactivité du fluor conduit paradoxalement aux plus fortes liaisons chimiques, particulièrement avec le carbone. Le PTFE est ainsi un polymère à haut point de fusion particulièrement stable chimiquement et thermiquement.
Réactions chimiques
Avec l’hydrogène
Tous les halogènes réagissent (spontanément à température ordinaire, sauf l'iode) avec l'hydrogène pour donner un gaz incolore de composition HX. Ces gaz sont solubles dans l'eau en donnant des acides halogénohydriques (H+,X−), tous des acides forts sauf HF (dissocié seulement partiellement)[5].
Avec les métaux
Les halogènes réagissent à température ambiante (et en brûlant à chaud) avec presque tous les métaux pour former des composés ioniques tels que le chlorure de sodium NaCl, le chlorure de fer(III) FeCl3 et l'iodure d'uranium(III) UI3.
Avec les non-métaux
Les halogènes réagissent avec la plupart des non-métaux tels que le carbone, le dihydrogène et le silicium pour former des halogénures covalents.
Avec les gaz nobles
La réactivité du fluor est telle qu'il forme toute une série de composés avec un gaz noble comme le xénon tels que des fluorures (XeF2, XeF4, XeF6) et des oxyfluorures (XeOF2, XeO2F2, XeO3F2).
Avec l'eau et les solutions aqueuses
Le fluor réagit avec l'eau H2O pour donner du fluorure d'hydrogène HF et du dioxygène O2 ainsi que de l'ozone O3. Le chlore et le brome sont modérément solubles dans l'eau, et leurs solutions se dissocient partiellement en acide halogénohydrique (H+,X−) et hypohalogénite HXO. L'iode est peu soluble[5].
En réagissant avec l'eau les halogènes peuvent donner (sauf le fluor) une série d'oxoacides dans lesquels l'halogène est à des états d'oxydation variables :
Nombre d'oxydation
de l'halogène XOxoacides d'halogènes Sels correspondants Nom Formule Exemple Nom Formule Exemple +I Acide hypohalogéneux HXO HClO Hypohalogénite MXO NaClO +III Acide halogéneux HXO2 HClO2 Halogénite MXO2 NaClO2 +V Acide halogénique HXO3 HClO3 Halogénate MXO3 NaClO3 +VII Acide perhalogénique HXO4 HClO4 Perhalogénate MXO4 NaClO4
Les halogènes interviennent comme oxydants dans la plupart des réactions, de sorte que les plus légers peuvent oxyder les anions halogénures plus lourds :
- F2 (g) + 2 X−(aq) → 2 F−(aq) + X2 (aq), où X = Cl, Br, I.
Le caractère oxydant des halogènes décroît — et le caractère réducteur des halogénures croît — du haut vers le bas de la colonne : plus l’ion est gros, plus il lui est facile de perdre un électron.
Avec les hydrocarbures
Avec les hydrocarbures, ils forment des hydrocarbures halogénés, qui sont une classe importante de matériaux industriels, comme le chloroforme (trichlorométhane CHCl3), les chlorofluorocarbures (CFC) et les perfluorocarbures (PFC).
Composés chimiques
Interhalogènes
Les interhalogènes sont de la forme XYn, où X et Y sont des halogènes et n vaut 1, 3, 5 ou 7. Ils sont constitués d'au plus deux halogènes différents. Les grandes molécules d'interhalogènes comme le trifluorure de chlore ClF3 sont produites par réaction d'un halogène pur avec un interhalogène plus petit comme le monofluorure de chlore ClF. Tous, hormis l'heptafluorure d'iode IF7, peuvent également être produits en combinant des halogènes purs dans diverses conditions.
| F | F2 | ||||
|---|---|---|---|---|---|
| Cl | ClF, ClF3, ClF5 | Cl2 | |||
| Br | BrF, BrF3, BrF5 | BrCl | Br2 | ||
| I | IF, IF3, IF5, IF7 | ICl, (ICl3)2 | IBr | I2 | |
| At | — | AtCl | AtBr | AtI | ? |
| F | Cl | Br | I | At |
Les interhalogènes sont généralement plus réactifs que les halogènes purs, hormis la molécule de difluor F2, car les liaisons interhalogènes sont moins fortes que celles des molécules d'halogènes homonucléaires. Leurs propriétés générales sont cependant globalement les mêmes que celles des halogènes purs. De nombreux interhalogènes sont formés d'un ou plusieurs atomes de fluor liés à un halogène plus lourd : jusqu'à cinq atomes de fluor peuvent se lier à un atome de chlore et de brome, et jusqu'à sept à un atome d'iode. La plupart d'entre eux sont gazeux aux conditions normales de température et de pression, mais certains sont liquides, comme le trifluorure de brome BrF3, et de nombreux interhalogènes iodés sont solides, comme le monobromure d'iode IBr.
- Exemples d'interhalogènes
 Monofluorure de chlore
Monofluorure de chlore Trifluorure de chlore
Trifluorure de chlore Pentafluorure de chlore
Pentafluorure de chlore Monochlorure de brome
Monochlorure de brome Monobromure d'iode
Monobromure d'iode Trichlorure d'iode
Trichlorure d'iode Pentafluorure d'iode
Pentafluorure d'iode Heptafluorure d'iode
Heptafluorure d'iode
Les interhalogènes présentent des propriétés physicochimiques intermédiaires de celles des halogènes qui les composent. Ainsi, le pouvoir oxydant du monochlorure de brome BrCl est moindre que celui du chlore Cl2 mais supérieur à celui brome Br2. Le monochlorure d'iode ICl est physiquement assez semblable au brome Br2 :
Propriétés Monochlorure d'iode Brome Apparence 

Masse molaire 162,35 u 159,81 u Masse volumique 3,10 g·cm-3 à 29 °C 3,10 g·cm-3 Température de fusion 27,2 °C (forme α)
13,9 °C (forme β)−7,2 °C Température d'ébullition 97,4 °C 58,8 °C
Des interhalogènes fluorés peuvent être utilisés comme réactifs de fluoration plus doux que le fluor F2, par exemple :
- Sn(s) + ClF3 (l) → SnF2 (s) + ClF(g) ;
- P4 (s) + 5 ClF3 (l) → 4 PF3 (g) (en) + 3 ClF(g) + Cl2 (g) ;
- 2 B2O3 (s) + 4 BrF3 (l) → 4 BF3 (g) + 2 Br2 (l) + 3 O2 (g).
Les interhalogènes peuvent être ionisés et donner des interhalogénures. Par exemple, l'ion triiodure I3− est un anion à la géométrie linéaire qui se forme par réaction directe en solution aqueuse entre le diiode I2 et l'ion iodure I−. C'est le paradigme de nombreux interhalogénures comme I2Cl−, moins courant, mais qui se forment de la même façon, par réaction entre I2 et l'ion chlorure Cl−.
Halogénures d'hydrogène et acides halogénohydriques
Tous les halogènes réagissent avec l'hydrogène pour former des halogénures d'hydrogène. La réaction est de la forme :
- H2 + X2 → 2 HX,
où HX représente le fluorure d'hydrogène HF, le chlorure d'hydrogène HCl, le bromure d'hydrogène HBr et l'iodure d'hydrogène HI. L'astate se comporte de ce point de vue comme un halogène et forme, par la même réaction, de l'astature d'hydrogène AtH. Le fluorure d'hydrogène est le seul des cinq à former des liaisons hydrogène.
La réaction entre l'hydrogène et les halogènes est de moins en moins rapide à mesure qu'on considère des halogènes plus lourds. Elle est immédiatement explosive avec le fluor même dans l'obscurité à froid, tandis qu'elle n'est explosive avec le chlore qu'en présence de lumière et à chaud, et n'est explosive avec le brome qu'en présence d'une flamme. Avec l'iode et l'astate, la réaction est incomplète, et il s'établit un équilibre chimique.
Tous les halogénures d'hydrogène sont des gaz à température ambiante, solubles dans l'eau pour former des acides halogénohydriques, respectivement l'acide fluorhydrique, l'acide chlorhydrique, l'acide bromhydrique, l'acide iodhydrique et l'acide astathydrique. L'acide fluorhydrique est un acide faible tandis que les quatre autres sont des acides forts, le plus fort d'entre eux étant l'acide astathydrique ; ce dernier tend cependant à se décomposer en astate et hydrogène.
Les halogénures d'hydrogène sont tous des composés irritants et toxiques. Le fluorure et le chlorure d'hydrogène sont très acides. Le fluorure d'hydrogène est utilisé dans l'industrie et est très toxique, susceptible de provoquer des œdèmes pulmonaires et des lésions cellulaires. Le chlorure d'hydrogène est létal à plus de 50 ppm dans l'atmosphère, tandis que le bromure d'hydrogène est létal à seulement 30 ppm.
Halogénures de métaux
Tous les halogènes réagissent avec le sodium, formant du fluorure de sodium NaF, du chlorure de sodium NaCl, du bromure de sodium NaBr, de l'iodure de sodium NaI et de l'astature de sodium NaAt. Ces réactions produisent des flammes orange clair.
Le fer réagit avec le fluor, le chlore et le brome pour former des halogénures de fer(III) à travers des réactions du type :
- 2 Fe + 3 X2 → 2 FeX3.
Avec l'iode, en revanche, il forme de l'iodure de fer(II) FeI2.
La paille de fer peut réagir rapidement avec le fluor, même à basse température, pour former du fluorure de fer(III) FeF3, de couleur blanche. Le fer réagit à chaud avec le chlore pour donner du chlorure de fer(III) FeCl3, de couleur noire à sec, mais de couleur brun-rouge en présence d'humidité. Le fer peut également réagir avec le brome, moins énergiquement cependant qu'avec le fluor et le chlore, pour donner du bromure de fer(III) FeBr3, de couleur brun-rouge en conditions anhydres. Avec l'iode, cependant, il se forme de l'iodure de fer(II) FeI2, probablement de couleur grise bien qu'il soit difficile d'en être certain en raison de contaminations du produit par un excès d'iode.
Oxydes, oxoacides et oxosels
On connaît de nombreux oxydes d'halogène, plus ou moins stables, qui peuvent se préparer par réaction directe avec le dioxygène O2 ou l'ozone O3, ou bien avec un oxyde comme HgO. Dans ces oxydes le fluor garde son nombre d'oxydation habituel −I[alpha 1], mais les autres halogènes ont des nombres d'oxydation variés, de +I à +VII.
Les oxydes dans lesquels l'halogène a pour nombre d'oxydation +I, +III, +V ou +VII sont les anhydrides d'oxoacides dénommés acide hypohalogéneux HXO, halogéneux HXO2, halogénique HXO3 et perhalogénique HXO4 (pour le chlore par exemple : acide hypochloreux HClO, chloreux HClO2, chlorique HClO3 et perchlorique HClO4). Les anions et les sels de ces oxoacides sont dénommés hypohalogénites, halogénites, halogénates et perhalogénates (pour le chlore par exemple : ion hypochlorite ClO− et hypochlorites, ion chlorite ClO−
2 et chlorites, etc.).
Usages pratiques
Éclairage
Les lampes dites halogène tiennent leur nom de la présence d'une petite quantité des éléments chimiques brome ou iode introduits pour permettre un survoltage du filament de tungstène, donc pour que celui-ci puisse atteindre une température plus élevée, donc une couleur plus blanche. L'intérêt de la présence d'halogène s'interprète chimiquement. Il est basé sur le fait que les halogénures de tungstène se forment, à température intermédiaire par action directe entre le dihalogène et le tungstène, et se décomposent à haute température en redonnant du tungstène et le dihalogène. Or le filament de tungstène a une température intermédiaire là où il possède son plus gros diamètre (résistance électrique plus faible) et une température élevée là où il possède son plus faible diamètre (forte résistance, donc fort effet Joule).
En réagissant avec le tungstène, le dihalogène oxyde le filament en formant les produits gazeux WBrn, (n = 5 ou 6). Ce bromure de tungstène est gazeux. Cela revient donc à évaporer une partie du filament de la lampe, là où son diamètre est le plus gros.
Cet halogénure gazeux se décompose là où la température de la lampe est la plus élevée. Cela revient à déposer du tungstène sur les parties du filament les plus fines. L'ensemble du processus (évaporation / redéposition) consiste donc à transférer du tungstène des parties épaisses aux parties fines du filament et donc à homogénéiser son diamètre. Ainsi auto-entretenu, le filament supporte d'être chauffé plus qu'une lampe à incandescence ordinaire.
Photographie
Selon le type de film photographique, des cristaux de chlorures, bromures et/ou d'iodures d'argent absorbent la lumière de diverses couleurs. Ces cristaux exposés deviennent capables de réagir avec les révélateurs pour former les grains de l'image.
Hygiène
L'élément chimique chlore, sous forme d'ion hypochlorite ClO−, présent dans l'eau de Javel est un agent oxydant et bactéricide efficace. Il sert également pour le blanchiment. Sur le plan industriel, certains oxydes de chlore sont également utilisés.
L'élément chimique brome, sous forme de dibrome, est utilisé pour la stérilisation de piscine. Le dibrome, liquide est plus facile à stocker que le dichlore, gazeux, et est moins agressif pour les cellules. Il est intéressant pour les piscines d'eau chaude comme les spas. Mais il reste un réactif coûteux.
L'élément chimique iode est également utilisé pour la désinfection, par exemple avec teinture d'iode ou la bétadine.
L'élément chimique fluor n'est pas utilisé pour l'hygiène. Sous forme de difluor gazeux, il serait bien trop dangereux car trop réactif.
Alimentaire
Les halogènes, surtout l'élément chimique chlore, étant omniprésent dans la nature, ils font partie de l'alimentation. L'ion chlorure est présent en particulier dans le sel de table qui est essentiellement constitué de chlorure de sodium. Cet élément chimique se retrouve aussi sous forme moléculaire dans l'alimentation par exemple avec un édulcorant artificiel, le sucralose
L'élément chimique iode est nécessaire à la santé humaine: une glande, la thyroïde est chargée de fixer cet élément chimique et de synthétiser des hormones iodées.
Pharmaceutique
De très nombreux médicaments contiennent des halogènes. Exemples :
- les agents anesthésiques volatils halothane, enflurane, desflurane, sévoflurane et isoflurane ;
- le bromure de potassium était utilisé comme somnifère ;
Polymères halogénés
- Fluoropolymères : polytétrafluoroéthylène (PTFE) (Téflon) ; polyfluorure de vinyle (PVF) ; polyfluorure de vinylidène (PVDF) ; éthylène tétrafluoroéthylène (ETFE) ; perfluoroalkoxy (PFA) ; polychlorotrifluoroéthylène (CTFE) ; polydifluoroéthylène.
- Chloropolymères : polychlorure de vinyle (PVC) ; polychlorure de vinyle surchloré (PVC-C) ; polychlorure de vinylidène (PVDC).
Solvants halogénés
Les hydrocarbures halogénés (fluorés, chlorés, bromés ou iodés) : perchloroéthylène, trichloréthylène, dichlorométhane, chloroforme, tétrachlorométhane (nocifs pour la couche d'ozone).
Notes et références
Notes
- ↑ Le fluor étant plus électronégatif que l'oxygène, on ne parle ordinairement pas d'oxydes de fluor mais de fluorures d'oxygène
 .
.
Références
- ↑ (en) Jörn Schmedt auf der Günne, Martin Mangst et Florian Kraus, « Occurrence of Difluorine F2 in Nature—In Situ Proof and Quantification by NMR Spectroscopy », Angewandte Chemie International Edition, vol. 51, no 31, , p. 7847-7849 (PMID 22763992, DOI 10.1002/anie.201203515, lire en ligne)
- ↑ (en) CRC Handbook of Chemistry and Physics, section 1 : Basic Constants, Units, and Conversion Factors, sous-section : Electron Configuration of Neutral Atoms in the Ground State, 84e édition en ligne, CRC Press, Boca Raton, Floride, 2003.
- ↑ (en) Cornelius Keller, Walter Wolf et Jashovam Shani, « Radionuclides, 2. Radioactive Elements and Artificial Radionuclides », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.o22_o15, lire en ligne)
- ↑ (en) K. Otozai et N. Takashi, « Estimation of the Chemical Form and the Boiling point of Elementary Astatine by Radiogaschromatography », Radiochimica Acta, vol. 31, nos 3-4, , p. 201-203 (DOI 10.1524/ract.1982.31.34.201, lire en ligne)
- 1 2 « Reactions of Main Group Elements with Halogens », (consulté le ).
Bibliographie
- (en) Silberberg, M.S., Chemistry: The molecular nature of Matter and Change, 3e édition, McGraw-Hill, 2009, p. 588-594.
- (en) Petrucci R.H., Harwood W.S. et Herring F.G., General Chemistry, 8e édition, Prentice-Hall, 2002
- (en) “Chem4kids” (http://www.chem4kids.com/files/elem_halogen.html)
- (en) “Chemistry explained” (http://www.chemistryexplained.com/Ge-Hy/Halogens.html)
- (en) “Bodner research web” (http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch10/group7.php)
Voir aussi
Articles connexes
- Lampe à incandescence halogène
- Pseudohalogène
- Halogénure
- oxydant
- eau de Javel
- CFC
- Perhalogéné
- Liaison halogène
Liens externes
- Ressource relative à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux alcalins | Métaux alcalino-terreux | Lanthanides | Métaux de transition | Métaux pauvres | Métalloïdes | Non-métaux | Halogènes | Gaz nobles | Éléments non classés |
| Actinides | |||||||||
| Superactinides |


