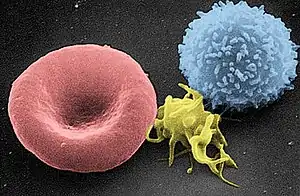
Un thrombocyte (du grec thrombôsis, dérivé du verbe thromboûn : faire coaguler[1] et de kytos : enveloppe) ou plaquette sanguine est un élément figuré du sang, formé par fragmentation des mégacaryocytes, grandes cellules contenues dans la moelle osseuse. Les thrombocytes ne sont donc en fait pas des cellules complètes mais uniquement de petits fragments. Ceux-ci sont dépourvus de noyau chez les mammifères, mais sont nucléés chez les oiseaux.
Leur durée de vie est d'environ 8 à 12 jours dans le compartiment sanguin. Le lieu de dégradation des thrombocytes est la rate. Elles sont un des composants indispensables à l'hémostase primaire.
Ultrastructure
Ce sont les plus petits éléments figurés du sang. Les thrombocytes ne sont pas des cellules à proprement parler ; il s'agit de fragments cellulaires formés à partir d'un précurseur plurinucléé, le mégacaryocyte, présent dans la moelle osseuse. La formation des plaquettes se fait par « pincement » de la membrane du mégacaryocyte en périphérie, partitionnant complètement des fragments de cytoplasmes qui intègrent ensuite le compartiment sanguin. Les thrombocytes sont ainsi dépourvus de noyaux (anucléés) mais, à l'opposé des érythrocytes, conservent leurs organites (notamment des mitochondries).
Les plaquettes (ou thrombocytes) sont de forme lenticulaire, en disque biconvexe, et mesurent entre 1,5 et 3,5 µm de diamètre. Les plaquettes sont présentes à raison de 150 000 à 400 000 /µL de sang. Sur frottis, les plaquettes sont souvent regroupées et possèdent une affinité tinctoriale pour les colorants basiques (bleu de méthylène ou hématoxyline), leur donnant une apparence pourpre-bleu foncée. Au microscope optique (photonique), on peut distinguer deux zones aux thrombocytes :
- une zone centrale, densément colorée, appelée granulomère ou chromomère. Cette région est riche en organites et en granulations, responsable de l'importante basophilie et l'affinité tinctoriale pour les colorants basiques ;
- une région périphérique, pâle, le hyalomère.
L'analyse ultrastructurale au microscope électronique permet de révéler une organisation des plaquettes en quatre zones :
- la zone périphérique, correspondant à la membrane plasmique (plasmolemme) et son épais glycocalyx. Le glycocalyx est un « manteau » hydrophile riche en glycoprotéines et composés osidiques qui revêt la surface externe de la cellule. La zone périphérique comporte des glycoprotéines, des GAG, le récepteur Gp-Ib du facteur de von Willebrand et des facteurs de coagulations issus du plasma ;
- la zone structurale, près de la périphérie, est formée d'un réseau de cytosquelette qui est responsable du maintien de la forme des plaquettes. Elle est formée notamment de microtubules, de microfilaments d'actines, de myosine et de protéines liantes à l'actine. L'ensemble forme un réseau sous la membrane qui lui fournit un échafaudage solide et flexible. La zone structurale est donc plus intérieure à la zone périphérique et est responsable de la forme des plaquettes : lors de l'agrégation plaquettaire, le cytosquelette du thrombocyte subit des changements dans cette zone qui comptent pour les modifications de morphologie observées ;
- la zone des organites forme l'essentiel du granulomère. Cette zone est la partie centrale de la cellule, renfermant des organites et des granulations. Elle comprend des mitochondries, des inclusions de glycogène, des peroxysomes et trois types de granulations : les granulations alpha, delta et gamma ;
- la zone membranaire consiste en deux types de systèmes de canaux membranaires : un système canaliculaire ouvert (OCS), qui peut être considéré comme un résidu des canaux de démarcation des mégacaryocytes, et correspond à des invaginations de la membrane cytoplasmique traversant le réseau sous-membranaire formé par le cytosquelette. Le deuxième système est système tubulaire dense, qui dérive du réticulum endoplasmique.
Le cytoplasme est très riche et on y retrouve :
- des organites : quelques mitochondries, quelques saccules golgiens, cytosquelette ;
- des inclusions : glycogène ;
- des granulations :
- granulations alpha : qui contiennent des facteurs de coagulation (du fibrinogène, facteur von Willebrand), de la fibronectine (protéine adhésive) et des facteurs de croissance (comme la PDGF). Mais également des protéines plasmatiques incorporées tels que l'albumine et des immunoglobulines,
- granulations denses (granules δ) : elles sont reliées à la membrane et à la surface de la cellule. Elles contiennent du calcium, de l’ADP (qui favorisent l’agrégation plaquettaire) et de la sérotonine (qui active la vasoconstriction),
- granules λ : qui correspondent aux lysosomes et renferment des hydrolases acides (rôle dans la lyse des thrombi),
- des peroxysomes : peu nombreux et ont une activité péroxydasique élevée due à une catalase.
Physiologie
Production

La thrombopoïèse s'effectue au niveau de la moelle osseuse. Elle se répartit en plusieurs étapes, mettant tour à tour en scène des divisions et des différenciations cellulaires. Toutefois, les poumons contribueraient à 50 % de la production des plaquettes[3].
Comme toute cellule différenciée, les plaquettes dérivent d'une cellule souche appelée également pluripotente. Puis celles-ci se différencient en cellules multipotentes. On observe alors une différenciation en CFU-GEMM (Colony Forming Unit - Granulocyte-Erythrocyte-Monocyte-Megakaryocyte) qui pourront également, à la suite de plusieurs différenciations, donner naissance aux érythrocytes ou encore aux macrophages.
Ces CFU-GEMM se différencient ensuite en précurseurs de chaque lignée, dont les CFU-MK (Colony Forming Unit - MegaKaryocytic), qui donneront les mégacaryoblastes. Après plusieurs divisions cellulaires (7 au total), on observe dans le cytoplasme, un noyau polyploïde. Le mégacaryocyte subit en effet plusieurs cycles de division cellulaire durant lesquels il réplique son ADN. Cependant, aucune n'étant menée à son terme, le noyau double sa quantité d'ADN à chaque division.
Ces fausses divisions appelées endomitoses achèvent la thrombopoïèse : les mégacaryoblastes vont devenir mégacaryocytes basophiles, puis granuleux et thrombocytogènes. La cellule mesure alors de 100 à 150 micromètres (les mégacaryocytes sont les plus grosses cellules de la moelle osseuse, mais aussi les plus rares[2]) et le noyau comporte jusqu'à 128 fois la quantité normale d'ADN (valeur modale : 16N) : ce dernier se condense avant d'être éliminé par caryopinocytose.
Dès lors, les proplaquettes (de 5 à 7, dans les mégacaryocytes) vont être libérées, et vont elles-mêmes littéralement exploser pour donner naissance à 1 000 voire 1 500 plaquettes chacune, conférant un pouvoir de production de l'ordre de 104 plaquettes par mégacaryocytes, ce qui se justifie par la courte durée de vie (9 à 10 jours[4] chez l'humain) des plaquettes dans le sang (environ 1011 plaquettes sont produites chaque jour pour garder le taux constant dans le sang humain[4]). Les plaquettes sont alors libérées dans le sang, afin qu'elles puissent remplir le rôle fondamental dans la survie du corps.
Circulation
Fonction
Leur principale fonction consiste à arrêter rapidement un saignement. Les thrombocytes sont donc importants pour l'hémostase primaire.
Les plaquettes, ou thrombocytes, sont des particules anucléées de 2 à 4 microns de diamètre. Après coloration au MGG, on met en évidence deux zones :
- centrale : contenant des granulations azurophiles, appelées granulomère (ou chromomère). On retrouve de la sérotonine, de l'ADP/ATP, du calcium ;
- périphérique ou hyalomère : fibrinogène, antigène spécifique du facteur VIII, facteur IV, fibronectine.

Les plaquettes sont libérées par les mégacaryocytes qui éclatent au moment du passage dans le torrent circulatoire, leur diamètre d'environ 11 microns ne leur permettant pas le passage dans les vaisseaux de la rate (d'un diamètre de 3 µm). Leur rôle principal est celui de l'hémostase primaire, qui survient quand il y a « solution de continuité » (c’est-à-dire rupture[6]) au sein de l'endothélium vasculaire ; autrement dit lorsque le sous-endothélium est exposé au torrent circulatoire (hémorragie interne ou externe).
Ce phénomène induit une réaction vasculaire vasoconstrictrice ayant pour effet, d'une part de diminuer la vitesse locale de passage de toutes les protéines et éléments sanguins, et d'autre part d'augmenter la concentration locale de certains médiateurs.
Après une phase d'agrégation, les plaquettes peuvent fixer le sous-endothélium par l'intermédiaire du facteur de Von Willebrand et du fibrinogène qui pontent respectivement le sous-endothélium aux protéines IB, IIB et IIIA des plaquettes. Les plaquettes, discoïdales au repos, prennent alors une forme sphérique. Une amplification du phénomène conduit à la formation d'un thrombus blanc (caillot sanguin constitué de plaquettes agglutinées les unes aux autres auxquelles s'accolent les leucocytes). Il s'ensuit la constitution d'un réseau de fibrine dans lequel les globules rouges s'enchâssent et s'immobilisent : c'est le thrombus rouge.
Les plaquettes interviennent dans l'hémostase primaire en fixant un complexe prothrombinase qui transforme la prothrombine en thrombine, la thrombine étant elle-même responsable de la dégradation du fibrinogène en fibrine.
Nombre
Leur concentration normale est de 150 à 400 G/L (milliards par litre). Elles sont comptées de manière automatisée lors d'une numération formule sanguin (ou NFS). Parfois le compte doit être demandé spécifiquement (« numération plaquettaire »). Leur nombre tend à diminuer avec l'âge[7]. Il est un peu plus important chez les afro-américains[8].
Lorsque la concentration est inférieure à 150 G/L, on parle de thrombopénie. Lorsqu'elle est supérieure à 400, on parle alors de thrombocytose.
Rôle dans les maladies
Valeurs anormalement élevées ou abaissées
Une numération normale des thrombocytes chez une personne saine est entre 150 et 400 G/L (150 à 400 milliards par litre de sang).
En cas de troubles de l'hémostase, on peut rencontrer aussi bien :
- une thrombocytopénie ou thrombopénie (taux bas). Généralement, de tels taux augmentent les risques d'hémorragie (bien qu'il y ait des exceptions, par exemple la thrombocytopénie immune induite par l'héparine) ;
- une thrombocytose (taux élevé) peut entraîner une thrombose.
En général, des taux bas ne requièrent pas de transfusions, à moins que le patient ne saigne ou que le taux soit descendu en dessous de 20 Giga/L ; elles sont contre-indiquées en cas de purpura thrombotique thrombocytopénique car cela aggraverait le trouble de l'hémostase.
Maladies
États entraînant une thrombocytopénie (numération abaissée)
- Thrombocytopénie
- Purpura thrombopénique immunologique (destruction auto-immune des plaquettes)
- Purpura thrombotique thrombocytopénique (consommation des plaquettes)
- Thrombocytopénie d'origine médicamenteuse
- Incompatibilité fœto-maternelle
- Rougeole
- Syndrome HELLP
- Syndrome hémolytique et urémique
États entraînant une thrombocytose (numération élevée)
Il s'agit d'une thrombocytose qu'on peut classer en :
- thrombocytoses secondaires :
- splénectomie et asplénie fonctionnelle,
- inflammation aiguë chronique,
- hémorragie aiguë,
- carence martiale,
- hémolyse chronique ;
- thrombocytoses des syndromes myéloprolifératifs :
- la thrombocytose essentielle caractérisée par une atteinte exclusive de la lignée plaquettaire.
Troubles de l'adhésion plaquettaire ou de l'agrégation plaquettaire
- Syndrome de Bernard-Soulier
- Thrombasthénie de Glanzmann
- Syndrome de Scott
- Maladie de von Willebrand
Troubles du métabolisme des thrombocytes
- Hyperactivité de la cyclooxygénase, induite ou congénitale
- Storage pool defects, acquis ou congénitaux
Transfusion
Notes et références
- ↑ « Larousse », sur www.larousse.fr (consulté le )
- 1 2 (en) Kellie R. Machlus et Joseph E. Italiano, « The incredible journey: From megakaryocyte development to platelet formation », The Journal of Cell Biology, vol. 201, , p. 785-796 (ISSN 0021-9525 et 1540-8140, PMID 23751492, DOI 10.1083/jcb.201304054, lire en ligne, consulté le )
- ↑ (en) Emma Lefrançais, Guadalupe Ortiz-Muñoz, Axelle Caudrillier et Beñat Mallavia, « The lung is a site of platelet biogenesis and a reservoir for haematopoietic progenitors », Nature, vol. 544, no 7648, , p. 105–109 (DOI 10.1038/nature21706, lire en ligne)
- 1 2 L. A. Harker, « The kinetics of platelet production and destruction in man », Clinics in Haematology, vol. 6, , p. 671-693 (ISSN 0308-2261, PMID 912957, lire en ligne, consulté le )
- ↑ Voir une animation sur l'activation plaquettaire.
- ↑ Le mot « solution » doit être pris ici dans le sens de « dissolution », ou « disparition ». La solution de continuité est donc la disparition de la continuité, c'est-à-dire la rupture.
- ↑ Balduini CL, Noris P, Platelet count and aging, Haematologica, 2014;99:953-955
- ↑ Segal JB, Moliterno AR, Platelet counts differ by sex, ethnicity, and age in the United States, Ann Epidemiol, 2006;16:123-130