| Sérotonine | |
.svg.png.webp)
| |
 |
|
| Identification | |
|---|---|
| Nom UICPA | 3-(2-aminoéthyl)-1H-indol-5-ol |
| No CAS | |
| No ECHA | 100.000.054 |
| No CE | 200-058-9 |
| PubChem | 5202 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C10H12N2O [Isomères] |
| Masse molaire[1] | 176,215 1 ± 0,009 5 g/mol C 68,16 %, H 6,86 %, N 15,9 %, O 9,08 %, |
| pKa | 9.97 (25 °C)[2] |
| Propriétés physiques | |
| T° fusion | 167,5 °C[2] |
| Solubilité | 20 g·L-1 (eau, 27 °C)[2] |
| Précautions | |
| Directive 67/548/EEC | |
 Xn |
|
| Écotoxicologie | |
| DL50 | 60 mg·kg-1 (souris, oral) 81 mg·kg-1 (souris, i.v.) 601 mg·kg-1 (souris, s.c.) 160 mg·kg-1 (souris, i.p.)[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
La sérotonine, encore appelée 5-hydroxytryptamine (5-HT), est une monoamine de la famille des indolamines. C'est un neurotransmetteur dans le système nerveux central et dans les plexus intramuraux du tube digestif, ainsi qu'un autacoïde (hormone locale) libéré par les cellules entérochromaffines et les thrombocytes. La production de sérotonine a aussi été observée dans le placenta des souris et de l'humain[3],[4],[5].
Elle est majoritairement présente dans l'organisme en qualité d'autacoïde. Son activité débute dans le cerveau où elle joue le rôle de neurotransmetteur en n'y représentant que 1 % du total présent dans le corps[6], mais elle y joue un rôle essentiel[7]. Elle est notamment impliquée dans la gestion des humeurs et est associée à l'état de bonheur[8],[9] lorsqu'elle est à un taux équilibré, réduisant la prise de risque[10] et en poussant ainsi l'individu à maintenir une situation qui lui est favorable. Elle est donc indispensable à la survie des mammifères dont l'être humain[11], et a un effet antagoniste à celui de la dopamine[12] qui favorise, au contraire, la prise de risque et l'enclenchement du système de récompense.
Elle est, en outre, également impliquée dans la régulation du cycle circadien[13] dans le noyau suprachiasmatique (siège de l'horloge circadienne), dans l'hémostase, dans la mobilité digestive et « dans divers désordres psychiatriques tels que stress, anxiété, phobies, dépression ». Elle est ainsi la cible de certains outils thérapeutiques, notamment les antidépresseurs, utilisés pour soigner ces maladies. Son activité est également modifiée par certains psychotropes[7].
Histoire
La sérotonine a été identifiée en 1946, sous le nom d'entéramine[14], par le pharmacologue italien Vittorio Erspamer (1909-1999) dans les cellules entérochromaffines du tube digestif[15]. À peu près à la même époque à Cleveland, Maurice M. Rapport qui s'intéressait aux substances hypertensives du sang, isola en 1948 une substance vasoconstrictrice qui apparaissait au moment de la coagulation du sang[16]. Il la dénomma « sérotonine » par la contraction de « serum », sa source et de « tonique », son action sur les vaisseaux sanguins. L'année suivante, il l'analysa comme la 5-hydroxytryptamine. Erspamer identifia peu après l'entéramine à la 5-hydroxytryptamine. La présence de sérotonine dans le système nerveux central fut ensuite caractérisée par B. M. Twarog et I. H. Page[17], peu après que Gaddum a montré que le LSD (diéthylamide de l'acide lysergique), un puissant psychotrope hallucinogène, se comportait comme la sérotonine sur certains récepteurs des tissus périphériques.
Localisation

La sérotonine a été identifiée dans la muqueuse gastro-intestinale, dans les plaquettes sanguines et dans le système nerveux central[14]. La sérotonine présente dans la muqueuse gastro-intestinale représente environ 80 % de la sérotonine totale de l'organisme. Elle est synthétisée et stockée au niveau des cellules entérochromaffines. Celles-ci stockent aussi des médiateurs peptidiques (cholécystokinine, neurotensine, peptide PYY). La libération de sérotonine par exocytose joue un rôle dans la motilité intestinale. Une partie de la sérotonine du tube digestif passe dans le sang où elle est stockée dans les plaquettes sanguines. La sérotonine est produite également dans les neurones sérotoninergiques et les ostéoclastes[18] du tissu osseux. Dans la première étape de la coagulation sanguine, lorsque les plaquettes s'agrègent entre elles, elles libèrent leur sérotonine qui, via les récepteurs 5-HT1 des muscles lisses vasculaires, provoque une vasoconstriction. L'effet global vasculaire est hypertenseur.
Dans le système nerveux central, les corps cellulaires des neurones sérotoninergiques sont localisés dans les noyaux du raphé du tronc cérébral d'où ils se projettent dans l'ensemble du cerveau et de la moelle spinale. On peut dire[19] que, d'une manière générale : les neurones sérotoninergiques du mésencéphale se projettent rostralement[20] dans les hémisphères cérébraux ; ceux du pont se ramifient dans le tronc cérébral et le cervelet ; et ceux de la moelle allongée vont à la moelle spinale. Les effets de la sérotonine sur les autres neurones peuvent être excitateurs ou inhibiteurs suivant la nature des récepteurs.
Métabolisme


95 % de la sérotonine (du corps) est produite dans l'intestin[21],[22].
La biosynthèse de la sérotonine est réalisée dans les neurones ou les cellules entérochromaffines. Elle est fabriquée à partir du tryptophane (Trp), un acide aminé qui est apporté au cerveau par la circulation sanguine entre autres. Le tryptophane est absorbé par les neurones grâce à un transporteur membranaire non sélectif. Certains neurones du noyau du raphé, situé au sein du tronc cérébral, transforment le tryptophane en 5-hydroxytryptophane (5-HTP) grâce à une enzyme, la tryptophane hydroxylase. L'activité du tryptophane hydroxylase dépend essentiellement de la disponibilité en substrat. Le 5-hydroxytryptophane est ensuite converti en sérotonine (5-HT) par une autre enzyme, une décarboxylase, la 5-hydroxytryptophane décarboxylase (L-amino acide décarboxylase, AADC). Cette enzyme n'est pas sélective car elle assure aussi la décarboxylation de la L-dopa. La sérotonine synthétisée dans le cytoplasme est ensuite stockée dans les granules par l'intermédiaire de transporteurs vésiculaires, nommés VMAT-1 et -2, communs aux diverses monoamines.
L'arrivée d'un potentiel d'action à la terminaison synaptique provoque la libération de la sérotonine par exocytose, dans la fente synaptique. Elle peut alors suivre quatre voies :
- être captée par des récepteurs sérotoninergiques postsynaptiques et assurer la transduction du signal neuronal ;
- être recaptée par des récepteurs sérotoninergiques présynaptiques ;
- être recaptée par des neurones (ou des plaquettes) par l'intermédiaire d'un transporteur membranaire sélectif SERT ;
- être dégradée par la monoamine oxydase MAO.
La MAO dégrade aussi les catécholamines. L'aldéhyde formé est ensuite oxydé en acide 5-hydroxy-indol-acétique (5-HIAA), éliminé par voie urinaire, grâce à l'aldéhyde déshydrogénase.
Recapture
La sérotonine déversée dans la fente synaptique peut être recapturée par le neurone présynaptique grâce à un transporteur (SERT) qui diminue ainsi la concentration de sérotonine synaptique. Cette recapture est inhibée par plusieurs antidépresseurs, notamment les ISRS (inhibiteurs sélectifs de la recapture de la sérotonine) qui sont : la fluoxétine, le citalopram et son énantiomère l'escitalopram, la fluvoxamine, la paroxétine et la sertraline.
Le polymorphisme du gène SLC6A4 codant le transporteur de la sérotonine a très possiblement un lien avec la démonstration de traits psychopathiques. Les allèles dits longs sont associés avec une transcription accrue du transporteur et les homozygotes de cet allèle démontrent des similarités importantes avec les psychopathes[23].
Récepteurs sérotoninergiques
Les neurones du raphé dorsal sont connectés à la plupart des régions du système nerveux central (cerveau, tronc cérébral, moelle spinale). La sérotonine est libérée dans des synapses et se lie à des récepteurs localisés sur la membrane de l'élément postsynaptique. Par l'intermédiaire de leurs axones, les neurones du noyau du raphé libèrent la sérotonine sur d'autres neurones du système nerveux central et, en se liant à des récepteurs spécifiques, modulent leurs propriétés électriques. La sérotonine agit en se liant à des récepteurs spécifiques situés dans la membrane des cellules cibles. On connaît au moins 14 gènes codant ces récepteurs sérotoninergiques 5-HT, capables de donner (par épissage alternatif) au moins 30 protéines réceptrices différentes[24].
Les différents types de récepteurs ont été répartis conventionnellement en sept groupes différents, notés 5-HT1 à 5-HT7, en fonction des analogies de structure des gènes.
On peut aussi distinguer :
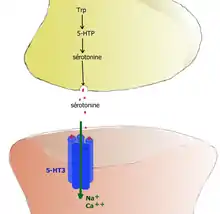
- récepteurs ionotropes : les récepteurs 5-HT3 sont des récepteurs canaux à perméabilité cationique. Leur stimulation provoque une entrée d'ions sodium Na+ et calcium Ca2+ qui diminuent rapidement la charge négative intracellulaire (soit une dépolarisation) du neurone postsynaptique et déclenchent un potentiel d'action postsynaptique excitateur (PPSE). Ils sont donc excitateurs.
- 5-HT3 → entrée de Na+ et Ca2+ → dépolarisation → potentiel d'action PPSE.
- Ces récepteurs 5-HT3 sont situés sur l'extrémité des fibres sensitives extrinsèques vagales et splanchniques. Leur stimulation envoie un signal par la moelle spinale jusqu'au centre de contrôle du vomissement qui induit une sensation de nausée et provoque le vomissement. Les antagonistes sélectifs du récepteur 5-HT3 de la famille des sétrons sont utilisés pour combattre les nausées et vomissements postopératoires ou ceux induits par les traitements anticancéreux[25].
- récepteurs couplés aux protéines G : les récepteurs 5-HT1, 2, 4, 5, 6 sont tous heptahélicoïdaux (protéine à sept hélices transmembranaires) couplés aux protéines G. Ces récepteurs modulent l'activité neuronale en augmentant ou diminuant les potentiels d'action postsynaptiques.
La famille des récepteurs 5-HT1 comporte cinq membres, nommés 5-HT1A, 5-HT1B, 5-HT1D, 5-HT1E, 5-HT1F. Ils ont pu être identifiés grâce à la spipérone, une molécule à haute affinité pour les récepteurs 5-HT1A et faible affinité pour 5-HT1D.
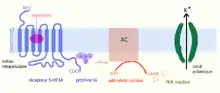
La fixation de la sérotonine sur un récepteur 5-HT1A (ou 5-HT1B) provoque une modification de sa configuration spatiale, ce qui active la protéine Gi à laquelle il est couplé. Il s'ensuit une cascade de réactions[14] :
- 5-HT1A → Gi → AC inhibé → cAMP ↓ → PKA inactive → sortie de K+ → hyperpolarisation → PA ↓.
L'inhibition de l'adénylate cyclase (AC) entraîne une diminution d'AMP cyclique et une inactivation de la protéine kinase A (PKA). Celle-ci permet une augmentation de l'ouverture d'un canal potassique et une sortie importante d'ions K+ de la cellule provoquant une augmentation de la charge négative intracellulaire. Finalement, le neurone portant le récepteur se retrouve hyperpolarisé, ce qui entrave la propagation de l'influx nerveux (PA ↓). La sérotonine en activant ces récepteurs 5-HT1A joue ainsi un rôle inhibiteur. Les corps cellulaires et les dendrites des neurones sérotoninergiques, situés dans les noyaux du raphé, l'hippocampe, l'amygdale et les noyaux de la base, expriment en quantité importante des autorécepteurs 5-HT1A et des canaux potassiques. Plus il y aura de sérotonine émise par le neurone, plus il y en aura de recaptée par les autorécepteurs pour freiner toute nouvelle libération. On a donc un mécanisme de rétroaction négative.
Les récepteurs 5-HT1A sont aussi largement distribués dans le système limbique où ils sont la cible privilégiée de nombreux anxiolytiques et antidépresseurs. Les récepteurs 5-HT1B et 5-HT1D sont surtout présents au niveau présynaptique dans les ganglions de la base où ils forment une boucle de rétroaction négative. Les récepteurs 5-HT2 n'ayant qu'une affinité modérée pour la sérotonine ne sont stimulés que lorsque les récepteurs 5-HT1 sont saturés. Les récepteurs 5-HT2B/C, couplés à une protéine Gq, entraînent une production de monoxyde d'azote NO et une relaxation des muscles lisses et donc une vasodilatation. Par contre, la stimulation des récepteurs 5-HT4, 5-HT6, 5-HT7, entraîne une augmentation de l'activité de l'adénylate cyclase (AC) et la cascade réactionnelle :
- 5-HT4 → Gs → AC → cAMP ↑ → PKA activée → blocage des sorties de K+ → dépolarisation → PA ↑.
La diminution de la conductance potassique produit une lente dépolarisation susceptible d'amplifier le potentiel d'action (PA). Les récepteurs 5-HT4 sont exprimés (avec les récepteurs 5-HT3) dans le tractus intestinal où ils contrôlent le péristaltisme du tube digestif. Dans le cerveau, on en trouve en position présynaptique dans le striatum où ils exercent un effet facilitateur sur la libération de l'acétylcholine et ainsi de renforcement des performances cognitives.
Rôles physiologiques
On trouve la sérotonine dans le cerveau (où elle joue le rôle de neurotransmetteur et de neuromodulateur) et dans le système digestif. Elle est impliquée dans la régulation de fonctions telles que la thermorégulation, les comportements alimentaires et sexuels, le cycle veille-sommeil, la douleur, l'anxiété ou le contrôle moteur. La sérotonine de la mère joue un rôle important dans le développement de l'embryon[26]. Un déséquilibre de sérotonine expliquerait 50 % des cas de mort subite du nourrisson[27].
L'activité des neurones du raphé est liée au cycle veille-sommeil. Au cours du sommeil, les neurones du raphé sont silencieux et ne libèrent donc pas de sérotonine. Lorsque le sujet est éveillé, les neurones du raphé produisent des potentiels d'action à intervalles très réguliers. La fréquence des influx nerveux est corrélée à l'activité motrice, ce qui suggère que la quantité de sérotonine libérée dans le système nerveux central est augmentée avec l'activité motrice. Comme la sérotonine joue un rôle important dans les changements d'état émotionnel, on pense que certaines molécules analogues à la sérotonine peuvent modifier ces états émotionnels. Les inhibiteurs sélectifs de la recapture de la sérotonine (des substances qui inhibent la recapture de la sérotonine, par exemple la fluoxétine), sont utilisés en médecine pour soigner les symptômes liés à la dépression ou aux troubles obsessionnels compulsifs et aussi pour la boulimie.
Douleur

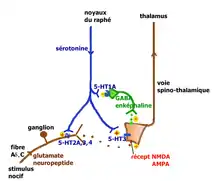

La sérotonine est impliquée aux divers niveaux des voies de transmission et de contrôle de la douleur.
L'inflammation consécutive à une lésion tissulaire libère un grand nombre de médiateurs qui vont activer les terminaisons des fibres afférentes primaires (FAP) de type C et Aδ (dont les corps cellulaires sont situés dans les ganglions des racines dorsales) chargés de transmettre l'information nociceptive au cerveau par la voie spinothalamique. Les terminaisons de ces FAP nociceptives comportent une large panoplie de récepteurs et canaux[28]. Les fibres C déchargent lorsque de la sérotonine se lie aux récepteurs ionotropes 5-HT3 qu'elles expriment. Ces terminaisons comportent aussi des récepteurs couplés à une protéine G, comme les récepteurs sérotoninergiques 5-HT2A et aussi à un moindre degré 5-HT1A, et des récepteurs aux autres molécules algogènes comme la bradykinine, de l'histamine, etc.
La sérotonine provient principalement des plaquettes sanguines mais aussi des mastocytes, lymphocytes et macrophages. Elle permet (via ces récepteurs couplés à une protéine G) une sensibilisation[29] des nocicepteurs aux substances algogènes comme la bradykinine, l'ATP ou les ions H+ qui génèrent l'influx dans les FAP. Quand les fibres C sont elles-mêmes lésées, leur contenu en sérotonine augmente et provoque une forte activation et sensibilisation pouvant expliquer l'hypersensibilisation périphérique des douleurs neuropathiques.
- Action au niveau de la moelle spinale : le premier relais de la transmission des informations nociceptives se trouve dans la corne dorsale de la moelle spinale. Le premier neurone des fibres Aδ ou C libère dans l'espace synaptique de ce relais des neurotransmetteurs excitateurs (glutamate, aspartate) et des neuropeptides (substance P, neurokinine A, CGRP, somatostatine, CCK et VIP). Le deuxième neurone qui croise la ligne médiane et monte vers le deuxième relais situé dans le thalamus, capte ces médiateurs ainsi que de nombreux médiateurs d'origines diverses : des peptides opioïdes (enképhaline, bêta-endorphine, dynorphine) émis par des interneurones inhibiteurs, eux-mêmes stimulés par les neurones de la voie descendante du raphé magnus ; la sérotonine émise par les neurones sérotoninergiques qui descendent des noyaux du raphé magnus.
Les neurones du raphé magnus, à l'origine de la majorité des projections sérotoninergiques, ont un rôle qui peut être pronociceptif, ou antinociceptif, suivant le contexte physiologique et pharmacologique (Millan[30] 2001). L'explication tient à la présence en des lieux différents de récepteurs sérotoninergiques différents pouvant activer ou ralentir l'activité neuronale. Millan propose les deux voies illustrées ci-contre.
Lors de stimulations nociceptives intenses, la voie rétroactive inhibitrice entraîne la suppression des messages nocicepteurs au niveau de la moelle. On peut observer chez le rat que la stimulation électrique du raphé provoque la libération de la sérotonine au niveau médullaire avec inhibition des fibres C, stimulation des interneurones GABAergiques et enképhalinergiques bloquant complètement la transmission du message nocicepteur au niveau du deuxième neurone de la voie spinothalamique. La voie facilitatrice descendante serait principalement mise en jeu par la stimulation soutenue à la périphérie des fibres afférentes primaires se projetant dans la corne dorsale sur des cellules exprimant le récepteur NK1 de la substance P. Ces cellules activent par une voie indirecte les noyaux du raphé magnus[31]. La facilitation implique la présence des récepteurs 5-HT3 et 5-HT2A.
Transit intestinal
La sérotonine est un médiateur du péristaltisme intestinal[32]. Quand la sérotonine baisse, le transit de l'intestin grêle et du colon est plus lent mais la vidange gastrique est plus rapide et il y a moins d’inflammation intestinale[33],[34]. Quand la sérotonine augmente, le transit de l'intestin grêle et du colon est plus rapide mais la vidange gastrique est plus lente et l’inflammation intestinale est augmentée.
Contrôle de l'agressivité
La sérotonine (en lien avec la dopamine) semble être impliquée dans certains suicides, certaines formes de dépression et la genèse de comportements agressifs[35],[36]. Un faible taux de sérotonine dans le fluide cérébrospinal, et plus encore de 5-HIAA (son principal métabolite) sont associés à une augmentation de l'agressivité impulsive[37]. Chez l'adulte, le faible fonctionnement sérotonergique est nettement associé à une agressivité augmentée[38], mais les études sur les enfants semblent plus contradictoires, l'histoire psychosociale et familiale (plus ou moins riche en adversité et conflits) modulerait cet effet[39]. Des causes ou facteurs de risques génétiques semblent parfois en cause[40].
Par effet inverse, la production de sérotonine va créer une forme d'inhibition comportementale, autant dans la recherche de sensation que dans le neuroticisme. Les personnes ayant une surproduction de sérotonine sont donc souvent des personnes qui ne sont pas à la recherche de sensations et qui sont peu anxieuses.
Les effets comportementaux d'hallucinogènes comme le LSD, la psilocybine, ou la mescaline sont liés à l'activation des récepteurs 5-HT2A. Toutefois, les récepteurs 5-HT1A et 5-HT2C et les récepteurs de la dopamine joueraient aussi un certain rôle. Les premières hypothèses sur la relation du LSD avec les récepteurs de la sérotonine datent des travaux de Gaddum (1953). Pourtant, le mécanisme précis d'action n'est toujours pas complètement établi. Le consensus actuel veut que l'ensemble des hallucinogènes stimulent les récepteurs 5-HT2 et particulièrement le 5-HT2A. Un bon appui à cette hypothèse vient de nombreuses études faites sur les rongeurs et plusieurs études cliniques sur l'humain. Dans une étude sur trois groupes de sujets volontaires, Vollenweider et al.[41] (1998) ont montré que des antagonistes sélectifs des 5-HT2A (kétansérine, ritansérine) bloquaient les effets hallucinogènes de la psilocybine. L'hypothèse que certaines perturbations psychiques induites par le LSD et la psilocybine sont proches de la schizophrénie a reçu de nouveaux soutiens ces dernières années. L'expérience a montré que les effets psychomimétiques de la psilocybine s'obtenaient par une suractivation des récepteurs 5-HT2A. D'autre part, les patients schizophrènes ont une densité réduite de ces récepteurs dans le cortex préfrontal[42].
Augmentation de production
Alimentation
L'alimentation a un effet sur le taux de sérotonine. Cependant, la sérotonine ne traverse pas la barrière hémato-encéphalique[43], seul le tryptophane peut le faire. La banane, par exemple, bien qu'elle contienne de la sérotonine, n'a pas d'effet sur l'humeur dû à ce neurotransmetteur. La dinde n'a pas non plus d'effet sur l'humeur (en tout cas par ce mécanisme), contrairement à une idée répandue[43]. L'α-lactalbumine, contenue en faible quantité dans le lait, contient relativement plus de tryptophane que la plupart des protéines.
La production de sérotonine dans le cerveau dépend du taux de transport du tryptophane au travers de la barrière hémato-encéphalique. Ce taux de transport est inversement proportionnel aux concentrations des autres grands acides aminés neutres (leucine, isoleucine, valine, tyrosine, phénylalanine) avec lesquels il est en compétition à l'entrée du cerveau. Les concentrations de ces derniers, enfin, varient en fonction de la proportion relative des glucides et protéines consommées. C'est ainsi que la consommation de sucre ou d'aliments sucrés aura pour effet d'augmenter indirectement (et momentanément) les concentrations de tryptophane dans le cerveau, tandis qu'un repas plus protéiné (paradoxalement plus riche en acides aminés, tryptophane compris) aura pour effet de diminuer les concentrations cérébrales de tryptophane et, probablement, de sérotonine[44].
Humeur
La sérotonine serait liée à l'humeur dans les deux sens. C'est-à-dire que le taux de sérotonine influencerait l'humeur, et que les pensées positives ou négatives influenceraient à leur tour le taux de sérotonine[43]. Relativement à l'état mental, il a été observé chez des individus dépressifs une diminution de l'activité d'amines biogènes, principalement la sérotonine[45].
Toutefois, une méta-analyse publiée en 2022 souligne que les principaux domaines de recherche sur la sérotonine ne fournissent aucune preuve cohérente de l'existence d'une association entre la sérotonine et la dépression, et aucun soutien à l'hypothèse selon laquelle la dépression est causée par une activité ou des concentrations de sérotonine réduites[46],[47].
Activité physique
L’activité physique soutenue entraine la libération de la sérotonine. Les effets à court terme se font ressentir chez l’individu quelques minutes après le début de l'activité. Dans le domaine sportif, la sérotonine est reconnue pour ces effets régulateurs de l’humeur, c’est-à-dire l’amélioration du bien-être[48]. Les effets à long terme quant à eux peuvent prendre de plusieurs heures à plusieurs jours avant de produire leur effet. Les effets à long terme combinés à la pratique régulière d’activité physique soutenue se résument à un équilibre général de bien-être chez son hôte à cause du taux d’hormone qui se situe au juste équilibre. Ce bien-être est traduit par la régulation du sommeil, de la faim et de l’humeur comme par la diminution du stress, de l’anxiété et des signes et symptômes dépressifs[49]. L’hormone a des effets bénéfiques sur l’apprentissage et la mémorisation[50]. La sérotonine joue un rôle dans la résorption osseuse[50] surtout après la pratique d’un sport à impact telle que le ski de bosses et la course à pied. L’activité sportive sur une base régulière permet l’homéostasie, c’est-à-dire de maintenir le corps en santé[50]. Rappelons qu’un taux élevé de l’hormone sérotonine joue un rôle dans des interactions moins détectables à l’œil ou sans les connaissances appropriées. Ces effets plutôt méconnus contribuent entre autres à la réaction inflammatoire et à la formation du clou plaquettaire[50].
La pratique régulière de l'activité physique augmente la sécrétion naturelle de sérotonine[43].
Lumière
L'exposition à la lumière du jour ou la luminothérapie évitent la transformation de la sérotonine en mélatonine[43].
Carences
Il semblerait que l'ecstasy augmente fortement la production de sérotonine de façon temporaire, causant après coup une carence de l'ordre de 50 à 80 % du niveau normal de sérotonine chez un utilisateur régulier[51]. La consommation d'une formule contenant tous les acides aminés sauf le tryptophane amène à une rapide et brutale baisse de sérotonine dans le cerveau. Ce protocole, appelé Acute Tryptophan Depletion, est utilisé à des fins diagnostiques[43].
Autre
Une expérience de domestication du renard argenté a montré que les animaux domestiqués ont plus de sérotonine que les animaux sauvages[52].
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- 1 2 3 4 (en) « Sérotonine », sur ChemIDplus, consulté le 8 février 2009.
- ↑ (en) Kathy Deroy, Francine Côté, Thierry Fournier et Thomas Sanderson, « Serotonin Production by Human and Mouse Trophoblast: Involvement in Placental Development and Function », Placenta, vol. 34, no 9, (DOI 10.1016/j.placenta.2013.06.214, lire en ligne).
- ↑ (en) W.Q. Huang, C.L. Zhang, X.Y. Di et R.Q. Zhang, « Studies on the localization of 5-hydroxytryptamine and its receptors in human placenta », Placenta, vol. 19, no 8, , p. 655–661 (DOI 10.1016/s0143-4004(98)90027-3, lire en ligne).
- ↑ (en) A. Bonnin et P. Levitt, « Fetal, maternal, and placental sources of serotonin and new implications for developmental programming of the brain », Neuroscience, vol. 197, , p. 1–7 (PMID 22001683, PMCID PMC3225275, DOI 10.1016/j.neuroscience.2011.10.005, lire en ligne, consulté le ).
- ↑ (en) H P Rang, M M Dale, JM Ritter, RJ Flower, Rang and Dale's Pharmacology, Churchill Livingstone Elsevier, 2007 (sixth edition), 830 p..
- 1 2 Fillion G., [Nouveaux aspects dans la recherche sur le système sérotonergique cérébral : Médecine médico-légale = New advances in research on cerebral serotogernic system: Forensic medical ] (résumé Inist-CNRS) ; Journées Internationales de biologie (JIB 97) No42, Paris, FRANCE (11/1997) ; 1998, vol. 32, no 234, p. 161-172 (17 ref.), p. 93-98.
- ↑ L'Express - Neurosciences: sérotonine vs dopamine, la chimie du bien-être - Par Stéphanie Benz, publié le 28/02/2018 : « Nous savons aujourd'hui que ces comportements participent à la production de sérotonine dans le cerveau, constate Pierre-Marie Lledo, directeur du département neurosciences de l'Institut Pasteur. Ce neurotransmetteur, impliqué dans le sentiment de plénitude et de contentement, se révèle essentiel à la régulation de nos humeurs: un cerveau baignant dans la sérotonine est indiscutablement un cerveau heureux. D'ailleurs, nombre de traitements de la dépression, à commencer par le plus célèbre d'entre eux, le Prozac, agissent en accroissant le taux de sérotonine dans notre encéphale. »
- ↑ Young SN, « How to increase serotonin in the human brain without drugs », Journal of Psychiatry & Neuroscience, vol. 32, no 6, , p. 394–9 (PMID 18043762, PMCID 2077351)
- ↑ Virginia Tech. (2018, April 30). Keep calm and carry on: Scientists make first serotonin measurements in humans. ScienceDaily - «"We found that serotonin is highly active in the part of the brain that helps us to navigate bad outcomes in a way that ensures we don't overreact to them," said Rosalyn Moran, who is now a reader at the Institute for Psychiatry, Psychology and Neuroscience in King's College London. At the time of the date collection, Moran was an assistant professor at the VTCRI. Prior to her current position, she was a lecturer at the University of Bristol. "Serotonin acts in a way that reminds us to pay attention and learn from bad things, and to promote behaviors that are less risk seeking but also less risk averse. When there's an imbalance of serotonin, you might hide in a corner or run towards the fire, when you should really be doing something in between."»
- ↑ Inserm - Les récepteurs centraux de la sérotonine (1993) - Michel Hamon et Henri Golan - «La sérotonine ou 5-hydroxytryptamine ( 5-HT), initialement identifiée au niveau périphérique (elle est très abondante dans les cellules entérochromaffines de l'intestin et dans les plaquettes sanguines), a été mise en évidence dans le système nerveux central (SNC) des mammifères il y a une quarantaine d'années. Très vite, la démonstration de l'hétérogénéité de la distribution de la 5-HT au niveau cérébral a conduit à suggérer que cette amine y jouait le rôle de neuromédiateur. ... Il est aujourd'hui clairement établi que les neurones qui synthétisent et libèrent la 5-HT (les neurones sérotoninergiques) participent au contrôle de nombreuses fonctions centrales telles que le rythme veille/sommeil, la prise alimentaire, la nociception, la thermorégulation, l'activité sexuelle, etc.»
- ↑ Virginia Tech. (2018, April 30). Keep calm and carry on: Scientists make first serotonin measurements in humans. ScienceDaily - «The research provides the first ever recordings of simultaneous sub-second fluctuations in dopamine and serotonin during active decision-making in a conscious human subject. The analysis provides new understanding of serotonin's role in regulating human choice and how it operates alongside dopamine, a neurotransmitter long-associated with reward and its reinforcement. This is the first clear evidence, in any species, that the serotonergic system acts as an opponent to dopamine signaling," said Read Montague, the director of the VTCRI Human Neuroimaging Laboratory and the VTCRI Computational Psychiatry Unit and senior author on the paper.»
- ↑ Cuesta, Marc (2009), Modulation sérotonergique différentielle de l’horloge circadienne principale entre rongeurs diurnes et nocturnes ; Thèses de doctorat, Université de Strasbourg.
- 1 2 3 Yves Landry, Jean-Pierre Gies, Pharmacologie Des cibles vers l'indication thérapeutique, Dunod, 2009 (2e édition).
- ↑ Erspamer, Archo Sci Biol. 1946;31, 86.
- ↑ Rapport MM, Green AA, Page IH, Crystalline serotonin, Science, 1948;108:329–330.
- ↑ (Am J Physiol. 1953;175:157-61).
- ↑ Communiqué CNRS du 2 février 2012.
- ↑ MJT FitzGerald, Jean Folan-Curran, Neuro-anatomie clinique et neurosciences connexes, Maloine, .
- ↑ vers l'avant.
- ↑ « Le Ventre, notre deuxième cerveau », Sciences et Avenir, no N°784, , p. 51 « L'intestin produit 95 % de la sérotonine.(...) on sait que 95 % de la sérotonine du corps est produite dans l'intestin ».
- ↑ Natalie Terry et Kara Gross Margolis, « Serotonergic Mechanisms Regulating the GI Tract: Experimental Evidence and Therapeutic Relevance », Handbook of Experimental Pharmacology, vol. 239, , p. 319–342 (ISSN 0171-2004, PMID 28035530, PMCID 5526216, DOI 10.1007/164_2016_103, lire en ligne, consulté le )
- ↑ (en) Glenn AL, « The other allele: exploring the long allele of the serotonin transporter gene as a potential risk factor for psychopathy: a review of the parallels in findings », Neurosci Biobehav Rev, vol. 35, no 3, , p. 612-20. (PMID 20674598, PMCID PMC3006062, DOI 10.1016/j.neubiorev.2010.07.005, lire en ligne [html]).
- ↑ (en) John R. Raymond, Yurii V. Mukhinb, Andrew Gelascoa, Justin Turner, Georgiann Collinsworth, Thomas W. Gettys, Jasjit S. Grewal, Maria N. Garnovskaya, « Multiplicity of mechanisms of serotonin receptor signal transduction », Pharmacology & Therapeutics, vol. 92, , p. 179-212.
- ↑ Laurent Grélot, « Physiopathologie des vomissements en chimiothérapie oncologique », Medecine Therapeutique 3(3), , p. 149-157 (lire en ligne)
- ↑ Le développement cérébral du fœtus est sous la dépendance du génome maternel, Le Monde du 20 décembre 2006.
- ↑ (en) Hannah C. Kinney, « Multiple Serotonergic Brainstem Abnormalities in Sudden Infant Death Syndrome » JAMA, 1er novembre 2006;296:2124-32.
- ↑ (en) E.J. Nestler, S. E. Hyman, R.C. Malenka, Molecular Neuropharmacology: A Foundation for Clinical Neuroscience, McGraw-Hill Medical, , 516 p..
- ↑ La sensibilisation résulte d'une baisse du seuil du nocicepteur et d'une augmentation de son activité.
- ↑ (en) Mark J. Millan, « Descending control of pain », Progress in neurobiology, vol. 66, , p. 355-474.
- ↑ Karine Thibault, Etude comparative de trois modèles de douleurs neuropathiques chez le rat : étude comportementale, pharmacologique et analyse transcriptomique (thèse), Université Pierre et Marie Curie, .
- ↑ Terence K Smith et Michael D Gershon, « CrossTalk proposal: 5-HT is necessary for peristalsis », The Journal of Physiology, vol. 593, no Pt 15, , p. 3225–3227 (ISSN 0022-3751, PMID 26228547, PMCID PMC4553043, DOI 10.1113/JP270182, lire en ligne, consulté le )
- ↑ Michael D. Gershon, « Serotonin is a Sword and a Shield of the Bowel: Serotonin Plays Offense and Defense », Transactions of the American Clinical and Climatological Association, vol. 123, , p. 268–280 (ISSN 0065-7778, PMID 23303993, PMCID PMC3540639, lire en ligne, consulté le )
- ↑ Jean-Eric Ghia, Nan Li, Huaqing Wang et Matthew Collins, « Serotonin has a key role in pathogenesis of experimental colitis », Gastroenterology, vol. 137, no 5, , p. 1649–1660 (ISSN 1528-0012, PMID 19706294, DOI 10.1053/j.gastro.2009.08.041, lire en ligne, consulté le )
- ↑ (en) Dongju Seo and Christopher J. Patrick « Role of Serotonin and Dopamine System Interactions in the Neurobiology of Impulsive Aggression and its Comorbidity with other Clinical Disorders » Aggress Violent Behav. 2008;13(5):383–95. DOI 10.1016/j.avb.2008.06.003 PMCID: PMC2612120 NIHMSID: NIHMS69814 (résumé).
- ↑ (en) Miczek KA, Fish EW, De Bold JF, De Almeida RM. « Social and neural determinants of aggressive behavior: pharmacotherapeutic targets at serotonin, dopamine and gamma-aminobutyric acid systems » Psychopharmacology (Berl). 2002;163(3-4):434-58.
- ↑ Heerbert et Martinez, 2001, in Barry H. Schneider, Sébastien Normand, Monique Allès-Jardel, Conduites agressives chez l'enfant: Perspectives développementales et psychosociales ; PUQ, 2009 ; 353 pages.
- ↑ Asberg, 94, cité in Barry H. Schneider, Sébastien Normand, Monique Allès-Jardel, Conduites agressives chez l'enfant: Perspectives développementales et psychosociales ; PUQ, 2009 ; 353 pages.
- ↑ (en) Moffit TE, Caspi et Fawcet P. (1997) « Whole blood serotonin and family background relate to male violence » in A.Raine, PA Brennan, DP Farrington et SA Mednick (dif.), Biosoccial Bases of Violence (p. 321-340) -Y Plenum Press.
- ↑ (en) Arango V, Huang YY, Underwood MD, Mann JJ. « Genetics of the serotonergic system in suicidal behavior » J Psychiatr Res. 2003;37(5):375-86.
- ↑ (en) Vollenweider, F. X., Vollenweider-Scherpenhuyzen, M. F., Babler, A., Vogel, H., & Hell, D., « Psilocybin induces schizophrenia-like psychosis in humans via a serotonin-2 agonist action », Neuroreport, vol. 9, .
- ↑ (en) Mark A. Geyer et Franz X. Vollenweider, « Serotonin research: contributions to understanding psychoses », Trends in Pharmacological Sciences, vol. 29, no 9, .
- 1 2 3 4 5 6 (en) Simon N. Young « How to increase serotonin in the human brain without drugs » Revue de psychiatrie et de neuroscience, Université McGill.
- ↑ (en) Wurtman RJ, Wurtman JJ, Regan MM, McDermott JM, Tsay RH, Breu JJ, « Effects of normal meals rich in carbohydrates or proteins on plasma tryptophan and tyrosine ratios », Am. J. Clin. Nutr., vol. 77, no 1, , p. 128–32 (PMID 12499331, lire en ligne).
- ↑ « Dépression : Dossier thématique », sur inserm.fr (consulté le ).
- ↑ (en) University College London, « No evidence that depression is caused by low serotonin levels, finds comprehensive review », sur medicalxpress.com, (consulté le )
- ↑ (en) Joanna Moncrieff et al., « The serotonin theory of depression: a systematic umbrella review of the evidence », sur nature.com, (consulté le )
- ↑ MCKINLEY, Michel P. et al., Anatomie et physiologie, Une approche intégrée, Montréal, CHENELIÈRE ÉDUCATION, , 1478 p.
- ↑ INSTITUT DU CERVEAU, « Une nouvelle étude sur le rôle joué par la sérotonine dans la prise de décision », (consulté le )
- 1 2 3 4 MCKINLEY, Michel P. et al., Anatomie et physiologie, Une approche intégrée, Montréal, CHENELIÈRE ÉDUCATION, , 1478 p.
- ↑ (en) Kish SJ, Furukawa Y, Ang L, Vorce SP, Kalasinsky KS « Striatal serotonin is depleted in brain of a human MDMA (Ecstasy) user » Human Neurochemical Pathology Laboratory, Centre for Addiction and Mental Health, Toronto, Canada. .
- ↑ Lucy Jones, « A Soviet scientist created the only tame foxes in the world » (consulté le )
Voir aussi
Articles connexes
- Syndrome sérotoninergique
- Tryptophane
- Système nerveux entérique
- Liste d'hormones
Liens externes
- Ressources relatives à la santé :
- ChEMBL
- DrugBank
- (en) International Union of Pharmacology
- (en) Medical Subject Headings
- (en) PatientLikeMe
- (no + nn + nb) Store medisinske leksikon
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Chimie du choix
- (es) Fundación CiEM de Cooperación Internacional contra la Esclerosis Múltiple