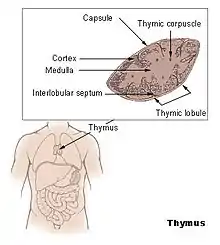
Le thymus (du grec θυμός, « excroissance charnue ») est un organe situé dans la partie supérieure du thorax, plaqué à l'arrière du manubrium sternal, plus précisément dans ce qu'il est convenu d'appeler le médiastin antéro-supérieur et antéro-moyen. Il supporte la différenciation et la sélection des lymphocytes T et joue donc un rôle fondamental dans l'immunité.
Son activité et sa taille sont maximales au cours de la puberté, avant d'involuer à l'âge adulte. Le thymus joue un rôle très important dans la mise en place du système immunitaire chez l'enfant en assurant la maturation des lymphocytes T aussi appelés thymocytes.
Histologiquement, c'est un organe lymphoïde épithélial. Il fait partie, avec la moelle osseuse, des organes lymphoïdes primaires. Il est entouré par une cloison conjonctive qui émet des travées délimitant des lobules. Chaque lobule possède une partie périphérique sombre, le cortex, et une partie centrale claire : la médulla.
Description
Anatomie
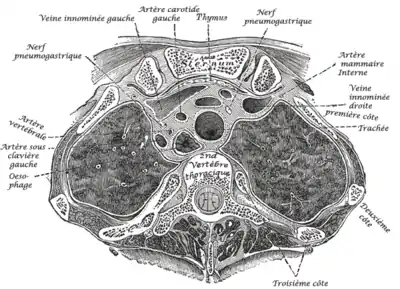
Le thymus est situé dans le médiastin antéro-supérieur et antéro-moyen. C’est un organe mou, constitué de deux lobes unis sur la ligne médiane sauf à l’extrémité supérieure et inférieure. Les deux lobes sont le plus souvent de tailles différentes ; occasionnellement, ils peuvent, être soit unis et formant alors une seule masse, ou soit séparés par un lobe intermédiaire. Son volume augmente en direction caudale. Il présente quatre faces : antérieure, supérieure et deux latérales.
Le thymus se projette entre le 4e cartilage costal et le bord inférieur de la thyroïde, il est donc partiellement dans le thorax et partiellement dans le cou.
Évolution
Parce que le thymus évolue constamment, les radiologistes ont parfois du mal à différencier le thymus sain du thymus pathologique. Comme Galien le remarqua le premier, le thymus augmente de taille de la naissance jusqu’à la puberté. Cette observation fut vérifiée par William Hewson en 1777, qui étudia l’évolution de la taille du thymus chez le fœtus et l’enfant. À la puberté, le thymus subit un processus appelé « involution », qui définit la décroissance progressive du thymus avec l’âge. Durant l’involution, le tissu épithélial s’atrophie en faveur de tissu adipeux.
Il pèse 15 g à la naissance. À la puberté, son poids atteint 35 g. Ensuite, l’involution du thymus entraine une diminution de sa masse, il pèse 25 g à 20 ans, moins de 15 g à 60 ans et moins de 6 g à 70 ans. Le thymus mesure 5 cm de long sur 4 cm de large et 1 cm d’épaisseur. Le thymus grandit de la naissance jusqu’à la puberté puis régresse progressivement.
Chez l’enfant, le thymus est rouge sombre en raison de sa riche vascularisation, mais devient progressivement plus gris, puis jaune chez la personne âgée par l’infiltration de tissu adipeux. Le thymus ne change pas significativement, mais le tissu lymphoïde est remplacé peu à peu par du tissu adipeux.
Rapports
Le thymus est contenu dans la loge thymique. La paroi antérieure de cette dernière est formée par le feuillet profond du fascia cervical moyen en haut et le ligament sterno-péricardique en bas. Sa paroi postérieure est constituée par le fascia thyro-péricardique et le péricarde sous-jacent. Latéralement, la loge thymique est délimitée par les gaines des vaisseaux du cou.
Antérieurs : le thymus répond en avant aux muscles sterno-hyoïdien et sterno-thyroïdien, au ligament sterno-péricardique supérieur, aux vaisseaux thoraciques et au corps et manubrium sternal.
Postérieurs : le thymus répond en haut à la trachée, et en bas à la partie inférieure de l’artère carotide commune gauche, au tronc brachio-céphalique artériel droit, à l’artère pulmonaire, à l’arc aortique, à la veine cave supérieure et au cœur.
Latéraux : le thymus répond à la gaine vasculo-nerveuse du cou, à la plèvre et aux poumons. Supérieurs : le thymus est en rapport avec le bord inférieur de la thyroïde, accolé ou distant de quelques millimètre. Dans ce dernier cas, la gaine de la thyroïde est reliée à la gaine du thymus par le ligament thyroïdien.
Innervation et vascularisation
L’innervation du thymus est sympathique par le ganglion cervico-thoracique et parasympathique par le nerf vague.
Le thymus est vascularisé par l’artère trabéculaire (issue de l’artère thoracique interne) et par des branches de l’artère thyroïdienne inférieure. Il existe souvent des anastomoses entre les artères qui vascularisent la thyroïde et le thymus. Le drainage veineux s’effectue par les veines thyroïdienne inférieure, thoracique interne et brachiocéphalique gauche. Les lymphatiques du thymus aboutissent aux nœuds des lymphocentres médiastinal antérieur transverse et thoracique interne.
Histologie
Le cortex est principalement composé de lymphocytes (aussi appelés thymocytes) ainsi que quelques cellules épithéliales et mésenchymateuses, tandis que la médulla est composée de nombreuses cellules épithéliales et quelques thymocytes. Les cellules épithéliales jouant un rôle majeur dans la maturation des lymphocytes T, sont nommées nurse cells (cellules nourricières). De plus, les récepteurs aux antigènes des thymocytes ou récepteur des cellules T interagissent avec les antigènes du complexe majeur d’histocompatibilité portés par les cellules épithéliales. Cette étape de la maturation permet d’éliminer les lymphocytes T autoréactifs.
Imagerie
Il est identifiable scanographiquement jusqu’à 35 ans. Au scanner, le thymus apparaît comme une structure bilobée triangulaire localisée dans le médiastin antérieur, le plus souvent antérieur à l’aorte ascendante, à la veine cave supérieure et aux voies pulmonaires. Différencier le thymus des autres structures médiastinales comme les nœuds lymphatiques ou le sinus supérieur du péricarde peut s’avérer difficile.
L’épaisseur du thymus a largement été étudiée au scanner et IRM. Baron et al. ont étudié 154 scanners de thymus normaux. Il en résulte que l’épaisseur moyenne du thymus est de 1,1 cm (écart type de 0,4 cm) dans le groupe des patients âgés de 6 à 19 ans et de 0,5 cm (écart type de 0,27 cm) dans le groupe de patients âgés de plus de 19 ans. L’épaisseur maximum était de 1,8 cm dans le groupe de patients de moins de 20 ans et de 1,3 cm dans le second groupe. Cependant, sur les images IRM, le thymus est plus épais (entre 1,5 et 2 cm chez les patients âgés de plus de 20 ans.) Ceci serait dû à une meilleure détection du tissu adipeux et des bords du thymus avec l’IRM.
Rôle
D'après Galien, le thymus était l'organe dans lequel se trouvait l'esprit ou l'âme. Autrefois, il était aussi décrit comme un organe de purification du système nerveux. Un peu plus tard, on pensait que le thymus était un coussin de protection de la cage thoracique ou encore qu'il régulait la fonction pulmonaire fœtale et néonatale. En 1832, Astley Cooper, chirurgien et anatomiste anglais, suggéra que le thymus avait une fonction majeure dans l’organisme, sans toutefois la préciser.
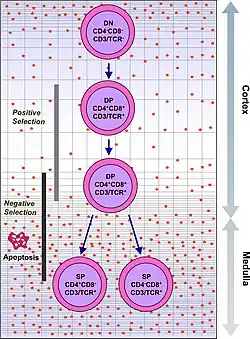
Le thymus est un organe lymphoïde primaire car spécialisé dans la maturation des lymphocytes dans lequel les cellules T d'origine médullaire subissent une différenciation cellulaire[1],[2],[3]. Cette différenciation se fait par l'acquisition du récepteur des cellules T. Le récepteur des cellules T est une glycoprotéine membranaire formée d'une chaîne alpha et d'une chaîne bêta.
Les thymocytes les plus immatures n'ont ni récepteur des cellules T ni les co-récepteurs CD4 et CD8, ils sont appelés « thymocytes double négatifs » (CD4− et CD8−) et représentent 5 % des thymocytes. La maturation se fait par l'acquisition des antigènes CD4 et CD8 aboutissant aux thymocytes double positifs (CD4+ et CD8+) constituant 80 % des thymocytes.
Deux hormones thymiques principales contrôlent ces étapes de différenciation des prothymocytes :
- la thymopoïètine qui agit sur les cellules nourricières des prothymocytes ;
- la thymosine (facteur humoral thymique) qui stimule l'immunocompétence des lymphocytes T.
Développement thymique des lymphocytes T
Le développement thymique des lymphocytes T couvre plusieurs processus qui requièrent la relocalisation dynamique des lymphocytes en développement, à l'intérieur et à l'extérieur des multiples environnements qui constituent l'architecture du thymus. Ces processus incluent[4],[5],[6],[7],[8],[9] :
- L'entrée des progéniteurs lymphoïdes dans le thymus ;
- La génération de thymocytes double-positifs (DP) CD4+ CD8+ dans le cortex thymique extérieur ;
- Le sécrétion de la thymuline, un peptide activant la division des lymphocytes T cytotoxiques[10] ;
- La sélection positive puis négative des thymocytes double-positifs dans le cortex ;
- L'interaction des thymocytes sélectionnés avec les cellules épithéliales thymiques médullaires pour l'assurance d'une tolérance centrale ;
- L'exportation des lymphocytes T matures depuis le thymus.
Pour que les thymocytes en développement puissent passer par chacune de ces étapes dans l'ordre et au bon endroit, ils doivent communiquer entre eux, de façon proximale ou distale. Cependant, le développement des thymocytes passe par une sélection rigoureuse du répertoire thymique dans laquelle seuls 1 à 3 % des thymocytes réussissent à survivre et à être exportés du thymus[11],[12],[13].
Embryologie
Le développement de la tête et du cou est marqué par l’apparition de l’appareil branchial. En effet, dès la quatrième semaine les six arcs branchiaux se forment à la suite de l’évagination dans le tissu mésenchymateux de cinq profonds sillons : les poches branchiales ectoblastiques et endoblastiques. Ce n’est pas sans rappeler la formation des fentes branchiales des poissons et amphibiens. Cependant chez l’embryon humain, les poches branchiales endoblastiques et ectoblastiques n’entreront pas en contact (sauf entre le premier et le deuxième arcs, où la réunion des poches formera le tympan). Les arcs branchiaux sont constitués d’un axe mésenchymateux tapissé extérieurement d’ectoblaste et intérieurement d’endoblaste. Les dérivés des arcs branchiaux sont nerveux, musculaires et constitutifs du squelette.
Exemple : le nerf VII ou facial, les muscles de la face, l’étrier, une partie de l'os hyoïde et de l'os temporal dérivent de l’arc branchial 2 (ou arc hyoïdien).
La troisième poche endobranchiale présente à son extrémité distale deux récessus l’un ventral et l’autre dorsal. À la cinquième semaine du développement, l’épithélium du récessus dorsal de la troisième poche se différencie en tissu parathyroïdien tandis que le récessus ventral forme l'ébauche du thymus. Ces ébauches glandulaires perdent leurs connexions avec la paroi pharyngienne et le thymus migre en direction caudale et médiale, entraînant avec lui la glande parathyroïde inférieure.
Le corps du thymus rejoint rapidement sa situation définitive dans le thorax, où il fusionne avec son homologue du côté opposé. Sa portion caudale, étroite et allongée, se segmente en petits fragments. Ces fragments disparaissent habituellement, mais ils peuvent parfois persister et sont alors enchâssés dans le corps de la thyroïde ou isolés (îlots thymiques accessoires).
À la neuvième semaine de gestation, le thymus est uniquement constitué de tissu épithélial, mais à la dixième semaine, de petites cellules lymphoïdes migrent du foie et de la moelle osseuse vers le thymus et participent ainsi à la division en lobules de l’organe. La différenciation entre le cortex et la médulla est complète à partir de la quinzième semaine.
Le développement du thymus se poursuit après la naissance et jusqu’à la puberté. Chez le jeune enfant, la glande occupe une place considérable dans le thorax, entre le sternum en avant et le péricarde et les gros vaisseaux en arrière. Chez l’adulte la glande s’atrophie et devient difficilement reconnaissable.
L’étude de l’embryologie du thymus permet d’aborder trois pathologies :
- thymus ectopique : du fait de la migration des tissus glandulaires, il n’est pas rare de retrouver des vestiges sur le trajet de migration. Des vestiges cervicaux sont parfois observés sur des scanners ou des IRM ;
- syndrome de Di-George (syndrome des troisième et quatrième poches endobranchiales) ;
- hypoplasie du thymus ou absence du thymus responsable d’un déficit immunitaire.
Pathologie
Chez l'être humain
Un élargissement du thymus peut être causé par différentes maladies : thymome, lymphome ou cancer. Il peut être également vu en cas de maladie de Basedow[14], secondaire à une hyperplasie lymphoïde et une hyperplasie du tissu thymique (non lymphoïde)[15].
Dans la myasthénie, l'hyperplasie thymique est fréquente pouvant aller jusqu'au thymome[16], lequel est parfois traité par thymomectomie.
Chez l'animal
Des anomalies histologiques et morphologiques du thymus sont induites par la prise d'anabolisant. Chez l'animal d'élevage, ces anomalies - facile à détecter à l'abattoir - sont assez importantes et caractéristiques pour être utilisée comme biomarqueur de l'utilisation illégale de Clenbuterol associé à d'autres molécules (dexaméthasone et autres stéroïdes sexuels ou corticostéroïdes, etc. encore retrouvés en Europe en 2012 après avoir été utilisés comme activateurs de croissance chez les veaux de boucherie et les bovins de boucherie). L'observation du thymus (sans analyse biochimique) permet même de détecter certains anabolisants, même si ces derniers ne sont plus détectables dans le plasma sanguin[17]. En effet, même de « faibles doses de dexaméthasone (DXM), administrées seules ou en association avec le clenbutérol comme facteur de croissance chez les bovins de boucherie, induisent des changements morphologiques dans le thymus » (augmentation de l’infiltrat graisseux, associé à une atrophie corticale) avec une réduction très nette du ratio cortex/médulla (C/M) chez les animaux traités[17]. Sous un seuil de 0,93 pour le ratio C/M, il s'agit d'animaux traités au DXM (qui inhibe la sécrétion de cortisol au cours de la période de traitement, mais avec un effet qui disparait 8 jours après la fin du traitement, ce qui permet qu'il ne soit plus détecté par les analyses classiques à l'abattoir[17].
Notes et références
- ↑ (en) Jacques F. A. P. Miller, « Immunological function of the thymus », Lancet, vol. 278, no 7205, , p. 748-749. (DOI 10.1016/S0140-6736(61)90693-6).
- ↑ (en) Michael J. Bevan, « In a radiation chimaera, host H–2 antigens determine immune responsiveness of donor cytotoxic cells », Nature, vol. 269, no 5627, , p. 417-418. (DOI 10.1038/269417a0).
- ↑ (en) R.M. Zinkernagel, G.N. Callahan, A. Althage, S. Cooper, P.A. Klein et J. Klein, « On the thymus in the differentiation of "H-2 self-recognition" by T cells: evidence for dual recognition? », J Exp Med, vol. 147, no 3, , p. 882-896. (DOI 10.1084/jem.147.3.882).
- ↑ (en) G. Sainte-Marie et C.P. Leblond, « Cytologic Features and Cellular Migration in the Cortex and Medulla of Thymus in the Young Adult Rat », Blood, vol. 23, no 3, , p. 275-299.
- ↑ (en) H. Cantor et I. Weissman, « Development and function of subpopulations of thymocytes and T lymphocytes », Progress in Allergy, vol. 20, , p. 1-64.
- ↑ (en) O. Stutman, « Intrathymic and extrathymic T cell maturation », Immunological Reviews, vol. 42, , p. 138-184.
- ↑ (en) A.K. Bhan, E.L. Reinherz, S. Poppema, R.T. McCluskey et S.F. Schlossman, « Location of T cell and major histocompatibility complex antigens in the human thymus », The Journal of Experimental Medicine, vol. 152, no 4, , p. 771-782 (DOI 10.1084/jem.152.4.77).
- ↑ (en) Howard T. Petrie, « Cell migration and the control of post-natal T-cell lymphopoiesis in the thymus », Nature Reviews Immunology, vol. 3, no 11, , p. 859-866 (DOI 10.1038/nri1223).
- ↑ (en) D.H. Gray, T. Ueno, A.P. Chidgey, M. Malin, G.L. Goldberg, Y. Takahama et R.L. Boyd, « Controlling the thymic microenvironment », Current Opinion in Immunology, vol. 17, no 2, , p. 137-143 (DOI 10.1016/j.coi.2005.02.001).
- ↑ Jacques-Paul Borel et Alain Randoux, Biochimie dynamique, De Boeck Supérieur, 1997, p. 427. (ISBN 9782804124533), en ligne.
- ↑ (en) R.G. Scollay, E.C. Butcher et I.L. Weissman, « Thymus cell migration. Quantitative aspects of cellular traffic from the thymus to the periphery in mice. », European Journal of Immunology, vol. 10, no 3, , p. 210-218 (DOI 10.1002/eji.1830100310).
- ↑ (en) M. Egerton, R. Scollay et K. Shortman, « Kinetics of mature T-cell development in the thymus », Proceedings of the National Academy of Sciences of the United States of America, vol. 87, no 7, , p. 2579-2582.
- ↑ (en) A.W. Goldrath et M.J. Bevan, « Selecting and maintaining a diverse T-cell repertoire », Nature, vol. 402, no 6759, , p. 255-262 (DOI 10.1038/46218).
- ↑ Huang W, Molitch ME, Enlarged thymus in a patient with dyspnea and weight loss, JAMA, 2015;313:2174-2175.
- ↑ Dalla Costa M, Mangano FA, Betterle C, Thymic hyperplasia in patients with Graves’ disease, J Endocrinol Invest, 2014;37:1175-1179.
- ↑ Philippe Levasseur La Chirurgie du thymus chez les myasthéniques, problèmes opératoires et résultats à distance: à propos de 62 interventions, Université de Paris, 1970.
- 1 2 3 (en) Vascellari M, Katia C, Annalisa S, Giancarlo B, Letizia M, Roberto S, Giandomenico P, Franco M. « Evaluation of thymus morphology and serum cortisol concentration as indirect biomarkers to detect low-dose dexamethasone illegal treatment in beef cattle » BMC Vet Res. 2012;8:129. DOI 10.1186/1746-6148-8-129 .
Voir aussi
Bibliographie
- (en) Jacques F. A. P. Miller, « The function of the thymus and its impact on modern medicine », Science, vol. 369, no 6503, , article no eaba2429 (DOI 10.1126/science.aba2429)
Articles connexes
- Ris de veau, nom donné au thymus du veau lorsqu'il est utilisé pour des préparations culinaires
- Involution du thymus