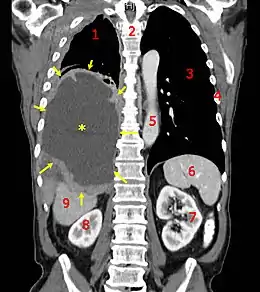
| Médicament | Prednisolone, dexaméthasone, cholécalciférol, prednisone, méthylprednisolone, acide alpha-linolénique et anticancéreux |
|---|---|
| Spécialité | Oncologie |
| CISP-2 | A79 |
|---|---|
| CIM-10 | C00-C97 |
| ICD-O | 8000/3 |
| DiseasesDB | 28843 |
| MedlinePlus | 001289 |
| MeSH | D009369 |
![]() Mise en garde médicale
Mise en garde médicale
Le cancer est une maladie provoquée par la transformation de cellules qui deviennent anormales et prolifèrent de façon excessive. Ces cellules déréglées finissent parfois par former une masse qu'on appelle tumeur maligne. Les cellules cancéreuses ont tendance à envahir les tissus voisins et à se détacher de la tumeur initiale. Elles migrent alors par les vaisseaux sanguins et les vaisseaux lymphatiques pour aller former une autre tumeur (métastase).
Les cancers rassemblent un ensemble de pathologies très diverses de formes et de conséquences, tout en partageant cependant systématiquement un ensemble très typique de caractéristiques quel que soit le cancer concerné.
Le pronostic dépend beaucoup du stade auquel est diagnostiqué un cancer. Dans les cas les plus graves, la survie du patient est menacée — en particulier le stade dit terminal implique que le patient est condamné à mourir des conséquences directes ou indirectes de son cancer à plus ou moins brève échéance. C'est pourquoi le dépistage du cancer doit être le plus précoce possible. Il est possible de guérir d'un cancer. Il est aussi possible d'avoir des récidives (parfois plusieurs années après), ou d'avoir un cancer peu agressif dont le traitement peut générer plus d'effets indésirables que de bénéfices pour le patient (par exemple, certains gliomes évoluent peu et peuvent ne jamais menacer la survie du patient bien qu'ils soient une éventuelle cause de troubles : le plus souvent des céphalées), d'où le maintien d'un contrôle régulier sur plusieurs années.
La prévalence des cancers varie fortement dans la population. Ce sont des maladies typiquement multifactorielles[1] alliant terrain individuel et histoire/environnement personnel.
Dans le terrain, on retrouve en particulier des mutations génétiques qui peuvent être héréditaires ou sporadiques — 31 localisations chromosomiques de mutation potentiellement cancéreuse[2] s'expliquent par des mutations aléatoires et concernent les 2/3 de la variation du risque (et non pas les 2/3 des cas de cancers comme l'ont souvent rapporté les médias[3]), le reste se partageant entre facteurs environnementaux et prédispositions génétiques.
Des facteurs hormonaux, et épigénétiques sont possibles. Des études scientifiques concluent que seuls 5 à 10 % des cas de cancer sont uniquement attribués à des facteurs génétiques contre 25 à 30 % au tabagisme, 30 à 35 % aux régimes alimentaires (ex. : alcoolisme, viandes trop cuites), 15 à 20 % aux infections, et 10 à 25 % à d'autres facteurs environnementaux (rayons ionisants, stress, activité physique insuffisante, pollution de l'environnement)[4]. Les recherches actuelles ont du mal à identifier des facteurs de risques uniquement liés à un facteur environnemental ou comportemental[5]. Certaines études mettent par exemple en relief certaines prédispositions génétiques du cancer qui ne favoriseraient l'apparition de la maladie qu'en cas de facteur externe : les obèses diabétiques ne seraient pas tous égaux face au risque de cancer selon leurs gènes[6]. Des études futures vont sans doute permettre de mieux comprendre l’interaction entre l'environnement et la génétique[7].
Plusieurs types de cancers semblent en augmentation. Si, dans certains cas, cette progression est liée à des facteurs de risque identifiés (tabac, alcool, polluants industriels reconnus cancérogènes, obésité, sédentarité, exposition au soleil), il est difficile dans certains cas d'attribuer à des facteurs précis l'augmentation observée. L'amélioration des outils de diagnostic[8] et le vieillissement de la population[9] expliquent une part importante de la progression de l'incidence de certains cancers. À l'inverse, une étude de l'Institut de veille sanitaire montre que les cancers de l'estomac, de l’œsophage (chez l'homme), du col de l'utérus et le lymphome de Hodgkin ont régressé entre 1980 et 2000[10].
Terminologie et étymologie
Le mot latin cancer (« crabe, chancre, cancer ») est apparenté au grec καρκίνος / karkínos, « écrevisse, chancre, tumeur ». Selon le livre sur la chirurgie du médecin de l'Antiquité, Paul d'Égine, ce nom aurait été donné par Hippocrate, parce que le cancer « a des veines étendues de tous côtés, de même que le crabe a des pieds »[11] : la zone centrale arrondie de certaines tumeurs se prolonge par des ramifications en rayon, comme les pattes de ce crustacé. Paul d'Égine fait également référence à l'adhérence de la tumeur aux tissus voisins en ajoutant que le nom du cancer « lui vient, selon quelques-uns, de ce que quand il s'est emparé d'un organe, il ne le lâche plus, de même que fait le crabe quand il s'est attaché à quelque chose »[12].
L'oncologie (ou cancérologie) est la spécialité médicale qui étudie les cancers, leur diagnostic et leur traitement. Les oncologues ou cancérologues peuvent être spécialisés, comme les chimiothérapeutes ou radiothérapeutes.
Les cancers sont de plusieurs types et la terminologie médicale est plus spécifique : tumeur maligne, néoplasie, néoplasme, polymitose, carcinome, etc..
Dans la langue populaire, le cancer est désigné par des termes synonymes comme tumeur ou crabe[13].
Biologie

Histologie
On retrouve dans tous les cancers les éléments histologiques suivants[14],[15],[16],[17] :
- une indépendance des cellules cancéreuses vis-à-vis des signaux qui stimulent normalement la multiplication des cellules ;
- une insensibilité des cellules cancéreuses aux signaux et mécanismes anti-prolifératifs ;
- une capacité proliférative qui n'est plus limitée (croissance à l'infini, résultant souvent en néoplasmes) ;
- la disparition du phénomène d'apoptose chez ces mêmes cellules cancéreuses, autrement dit une forme d'"immortalité" agressive aux dépens du malade (on utilise notamment des cellules HeLa pour immortaliser in vitro des lignées cellulaires) ;
- la régression ou dédifférenciation cellulaire[18] vers une forme rappelant de plus en plus des cellules souches embryonnaires (comme si la cellule cancéreuse faisait le chemin inverse depuis l'état de cellule spécialisée/différenciée vers l'état de cellule œuf immature) ;
- une capacité anormale à susciter l'angiogenèse ;
- souvent l'acquisition d'un pouvoir invasif dans les stades avancés ;
- des lésions dans les tissus environnants (nécroses), qu'il y ait ou non invasion tissulaire ;
- sauf dans de très rares exceptions (exemple : cancer de la face chez le diable de Tasmanie, problèmes liés à une greffe…), il s'agit de cellules issues de l'individu touché par ce cancer (ce sont des cellules du soi).
C'est seulement si toutes ces caractéristiques sont réunies qu'il s'agit d'un vrai cancer, car il existe des hyperplasies tissulaires non-cancéreuse et même non-tumorales (exemple typique : les tissus cicatriciels présentent une surabondance de tissus conjonctifs, mais dont la nature n'est ni cancéreuse ni tumorale).
Typologie
Par type tissulaire
On distingue généralement :
- les carcinomes : cancers d'un tissu épithélial (formés de cellules avec un pôle basal et un pôle apical) ;
- les sarcomes : cancers proliférants dans des tissus conjonctifs comme les os ;
- les cancers hématopoïétiques : cancer des cellules sanguines.
Par organe
Il existe un classement selon les organes touchés, par exemple :
- le cancer du sein ;
- le cancer du côlon (et, proche, celui du rectum) ;
- le cancer du pancréas ;
- le cancer de la prostate ;
- le cancer du cerveau ;
- le myélome : cancer de la moelle osseuse ;
- les leucémies : cancers du sang ;
- le sarcome de Kaposi : cancer des vaisseaux sanguins ;
- les lymphomes : maladie de Hodgkin et lymphome non-hodgkinien ;
- le cancer du testicule ;
- le cancer du poumon, causé le plus souvent par la cigarette ou l'amiante ;
- les métastases osseuses ;
- etc.
Il existe presque autant de sources de cancer que de tissus dans l'organisme. Certains sont toutefois plus fréquents que d'autres.
Génétique
D'un point de vue pathologique, les cancers sont des maladies génétiques, c'est-à-dire qu'ils ont pour origine une modification quantitative ou qualitative de nos gènes. Comme il s'agit d'altérations génétiques somatiques qui ne sont présentes que dans le tissu malade, la plupart des cancers ne sont donc pas eux-mêmes héréditaires, seul un terrain plus ou moins favorable pouvant l'être. Les cancers familiaux (10 % des cancers humains) sont associés à une altération constitutionnelle (ou germinale) d'un gène. Cette altération est donc présente dans toutes les cellules de l'organisme, gamètes inclus. Elle peut être transmise à la descendance.
Il y a trois grandes catégories de gènes associés aux maladies cancéreuses : les oncogènes, les gènes suppresseurs de tumeurs et les gènes de réparation de l'ADN.
- Les oncogènes (appelés proto-oncogènes lorsqu'ils sont dans leur état normal et oncogènes lorsqu'ils sont mutés, ou c-onc) sont les régulateurs positifs de la prolifération cellulaire. Ils deviennent hyperactifs et leur modification est dominante car il suffit qu'une des deux copies du gène soit modifiée. On a identifié actuellement plus de cent oncogènes. Les plus connus sont les gènes Ha-ras, myc, ou abl.
- La seconde catégorie comprend les gènes suppresseurs de tumeurs qui sont des régulateurs négatifs de la prolifération cellulaire (les freins). Les deux copies de ces gènes sont inactivées dans les cancers.
- La troisième catégorie correspond aux gènes des multiples systèmes de réparation qui sont capables de détecter et de réparer les lésions de l'ADN qui ont modifié les oncogènes ou les gènes suppresseurs de tumeur. Ces systèmes de réparation sont également inactivés dans les cellules cancéreuses.
Transformation cellulaire

La transformation cellulaire désigne ici les étapes successives de la cellule différenciée saine jusqu'au stade cancéreux.
Contrairement aux maladies génétiques comme la mucoviscidose, les myopathies ou certaines hémophilies qui sont des maladies monogéniques (un seul gène est généralement altéré), le cancer est une maladie multigénique[19]. Chaque cancer a pour origine l'altération de 10 à 20 gènes. Ces altérations se produisent de manière successive, chacune d'entre elles favorisant la suivante (voir encadré). Cette suite d'altérations se produit généralement sur une très longue plage chronologique (5 à 20 ans) ; elle n'est pas aléatoire et pour chaque type de cancer, on a pu mettre en évidence d'une part une certaine spécificité des gènes altérés, et d'autre part une chronologie dans le développement des évènements.
Dans les cancers du côlon, cette succession d'événements comprend (entre autres) tout d'abord l'inactivation du gène suppresseur de tumeur APC, puis une mutation de l'oncogène Ha-ras suivi de l'inactivation du gène suppresseur de tumeur P53. Il y a d'autres événements qui restent à identifier. Le point essentiel est la spécificité des gènes altérés et leur chronologie. Dans un autre type de cancer, les gènes impliqués et la chronologie sont totalement différents. APC n'est altéré que dans les cancers du côlon et jamais dans les cancers de la peau. Par contre, l'altération de P53 peut être retrouvée dans pratiquement tous les types de cancers. Dans le cancer de la peau, contrairement au cancer du côlon, l'altération du gène P53 est l'un des premiers événements. Cette très grande diversité génétique est à la base de l'hétérogénéité de la pathologie cancéreuse. À l'intérieur même d'un type de cancer particulier comme le cancer bronchique, existent plusieurs sous-types (cancer bronchique à petites cellules, adénocarcinome, cancer bronchique à grandes cellules, etc.) chacun étant associé à des altérations génétiques particulières. La situation est identique pour d'autres cancers comme celui du sein, de l'estomac ou de la peau, chaque organe pouvant être associé à plusieurs types de cancers suivant le type histologique de la cellule ayant été à l'origine de la maladie.
Dédifférenciation
C'est le dernier stade de la transformation en cellule cancéreuse. C'est un processus au cours duquel la cellule perd ses spécifictés tissulaires et « retourne » à un état proche de la cellule souche. Cette capacité est liée à l'expression voire la surexpression de gènes en principe exprimés dans des cellules souches indifférenciées[20].
Une des problématiques liées à ces cellules tient au fait qu'elles sont un poids mort pour l'organisme (elles cessent progressivement d'assumer leurs fonctions tissulaires originales et propres à répondre aux besoins de l'organisme).
Origine
Environ 15 % des cancers humains peuvent être associés à des agents infectieux. Cela peut être des virus (virus de l'hépatite B et cancer du foie, papillomavirus humain et cancer du col de l'utérus, virus d'Epstein-Barr et lymphome de Burkitt), plus rarement des bactéries (Helicobacter et cancer gastrique) ou encore plus rarement des parasites (schistosomes et cancer du foie). Dans tous ces cas, outre l'infection, on trouve également des altérations d'oncogènes ou de gènes suppresseurs dans les tumeurs. L'agent infectieux n'intervient qu’à une étape du processus de transformation cellulaire.
L'origine des altérations qui modifient les oncogènes et les gènes suppresseurs de tumeurs est multiple. On les classe généralement en deux grandes catégories, exogène et endogène.
- L'origine exogène correspond à toutes les expositions environnementales auxquelles un organisme est soumis. Cela va du tabac aux ultraviolets du soleil en passant par l'amiante, les radiations gamma, l'alcool et de nombreuses autres substances auxquelles un individu est exposé volontairement ou involontairement. Elles peuvent agir directement au niveau de notre ADN et provoquer des altérations (comme certaines molécules dans le tabac ou les ultraviolets), ou provoquer des états inflammatoires favorisant l'apparition de cellules cancéreuses (alcool).
- Les altérations d'origine endogène sont provoquées en partie par des molécules issues de notre métabolisme comme les espèces réactives à l'oxygène. Chaque jour notre ADN subit des millions d'agressions de la part de ces molécules, mais dans la très grande majorité des cas, celles-ci sont réparées de manière très efficace. Néanmoins, il suffit d'une défaillance dans la réparation d'un gène important pour enclencher ou continuer un processus de transformation cellulaire. Des travaux récents (2007) suggèrent que les systèmes de réparation de l'ADN ont une efficacité qui diminue avec l'âge.
En 2000, dans leur article « The hallmarks of cancer »[14], Robert Weinberg et Douglas Hanahan ont suggéré que la transformation cellulaire cancéreuse passe par l'acquisition d'au moins six propriétés :
- indépendance vis-à-vis des signaux stimulant la prolifération. Les cellules normales ne se divisent que lorsqu'elles reçoivent un stimulus particulier. Les cellules tumorales n'ont plus besoin de ce signal ;
- insensibilité aux signaux inhibiteurs ;
- abolition de l'apoptose ou mort cellulaire programmée. En cas de stress ou d'anomalie ne pouvant pas être éliminée, une cellule normale se suicide en utilisant l'apoptose. Les cellules tumorales ont inactivé tous ces mécanismes pour mieux survivre ;
- capacité proliférative illimitée : le nombre usuel de divisions cellulaires pour une cellule humaine est de 50 à 60 (sénescence cellulaire, limite de Hayflick), après quoi elle cesse de pouvoir se diviser (voir article Télomère). Les cellules tumorales continuent de se diviser sans limite visible grâce à l'activité de la télomérase qui est fortement active dans toutes les cellules cancéreuses ;
- capacité de susciter l'angiogenèse. Les cellules tumorales (et la tumeur) ont un besoin important en oxygène pour survivre. Elles vont donc stimuler la formation de nouveaux vaisseaux sanguins afin d’oxygéner la tumeur ;
- acquisition d'un pouvoir invasif. Les cellules tumorales sont capables de passer à l'intérieur d'un vaisseau sanguin afin d'être transportées dans un autre organe où elles vont générer une seconde tumeur (métastase).
Chronologie de la transformation cancéreuse
La cancérogenèse est causée par un rayonnement ou des substances cancérogènes entraînant des anomalies génétiques touchant l'architecture ou la séquence de l'ADN. À ce stade, le cancer en formation n'est cliniquement pas observable et n'a pas de conséquence fonctionnelle.
Les cellules cancéreuses acquièrent d'un mécanisme d'élongation ou d'entretien de l'ADN télomérique, ce qui leur permet de se diviser indéfiniment (immortalisation). C'est une étape-clé de l'immortalisation cellulaire qui est utilisée comme marqueur lors d’un diagnostic. La télomérase, un complexe enzymatique rallongeant les télomères par addition de séquences de télomères répétées aux extrémités des chromosomes est activée dans environ 80 % des tumeurs[21]. La plupart des cancers produisent la télomérase, mais souvent à un stade tardif, la cancérogénèse débutant par une érosion importante des télomères[22],[23].
Selon une théorie apparue au début du XXIe siècle, le cancer apparaît quand quelque chose désorganise la multicellularité et que certaines cellules commencent à se comporter comme si elles étaient isolées. Des gènes actifs dans sept types de cancers solides ont été récemment étudiés du point de vue de leur ascendance ; ils remontent effectivement à des organismes unicellulaires et dans ces cancers les gènes d'origine animale étaient devenus silencieux. Selon les auteurs de ce travail, certains de ces gènes (connus pour être responsables de cancers) ont en outre tant de liens avec d'autres gènes que les traitements contre le cancer, ne ciblant qu'une seule de ces connexions ne peuvent qu'avoir des effets limités[24].
La formation d'un cancer – au sens strict – comporte deux étapes distinctes et nécessairement successives : cancérogenèse et tumorogenèse.
Cancérogenèse
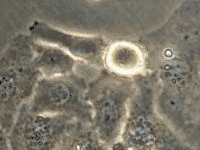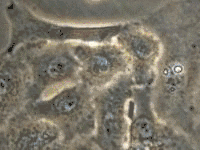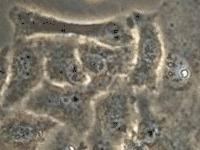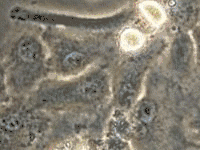
Le stade cancérogenèse de la transformation cancéreuse nécessite deux étapes : l'initiation et la promotion. Ces deux étapes sont obligatoirement successives et l'initiation précède toujours la promotion, sans quoi le processus cancéreux s'arrête.
Initiation
L'initiation correspond à l'accumulation des anomalies génétiques.
L'initiation (ou transformation cellulaire) comporte deux éléments majeurs :
- l'immortalisation : les cellules deviennent incapables d'initier leur propre mort (apoptose) ou ne répondent plus aux signaux extérieurs qui la déclenchent ;
- la perte d'homéostasie. L'homéostasie est caractérisée normalement par un équilibre divisions/morts qui assure le maintien de la taille et de la fonctionnalité d'un organe. Dans notre cas, les cellules cancéreuses perdent la sensibilité aux signaux qui régulent la prolifération.
L'initiation est la conséquence de la carcinogenèse. L'action des carcinogènes mute des gènes importants dans le maintien de l'intégrité et des caractéristiques de chaque type cellulaire.
Il en résulte des pertes ou gains de fonctions cellulaires :
- activation ou dérépression d'un proto-oncogène : les proto-oncogènes (appelés oncogènes lorsqu'ils sont mutés) sont souvent des activateurs de la multiplication ou des inhibiteurs de l'apoptose (BCL, BCLX1, etc.) ;
- inhibition ou répression d'un gène suppresseur de tumeur aussi appelés anti-oncogènes : les gènes suppresseurs sont des inducteurs de l'apoptose ou des bloqueurs du cycle cellulaire (P53, BAC, etc.).
Promotion
La promotion recouvre la réception par la cellule de facteurs de prolifération qui vont entraîner les divisions. Ces signaux vont donc pérenniser les anomalies au cours des divisions, et ainsi assurer la descendance de la cellule anormale, qui va de surcroît accumuler de nouvelles anomalies génétiques (voir Transformation cellulaire).
La promotion est caractérisée par une grande instabilité génomique et une augmentation de la perte d'homéostasie.
L'instabilité génomique est due à des mutations de deux types de gènes :
- les gènes portiers (gate keeper genes) : ils assurent le contrôle du passage à une étape ultérieure du cycle cellulaire. Une perte de fonction de ces gènes permet à la cellule cancéreuse de passer rapidement à la phase ultérieure du cycle cellulaire, donc in fine de proliférer de façon incontrôlée ;
- les gènes soignants (care taker genes) : ils assurent physiologiquement la réparation des anomalies liées à l'ADN. Leur inactivation entraîne une instabilité accrue et une accumulation d'anomalies génétiques (mutation, perte d'hétérozygotie, modifications épigénétiques, aussi dénommées « épimutation » : hypo/hyperméthylation, désacétylation, etc.).
Ces points de contrôle et de réparation altérés, la cellule cancéreuse a désormais perdu la capacité à « reconnaître sa vieillesse », initier sa mort et réparer les dommages de son ADN. La réponse aux signaux de croissance physiologiques est en outre disproportionnée. Ensuite, la cellule commence à produire ses propres signaux de prolifération (cf. infra) : la croissance incontrôlée d'un pool de cellules n'a alors plus de limite.
À ce stade, le cancer est infraclinique : c'est une masse de cellules qui survit dans l'organisme. L'environnement des cellules cancéreuses (ou stroma, microenvironnement) est dit non coopératif : il ne fournit pas aux cellules cancéreuses les nutriments et le soutien que leur développement réclame. Cette phase est critique dans le développement clinique du cancer : si le stroma reste non-permissif, le cancer n'évolue pas, ou alors très lentement. Si, en revanche, il peut s'établir une réciprocité de maintien entre cancer et stroma, le cancer envoie des signaux permissifs au stroma, qui se modifie en faveur du cancer et va lui apporter nutriments et soutien. Ainsi le cancer grossit, produit de plus en plus de signaux permissifs, etc. Dans le cas où la réciprocité s'établit, l'évolution du cancer reprend et passe à un stade clinique.
Le stroma devient permissif à deux conditions :
- lorsqu'il est le siège d'une néoangiogenèse, c'est-à-dire d'une sécrétion par la tumeur de facteurs de croissance angiogéniques (VEGF) accompagnée d'une apparition des récepteurs à ces facteurs sur le stroma (VEGF-R) ;
- lorsqu'il y a apparition de récepteurs tumoraux aux facteurs de croissances cellulaires (boucle autocrine) ou microenvironnementaux (boucle paracrine).
Tumorigenèse
Il s'agit du développement du cancer donnant des conséquences cliniques : il grossit dans des limites histologiques précises (on parle de cancer in situ), puis les dépasse et devient donc invasif avec dissémination très probable de métastases.
La néoangiogenèse et la mise en place d'une circulation sanguine stable et relativement efficace sont les préalables indispensables à cette phase : la croissance tumorale est telle qu'elle ne peut plus se contenter d'une diffusion à partir d'un stroma non permissif, mais nécessite des apports importants et dédiés.
La tumeur grossit jusqu'à atteindre la lame basale : le cancer est dit in situ et son risque de métastase est faible.
La croissance tumorale continue et la membrane basale se rompt, le cancer devenant alors invasif : les cellules cancéreuses ont de grandes facilités à atteindre les courants métastatiques (circulation lymphatique pour les carcinomes et circulation veineuse pour les sarcomes), et la dissémination dans le corps débute.
Évolution
De son foyer initial, le cancer va (en dehors de tout traitement ou si le traitement n'est pas efficace) :
- se développer de manière locale. Il provoque dans ce cas une compression des organes voisins, voire un envahissement et une destruction des tissus adjacents ;
- se développer de manière régionale. Il envahit les ganglions lymphatiques, où logent les cellules du système immunitaire ;
- se propager à distance de la tumeur initiale et former des métastases. Il y a souvent une confusion chez les patients et leur famille : un cancer du sein avec des métastases au niveau du cerveau ne donne pas un cancer du cerveau ; c'est toujours le cancer du sein initial, mais qui s'est développé ailleurs. Il faut continuer à le traiter comme un cancer du sein. La localisation des métastases ne se fait pas complètement au hasard : les métastases de certains organes se localisent de préférence dans des types d'organes bien marqués. Voir à ce propos l'exemple des métastases osseuses (c'est-à-dire dans les os).
L'évolution dépend du type du cancer et de sa prise en charge : certains ne font que très peu de métastases et sont très sensibles aux traitements permettant d'aboutir dans la grande majorité des cas à une rémission complète et prolongée (ce terme de rémission est spécifique de la cancérologie et diffère de guérison par l'absence de certitude quant à une récidive à court, moyen ou long terme). D'autres sont difficilement maîtrisables et peuvent entraîner le décès à court terme. Une évaluation précise du type du cancer auprès d'un médecin spécialisé est donc indispensable.
De quoi meurt-on exactement quand on « meurt d'un cancer » ?
C'est une question fréquemment posée par ceux qui ont peine à croire qu'une petite tumeur puisse menacer tout un organisme.
La réponse est que la vie dépend de la bonne marche d'un certain nombre de fonctions, dont la respiration (au sens large, en incluant la distribution d'oxygène par la circulation sanguine), la digestion et l'excrétion (reins, foie). Selon celui des trois systèmes qui est altéré par les cellules cancéreuses, par exemple, le patient meurt — si l'on n'arrive pas à juguler la progression du mal :
- d'insuffisance respiratoire ;
- d'hémorragie interne ;
- de dénutrition ;
- d'empoisonnement, par accumulation de substances toxiques normalement filtrées et excrétées par les reins et le foie, etc.
Causes du cancer
Mutations génétiques aléatoires
Des études américaines[25],[26],[27] de Christian Tomasetti et Bert Vogelstein ensuite rejoints par Lu Li, publiées en 2014 et 2017 parviennent à la conclusion que deux cancers sur trois sont dus à des mutations génétiques aléatoires et ne seraient donc pas liés à des causes héréditaires ou environnementales[28]. Ces résultats ont néanmoins suscité la controverse[29] et ne font pas consensus à l'heure actuelle. L'OMS estime que 30% à 50% des cancers peuvent être évités, en s'appuyant sur les causes actuellement connues[30].
Les facteurs de risque du cancer peuvent être endogènes (provenant de l'organisme) ou exogènes (extérieurs à l'organisme). L'étude sur des registres de vrais jumeaux ou des changements de taux de cancer chez les populations migrantes permet de démontrer la part environnementale de nombreux cancers.
Risques endogènes
Dans certains cas, l'apparition d'un cancer a une composante héréditaire. C'est le cas de quelques-uns comme certains cancers du sein[31]. Certains cancers induits par certains comportements transmis de génération en génération (consommation d'alcool ou de tabac) peuvent être confondus avec un risque génétique vrai, et inversement, certains gènes prédisposant au cancer pourraient n'être activés que dans certaines circonstances (obésité, alcoolisme, etc.).
Risques dits « environnementaux »

Les facteurs exogènes de risque (facteurs non-génétiques ou « environnementaux ») dépassent le seul champ de l'environnement (au sens français du terme), puisque recouvrant aussi, par exemple, les bactéries et virus inducteurs de cancers. Ils sont pour partie liés à l'environnement et pour partie aux comportements à risque qui augmentent l'exposition de l'individu à ces facteurs.
Pour l'Académie nationale française de médecine (rapport 2007), le tabac reste la principale cause de cancer. Viennent ensuite l'alcool, le surpoids et l'insuffisance d'exercice physique, puis les expositions professionnelles et les traitements hormonaux de la ménopause chez la femme. La moitié des origines du cancer demeure inexpliquée[32].
Tabac
Le tabac est un facteur de risque majeur pour différents cancers (80 % des cancers du poumon, 75 % du larynx, 50 % de la vessie), il est aussi impliqué dans certains cancers du foie, du pancréas, de l'estomac, du rein, du col de l'utérus, du sein, du côlon-rectum, de l'ovaire et de certaines leucémies. C'est la première cause de mortalité évitable par cancer avec près de 47 000 décès par an en France[33], soit environ 25 % de la mortalité totale par cancer[34].
Alcool
L'alcool est en France « la deuxième cause de mortalité évitable par cancer après le tabac. » L'éthanol (alcool) - même à dose modérée[35] est classé dans la liste des cancérogènes du groupe 1 du CIRC ; il augmente le risque de plusieurs cancers, d'autant plus que la dose ingérée est importante - il n'y a pas de dose sans effet[36]. Les cancers les plus favorisés par l'alcool incluent le cancer du foie et le cancer du pancréas[35] ; les cancers des voies aérodigestives supérieures : cancer de la bouche (langue, rhinopharynx, lèvres), cancer de l'œsophage, cancer de l'estomac[35] ; et le cancer du sein, une femme augmente son risque de cancer du sein de 10 % par 10 g d'alcool par jour. Le rapport du Circ (Iarc, 2007) estime la part attribuable à l'alcool à 10,8 % de l'incidence des cancers et 9,4 % des décès par cancers chez l’homme et à respectivement 4,5 % et 3 % chez la femme. En 2015, on estime que la consommation d'alcool est responsable de plus de 15 000 décès par cancer par an en France[37], sur un total de 148 000 décès par cancer[38]. L'alcool est un facteur de risque pour de nombreux accidents et maladies. Il a été estimé, pour l'année 2015, que 49 000 décès (toutes causes confondues) étaient attribuables à l'alcool[39],[40] par an en France, sur un total de 570 000 décès toutes causes confondues.
Alimentation
L'alimentation joue un rôle dans la survenue ou la prévention de cancers, elle serait particulièrement impliquée dans la forte prévalence du cancer colorectal qui touche environ 37 000 personnes et en tue 17 000 par an en France[41]. Selon le Fonds mondial de recherche contre le cancer, 30 à 40 % des cancers seraient imputables à l'alimentation[42]. Outre l'alcool cité plus haut, la consommation excessive de viandes rouges, de charcuterie ou de sel et les mycotoxines[43] pourraient augmenter le risque de cancer[44],[45] et des ovaires[46], mais le lait réduirait le risque de cancer colorectal[47].
La consommation de viandes rouges est souvent citée comme un facteur probable des cancers colorectaux[48],[49], sauf dans le cas d'une consommation modérée (50 g par jour)[50]. Plusieurs méta-études jugent cependant les données statistiques insuffisantes pour conclure[51],[52],[53], mais l'OMS et le CIRC ont jugé en 2015 que la viande rouge devait être classée en cancérigène probable (groupe 2A) et les charcuteries en cancérigène (groupe 1)[54]. Le lien entre la consommation de viandes transformées (charcuteries par exemple) et certains cancers (colorectal[55], œsophage[56] et estomac[57],[58]) semble mieux établi. Plusieurs études attribuent l'effet cancérigène des viandes transformées à l'ajout d'agents de conservation à base de nitrites[59],[60],[61] absents dans la viande fraîche[62]. Les nitrites sont des précurseurs d'une famille de composés cancérigènes, les nitrosamines[63],[64]. L'exposition aux nitrosamines, associée à la consommation de viande et de poisson transformés - dont en particulier les produits fumés[65] - augmente le risque de cancer de l'estomac[66]. La consommation de légumes conservés en saumure acide (de type pickles) augmente le risque de cancer de l'estomac[67] et de l’œsophage[68], ils contiennent eux aussi de grande quantité de précurseurs de nitrosamines.
Il existe aussi un lien entre consommation de viandes rouges ou transformées avec le cancer du pancréas, sans que les graisses saturées ne puissent être incriminées ; pour les auteurs, l'effet du mode de cuisson sur le sur-risque est à explorer[69]. Le mode de cuisson de la viande comme des aliments végétaux semble effectivement jouer un rôle important dans leur potentiel cancérigène. Deux composés, l'acrylamide et le benzopyrène, produits par les cuissons à hautes températures (friture[70],[71],[72], en particulier pour les produits de pomme de terre frits ; cuisson au contact de la flamme[73], en particulier pour les viandes) sont plus particulièrement cités parmi les facteurs de risques reconnus.
Une forte consommation de sel est corrélée à un risque plus élevé de cancer de l'estomac[74],[75]. Les consommations de maté[76] et de noix de bétel[77] sont corrélées à un risque plus élevé de cancer de l'œsophage et/ou du pharynx.
La consommation de matières grasses saturées pourrait aussi être un facteur de risque, en particulier pour le cancer colorectal[78],[79], certaines matières grasses pouvant toutefois avoir un effet protecteur comme les huiles de poisson et l'huile d'olive[80], les méta-analyses étant cependant moins catégoriques[81].
Outre les mycotoxines évoquées plus haut (dont en particulier l'aflatoxine), d'autres contaminants cancérigènes peuvent être présents dans les aliments, parfois naturellement (hydrazines[82] dans les champignons frais par exemple), parfois à des teneurs anormalement élevées pour cause soit de concentration tout au long de la chaîne alimentaire (métaux lourds dont en particulier le cadmium[83],[84] - par exemple dans le foie de bœuf ou l'hépatopancréas des crustacés, soit de contamination de l'environnement : métaux lourds de nouveau dont en particulier l'arsenic[85] dans les eaux de certains pays comme le Bangladesh, hydrocarbures aromatiques polycycliques, furfural, dioxine[86] - par exemple dans le lait et les produits laitiers).
Sur le plan des facteurs protecteurs, la consommation régulière de fruits et légumes diminue le risque de survenue d'un cancer[87],[88],[89]. Une étude publiée dans Food and Chemical Toxicology estime qu'une augmentation de la consommation de fruits et légumes éviterait 20 000 cas de cancer par an aux États-Unis en ne générant que dix cas liés aux résidus de pesticides[90]. En revanche, la consommation en quantité élevée d'agrumes (plus de six fois par semaine) augmenterait le risque de cancer de la peau[91]. La recherche met en évidence le lien entre plusieurs substances d'origine végétale et la réduction de risque de certains cancers : brassicacées (choux, brocolis, etc.)[92], ail[93], lycopène[94] et autres caroténoïdes, flavonoïdes, huile d'olive[95], mais c'est bien la consommation de fruits et légumes en général - et non de compléments alimentaires - qui est encouragée par les pouvoirs publics[96]. La consommation de fibres[97],[98] - typiquement apportées par les fruits, les légumes et les céréales entières[99] - réduit aussi le risque de cancer. La pratique du jeûne intermittent[100], de la diète cétogène[100],[101],[102], et de la restriction calorique[103], les régimes pauvres en glucides et riches en protéines[104],[105] et Atkins[106] pourraient avoir un effet protecteur et améliorer les chances de survie des malades. L'apport en oméga-3 - souvent mis en avant dans la littérature grand public - pourrait avoir un effet. Une étude stipule que, après étude des données relatives à 48 essais randomisés et contrôlés et à 41 études de cohortes, « les oméga-3 ne montrent qu'un léger bénéfice sur la mortalité totale, les événements cardiovasculaires ou le cancer »[107].
Enfin, et parce qu’ils contribuent à l’obésité, des apports énergétiques excessifs (alimentation trop riche c’est-à-dire trop dense en calories, une consommation excessive de boissons sucrées ou de grandes tailles de portion) sont une cause indirecte de cancer[108],[109],[110].
Obésité
L'obésité jouerait un rôle dans près de 4 % des cancers, et pour beaucoup des cancers hormono-dépendants (du sein et de l'utérus, et semble-t-il colorectal, de la vésicule biliaire, de la prostate, du pancréas et des reins ; à cause d'une production œstrogénique anormale et accrue dans les tissus gras).
Un indice de masse corporelle de 30 à 35 (seuil de l'obésité) augmente d'un tiers le risque de mourir du cancer[111]. 100 000 cancers auraient été causés par l'obésité par an entre 2000 et 2010[111]. Une étude américaine récente a conclu que 9 % des cas de cancer colorectal, 17 % des cas de cancer du sein, 21 % des cas de cancer de la vésicule biliaire, 24 % des cas de cancer du rein, 28 % des cas de cancer du pancréas, 35 % des cas de cancer de l'œsophage et une écrasante majorité de 49 % des cas de cancer de l'endomètre avaient l'obésité comme cause probable[111],[112]. De plus, les chances de survie sont moindres chez l'obèse, car leur cancer est souvent détecté plus tardivement. Aux États-Unis où l'obésité a fortement progressé (touchant 15 % des enfants et adolescents de 6 à 19 ans en 2000[113], avec 65 % des adultes étant soit en situation d'embonpoint, soit obèses[113], soit 3 fois plus qu'en 1980), elle serait même déjà la cause de 14 % des décès par cancer chez les hommes et 20 % chez les femmes (devant le tabagisme)[114].
Probablement pour les mêmes raisons (hormonales), l'obésité de la mère aggrave aussi le risque de cancer du testicule chez le futur enfant (il y en avait déjà un indice avec un taux plus faible de cancer des testicules observé chez les hommes conçus durant la dernière guerre mondiale en Europe de l'Ouest, alors que la nourriture était rationnée). Pourtant, environ 40 % des gens sondés sur tous les continents ne connaissaient pas le lien entre obésité et cancer[115]. Le message de la campagne mondiale 2009 contre le cancer de l'UICC[116] était qu'environ un cancer sur trois parmi les cancers les plus communs pourrait être évité par un poids normal, entretenu par une alimentation saine et équilibrée et une activité physique suffisante.
Une étude récente[117] a conclu que le risque de cancer du pancréas double pour ceux qui étaient obèses ou en surpoids à l'adolescence, par rapport à ceux qui n'ont jamais été obèses ou en surpoids. Sur tous les cas de cancer étudiés, 27 % ont été attribués à l'obésité (les autres facteurs de risque pour ce type de cancer sont surtout le tabagisme - 25 % des cas -, puis le diabète).
Activité physique
L'activité physique pratiquée au quotidien a un effet protecteur vis-à-vis du cancer[118]. Cet effet est plus marqué pour le cancer du côlon, du sein, de l'utérus et des poumons[119].
Polluants
Le rôle exact des polluants dans la genèse des cancers reste difficile à évaluer, sauf dans le cas des expositions professionnelles où de nombreuses reconnaissances officielles confirment le lien entre cancer et exposition aux polluants. Les risques associés au contact en milieu professionnel avec des produits cancérogènes sont reconnus pour de nombreuses substances : amiante[120], benzène, trichloréthylène, arsenic, formaldéhyde, gaz moutarde, iode 131, les poussières de bois, le goudron de houille et la suie[121]. Les mycotoxines peuvent être inhalées dans des locaux insalubres, l'effet à long terme est cependant mal quantifié[122]. L'exposition aux pesticides[123],[124] est responsable de certains cancers (lymphome, leucémie, prostate) chez les agriculteurs, en particulier les arboriculteurs et viticulteurs[125]. L'incidence d'autres cancers chez les agriculteurs est moindre que dans l'ensemble de la population, notamment en raison d'un mode de vie plus sain (vie active, moins de fumeurs). L'OMS estime à 10 % la proportion de cancers liés au travail, ce qui correspond à plus de 200 000 décès annuels dans le monde. En France 2,5 à 3 millions de travailleurs seraient exposés, générant 11 à 23 000 nouveaux cas de cancer par an, dont seulement 15 à 30 % seraient officiellement reconnus[126]. Une autre étude comptabilise environ 12 000 cancers dus à l'exposition professionnelle en France en 2015[127]. Néanmoins, ces comptabilisations sont partielles car elles reposent sur les causes actuellement avérées de cancers et sur les données d'exposition dont on ne dispose que pour une partie d'entre eux[128]. Par construction, il s'agit donc d'une sous-estimation.

Radiations solaires
Les UV du soleil sont cancérigènes. Il est notamment important d'éviter une surexposition au soleil, ou d'utiliser des crèmes solaires dont l'effet protection est démontré[129] lors d'une exposition prolongée au soleil.
Microorganismes et virus
Les microorganismes (comme les bactéries) et les virus, font partie des facteurs exogènes du cancer. Certains cancers peuvent être induits par des virus, tels le cancer du col de l'utérus provoqué par le VPH[130].
Perturbateurs endocriniens
Mimant les hormones naturelles, certains perturbateurs endocriniens sont fortement soupçonnés[131] d'initier des cancers dits « dépendants des hormones » (par exemple, le cancer du sein) ; la perturbation peut se produire in utero et donner par exemple des cancers du testicule, ou d'autres types de cancers susceptibles d'être induits par des molécules telles que le distilbène.
Éclairage artificiel
L'éclairage artificiel est évoqué, et parfois assimilé à la catégorie pollution lumineuse (pour le cancer du sein au moins), via une perturbation endocrinienne chez les femmes exposées à une lumière artificielle la nuit[132]. Les femmes travaillant en équipe de nuit ont un risque de cancer du sein plus élevé[133].
Radioactivité
Les rayonnements ionisants, artificiel ou naturel[134], sont cancérigènes au-delà d'un seuil estimé à 100 à 2 000 mGy[135]. Les risques associés à des doses dites faibles (inférieures à 100 mSv) sont mal connus[136]. Une étude publiée en 2015, coordonnée par le Centre international de recherche sur le cancer, conclut que le risque existe aussi pour de faibles expositions[137]. Les risques de pollution radioactive militaire, industrielle ou accidentelle sont encadrés par des règles de radioprotection.
Nanomatériaux
Certains nanomatériaux ont une toxicité avérée, et/ou une génotoxicité potentielle, aggravée par la taille infime de ces particules qui peuvent ainsi atteindre l'ADN et le génome. Ils sont suspectés de contribuer à certains cancers. Un projet européen Nanogenotox[138] doit pré-évaluer cette question, ou au moins proposer des outils de mesure du risque[138], sur la base de tests faits sur 14 matériaux à base de dioxyde de titane, silice et nanotubes de carbone. Ces trois nanomatériaux ont été choisis car déjà utilisés dans des cosmétiques, aliments, produits de consommation courante[138].
Sexualité non protégée
Les rapports sexuels de toutes natures qui ne sont pas protégés en raison des risques de contamination par certaines souches du VPH qui peuvent causer des verrues génitales ou anales, et d’autres encore peuvent évoluer en cancer du col utérin, de l’anus, du pénis ou de la gorge[139].
Prévention
Il convient de faire la différence entre la prévention, qui cherche à diminuer la survenue de la maladie en luttant contre ses facteurs favorisants, et le dépistage, qui cherche à mettre en évidence une maladie de manière précoce pour la traiter plus facilement.
La prévention du cancer se fonde sur :
- l'évitement ou la diminution de l'exposition aux cancérogènes de l'environnement et industriels : principalement, la lutte contre le tabagisme, la consommation excessive d'alcool et de graisses animales, l'exposition excessive au soleil, les normes de construction (désamiantage), radioprotection, manutention de produits dangereux dans le cadre professionnel, étude REACH ;
- le rôle protecteur (« oncostatique ») de certains éléments : fibres, vitamines et autres antioxydants (céréales, légumes verts, fruits[140],[141]), ainsi que le thé vert (plus que le noir) ou le chocolat, et plus précisément les aliments contenant de la catéchine. Consommer une gousse d'ail par jour réduirait de moitié le risque de cancer de l'estomac, du côlon et du rectum[142].
En France, le « Plan Cancer » (2003-2007/2009-2013) prévoit une réorganisation de la recherche médicale, le renforcement de la prévention primaire, des efforts de dépistage, une amélioration de la prise en charge des maladies, des aides à l'insertion sociale des malades et des actions pour améliorer l'environnement.
Dépistage
Il consiste en la détection la plus précoce possible de lésions précancéreuses ou de cancers, chez des personnes ne présentant pas encore de symptômes évidents. Le but est de trouver, dans une population donnée, des lésions que l'on peut encore traiter facilement : si l'on attend les symptômes, il est souvent nécessaire d'avoir recours à des traitements plus « lourds » pour traiter la maladie.
Cela se fait par la clinique (l'examen du patient) : palpation des seins, toucher rectal, etc. et des examens paracliniques (scanner, IRM, tomographie optique ou parfois échographie). Certains dépistages ont prouvé leur intérêt en diminuant le nombre de décès par cancer : le frottis du col utérin, pour dépister les lésions précancéreuses et les petits cancers du col utérin et les examens colorectaux. La mammographie, pour dépister des cancers du sein à un stade précoce, a fait l'objet de plusieurs controverses, en raison d'un fort accroissement des faux-positifs dans la population de moins de 50 ans, et il existe un consensus pour ne la pratiquer de façon systématique qu'au-delà de cet âge[143]. Pour autant, si tous les acteurs en rejettent l'idée avant 50 ans, tous n'adhèrent pas au principe d'un dépistage systématique après cet âge[144].
En novembre 2014, une équipe de chercheurs du centre hospitalier universitaire de Nice (France) montre que le Test ISET a permis d'obtenir des résultats majeurs pour le dépistage des cancers du poumon[145] - [146]. C'est une technologie récente permettant d'isoler les cellules tumorales circulantes présentes dans le sang. Très simple pour le patient, sa mise en œuvre consiste en une simple prise de sang. En 2016, tous les types de cancer excepté les leucémies et les lymphomes peuvent être détectés par cette méthode. À l'été 2016, ce test est disponible en France, mais il n'est pas remboursé par la Sécurité sociale[147].
L'intérêt de la recherche de saignements minimes dans les selles (test hémocult) fait encore l'objet de discussions pour le dépistage des polypes et des petits cancers du côlon.
Pour Sorensen et al.[148], les fièvres prolongées non-expliquées (FPI) sont un marqueur de néoplasies occultes.
Diagnostic
Même s'il existe des éléments permettant d'identifier un cancer avec une grande probabilité, le diagnostic de certitude ne se fait que sur analyse au microscope (anatomopathologie) d'un échantillon de la tumeur (éventuellement aidé par d'autres techniques comme le scanner, l'IRM voire parfois l'échographie). Cet échantillon vient soit d'une biopsie (simple prélèvement d'un morceau de la tumeur) qui peut être faite, suivant la localisation, suivant différentes procédures (fibroscopie, ponction à travers la peau…), soit d'une pièce opératoire (tumeur enlevée par le chirurgien).
De nouvelles méthodes de diagnostic basées sur l'intelligence artificielle sont maintenant utilisées pour l'analyse, la détection et le suivie des patients. en se basant sur les images radiologiques, histologique et/ou les caractéristiques biologiques du patient, le modèle peut prédire avec une bonne précision le type de cancer et/ou le stade de la maladie. (Glioma[149], Cancer du sein[150], Cancer de poumons[151], etc)
Traitements
Historique
Cet historique est surtout basé sur la revue MIT Technology Review[152] :
- vers 1880 : le chirurgien William Stewart Halsted soutient que la réapparition des tumeurs après l'intervention chirurgicale est due à des traces non éliminées. Il promeut la mastectomie radicale.
- 1896 : Emil Grubbe utilise pour la première fois un tube à rayons X pour effectuer une radiothérapie sur Rose Lee atteinte d'un cancer du sein.
- 1949 : le gaz moutarde est approuvé par la FDA. C'est la première chimiothérapie acceptée après que la démonstration a été faite que le gaz moutarde détruisait les globules blancs malins chez les patients atteints de lymphome.
- 1957 : Les premières transplantations de moelle osseuse sont effectuées à Seattle. Bien que les six patients traités meurent dans les 100 jours, la technique est une percée.
- 1981 : le premier vaccin contre l'hépatite B, responsable de certains cancers du foie, devient le premier vaccin contre le cancer mis en circulation aux États-Unis.
- 1995: James Allison réussit à soigner des souris en utilisant un nouveau type de traitement : un inhibiteur de point de contrôle.
- 1997 : l'anticorps rituximab est approuvé pour traiter le lymphome non-Hodgkinien. C'est le premier médicament ciblé moléculaire contre le cancer.
- 2006 : le traitement du cancer entre dans l'ère de la génomique. Les scientifiques de Johns Hopkins appliquent le séquençage d'ADN à grande vitesse à 22 tumeurs.
- 2006 : la vaccination en masse commence contre le virus du papillome humain, la cause principale du cancer du col de l'utérus.
- 2011 : Ipilimumab ou Yervoy est approuvé pour traiter le mélanome avancé. C'est le premier inhibiteur de point de contrôle à être commercialisé.
- 2016 : reconnaissant les « progrès incroyables » en immunothérapie, le président Barack Obama et le vice-président, Joe Biden, annoncent un nouveau « plan cancer » avec pour objectif de guérir le cancer.
- 2017 : le premier traitement à base de CAR a été approuvé par la FDA américaine en pour le traitement de leucémies chez l'enfant et les jeunes adultes[153].
- 2018 : l'immunothérapie est devenue incontournable dans le traitement des cancers et tend à remplacer pour certains cancers les chimiothérapies[154].
- 2019 : Le séquençage du génome entier des tumeurs humaines a conduit une équipe de chercheurs à publier une première liste établissant un lien entre des agents cancérigènes environnementaux précis et des mutations génétiques responsables de certains cancers[155].
- 2022 : une jeune fille atteinte de leucémie a été traité avec succès avec la technologie CRISPR, alors que les traitements usuels restaient inefficaces[156].
Description
Le traitement est effectué en milieu spécialisé, en règle sur une stratégie définie par une équipe médicale pluridisciplinaire (c'est-à-dire comportant des médecins de plusieurs spécialités : oncologie, radiothérapie, chirurgie, gynécologie, gastro-entérologie, etc.).
Il nécessite d'avoir un diagnostic de certitude et de connaître le type du cancer ; d'évaluer son extension locale, régionale et la présence ou non de métastases ; et d'évaluer l'état général du patient (âge, fonctions cardiaque et rénale, présence d'autres maladies).
Suivant les cas, il repose sur :
- l'exérèse (l'ablation) chirurgicale large de la tumeur quand cela est possible, large voulant dire que le bistouri du chirurgien passe uniquement par des tissus sains ;
- un traitement mini-invasif percutané par radiofréquence, micro-ondes ou cryothérapie en complément ou en alternative à la chirurgie ;
- une chimiothérapie, prescription de médicaments s'attaquant au cancer et à ses métastases ;
- une radiothérapie, l'irradiation de la tumeur permettant de faire diminuer, voire disparaître celle-ci.
Certains cancers peuvent bénéficier également :
- d'un traitement hormonal ;
- d'un traitement à visée immunologique consistant à augmenter l'action du système immunitaire ; une piste est notamment explorée, qui associe l'interleukine 7 (IL-7) à un vaccin viral pour inciter le système immunitaire à attaquer les tumeurs. Ces travaux ont aussi montré comment l'IL-7 casse les barrières qui freinaient la réponse immunitaire aux tumeurs[157].
- d'un traitement à base d'ultrasons, une technologie en plein développement s'appuyant sur la focalisation d'un faisceau ultrasonore très puissant sur une métastase ;
- d'un traitement par photochimiothérapie qui consiste à détruire les cellules cancéreuses (notamment dans les cancers de la peau) au moyen de substances chimiques devenant toxiques à la lumière.
Souvent, plusieurs de ces types de traitements sont nécessaires chez un même patient. Il ne faut pas oublier le traitement des conséquences de la tumeur, la prise en charge des effets secondaires du traitement et le traitement de la douleur.
Chirurgie
L’exérèse est une technique nécessitant des équipes entrainées à traiter le cancer diagnostiqué. Pour ce faire, en France, les ARS délivrent des habilitations aux établissement habitués à traiter tel ou tel cancer et pratiquant un nombre d’intervention annuel suffisant. Toutefois, des établissements ne disposant pas de cette habilitation pratiquent ces opérations prétextant une situation d'urgence qui n'est généralement que relative. De ce fait, un transfert vers un établissement spécialisé reste possible[158],[159].
L'infographie publiée par France Info récapitule le nombre d'opérations par cancer et par établissement en moyenne annuelle entre 2016 et 2018[160].
Médecine personnalisée
La médecine personnalisée permet à l'aide du développement des diagnostics moléculaires de cibler les anomalies spécifiques à chaque tumeur. Elle comprend les traitements d'immunothérapie et les thérapies ciblées[161].
Le profilage moléculaire des tumeurs, permet en analysant en profondeur l'ADN, l'ARN et les protéines des tumeurs de proposer des options thérapeutiques plus adaptées à chaque patient.
Chaque cancer et chaque patient est différent, il est donc indispensable d’utiliser les armes les plus adaptées à chaque cas. C’est ce que l’on appelle la médecine personnalisée[162].
La médecine propose une avancée majeure dans ce sens en permettant l’analyse très précise des tumeurs solides (profilage moléculaire).
En effet, chaque cancer possède ce que l’on pourrait comparer à une empreinte digitale, les biologistes peuvent la lire à travers son ADN et ses protéines. Ces signatures renseignent sur les forces et faiblesse de chaque tumeur et permettent de dresser la liste des médicaments les plus susceptibles d’affaiblir le cancer efficacement. Grâce à l’analyse complète (ADN et protéines) des tumeurs, les oncologues peuvent donc proposer à leurs patients atteints de cancers métastatiques des traitements personnalisés, et parfois même encore en phase d’essai clinique. Objectif : lutter de manière hautement ciblée contre le cancer.
Souvent, les oncologues n’ont accès qu’à quelques analyses restreintes remboursées par la Sécurité sociale et ne peuvent pas proposer ce profilage complet.
Profiler une tumeur cancéreuse exige la maîtrise d’une batterie de tests en laboratoire et d’analyses pointues, qui chiffrent le coût de l’opération à plusieurs milliers d'euros.
Le profilage moléculaire des tumeurs : pour qui est-ce conseillé ?
Il ne s’agit pas d’un test pour détecter un cancer ou un risque de développer un cancer. Cette analyse profonde de la tumeur n’est indiquée que pour les patients adultes déjà diagnostiqués pour un cancer solide avancé (stade III ou stade IV). Un cancer solide veut dire un cancer d’un ou de plusieurs organes, à l’opposé d'un cancer liquide, c’est-à-dire du sang ou de la moelle.
Les cancers moins avancés, les leucémies, les myélomes ou les cancers chez l’enfant ne sont malheureusement pas concernés par ce remboursement car les techniques sont différentes et les bénéfices pour les patients moins clairs.
Quelles sont les chances qu'un test de ce type permette de trouver un meilleur traitement pour le patient ?
Effectuer un profilage moléculaire n’est malheureusement pas une garantie pour trouver une solution pour tout le monde. Dans le cancer métastatique avancé, une étude scientifique a montré qu’une option thérapeutique était trouvée pour 92 % des patients. Mais comme chaque cancer est différent, il peut arriver qu'aucune alternative ne soit trouvée. Cela dépend du type de cancer, de sa gravité, du traitement déjà pris et de nombreux autres paramètres. Seul un oncologue peut évaluer les chances de chaque cas.
Comment ça marche ?
L’oncologue, après avoir commandé une analyse spécifique chez une firme spécialisée, recevra un kit pour transport d'échantillon. Le médecin enverra gratuitement une biopsie récente (petite partie de la tumeur ou de l’échantillon de sang) à cette société.
L’analyse sera faite dans un délai de 7 à 10 jours et les résultats seront transmis à l’oncologue. Il obtiendra ainsi de nombreuses informations sur la carte d'identité spécifique de la tumeur avec, dans de nombreux cas, des recommandations de traitement personnalisés.
Si le rapport d’analyse suggère des nouveaux traitements, sont-ils disponibles ou remboursés ?
Une liste de médicaments potentiellement efficaces du monde entier et pour de nombreux types de cancer est fournie au docteur. Ces traitements ne sont pas nécessairement disponibles ou remboursés dans votre pays. Dans certains cas, si un médicament n’est pas officiellement disponible ou remboursé, il peut vous être suggéré de prendre part à un essai clinique ou un usage compassionnel. Si vous êtes dans le cas, demandez à l’oncologue quelles sont les meilleures options. Dans une publication récente, l'oncologue a pu prescrire un traitement dans 60,4 % des cas, conformément à la recommandation de l’analyse moléculaire.
Le patient a-t-il une chance réelle de répondre au traitement et de vivre plus longtemps ?
Chaque patient est différent et un traitement peut réagir différemment selon les patients. Les tests peuvent suggérer des médicaments potentiellement plus efficaces ou d’informer sur certains traitements inefficaces ou toxiques pour le patient. Si le traitement s’avère en effet efficace, cela peut améliorer l’espérance de vie ou la qualité de vie. Dans des publications récentes, la moitié des patients présentait une nette amélioration de la survie. L’oncologue est le meilleur conseil pour orienter vers le choix le plus judicieux au cas par cas.
Immunothérapie
Après des décennies de déceptions dans le traitement du cancer, l'utilisation de l'immunothérapie a finalement atteint l'âge de maturité et a entraîné un véritable changement de paradigme dans le traitement du cancer pour de nombreux types de tumeurs. Avec l'avènement de nouvelles immunothérapies basées sur une compréhension croissante du système immunitaire humain, la guérison est devenue une possibilité réelle pour de nombreux patients[163]. Contrairement aux chimiothérapies qui permettent parfois de détruire 99 % de la tumeur mais où le 1 % restant résiste à la chimiothérapie et cause souvent une rechute, les immunothérapies permettent souvent d'éliminer durablement les tumeurs. Une molécule, appelée PD-1, a rapidement été identifiée et ciblée avec succès par des inhibiteurs de points de contrôle. Le Yervoy développé par Bristol-Myers Squibb a été le premier traitement approuvé en 2011 par la Food and Drug Administration (FDA) des États-Unis pour le traitement du mélanome. Trois ans plus tard, la FDA a approuvé le pembrolizumab (Keytruda) et le nivolumab (Opdivo) deux inhibiteurs de PD-1 respectivement de Merck et de Bristol-Myers Squibb. L'un et l'autre ont été approuvés pour traiter certains types de cancer du poumon, de cancer du rein et de lymphome de Hodgkin, créant la plus importante nouvelle classe de médicaments contre le cancer depuis un siècle[152].
Le renouveau de l'immunothérapie comprend différentes stratégies parfois associées dont des virus anti-cancer, des lymphocytes T génétiquement reprogrammés[164] (notamment à l'aide de récepteur antigénique chimérique, voir aussi : transfert adoptif de cellule) et des vaccins conçus pour susciter une réponse immunitaire contre la tumeur.
En , plus de 166 736 patients étaient recherchés pour participer à des études pour des médicaments ciblant une seule protéine appelée PD-1. Le nombre total d'essais d'immunothérapie en cours dépasse en vraisemblablement 3 000, d’après Jeff Bluestone, immunologiste à l'Université de Californie à San Francisco[152].
Même si ces nouvelles thérapies font naître de grands espoirs, les traitements ne sont pas encore efficaces pour tous les malades. En effet, pour un grand nombre de patients, les traitements n'apportent pas les effets escomptés. Par exemple, dans le cas du Yervoy seuls 20 % des patients atteints de mélanome métastatiques peuvent être guéris[152]. Le protocole Keytruda remplace cependant désormais la chimiothérapie pour certains types de cancer du poumon[165]. Des essais cliniques basés en particulier sur des lymphocytes T et sur les lymphocytes NK, paraissent cependant très prometteurs[166].
L'INSERM a mis en évidence que les vaisseaux HEV étaient le principal moyen d'accès des lymphocytes tueurs aux tumeurs. Ainsi, dans le cas du mélanome métastatique, les tumeurs irriguées par un grand nombre de vaisseaux HEV répondent mieux à l’immunothérapie anti-PD-1 plus anti-CTLA-4. Un traitement visant à augmenter la proportion de vaisseaux HEV dans les tumeurs pourrait être une voie d’amélioration de l’efficacité de l’immunothérapie[167].
Le taux de réponse d'un patient aux immunothérapies peut être estimé en réalisant une analyse moléculaire complète de la tumeur par profilage moléculaire des tumeurs.
Thérapies ciblées
Les thérapies ciblées visent à bloquer certains mécanismes spécifiques des cellules cancéreuses comme leur vascularisation ou leur croissance, ou à déclencher leur mort programmée (apoptose)[168]. D’importants progrès thérapeutiques ont été réalisés au cours de la dernière décennie grâce aux thérapies ciblant les voies de signalisation impliquées dans la croissance et la survie des cellules tumorales, et ces traitements ont démontré leur efficacité pour une partie des patients[169]. Ces traitements créent moins de dommages aux cellules et tissus sains environnant les tumeurs et composant l'organisme du malade[170].
Traitements alternatifs
En médecine, les traitements reposent sur des études scientifiques de bonne qualité, qui sont nécessaires avant qu'un traitement puisse être considéré comme efficace. Il existe de nombreux traitements alternatifs, mais l'évaluation scientifique de leur efficacité est souvent soit inexistante, soit non validée en pratique clinique, c'est-à-dire validées dans des modèles expérimentaux ou animaux, mais pas chez l'humain. Par exemple, de nombreuses substances tuent les cellules cancéreuses en laboratoire ou chez l'animal, mais fonctionnent mal chez l'humain[171].
De nombreuses personnes se tournent vers des traitements alternatifs pensant qu'ils n'ont pas d'effets négatifs, ce qui n'est pas toujours le cas, certains étant nocifs et pouvant même entraîner la mort[171]. D'autre part, le simple fait de retarder un traitement reconnu peut permettre au cancer de se développer et d'atteindre d'autres parties du corps[171].
Certains traitements alternatifs sont assimilables à du charlatanisme ou de la fraude, ces méthodes étant souvent basées sur des théories de la maladie qui sont contraires aux idées scientifiques reconnues, de simples témoignages de patients étant parfois utilisés comme preuves[171]. Ces « remèdes miraculeux » prétendent souvent soigner d'autres maladies que le cancer.
Quelques exemples de traitements alternatifs :
La supplémentation de très fortes doses de vitamine C en médecine orthomoléculaire, dont l'idée initiale a été donnée par Irwin Stone, reprise par Linus Pauling (mort d'un cancer de la prostate, à l'âge honorable de 93 ans toutefois) et notamment Matthias Rath (dont les travaux sont très controversés). Un effet favorable semble exister chez les cultures cellulaires ou chez des animaux, mais aucune preuve satisfaisante n'existe chez l'être humain à titre curatif[172], ou préventif[173]. La Société Suisse de lutte contre le cancer souligne en particulier les faiblesses du dossier scientifique de Matthias Rath[174].
Il existe de nombreux régimes alimentaires censés lutter contre le cancer, par exemple[175] : la cure de raisin de Johanna Brandt, la cure anticancer de Rudolf Breuss, l'instinctothérapie de Guy-Claude Burger, des régimes végétariens, le régime cétogène[176], la méthode de Gerson-Kelley, la diététique de Kousmine, le régime et la thérapie du Dr Moerman, la thérapie de Livingtone-Wheeler, le zen macrobiotique. Certaines théories utilisent le jeûne thérapeutique dans le but de « détoxifier » l'organisme ou pour faire « maigrir » les tumeurs. Les preuves scientifiques disponibles ne soutiennent pas une efficacité significative contre le cancer chez l'humain[171]. Des périodes de jeûne même de courte durée peuvent avoir des effets négatifs sur certaines personnes affaiblies, sur de longues périodes, les effets peuvent être plus graves et même entraîner la mort[171].
D'autres méthodes[175] font appel à la guérison par la foi et la prière, depuis l'Antiquité, il existe notamment aux États-Unis des évangélistes guérisseurs. La chirurgie psychique est pratiquée par des guérisseurs aux Philippines, la méthode très controversée de Hamer en Allemagne et en France, etc.
Voir aussi les travaux de Mirko Beljanski. Par ailleurs, G. Edward Griffin prétend que le cancer résulterait notamment d'une carence en vitamine B17 ordinairement appelée amygdaline ou laetrile[177]. Le professeur Didier Raoult a exposé dans Le Point en 2014 les travaux de William Coley[178], qui ont fait l'objet d'un article dans la revue Nature[179].
Un autre traitement alternatif, ou plutôt une approche alternative, est la chronothérapie. Elle consiste à administrer les agents anti-cancers à des moments spécifiques de la journée pour maximiser les bénéfices du traitement et réduire les effets secondaires. Elle se dirige plus vers une médecine spécialisée pour les rythmes endogènes de chaque patient.
Règles hygiénodiététiques
Une étude de l'Institut national du cancer publiée en 2020 se donne pour objectif d'évaluer scientifiquement l'intérêt de différents régimes alimentaires étudiés — en termes de mortalité globale et spécifique, récidive, second cancer primitif, progression et qualité de vie — chez les personnes souffrant ou ayant souffert d'un cancer[180]. Cette étude compile 63 méta-analyses, 22 analyses poolées, 65 essais d'intervention et 93 études de cohorte. Les résultats validés sont classés en trois niveaux de confiance : suggéré, probable, convaincant.
Cette étude confirme les facteurs de risques suivants :
- l'obésité notamment pour le cancer du sein, colorectal et du rein ; elle réduit par contre le risque de cancer du poumon ou de l’œsophage ;
- l'insuffisance pondérale (maigreur) pour le cancer colorectal ou du poumon ;
- la sarcopénie pour les cancers de l'œsophage, du pancréas, du foie et de l'estomac[181].
Concernant l'alimentation, les résultats validés scientifiquement font défaut :
- les fibres alimentaires s'avèrent bénéfiques dans le cas du cancer du sein et du cancer colorectal ;
- une alimentation peu grasse est favorable dans le cas du cancer du sein ; les graisses végétales semblent protectrices dans le cas du cancer de la prostate contrairement aux graisses saturées ;
- la supplémentation en vitamine C, D et E présente un intérêt dans le cas du cancer du sein, notamment ; la supplémentation en acides aminés à chaine ramifiée pourrait réduire le risque de mortalité global du cancer du foie.
L’intérêt potentiel du soja ou d'extraits de Coriolus versicolor est à prendre avec précautions du fait d'absence de précisions sur les doses et la fréquence de consommation.
Cette étude fait suite à deux autres qui avaient mis en évidence les bénéfices de l’activité physique et de l’arrêt du tabac.
Psycho-oncologie et qualité de vie
Le diagnostic et les traitements contre le cancer génèrent une grande détresse chez le patient et ses proches. Ils altèrent profondément la vie du malade (par exemple, son parcours scolaire ou professionnel, ses relations sociales, etc.)[182]. Dans les années 1970, la discipline de psycho-oncologie s'est développée pour répondre aux besoins psychologiques particuliers des personnes souffrant du cancer[183]. La psycho-oncologie est pluridisciplinaire et a plusieurs objectifs allant de la diminution de la détresse du patient, du traitement de certains symptômes secondaires comme les nausées ou les troubles cognitifs, en passant par l'aide aux survivants dans le long-terme[184]. Elle s'avère un complément efficace dans le traitement médical des patients, améliorant la tolérance aux traitements et la qualité de vie durant et après les traitements[184],[185].
Après le cancer
Le nombre de patients survivant au-delà du traitement actif du cancer est en forte augmentation en France comme aux États-Unis[186], l'ensemble des malades représentant 3,8 millions de personnes en France en 2020[187]. Ils doivent parfois suivre un traitement plus léger, pendant plusieurs années ou à vie. L'identité d'ancien malade est plus ou moins assumée par les jeunes, certains choisissant leur métier en fonction de cette expérience quand d'autres tentent de mener une vie normale[188].
La plupart des patients souffrent de séquelles du cancer et/ou de son traitement, qui peuvent être physiques, psychologiques et sociales[189]. Leur prise en charge est souvent moins structurée que celle des patients en phase active de traitement, le suivi systématique étant contesté par certains praticiens qui préfèrent réagir aux symptômes des patients[190]. La peur de la rechute est le principal facteur de risque psychologique, présent chez 50 à 75 % des malades[191].
Coûts économiques et socio-économiques
La chimiothérapie et la chirurgie lourde, ainsi que les traitements au long cours font du cancer une des maladies financièrement les plus coûteuses pour la société. Le coût social du cancer est difficile à évaluer, mais est important et ne cesse d'augmenter[192]. Avec l'industrialisation des pays pauvres et l'évolution de leur mode de vie et de l'espérance de vie, le cancer tend à se globaliser sur la planète[193]. En 2010, plus de 50 % des nouveaux cas de cancer et près des 2/3 des décès par cancer touchent des personnes à faible revenu, à revenu inférieur à la moyenne et des pays en développement à revenu intermédiaire du monde (à titre de comparaison, en 1970, les pays en développement ne représentaient que 15 % des cancers nouvellement signalés[194]). En 2030, le monde en développement sera censé supporter 70 % du fardeau mondial du cancer[194].
En France, dans les années 2000, environ 280 000 nouveaux cas étaient détectés par an[195], avec une augmentation régulière du nombre de cas (358 000 nouveaux cas attendus en 2010 selon les modélisations de l'INVS, rendues nécessaire par le fait qu'en France, seule environ 20 % de la population est concernée par un registre du cancer[196]), dont le coût annuel est estimé à 30 milliards d'euros pour 2004[195]. 730 millions d'euros ont été accordés au 2d Plan cancer (2009-2013), dont 95 millions pour la recherche et 400 millions pour les soins[195]. La recherche porte aussi sur les moyens de diminuer les coûts socio-économiques de la maladie et des soins. Les 6es Rencontres parlementaires sur le Cancer (jeudi ) à l'Assemblée nationale ont porté sur le thème : « Cancer : quels coûts pour la société ? »[195]. Certaines réflexions de la littérature internationale suggèrent « d'accepter, sans se poser de question, les stratégies thérapeutiques dont les coûts marginaux pour le système de santé par année de vie gagnée demeurent inférieurs à deux fois le PNB par tête », soit moins de 50 000 euros[197].
Force est de rapprocher ce chiffre du fait que la moyenne des années de vie perdues est de quinze ans sur l'ensemble des cancers[198].
Des médecins et ONG telles le MDRGF et le réseau européen HEAL[199] protestent contre le fait que ces types d'approche, ne portant que sur les coûts du soin, omettent de poser la question des causes environnementales et comportementales du cancer. Mieux les traiter permettrait selon eux d'importantes économies, plus durables, avec peut-être une forte réduction du nombre et de la gravité des cancers[200].
Selon une étude publiée par les chercheurs de l'université d'Oxford (et rapportée dans le quotidien Direct Matin du ), le coût financier pour l'Union européenne s’élève à 26 milliards d'euros par an, ce chiffre inclut les coûts de la maladie pour les systèmes de santé, le manque à gagner lié à l'incapacité de travailler des malades, ainsi que les soins fournis par les proches des malades.
Le cancer, même guéri, peut avoir des implications économiques à long terme. En France, par exemple, les patients ont, jusqu'en 2015 des difficultés à avoir certains prêts jusqu'à l'instauration, le , du « droit à l'oubli ». Ce droit permet aux personnes guéries de certains cancers ou d'une hépatite C de contracter un emprunt sans avoir à déclarer leur ancienne maladie après une période définie[201].
Épidémiologie

- pas de données
- moins de 55
- 55-80
- 80-105
- 105-130
- 130-155
- 155-180
- 180-205
- 205-230
- 230-255
- 255-280
- 280-305
- plus de 305
En 2012, le cancer a causé la mort de 8,8 millions de personnes, surtout dans les pays en voie de développement, en raison d'un diagnostic tardif et l'inaptitude à proposer un traitement dans un système de santé adapté, selon une étude de l'Organisation mondiale de la santé[203]. En 2008, 56 % des 12,7 millions de nouveaux cas de cancer et 63 % des 7,6 millions de décès associés à un cancer dans le monde sont survenus dans les pays en développement, selon une étude fondée sur 27 formes de cancer[204].
Les cancers les plus fréquemment diagnostiqués dans le monde sont ceux du poumon (12,7 %), du sein (10,9 %) et le cancer colorectal (9,7 %). Les décès les plus fréquents sont provoqués par le cancer du poumon (18,2 %), de l'estomac (9,7 %) et le cancer du foie (9,2 %). Les cancers du col utérin et du foie sont beaucoup plus fréquents dans les régions en développement, tandis que ceux de la prostate et du côlon-rectum sont plus fréquents dans les régions développées.
En prenant en compte le nombre d'habitants de chaque pays, ce sont les pays d'Amérique du Nord, ceux d'Europe de l'Ouest et l'Australie qui enregistrent les taux de mortalité les plus élevés.
France
« Depuis 2004, le cancer est la première cause de mortalité prématurée en France, devant les maladies cardiovasculaires. Le cancer est la première cause de mortalité chez l'homme et la deuxième chez la femme »[205]. Son incidence diffère selon le sexe (chiffres 2012 et 2017) : le cancer de la prostate est le plus fréquent des cancers métastatiques[206] chez l'homme (28 % des nouveaux cas de cancers masculins), nettement devant celui du poumon (14 %) et du côlon-rectum (12 %). Chez la femme, le plus fréquent est le cancer du sein (31 %), devant le cancer colorectal (12 %) et le cancer du poumon (7 %)[207],[208].
Il existe une augmentation du nombre de certains cancers. Les cancers du poumon, mésothéliomes, hémopathies malignes, tumeurs cérébrales et cancers du sein, de l'ovaire, du testicule, de la prostate et de la thyroïde sont en augmentation très significative depuis les années 1980[209],[210]. Ceci est en partie lié au vieillissement et à la croissance de la population et touche différemment l'homme et la femme. De 1980 à 2005 (en tenant compte de la démographie), le taux de cancers s'est élevé de 35 % pour les hommes et de 43 % pour les femmes[211]. En 2008, l'INSERM a conclu d'une revue de la littérature scientifique mondiale relative aux liens entre ces neuf cancers en augmentation et exposition passive à des cancérogènes, avérés ou suspectés dans l'environnement (incluant donc le tabagisme passif, mais non le tabagisme actif), que ni les améliorations du dépistage ni l'évolution de la démographie ne pouvaient expliquer cette augmentation. L’exposition aux cancérigènes de l'environnement est donc supposée, mais reste mal évaluée, bien que des liens de causalité soient déjà établis par exemple entre cancer du poumon et pollution particulaire de l’air par le trafic automobile, le chauffage et l’industrie (« Environ 1 300 à 1 900 décès par cancer du poumon pourraient être évités chaque année dans vingt-trois villes européennes si les niveaux de PM2,5 particules fines étaient ramenés respectivement à 20 et à 15 microgrammes par millimètre cube (µg/mm3) ». Mais la norme européenne sur les PM2,5 (max de 25 µg/mm3 en 2010) ne sera en vigueur qu'en 2015.
| Cancer | Incidence | Mortalité |
|---|---|---|
| Tous les cancers | 319 380 | 145 762 |
| Prostate | 62 245 | 9 202 |
| Sein | 49 814 | 11 201 |
| Côlon-rectum | 37 413 | 16 865 |
| Poumons | 30 651 | 26 624 |
| Cavité buccale et pharynx | 12 270 | 4 000 |
| Lymphome Malin Non Hodgkinien | 10 224 | 4 203 |
| Vessie | 9 679 | 4 482 |
| Rein | 7 949 | 3 684 |
| Mélanome (peau) | 7 401 | 1 440 |
| Pancréas | 7 218 | 7 787 |
| Estomac | 6 794 | 4 756 |
| Thyroïde | 6 672 | 403 |
| Foie | 6 433 | 7 390 |
| Utérus (corps) | 5 774 | 1 800 |
| Œsophage | 4 721 | 3 850 |
| Myélome | 4 516 | 2 789 |
| Ovaire | 4 375 | 3 180 |
| Système nerveux | 4 120 | 3 019 |
| Larynx | 3 735 | 1 406 |
| Leucémie lymphoïde chronique | 3 224 | 1 059 |
| Leucémies aiguës | 3 082 | 2 733 |
| Col de l'utérus | 3 068 | 1 067 |
| Testicule | 2 002 | 82 |
| Maladie de Hodgkin | 1 544 | 218 |
| Plèvre | 906 | 1 090 |
Il est essentiel de bien noter la différence entre l'incidence d'un cancer (la fréquence annuelle calculée sur une durée précise) et la mortalité. Ce tableau montre bien que certains cancers très fréquents (prostate) ont une mortalité faible contrairement à des cancers plus rares (pancréas) qui ont une mortalité très élevée.
La France est parfois présentée comme étant le pays ayant la plus longue survie après cancer[213]. Mais concernant la survie à 5 ans après le diagnostic, elle serait le second en Europe derrière la Suède, avec environ 52 % de survie (63 % pour les femmes, 44 % pour les hommes)[214]. Cela cache de grandes disparités selon les cancers. On atteint des chances de survie de 95 % pour le cancer de la thyroïde ; chez les hommes, on atteint 80 % de survie à 5 ans pour le cancer de la prostate, et quasiment 100 % pour les cancers des testicules et, chez les femmes, 85 % pour le cancer du sein entre 15 et 44 ans, mais 78 % au-delà de 75 ans. En revanche, les cancers profonds sont diagnostiqués plus tardivement et sont très souvent mortels : cancer du pancréas (10 % de survie), du poumon, etc.
En France, outre l'InVS et l'INPES, l'INSERM, les ARS et ORS, l'Institut de recherche et documentation en économie de la santé (IRDES) et la Direction de la recherche, des études, de l'évaluation et des statistiques (DREES) dépendant du ministère chargé de la Santé, existent plus spécifiquement :
- un outil[215] en ligne, l'Institut national du cancer (INCa), qui donne accès aux principaux indicateurs et recherches sur le cancer (avec un rapport 2011 sur la situation en France[216].
- un « Observatoire sociétal des cancers » confié au Pôle sociétal de la Ligue contre le cancer. Il publie depuis 2012 un rapport annuel (sur le « vécu des malades en 2012 »[217] et sur « le parcours professionnel » en 2014[218]) et a confirmé que la maladie est paupérisante, surtout chez les plus vulnérables (arrêt maladie, perte de revenus, invalidité, rupture sociale, fracture psychologique), avec des démarches administratives fastidieuses ;
- un « Comité éthique et cancer », organe de recours indépendant, rendant des avis[219], associant 35 membres permanents et présidé par le Pr Axel Kahn ;
- un Collectif interassociatif sur la santé (CISS) regroupant (en 2011) 37 associations et une plate-forme Cancer info[220], une plate-forme collaborative (Web 2.0)[221], créée avec le pôle citoyen de Cancer Campus® pour coproduire des contenus inédits et innovants issus des expériences individuelles et collectives concernant le cancer.
Dans le cadre du Plan cancer 2009-2013, depuis 2007, l'Institut national du cancer publie annuellement une synthèse des données sur le cancer.
En 2015, selon un rapport InVS réalisé dans le plan cancer 2014-2019 : en France métropolitaine, les registres des cancers ne couvrent que 20 % de la population[222]. Pour la période 2008-2010 et pour 8 cancers chez l'homme et 8 chez la femme, des disparités départementales persistent pour certains cancers (liés au tabac, à l'alcool, à l'environnement) et « qui semblent correspondre aux variations d'exposition des populations à ces facteurs de risque »[222]. Chez les hommes, l'incidence des cancers des lèvres-bouche-pharynx, du larynx, du poumon et de l’œsophage plus élevée dans les départements du nord, avec une incidence très élevée (dans le Pas-de-Calais, le Nord et la Seine-Maritime notamment) alors que les départements de l'ouest et du sud sont en sous-incidence. Les femmes sont plus victimes du cancer du poumon dans le sud et l'Île-de-France, plus particulièrement dans les départements urbanisés (Alpes-Maritimes : 18,6 ; Hérault : 19,0 ; Haute-Garonne : 18,6 et dans une moindre mesure Var : 17,4) et en Île-de-France (17,5), mais avec une sous-incidence dans le nord. Pour les autres cancers étudiés, les différences départementales sont moins nettes[222].
En 2018, selon les données de l'Institut national du cancer, 382 000 nouveaux cas de cancer sont diagnostiqués, et 157 400 personnes en sont mortes[223].
En France, le nombre des cancers a doublé depuis 1990, selon les données de Santé Publique France et de l'INC[224]. En 2023, 433 136 nouveaux cas de cancers devraient être déclarés, dont 57% chez l'homme et 43% chez la femme. Cette hausse observée s'explique principalement par l'accroissement et le vieillissement de la population pour près de 80% chez l'homme, et 57% chez la femme ; les autres cas sont liés au mode de vie (alcool, tabac, surpoids) et à l'environnement.
| Cancer | Incidence | Mortalité |
|---|---|---|
| Tous les cancers | 399 626 | 150 303 |
| Prostate | 48 427 | 8 207 |
| Sein | 58 968 | 11 883 |
| Côlon-rectum | 44 872 | 17 684 |
| Poumons | 49 109 | 30 991 |
| Cavité buccale et pharynx | 12 044 | 2 925 |
| Vessie | 13 338 | 5 013 |
| Rein | 14 139 | 4 668 |
| Mélanome (peau) | 15 404 | 1 783 |
| Pancréas | 14 220 | non indiqué |
| Estomac | 6 616 | 4 440 |
| Thyroïde | 10 605 | 351 |
| Foie | 10 705 | 8 651 |
| Utérus (corps) | 8 367 | 2 336 |
| Œsophage | 4 839 | 3 225 |
| Ovaire | 4 714 | 3 111 |
| Système nerveux | 5 551 | 3 806 |
| Larynx | 3 220 | 698 |
| Col de l'utérus | 2 835 | 1 084 |
| Testicule | 2 353 | 83 |
Taux de survie et surmortalité
Le taux de survie des cancers n'a cessé de s'améliorer au cours des décennies : dans les années 2010, la survie à 10 ans est similaire, en Angleterre et en Écosse, à la survie à un an en 1970[226].
Le taux de survie dépend aussi de l'âge. Cinq ans après le diagnostic, 70 % des 15–45 ans survivent (99 % en population générale[227]). Alors que seuls 40 % des malades cancéreux âgés de 75 ans survivront plus de 5 ans ; compte tenu du risque de métastases, on ne parle pas de guérison pour un cancer, mais de rémission (voir Évolution plus loin). En France et au Canada, le cancer est la première cause de mortalité chez les plus de 65 ans[228].
Pour estimer l'efficacité du dépistage et des soins, on utilise le taux de survie et la surmortalité à une certaine durée après le diagnostic.
Taux de survie
En Europe, selon l'étude « Eurocare-5 » (publié dans The Lancet Oncology en 2013, il varie beaucoup selon le type de cancer, avec par exemple un taux de survie élevé à cinq ans — plus de 80 % — pour les tumeurs ou cancers des testicules, des lèvres, de la thyroïde ou encore de la prostate[229]. Les chances de survie varient aussi significativement selon le pays[229] ; les pays de l'Ouest (Autriche, Belgique, France, Allemagne, Suisse, Italie, Espagne, Portugal) ont de meilleurs taux de survie après cancer. La Bulgarie, les Pays baltes, la Pologne la Slovaquie ont les scores les plus bas, tandis que le Royaume-Uni et le Danemark ont des résultats moyens[229].
En France, d'après La Ligue nationale contre le cancer, le taux de survie à cinq ans après diagnostic en France, pour des patients suivis entre 1989 et 1997 était, en 2006 :
| Hommes | Femmes | ||
|---|---|---|---|
| 75 % et + | |||
| Lèvre | 96 % | Thyroïde | 95 % |
| Testicule | 95 % | Maladie de Hodgkin | 92 % |
| Thyroïde | 88 % | Mélanome de la peau | 89 % |
| Maladie de Hodgkin | 85 % | Lèvre | 88 % |
| Mélanome de la peau | 83 % | Sein | 85 % |
| Prostate | 80 % | Corps utérin | 76 % |
| 50 à 74 % | |||
| Pénis | 67 % | Col utérin | 70 % |
| Rein | 63 % | Rein | 64 % |
| Vessie | 60 % | Os, articulations et cartilages articulaires | 62 % |
| Os, articulations et cartilages articulaires | 59 % | Larynx | 59 % |
| Côlon | 56 % | Rectum | 58 % |
| Rectum | 55 % | Côlon | 57 % |
| Larynx | 54 % | Vulve et vagin | 52 % |
| Lymphome malin non hodgkinien | 54 % | Vessie | 50 % |
| 25 à 49 % | |||
| Nasopharynx | 45 % | Langue | 45 % |
| Intestin grêle | 45 % | Myélomes multiples | 43 % |
| Myélomes multiples | 42 % | Intestin grêle | 42 % |
| Cavité orale | 38 % | Ovaire | 40 % |
| Langue | 33 % | Fosses nasales, sinus annexes de la face, oreille moyenne et oreille interne |
37 % |
| Hypopharynx | 34 % | ||
| Leucémie aiguë lymphoblastique | 29 % | ||
| Estomac | 28 % | ||
| 25 % et − | |||
| Estomac | 23 % | Système nerveux central | 19 % |
| Système nerveux central | 20 % | Poumon | 18 % |
| Poumon | 13 % | Œsophage | 14 % |
| Œsophage | 11 % | Mésothéliome de la plèvre | 13 % |
| Foie | 7 % | Foie | 9 % |
| Mésothéliome de la plèvre | 6 % | Pancréas | 7 % |
| Pancréas | 5 % | ||
En France, selon un rapport conjoint de l'Institut de veille sanitaire (InVS), du réseau Francim des registres des cancers, de l'Institut national du cancer (INCa) et des Hôpitaux de Lyon, la durée de survie des patients atteints d'un cancer de la prostate, du sein ou du côlon-rectum, a augmenté dans la période allant de 2005 à 2010 comparativement à la période allant de 1989 à 1993[231].
Surmortalité
Pour un groupe de personnes chez lesquelles on a diagnostiqué un cancer, on peut distinguer celles mortes des suites de leur cancer, et celles mortes d'une autre cause. La surmortalité à une durée t (par exemple de 10 ans) liée au cancer est la probabilité de mourir du seul fait du cancer durant la durée t qui suit le diagnostic.
Le problème de l'évaluation de cette mortalité est qu'il faudrait connaître les causes de tous les décès des personnes dont on a diagnostiqué un cancer, ce qui est impossible. On utilise donc une autre estimation ; pour un groupe de personnes du même sexe et du même âge, on utilise la « survie relative », c'est-à-dire le rapport entre :
- la probabilité de survie après un temps t du groupe de personnes dont on a diagnostiqué un cancer, et
- la probabilité de survie à t d'un groupe de personnes n'ayant pas de cancer, de même âge et de même sexe.
La surmortalité est alors le complément à 1 de cette survie relative.
Les études montrent une surmortalité d'environ 2 % au-delà de 10 ans après le diagnostic dans les pays développés, ce qui pointe l'irrationalité de la ségrégation que subissent les patients ayant eu un cancer de la part des assurances et des banques (surtaxes, refus de prêt, etc.).
Les résultats ci-après sont issus du document Cancers — Pronostics à long terme de l'INSERM[232].
L'étude Eurocare s'est penchée sur une vingtaine de pays européens pour des cas diagnostiqués durant trois périodes (les malades étudiés durant une période forment une « cohorte ») : 1978-1985, 1985-1989 et 1990-1994. Cette étude ne distingue pas le stade du diagnostic.
| délais après diagnostic | surmortalité | ||
|---|---|---|---|
| deux sexes confondus | femmes | hommes | |
| 0–1 an | 27 % | 20 % | 33 % |
| 2e année | 15 % | ||
| 5e année | 5 % | ||
| 10e année | 2,27 % | 1,95 % | 3,18 % |
| 11-12e année | 2 % | moins de 2 % | un peu plus de 2 % |
| délais après diagnostic | surmortalité par classe d'âge | ||||
|---|---|---|---|---|---|
| toutes classes d'âge confondues | 15–44 ans | 45–54 ans | 54–65 ans | 65–74 ans | |
| 0–1 an | 27 % | 12 % | 33 % | ||
| 4e année | moins de 5 % | ||||
| 10e année | 2,27 % | 1,24 % | 2,06 % | 2,42 % | 3,03 % |
| 11-12e année | 2 % | un peu plus de 1 % | plus de 3 % | ||
| surmortalité | localisation du cancer |
|---|---|
| < 2 % |
|
| 2–5 % |
|
| > 5 % |
|
L'étude américaine SEER s'est intéressée au stade du cancer au moment de son diagnostic, selon trois catégories :
- tumeur localisée ;
- tumeur ayant un développement régional (ganglionnaire) ;
- tumeur ayant un développement à distance (métastase).
| surmortalité | localisation du cancer |
|---|---|
| < 1 % |
|
| 1–3 % |
|
| 3–5 % | larynx (2,90 %) |
| > 5 % | poumon (7,20 %) |
Chez l'enfant
Selon une grande étude européenne[233] publiée fin 2004 et fondée sur les registres du cancer, l'analyse d'une base de données financée par l'Union européenne regroupant 80 registres de cancers et couvrant environ la moitié des enfants (jusqu'à 14 ans) et un quart des adolescents (15 à 19 ans), le taux moyen de l'incidence du cancer par classe d'âge dans les années 1990, calculé sur près de 50 000 cas, s'établit à 140 cancers par million d'enfants, contre 118 dans les années 1970 et 124 dans les années 1980. Ainsi, les cancers de l'enfant sont en augmentation. Dans les pays industrialisés, environ 1 enfant sur 500 déclare un cancer avant l'âge de 15 ans (presque 1 500 nouveaux cas par an en France, dont 50 % avant l'âge de 6 ans). Chez les adolescents, ce taux est de 193 par million au cours des années 1990, contre 147 dans les années 1970 et 165 dans les années 1980[233]. Dans les années 1990, le taux de cancer chez l'enfant était en Europe un peu plus important à l'Est qu'à l'Ouest, à cause de cancers de la thyroïde plus fréquents (attribués aux retombées de Tchernobyl)[233].
Si les cancers des enfants ne comptent que pour moins de 1 % du nombre total de cancers. Dans les pays économiquement affluents, bien que les cancers soient guéris dans environ 70 % des cas[232], ils restent la seconde cause de mortalité de l'enfant[234].
En France, les leucémies sont les cancers les plus fréquents chez l'enfant (450 cas nouveaux par an)[235]. Suivent (principalement) :
- les tumeurs cérébrales (300/an en France) ;
- les lymphomes (190/an en France, dont 56 % de lymphomes non-hodgkiniens déclarés entre 2 et 3 ans).
Les tumeurs embryonnaires sont plus fréquentes les premières années de la vie, et des sarcomes osseux et des tissus mous chez les grands enfants.
| délais après diagnostic | surmortalité (%) |
|---|---|
| 0–1 an | > 10 |
| 4e année | 2 |
| 7e année | 1 |
En raison d'une évaluation difficile des expositions indirectes et des effets de synergies possibles, des relations certaines de cause à effet sont difficiles à établir[236], mais les pesticides (ingérés ou inhalés par l'enfant, ou ses parents avant la naissance) semblent être l'une des causes d'augmentation, notamment pour les tumeurs du cerveau, avec 9 études sur 16 qui concluent à une relation causale possible en cas d'emploi de sprays insecticides ou d'autres pesticides par les parents, (OR 1,5 ; 2,2) ou par la manipulation de pesticides agricoles (RR 2,0 ; 2,9 ; 3,3)[237] (dans de mêmes conditions environnementales, les enfants sont significativement plus exposés que les adultes aux pesticides[238],[239],[240],[241],[242],[243],[244],[245], alors même qu'ils y sont a priori plus vulnérables). D'autres cancers de l'enfant semblent induits ou co-induits par des pesticides (leucémie[237], neuroblastome[237], tumeur de Wilms[237], sarcomes des tissus mous[237], sarcomes d'Ewing[237], lymphome non-Hodgkinien[237], cancer colorectal[237] et cancer des testicules[237])[237]. Dans ce dernier cas, un effet perturbateur endocrinien est probable.
Par exemple, une étude suggère que l'exposition de la femme enceinte aux pesticides domestiques augmente le risque de cancers hématopoïétiques (cancer du sang) de l'enfant[246]. Cette étude a exploité le RNHE, le « Registre national des hémopathies malignes de l'enfant » (antérieurement dénommé « Registre national des leucémies de l'enfant »)[247] qui enregistre les cas signalés d'hémopathie maligne ou à la limite de la malignité, chez les enfants habitant en France métropolitaine ayant moins de 15 ans au moment du diagnostic.
Chez l'adolescent et le jeune adulte
Les données sont difficilement connues concernant les adolescents et les jeunes adultes. Cependant, en France, la tranche d'âge des 15 à 25 ans fait l'objet d'un suivi particulier. Environ 1 700 adolescents et jeunes adultes (dits "AJA") sont diagnostiqués d’un cancer chaque année en France[248].
Le cancer est la 3e cause de mortalité chez cette tranche d’âge (15-25 ans), après les accidents et les suicides.
Les 5 cancers principaux chez les AJA sont les lymphomes, les sarcomes, les tumeurs germinales, les leucémies aiguës et les tumeurs du système nerveux central.
Le taux de patients vivants 5 ans après le diagnostic dans la population AJA atteinte d'un cancer est en constante progression.
Des centres de soins ainsi que des structures d'accompagnement social (comme Cheer Up !) sont spécialisés sur les jeunes.
Historique
Le cancer paraît être une maladie aussi vieille que le genre humain[249] : des traces d'ostéosarcomes sont décelées dans des ossements datés du Néolithique[250]. Des cancers sont déjà décrits dans des textes égyptiens (papyrus Ebers[251], papyrus Edwin Smith rédigés au XVIe siècle avant notre ère et qui évoquent l'ablation de tumeurs[252]). C'est le médecin antique grec Hippocrate qui donne la première définition de la maladie, distinguant la tuméfaction bénigne (carcinos), le cancer curable (squirrhos) et le cancer entraînant la mort (carcinoma) : une tumeur (gonflement) dure, non-inflammatoire, ayant tendance à récidiver et se généraliser jusqu'à la mort[253]. Le médecin grec Galien utilise le terme oncos pour désigner les tumeurs, estime qu'elles sont dues à un excès de bile noire dans l'organisme et préconise l'administration de purges pour dissoudre la bile solidifiée. Cette théorie des humeurs perdure jusqu'à la Renaissance qui voit le développement de chirurgiens comme Ambroise Paré qui jugent l'exérèse utile lorsque le cancer est petit[254].
Le médecin français Xavier Bichat propose en 1797 la « théorie tissulaire » du cancer, affirmant que les tumeurs se présentent sous la forme de tissu. En 1858, le médecin allemand Rudolf Virchow publie sa théorie de la pathologie cellulaire d'après laquelle les maladies ont leurs origines dans des altérations des cellules du corps. Il impose rapidement l'idée dans la communauté scientifique qu'il existe des caractéristiques propres à la cellule cancéreuse. Il affirme notamment que même cancéreuse, toute cellule naît d'une autre cellule (« Omnis cellula a cellula »), favorisant l'essor de la chirurgie cancéreuse comme traitement curatif[255].
Les premiers succès thérapeutiques sont réalisés à la fin du XIXe siècle grâce à des chirurgiens comme Theodor Billroth qui réussit en 1881 la première ablation d'un cancer de l'estomac ; William Halsted prévient les métastases en mettant au point en 1890 la mastectomie élargie appliquée au cancer du sein ; Ernst Wertheim (en) réalise en 1898 la première hystérectomie radicale appliquée au cancer du col utérin[256].
Parallèlement se développe la radiothérapie avec des précurseurs comme Victor Despeignes qui, en 1896, traite aux rayons X un cancer de l'estomac. Les historiens des sciences créditent Emil Grubbe (en) comme le premier à avoir utilisé ces irradiations, non pas en complément, mais comme traitement principal du cancer du sein[257].
En 1906, la première conférence internationale pour l'étude du cancer se réunit à Heidelberg et à Francfort, en Allemagne, sur convocation du Comité central allemand pour l'étude du cancer. On y déclare pour la première fois le cancer comme fléau de l'humanité[258],[259].
La chirurgie et la radiothérapie n'agissent que sur des cancers localisés. Une nouvelle méthode est mise au point au début du XXe siècle pour combattre les métastases : la chimiothérapie cytotoxique. L'immunologiste August von Wassermann teste en 1911 le sélénium sur un sarcome de souris et obtient une complète rémission mais la cytotoxicité de ce traitement se révèle trop forte[260]. Les travaux des pharmacologues Louis S. Goodman (en) et Alfred Zack Gilman (en) sur les effets cytotoxiques du gaz moutarde conduisent à la mise sur le marché du Mustargen, premier chimiothérapique anticancéreux commercialisé dans l'histoire médicale[261]. En montrant en 1948 que des enfants leucémiques bénéficient de rémissions relativement longues à la suite de l'utilisation de l'aminoptérine, le pédiatre Sidney Farber est considéré comme le « père de la chimiothérapie anticancéreuse »[262]. Dans les années 1950, les médecins Emil Frei (en), Emil J. Freireich (en) et James F. Holland (en) proposent de ne plus employer seul un médicament (monothérapie induisant souvent des phénomènes de résistance) mais de l'associer à d'autres médicaments (chimiothérapie combinée appelée polychimiothérapie)[263].
Depuis les années 1980 se développent d'autres traitements conventionnels généraux de chimiothérapie adjuvante, notamment l'hormonothérapie additive et l'immunothérapie[264].
Chez les animaux

Les cancers sont présents chez presque tous les animaux, sauvages comme domestiques. Seules quelques espèces semblent épargnées, requins et rats-taupes nus notamment. On pourrait s'attendre à ce que le risque de cancer augmente avec le nombre de cellules de l'organisme : cette corrélation est bien vérifiée au sein d'une même espèce (petits chiens vs grands chiens, par exemple), mais pas du tout d'une espèce à l'autre (paradoxe de Peto). Les mécanismes développés par les espèces immunes et par les espèces de grande taille (éléphants et baleines, notamment) pour restreindre l'incidence des cancers sont étudiés per se, et aussi dans l'optique de thérapies futures[265].
Les animaux domestiques, dont les chiens et les chats[266], sont fréquemment victimes de cancers semblables à ceux des humains[266] (en particulier : ostéosarcomes, cancer des mamelles, mélanomes buccaux, carcinomes épidermoïdes, tumeurs nasales, carcinome du poumon, sarcomes des tissus mous, et tumeurs malignes non hodgkiniennes, etc.[266]). Ces cancers semblent également de plus en plus fréquents ; c'est même la 1re cause de mortalité des chiens dans le monde[267] (chiens dont l'espérance de vie est en moyenne de 11 ans et trois mois[267]). 27 % des chiens meurent d'un cancer, alors que 18 % meurent d'une affection cardiaque, sachant aussi que les maladies dominantes des chiens adultes sont infectieuses bactériennes, virales ou parasitaires, et que 50 % des chiens seraient obèses (facteurs qui peuvent contribuer à augmenter le risque de certains cancers).
Une médication et des moyens spécifiques (incluant chimiothérapie et radiothérapie) ont été développés pour les animaux, sur la base des mêmes molécules et moyens.
Les animaux de laboratoires sont utilisés comme modèle en cancérologie humaine, y compris en épidémiologie[268] ou pour tester de manière statistiquement significative des médicaments à grande échelle[269].
Le , un cas de cancer osseux chez un dinosaure a été confirmé par une équipe canadienne chez un Centrosaurus apertus adulte mort il y a plus de 75 millions d'années[270].
Prion cellulaire
Le prion cellulaire PrPC, (à distinguer de la forme pathogène PrPSc), naturellement présent dans le corps humain dès l'embryogenèse, est impliqué dans divers aspects de la biologie du cancer. Sa surexpression pourrait favoriser la prolifération des cellules cancéreuses selon différents mécanismes dans les cancers de l'estomac, du pancréas, du colon, du sein et du poumon, y compris dans les métastases, et entrainer une résistance aux médicaments en inhibant l'apoptose et l'autophagie des cellules cancéreuses. Sa régulation a donc été proposée comme cible thérapeutique[271],[272],[273],[274],[275],[276],[277],[278].
Découvertes récentes en cancérologie
Les métastases du cancer maternel dans le placenta et chez le fœtus existent[279], mais sont si rares, qu'elles laissent penser qu'il existe des mécanismes de protection biologiques pour l'unité placentofetale, peut être liées à des réponses circulatoires ou immunologiques[280] ou à une propriété trophoblastique intrinsèque dont la compréhension pourrait éclairer le mécanisme des métastases pour mieux les traiter[281].
Des découvertes concernant les cellules souches pourraient faire mieux comprendre la cancérogenèse. Jusqu'à récemment, un unique modèle « stochastique » était proposé pour l'expliquer, en faisant l'hypothèse que toute cellule capable de se diviser peut voir son information génétique perturbée (via les mutations dans l'ADN) et acquérir ainsi des caractéristiques tumorales lui conférant un pouvoir cancérogène[282]. Plus spécifiquement, ce modèle suppose que n'importe quelle cellule capable de se diviser peut être à l'origine d'un cancer, les cancers ne touchant pas les cellules incapables de se diviser comme les neurones.
Un deuxième modèle se base sur le fait que ce sont les cellules souches qui acquièrent des caractéristiques tumorales, et qui donc donnent sans cesse des cellules cancéreuses différenciées[283]. Dans ce modèle, les cellules souches sont placées en tête dans la hiérarchie de la formation de tout cancer. Pour certaines leucémies (cancers du sang), ce sont les cellules souches hématopoïétiques par exemple qui deviennent anormales et qui prolifèrent en trop grand nombre, donnant des cellules différenciées anormales et trop nombreuses. Une autre tentative d'explication a été fournie, qui suppose qu'une cellule déjà différenciée peut se dédifférencier de façon anormale, revenir au stade de cellule souche et commencer à proliférer comme décrit ci-dessus, pour redonner des cellules différenciées anormales et en grand nombre. Des cellules souches existant dans tous les tissus renouvelables, cette théorie n'est donc pas valable seulement pour les leucémies, mais aussi pour d'autres types de cancers concernant des tissus renouvelables. Cette nouvelle théorie est appuyée par l'observation de certaines tumeurs dites « hétérogènes » (hétérogénéité tumorale), qui possèdent à la fois des cellules assez différenciées et ces cellules indifférenciées que sont les cellules souches cancéreuses (CSC). Il y a donc un gradient de différenciation observé[284].
Toutefois, il se pourrait que certains cancers aient pour origine une seule de ces deux explications (« modèle stochastique » ou « modèle des cellules souches ») ou bien les deux, la formation d'un cancer ne serait également pas identique à celle d'un autre cancer, ce qui rend les recherches difficiles.
Une autre étude récente prouvant que les lymphocytes T régulateurs empêchent les réponses cytotoxiques lorsqu'un nouveau cancer se forme, une piste pourrait être de diminuer l'action de ces lymphocytes T régulateurs, sans pour autant susciter des réactions auto-immunes[285].
La concentration en lymphocytes T à mémoire serait modulée par l'équilibre entre les différents types d'interleukines : Interleukine 15, Interleukine 7 et Interleukine 2[286]. L'immunothérapie, basée sur l'immunologie des tumeurs, est perçue par certains comme une voie très prometteuse[287],[288].
D'autres voies s'ouvrent, toujours au stade de la recherche fondamentale, notamment l'oncologie physique, qui permet de mesurer les paramètres mécaniques qui régissent les rapports entre la matrice extracellulaire, le tissu cancéreux et les tissus normaux[289],[290].
En sciences humaines et sociales, la socio-oncologie désigne un modèle innovant de recherche-action du travail social dans le domaine de la lutte contre les cancers. C'est également une discipline fondamentale des soins oncologiques de support.
Statistiques
En 2023, en France métropolitaine, plus de 433 000 nouveaux cas de cancers diagnostiqués sont extrapolés à partir des données recueillies lors des six premiers mois de l'année[291].
Bibliographie
Ouvrages généraux
- Siddhartha Mukherjee, L'Empereur de toutes les maladies : Une biographie du cancer, paru originellement en anglais, Flammarion , 2013 pour la traduction française (ISBN 978-2-0812-8544-6). Le livre a reçu en 2011 le Prix Pulitzer de l'essai.
- David Servan-Schreiber, Anticancer Prévenir et lutter grâce à nos défenses naturelles, Éditions Robert Laffont, Paris, 2007
Littérature jeunesse
L'association Sparadrap propose sur son site une liste d'ouvrages jeunesse sur un parent malade ou décédé du cancer[292].
Notes et références
- ↑ (en) Hutter CM, Mechanic LE, Chatterjee N, Kraft P, Gillanders EM; NCI Gene-Environment Think Tank, « Gene-environment interactions in cancer epidemiology: a National Cancer Institute Think Tank report », Genet Epidemiol, vol. 37, no 7, , p. 643-57. (PMID 24123198, DOI 10.1002/gepi.21756)
- ↑
- Conférence intitulée « Génome et Cancer » par Mark Lathrop, pour l'Université de tous les savoirs (vidéo de 57 minutes), .
- ↑ (en) Jennifer Couzin-Frankel, « Bad luck and cancer: A science reporter’s reflections on a controversial story », Science.org, (lire en ligne).
- ↑ (en) Anand P, Kunnumakkara AB, Sundaram C, Harikumar KB, Tharakan ST, Lai OS, Sung B, Aggarwal BB, « Cancer is a preventable disease that requires major lifestyle changes », Pharm Res, vol. 25, no 9, , p. 2097-116. (PMID 18626751, PMCID PMC2515569, DOI 10.1007/s11095-008-9661-9, lire en ligne [html]).
- ↑ (en) Schoeps A, Rudolph A, Seibold P, Dunning AM, Chang-Claude J. et al., « Identification of new genetic susceptibility loci for breast cancer through consideration of gene-environment interactions », Genet Epidemiol, vol. 38, no 1, , p. 84-93. (PMID 24248812, PMCID PMC3995140, DOI 10.1002/gepi.21771)
- ↑ (en) Tang H, Wei P, Duell EJ, Risch HA, Li D et al., « Genes-environment interactions in obesity- and diabetes-associated pancreatic cancer: a GWAS data analysis », Cancer Epidemiol Biomarkers Prev, vol. 23, no 1, , p. 98-106. (PMID 24136929, DOI 10.1158/1055-9965.EPI-13-0437-T).
- ↑ (en) Mechanic LE, Chen HS, Amos CI, Chatterjee N, Cox NJ, Divi RL, Fan R, Harris EL, Jacobs K, Kraft P, Leal SM, McAllister K, Moore JH, Paltoo DN, Province MA, Ramos EM, Ritchie MD, Roeder K, Schaid DJ, Stephens M, Thomas DC, Weinberg CR, Witte JS, Zhang S, Zöllner S, Feuer EJ, Gillanders EM, « Next generation analytic tools for large scale genetic epidemiology studies of complex diseases », Genet Epidemiol, vol. 36, , p. 22-35. (PMID 22147673, PMCID PMC3368075, DOI 10.1002/gepi.20652).
- ↑ http://www.has-sante.fr/portail/jcms/c_758598/depistage-du-cancer-de-la-prostate-de-nouveaux-eclairages-vont-contribuer-a-la-definition-de-la-politique-publique-a-mettre-en-place.
- ↑ http://www-ulpmed.u-strasbg.fr/medecine/cours_en_ligne/e_cours/cancero/module10_item138C.pdf [PDF].
- ↑ « InVS > Evolution de l'incidence et de la mortalité par cancer en France de 1978… », sur sante.fr via Wikiwix (consulté le ).
- ↑ Ralph W. Moss, Galen on Cancer: How Ancient Physicians Viewed Malignant Disease, 1989, citant Michael Shimkin, Contrary to Nature, DHEW Publication no (NIH) 79-720, Superintendent of Documents, Washington, DC, p. 35, lui-même citant Paul d'Égine, Le Livre de la chirurgie, VIIe siècle.
- ↑ Louis-Paul Fischer, Le bistouri et la plume. Les médecins écrivains, Harmattan, , p. 130.
- ↑ « CRABE : Définition de CRABE », sur cnrtl.fr (consulté le ).
- 1 2 (en) Douglas Hanahan et Robert A. Weinberg, « The hallmarks of cancer », Cell, vol. 100, , p. 57-70 (PMID 10647931).
- ↑ (en) Douglas Hanahan et Robert A. Weinberg, « Hallmarks of cancer: the next generation », Cell, vol. 144, no 5, , p. 646-674 (PMID 21376230, DOI 10.1016/j.cell.2011.02.013)
- ↑ Anton Vos, « Comment le cancer se développe », Le Temps, , p. 14.
- ↑ Bulletin de veille scientifique Santé / Environnement / Travail, no 13, ANSES (2011).
- ↑ « Dedifferentiation and reprogramming: origins of cancer stem cells »(en).
- ↑ Vincent Bours, CHU de Liège, « Le cancer : Qu’est-ce que c’est ? Pourquoi tue-t-il », , lire en ligne, consulté le
- ↑ (en) « Dedifferentiation of cancer cells following recovery from a potentially lethal damage is mediated by H2S-Nampt ».
- ↑ (en) T. Aschacher, B. Wolf, F. Enzmann et P. Kienzl, « LINE-1 induces hTERT and ensures telomere maintenance in tumour cell lines », Oncogene, vol. 35, no 1, , p. 94–104 (ISSN 0950-9232, DOI 10.1038/onc.2015.65, lire en ligne, consulté le ).
- ↑ Hastie ND, Dempster M, Dunlop MG, Thompson AM, Green DK, Allshire RC, [ « Telomere reduction in human colorectal carcinoma and with ageing »], Nature, vol. 346, p. 866-868 (1990).
- ↑ Laurent Jullien(2011), Télomères et Cancer, Éditions Universitaires Européennes novembre
- ↑ (résumé par I Pennisi (Science News), intitulé "Is cancer a breakdown of multicellularity ?" ; Science, 29 Jun 2018 : vol. 360, Issue 6396, p. 1391 DOI: 10.1126/science.360.6396.1391).
- ↑ (en) Cristian Tomasetti et Bert Vogelstein, « Variation in cancer risk among tissues can be explained by the number of stem cell divisions », Science, vol. 347, , p. 78-81 (ISSN 0036-8075 et 1095-9203, PMID 25554788, PMCID 4446723, DOI 10.1126/science.1260825).
- ↑ (en) « Bad Luck of Random Mutations Plays Predominant Role in Cancer, Study Shows - 01/01/2015 », sur hopkinsmedicine.org (consulté le ).
- ↑ (en) Cristian Tomasetti, Lu Li et Bert Vogelstein, « Stem cell divisions, somatic mutations, cancer etiology, and cancer prevention », Science, vol. 355, no 6331, , p. 1330–1334 (ISSN 0036-8075 et 1095-9203, PMID 28336671, DOI 10.1126/science.aaf9011, lire en ligne, consulté le ).
- ↑ Les deux tiers des cancers dus à des "mutations génétiques aléatoires" ? La Nouvelle République.fr
- ↑ Stéphanie Chevrel, « Cancer et hasard. Une dérive médiatique passée au crible », Les Tribunes de la santé, vol. n° 53, no 4, , p. 103 (ISSN 1765-8888 et 2105-2182, DOI 10.3917/seve.053.0103, lire en ligne, consulté le )
- ↑ « Cancer », sur www.who.int (consulté le )
- ↑ en particulier si la mère, une sœur ou une fille a été diagnostiquée avant la ménopause ou s'il y a présence de mutations héréditaires de certains gènes tels BRCA1 ou BRCA2.
- ↑ Rapport 2007 de l'Académie nationale de Médecine sur les causes du cancer.
- ↑ Institut National Du Cancer, « Le tabac, premier facteur de risque évitable de cancers - Tabac | Institut National Du Cancer », sur e-cancer.fr (consulté le ).
- ↑ INVS, « Evolution de l'incidence et de la mortalité par cancer en France entre 1980 et 2012 / 2013 / Communiqués de presse / Espace presse / Accueil », sur invs.sante.fr (consulté le ).
- 1 2 3 Conclusions du Centre international de recherche sur le cancer (CIRC).
- ↑ (fr) http://www.e-cancer.fr/Comprendre-prevenir-depister/Reduire-les-risques-de-cancer/Alcool Page Alcool" de l'Institut National Du Cancer].
- ↑ Institut National du Cancer, page alcool.
- ↑ Les cancers en France, édition 2014. Collection. État des lieux et des connaissances, ouvrage collectif édité par l’INCa, Boulogne Billancourt. .
- ↑ Jules Bonnard, « L'alcool, deuxième cause de mortalité évitable en France », Le Monde.fr, (lire en ligne).
- ↑ Observatoire des cancers, La situation du cancer en France en 2011, .
- ↑ Ligue Contre le Cancer, Les cancers du côlonet du rectum (lire en ligne).
- ↑ (en) Gary Gardner and Brian Halweil, Underfed and Overfed: The Global Epidemic of Malnutrition Worldwatch Institute, March 1, 2000, 68 pages, (ISBN 1-878071-52-1).
- ↑ « Toxigenic fungi and mycotoxins », British Medical Bulletin, vol. 56, no 1, , p. 184-192 (lire en ligne)[PDF]
- ↑ (fr) Cancer et alimentation, Cancer Environnement.
- ↑ (en) « Role of Diet in Prostate Cancer Development and Progression »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ), Journal of Clinical Oncology, vol. 23, no 32, : p. 8152-8160.
- ↑ (en) Milk, milk products and lactose intake and ovarian cancer risk: A meta-analysis of epidemiological studies, International Journal of Cancer, vol. 118, issue 2, p. 431-441.
- ↑ Robin A. Ralston, Helen Truby, Claire E. Palermo et Karen Z. Walker, « Colorectal cancer and nonfermented milk, solid cheese, and fermented milk consumption: a systematic review and meta-analysis of prospective studies », Critical Reviews in Food Science and Nutrition, vol. 54, , p. 1167-1179 (ISSN 1549-7852, PMID 24499149, DOI 10.1080/10408398.2011.629353, lire en ligne).
- ↑ (en) Azeem et al., « Diet and Colorectal Cancer Risk in Asia - a Systematic Review. », Asian Pacific Journal of Cancer Prevention, (DOI 10.7314/APJCP.2015.16.13.5389, résumé, lire en ligne).
- ↑ Adventist Health Study-1 | Cancer Findings: Some Highlights.
- ↑ (en) Elizabeth A. Spencer, Timothy J. Key, Paul N. Appleby et Christina C. Dahm, « Meat, poultry and fish and risk of colorectal cancer: pooled analysis of data from the UK dietary cohort consortium », Cancer Causes & Control, vol. 21, , p. 1417-1425 (ISSN 0957-5243 et 1573-7225, DOI 10.1007/s10552-010-9569-7, lire en ligne).
- ↑ (en) Dominik D. Alexander, Douglas L. Weed, Colleen A. Cushing et Kimberly A. Lowe, « Meta-analysis of prospective studies of red meat consumption and colorectal cancer », European journal of cancer prevention: the official journal of the European Cancer Prevention Organisation (ECP), vol. 20, , p. 293-307 (ISSN 1473-5709, PMID 21540747, DOI 10.1097/CEJ.0b013e328345f985, lire en ligne).
- ↑ (en) Marije Oostindjer, Jan Alexander, Gro V. Amdam et Grethe Andersen, « The role of red and processed meat in colorectal cancer development: a perspective », Meat Science, vol. 97, (DOI 10.1016/j.meatsci.2014.02.011, lire en ligne).
- ↑ (en) Dominik D. Alexander, Douglas L. Weed, Paula E. Miller et Muhima A. Mohamed, « Red Meat and Colorectal Cancer: A Quantitative Update on the State of the Epidemiologic Science », Journal of the American College of Nutrition, , p. 1-23 (ISSN 1541-1087, PMID 25941850, DOI 10.1080/07315724.2014.992553, lire en ligne).
- ↑ IARC Monographs evaluate consumption of red meat and processed meat.
- ↑ Raphaëlle L. Santarelli, Fabrice Pierre et Denis E. Corpet, « Processed Meat and Colorectal Cancer: A Review of Epidemiologic and Experimental Evidence », Nutrition and Cancer, vol. 60, , p. 131-144 (ISSN 0163-5581, PMID 18444144, PMCID 2661797, DOI 10.1080/01635580701684872, lire en ligne).
- ↑ (en) Eduardo De Stefani, Paolo Boffetta, Alvaro Luis Ronco et Hugo Deneo-Pellegrini, « Processed meat consumption and squamous cell carcinoma of the oesophagus in a large case-control study in Uruguay », Asian Pacific journal of cancer prevention: APJCP, vol. 15, , p. 5829-5833 (ISSN 1513-7368, PMID 25081709, lire en ligne).
- ↑ (en) Susanna C. Larsson, Nicola Orsini et Alicja Wolk, « Processed meat consumption and stomach cancer risk: a meta-analysis », Journal of the National Cancer Institute, vol. 98, , p. 1078-1087 (ISSN 1460-2105, PMID 16882945, DOI 10.1093/jnci/djj301, lire en ligne).
- ↑ (en) Eugene J. Mitacek, Klaus D. Brunnemann, Maitree Suttajit et Lee S. Caplan, « Geographic Distribution of Liver and Stomach Cancers in Thailand in Relation to Estimated Dietary Intake of Nitrate, Nitrite, and Nitrosodimethylamine », Nutrition and Cancer, vol. 60, , p. 196-203 (ISSN 0163-5581, PMID 18444151, DOI 10.1080/01635580701649636, lire en ligne).
- ↑ (en) Michael E. Davis, Michal P. Lisowyj, Lin Zhou et James L. Wisecarver, « Induction of Colonic Aberrant Crypts in Mice by Feeding Apparent N-Nitroso Compounds Derived From Hot Dogs », Nutrition and Cancer, vol. 64, , p. 342-349 (ISSN 0163-5581, PMID 22293095, PMCID 3733137, DOI 10.1080/01635581.2012.650777, lire en ligne).
- ↑ (en) Susanna C. Larsson, Leif Bergkvist et Alicja Wolk, « Processed meat consumption, dietary nitrosamines and stomach cancer risk in a cohort of Swedish women », International Journal of Cancer. Journal International Du Cancer, vol. 119, , p. 915-919 (ISSN 0020-7136, PMID 16550597, DOI 10.1002/ijc.21925, lire en ligne).
- ↑ (en) Yun Zhu, Peizhon Peter Wang, Jing Zhao et Roger Green, « Dietary N-nitroso compounds and risk of colorectal cancer: a case-control study in Newfoundland and Labrador and Ontario, Canada », The British Journal of Nutrition, vol. 111, , p. 1109-1117 (ISSN 1475-2662, PMID 24160559, PMCID 4339287, DOI 10.1017/S0007114513003462, lire en ligne).
- ↑ (en) Marco Iammarino et Aurelia Di Taranto, « Nitrite and nitrate in fresh meats: a contribution to the estimation of admissible maximum limits to introduce in directive 95/2/EC », International Journal of Food Science & Technology, vol. 47, , p. 1852-1858 (ISSN 1365-2621, DOI 10.1111/j.1365-2621.2012.03041.x, lire en ligne).
- ↑ http://www.ineris.fr/substances/fr/substance/getDocument/9578
- ↑ (en) W. Lijinsky, « N-Nitroso compounds in the diet », Mutation Research, vol. 443, , p. 129-138 (ISSN 0027-5107, PMID 10415436, lire en ligne).
- ↑ Johanna E. Torfadottir, Unnur A. Valdimarsdottir, Lorelei A. Mucci et al., « Consumption of Fish Products across the Lifespan and Prostate Cancer Risk », PLOS ONE, (lire en ligne).
- ↑ (en) Ling Xu, Yong-Hua Qu, Xin-Di Chu et Renwei Wang, « Urinary Levels of N-Nitroso Compounds in Relation to Risk of Gastric Cancer: Findings from the Shanghai Cohort Study », PLoS ONE, vol. 10, , e0117326 (PMID 25658333, PMCID 4319940, DOI 10.1371/journal.pone.0117326, lire en ligne).
- ↑ (en) Jian-Song Ren, Farin Kamangar, David Forman et Farhad Islami, « Pickled Food and Risk of Gastric Cancer—a Systematic Review and Meta-analysis of English and Chinese Literature », Cancer Epidemiology Biomarkers & Prevention, vol. 21, , p. 905-915 (ISSN 1055-9965 et 1538-7755, PMID 22499775, DOI 10.1158/1055-9965.EPI-12-0202, lire en ligne).
- ↑ (en) C. Ji et M. Li, « [Studies of pickled vegetables and cause of esophageal cancer in Linxian. II. Determination of nitrosamines and their precursors] », Zhongguo Yi Xue Ke Xue Yuan Xue Bao. Acta Academiae Medicinae Sinicae, vol. 13, , p. 230-232 (ISSN 1000-503X, PMID 1831733, lire en ligne).
- ↑ (en) Ute Nöthlings, Lynne R. Wilkens, Suzanne P. Murphy et al., « Meat and Fat Intake as Risk Factors for Pancreatic Cancer: The Multiethnic Cohort Study », Journal of the National Cancer Institute, (lire en ligne)[PDF]
- ↑ (en) Giuseppe Lippi et Camilla Mattiuzzi, « Fried food and prostate cancer risk: systematic review and meta-analysis », International Journal of Food Sciences and Nutrition, vol. 66, , p. 587-589 (ISSN 0963-7486, DOI 10.3109/09637486.2015.1056111, lire en ligne).
- ↑ (en) Amit D. Joshi, Andre Kim, Juan Pablo Lewinger et Cornelia M. Ulrich, « Meat intake, cooking methods, dietary carcinogens, and colorectal cancer risk: findings from the Colorectal Cancer Family Registry », Cancer Medicine, vol. 4, (PMID 25846122, PMCID 4472216, DOI 10.1002/cam4.461, lire en ligne, consulté le ).
- ↑ (en) A. Olsen, J. Christensen, M. Outzen, P. Thonning Olesen, H. Frandsen, K. Overvad et J. Halkjæra, « Pre-diagnostic acrylamide exposure and survival after breast cancer among postmenopausal Danish women », Toxicology, (résumé).
- ↑ (en) S Robbana-Barnat, M Rabache, E Rialland et J Fradin, « Heterocyclic amines: occurrence and prevention in cooked food », Environ Health Perspect, (lire en ligne)
- ↑ (en) Xiao-Qin Wang, Paul D Terry et Hong Yan, « Review of salt consumption and stomach cancer risk: Epidemiological and biological evidence », World J Gastroenterol, (lire en ligne)
- ↑ (en) C Zhong, KN Li, JW Bi et BC Wang, « Sodium intake, salt taste and gastric cancer risk according to Helicobacter pylori infection, smoking, histological type and tumor site in China », Asian Pac J Cancer Prev, (lire en ligne).
- ↑ (en) Ananda P. Dasanayake, Amanda J. Silverman et Saman Warnakulasuriya, « Maté drinking and oral and oro-pharyngeal cancer: a systematic review and meta-analysis », Oral Oncology, (DOI https://dx.doi.org/10.1016/j.oraloncology.2009.07.006, lire en ligne).
- ↑ Areca (Betel) Nut Consumption: An Underappreciated Cause of Cancer
- ↑ (en) WC Willett, MJ Stampfer, GA Colditz, BA Rosner et FE Speizer, « Relation of meat, fat, and fiber intake to the risk of colon cancer in a prospective study among women », N Engl J Med, (PMID 2172820, DOI 10.1056/NEJM199012133232404).
- ↑ (en) BS Reddy, « Dietary fat and colon cancer: animal model studies », Lipids, (PMID 1435100, lire en ligne).
- ↑ (en) CV Rao, Y Hirose, C Indranie et BS Reddy, « Modulation of experimental colon tumorigenesis by types and amounts of dietary fatty acids », Cancer Res, (PMID 11280748, lire en ligne).
- ↑ (en) DD Alexander, CA Cushing, KA Lowe, B Sceurman et MA Roberts, « Meta-analysis of animal fat or animal protein intake and colorectal cancer », Am J Clin Nutr, (PMID 19261724, DOI 10.3945/ajcn.2008.26838).
- ↑ Phenylhydrazines in the Cultivated Mushroom (Agaricus bisporus)
- ↑ WHO: EXPOSURE TO CADMIUM: A MAJOR PUBLIC HEALTH CONCERN.
- ↑ Dietary Cadmium Intake and the Risk of Cancer: A Meta-Analysis
- ↑ American Cancer Society: Arsenic.
- ↑ WHO: Dioxins and their effects on human health
- ↑ (en) Boffetta P, Couto E, Wichmann J et al. « Fruit and vegetable intake and overall cancer risk in the European Prospective Investigation Into Cancer and Nutrition (EPIC) » JNCI 2010.
- ↑ Adventist Health Study-1 - Cancer Findings: Some Highlights.
- ↑ (en) Federica Turati, Marta Rossi, Claudio Pelucchi et Fabio Levi, « Fruit and vegetables and cancer risk: a review of southern European studies », The British Journal of Nutrition, vol. 113 Suppl 2, , S102-110 (ISSN 1475-2662, PMID 26148912, DOI 10.1017/S0007114515000148, lire en ligne, consulté le ).
- ↑ (en) Richard Reiss, Jason Johnston, Kevin Tucker et John M. DeSesso, « Estimation of cancer risks and benefits associated with a potential increased consumption of fruits and vegetables », Food and Chemical Toxicology, vol. 50, (DOI 10.1016/j.fct.2012.08.055, lire en ligne, consulté le ).
- ↑ (en) Shaowei Wu, Eunyoung Cho, Diane Feskanich et Wen-Qing Li, « Citrus Consumption and Risk of Basal Cell Carcinoma and Squamous Cell Carcinoma of the Skin », Carcinogenesis, (ISSN 1460-2180, PMID 26224304, DOI 10.1093/carcin/bgv109, lire en ligne, consulté le )
- ↑ Cruciferous Vegetables and Cancer Prevention
- ↑ Garlic and Cancer Prevention.
- ↑ An Update on the Health Effects of Tomato Lycopene
- ↑ Olive oil intake is inversely related to cancer prevalence: a systematic review and a meta-analysis
- ↑ Site du PNNS: 5 fruits et légumes par jour.
- ↑ How Fiber Helps Protect Against Cancer.
- ↑ (en) Andrew T. Kunzmann, Helen G. Coleman, Wen-Yi Huang et Cari M. Kitahara, « Dietary fiber intake and risk of colorectal cancer and incident and recurrent adenoma in the Prostate, Lung, Colorectal, and Ovarian Cancer Screening Trial », The American Journal of Clinical Nutrition, (ISSN 1938-3207, PMID 26269366, DOI 10.3945/ajcn.115.113282, lire en ligne)
- ↑ (en) D. Aune, D.S.M. Chan, R. Lau, R. Vieira, D.C. Greenwood, E. Kampman et T. Norat, « Dietary fibre, whole grains, and risk of colorectal cancer: systematic review and dose-response meta-analysis of prospective studies », BMJ, (lire en ligne).
- 1 2 (en) Mengmeng Lv, Xingya Zhu, Hao Wang et Feng Wang, « Roles of Caloric Restriction, Ketogenic Diet and Intermittent Fasting during Initiation, Progression and Metastasis of Cancer in Animal Models: A Systematic Review and Meta-Analysis », PLoS ONE, vol. 9, , e115147 (PMID 25502434, PMCID 4263749, DOI 10.1371/journal.pone.0115147, lire en ligne).
- ↑ (en) Eric C. Woolf, Kara L. Curley, Qingwei Liu et Gregory H. Turner, « The Ketogenic Diet Alters the Hypoxic Response and Affects Expression of Proteins Associated with Angiogenesis, Invasive Potential and Vascular Permeability in a Mouse Glioma Model », PLoS ONE, vol. 10, , e0130357 (PMID 26083629, PMCID 4470583, DOI 10.1371/journal.pone.0130357, lire en ligne, consulté le )
- ↑ (en) Federico Bozzetti et Beth Zupec-Kania, « Toward a cancer-specific diet », Clinical Nutrition, (DOI 10.1016/j.clnu.2015.01.013, lire en ligne).
- ↑ Calorie restriction and cancer prevention.
- ↑ (en) Victor W. Ho, Melisa J. Hamilton, Ngoc-Ha Thi Dang et Brian E. Hsu, « A low carbohydrate, high protein diet combined with celecoxib markedly reduces metastasis », Carcinogenesis, vol. 35, , p. 2291-2299 (ISSN 0143-3334 et 1460-2180, PMID 25023988, PMCID 4178469, DOI 10.1093/carcin/bgu147, lire en ligne, consulté le ).
- ↑ (en) Erika Ax, Hans Garmo, Birgitta Grundmark et Anna Bill-Axelson, « Dietary Patterns and Prostate Cancer Risk: Report from the Population Based ULSAM Cohort Study of Swedish Men », Nutrition and Cancer, vol. 66, , p. 77-87 (ISSN 0163-5581, PMID 24325263, DOI 10.1080/01635581.2014.851712, lire en ligne, consulté le ).
- ↑ (en) Edward L. LaGory et Amato J. Giaccia, « A low-carb diet kills tumor cells with a mutant p53 tumor suppressor gene », Cell Cycle, vol. 12, , p. 718-719 (ISSN 1538-4101, PMID 23422857, PMCID 3610718, DOI 10.4161/cc.23948, lire en ligne, consulté le ).
- ↑ (en) L Hooper, R Thompson, R Harrison et al. « Risks and benefits of omega 3 fats for mortality, cardiovascular disease, and cancer: systematic review » BMJ 2006;332:752-60.
- ↑ (fr) Obésité et cancer, Cancer Environnement.
- ↑ Factors Contributing to Overweight and Obesity
- ↑ Sugary Drinks Linked to High Death Tolls Worldwide.
- 1 2 3 (en) American Institute for Cancer Research.
- ↑ (en) Article de l'UICC intitulé « Obesity Causes 100,000 Cancer Cases Annually ».
- 1 2 Sondage 1999-2000 National Health and Nutrition Examination Survey
- ↑ Association américaine pour l'avancement des sciences, .
- ↑ étude du uicc (international union against cancer).
- ↑ (en) UICC World Cancer Campaign lancée le .
- ↑ Étude américaine ayant porté sur 841 victimes d'un cancer du pancréas et 754 personnes-témoins n'en ayant pas, citée dans le New York Times et citée par l'UICC.
- ↑ Prévention des cancers : le rôle de l'activité physique.
- ↑ Physical Activity and Cancer Risk.
- ↑ (en) Kaushal Raj Pandey, « Occupational cancer kills more than 200 000 people a year », BMJ, vol. 334, , p. 925 (PMCID PMC1865426, DOI 10.1136/bmj.39202.548588.DB).
- ↑ Liste du Centre international de recherche sur le cancer (CIRC), ref à retrouver
- ↑ Health Effects of Mycotoxins in Indoor Air: A Critical Review.
- ↑ « Pesticides et santé – Nouvelles données (2021) ⋅ Inserm, La science pour la santé », sur Inserm (consulté le )
- ↑ (en) Ki-Hyun Kim, Ehsanul Kabir et Shamin Ara Jahan, « Exposure to pesticides and the associated human health effects », Science of The Total Environment, vol. 575, , p. 525–535 (DOI 10.1016/j.scitotenv.2016.09.009, lire en ligne, consulté le )
- ↑ Cancers and agriculture in France.
- ↑ « Cancer et travail : les facteurs de risque professionnels », sur inserm.fr (consulté le ).
- ↑ SPF, « Nombre et fractions de cancers attribuables au mode de vie et à l'environnement en France métropolitaine en 2015 : résultats principaux », sur www.santepubliquefrance.fr (consulté le )
- ↑ Emmanuel Henry, La fabrique des non-problèmes, Les Presses de Sciences-Po, , p. 82-85
- ↑ (en) Richard P. Holm, « Skin cancer prevention and screening », South Dakota Medicine: The Journal of the South Dakota State Medical Association, vol. Spec No, , p. 75-77, 79-81 (ISSN 0038-3317, PMID 25985614, lire en ligne, consulté le ).
- ↑ Page intitulée Papillomavirus et cancer du col de l'utérus (Institut Pasteur).
- ↑ (en) A. C. Gore, V. A. Chappell, S. E. Fenton et J. A. Flaws, « EDC-2: The Endocrine Society's Second Scientific Statement on Endocrine-Disrupting Chemicals », Endocrine Reviews, vol. 36, no 6, , E1–E150 (ISSN 0163-769X et 1945-7189, PMID 26544531, PMCID PMC4702494, DOI 10.1210/er.2015-1010, lire en ligne, consulté le )
- ↑ Artificial lighting in the industrialized world: circadian disruption and breast cancer
- ↑ Night shift work and cancer risk: a literature review.
- ↑ « Le radon », sur irsn.fr (consulté le ).
- ↑ Inserm, « Radioactivité : faibles doses, fortes doses, sommes-nous tous égaux ? » (consulté le ).
- ↑ (en) Ki Moon Seong, Songwon Seo, Dalnim Lee et Min-Jeong Kim, « Is the Linear No-Threshold Dose-Response Paradigm Still Necessary for the Assessment of Health Effects of Low Dose Radiation? », Journal of Korean Medical Science, vol. 31, , S10–S23 (ISSN 1011-8934, PMID 26908982, PMCID 4756336, DOI 10.3346/jkms.2016.31.S1.S10, lire en ligne, consulté le ).
- ↑ « De faibles radiations induisent des cancers », sur sante.lefigaro.fr (consulté le ).
- 1 2 3 projet Nanogenotox, coordonnée par l'Afsset pour 3 ans, afin de donner à la Commission européenne un moyen robuste et fiable de détection du potentiel génotoxique des nanomatériaux susceptibles d'engendrer un risque de cancer ou de toxicité pour la reproduction chez l'homme.
- ↑ « Ce que vous devez savoir sur le virus du papillome humain (VPH) », sur catie.ca (consulté le )
- ↑ « OIV, numéro 62, 2001. »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- ↑ information hospitalière, 2004..
- ↑ (en) Aaron T Fleischauer, Charles Poole and Lenore Arab. « Garlic consumption and cancer prevention: meta-analyses of colorectal and stomach cancers 1,2,3 » American Journal of Clinical Nutrition 2000;72(4):1047-52.
- ↑ Le dépistage du cancer du sein : l’obstacle des faux positifs ne doit pas faire oublier son intérêt, Inserm, 1999.
- ↑ « Ensemble, améliorons le dépistage du cancer du sein - Rapport du Comité d'orientation », sur concertation-depistage.fr, .
- ↑ Tristan Vey, « Des cellules annonciatrices du cancer détectées dans le sang », Le Figaro.fr, (lire en ligne)
- ↑ (en) M Ilie, V Hofman, E Long-Mira, E Selva, J-M Vignaud et al., « “Sentinel” Circulating Tumor Cells Allow Early Diagnosis of Lung Cancer in Patients with Chronic Obstructive Pulmonary Disease », PLoS ONE, (DOI 10.1371/journal.pone.0111597, lire en ligne).
- ↑ « Cancer : un diagnostic à la cellule près », sur francetvinfo.fr, (consulté le ).
- ↑ (en) Henrik Toft Sørensen, Lene Mellemkjær, Mette Vinther Skriver, Søren P Johnsen, Bente Nørgård, Jørgen H Olsen, John A Baron. « Fever of unknown origin and cancer: a population-based study » Lancet Oncol. 2005; 6:851–5. En ligne le , DOI:10.1016/S1470-2045(05) 70346-6.
- ↑ (en) Anuj Kumar, Ashish Kumar Jha, Jai Prakash Agarwal et Manender Yadav, « Machine-Learning-Based Radiomics for Classifying Glioma Grade from Magnetic Resonance Images of the Brain », Journal of Personalized Medicine, vol. 13, no 6, , p. 920 (ISSN 2075-4426, DOI 10.3390/jpm13060920, lire en ligne, consulté le )
- ↑ Maged Nasser et Umi Kalsom Yusof, « Deep Learning Based Methods for Breast Cancer Diagnosis: A Systematic Review and Future Direction », Diagnostics, vol. 13, no 1, , p. 161 (ISSN 2075-4418, PMID 36611453, PMCID 9818155, DOI 10.3390/diagnostics13010161, lire en ligne, consulté le )
- ↑ Lulu Wang, « Deep Learning Techniques to Diagnose Lung Cancer », Cancers, vol. 14, no 22, , p. 5569 (ISSN 2072-6694, PMID 36428662, PMCID 9688236, DOI 10.3390/cancers14225569, lire en ligne, consulté le )
- 1 2 3 4 (en) Adam Piore, « The unfinished business of immunotherapy », MIT Technology Review, (lire en ligne, consulté le ).
- ↑ (en) Emily Mullin, « A pioneering gene therapy for leukemia has arrived in the U.S. », MIT Technology Review, (lire en ligne, consulté le ).
- ↑ « Cancer : la grande victoire de l'immunothérapie », sur lesechos.fr (consulté le ).
- ↑ (en) Jill E. Kucab, Xueqing Zou, Sandro Morganella, Madeleine Joel, A. Scott Nanda, Eszter Nagy, Celine Gomez, Andrea Degasperi, Rebecca Harris, Stephen P. Jackson, Volker M. Arlt, David H. Phillips et Serena Nik-Zainal, « A Compendium of Mutational Signatures of Environmental Agents », Cell, Elsevier BV, (ISSN 0092-8674, DOI 10.1016/j.cell.2019.03.001, lire en ligne).
- ↑ (en) « 10 Ways the World Got Better In 2022 », sur Time, (consulté le )
- ↑ Nature Medicine, 27 avril 2009.
- ↑ France 2, « Info france 2. cancer : 812 hôpitaux et cliniques ont opéré sans autorisation en france en 2018 », sur francetvinfo.fr, (consulté le ).
- ↑ Cash Investigation. 33 hôpitaux et cliniques bretons ont opéré des cancers en 2018 sans autorisation.
- ↑ Opérations de cancers : les hôpitaux et cliniques de votre région respectent-ils les seuils d'activités légaux ?
- ↑ Institut National Du Cancer, « Médecine de précision : thérapies ciblées et immunothérapie spécifique - Thérapies ciblées et immunothérapie spécifique | Institut National Du Cancer », sur www.e-cancer.fr (consulté le ).
- ↑ The Promise of Molecular Profiling for Cancer Identification and Treatment, Clinical Medicine & Research Volume 2, Number 3: 147-150.
- ↑ (en) Monika Joshi, Sumanta K Pal et Joseph J Drabick, « Novel Approaches in Cancer Immunotherapy — A Light at the End of the Tunnel », Discovery Medicine, vol. 21, no 118, (lire en ligne, consulté le ).
- ↑ (en) Olivia Wilkins, Allison M. Keeler et Terence R. Flotte, « CAR T-Cell Therapy: Progress and Prospects », Human Gene Therapy Methods, vol. 28, no 2, , p. 61–66 (ISSN 1946-6536, DOI 10.1089/hgtb.2016.153, lire en ligne, consulté le ).
- ↑ "Psychomedi, 2017: L'immunothérapie Keytruda remplace la chimiothérapie pour certains cancers du poumon en France".
- ↑ "You tube: La thérapie NKR-2 de Celyad - Celyad vidéo".
- ↑ « Traitement du cancer : identification des vaisseaux sanguins qui permettent aux lymphocytes tueurs d’accéder aux tumeurs et de les détruire », sur INSERM salle de presse, (consulté le ).
- ↑ « thérapie ciblée une révolution médicale », sur ligue-cancer.net.
- ↑ Marc Pusztaszeri et al., « Thérapies ciblées du cancer pulmonaire : tests moléculaires à partir d’échantillons cytologiques », Rev Med Suisse, (ttps://www.revmed.ch/RMS/2011/RMS-303/Therapies-ciblees-du-cancer-pulmonaire-tests-moleculaires-a-partir-d-echantillons-cytologiques).
- ↑ « Traitements du cancer - Les thérapies ciblées », sur Journal des Femmes Santé (consulté le ).
- 1 2 3 4 5 6 Complementary and Alternative Methods for Cancer Management, American Cancer Society.
- ↑ (en) Block KI. Koch Amanda, Mead MN. « Impact of antioxidant supplementation on chemotherapeutic efficacy: A systematic review of the evidence from randomized controlled trials » Cancer Treatment Reviews 2007;33:407-18.
- ↑ (en) Bjelakovic G, Nikolova D, Gluud LL, Simonetti RG, Gluud C. « Antioxidant supplements for prevention of mortality in healthy participants and patients with various diseases » Cochrane Database of Systematic Reviews 2008;2 DOI 10.1002/14651858.CD007176.
- ↑ Document de la ligue contre le cancer Suisse sur les études du Dr Rath et la vitamine C.
- 1 2 Olivier Jallut, Médecines parallèles et cancers : modes d'emploi et de non-emploi, Bordeaux, L'Horizon chimérique, , 363 p. (ISBN 2-907202-35-9, OCLC 463415559).
- ↑ Le régime cétogène, article sur le site La Nutrition.
- ↑ (en) G. Edward Griffin., World Without Cancer The Story of Vitamin B17 (Laetrile). http://www.realityzone.com/worwitcan.html
- ↑ Didier Raoult, « Ce vaccin contre le cancer… qui ne sera pas commercialisé », Le Point.fr, (lire en ligne)
- ↑ (en) Sarah DeWeerdt, « Bacteriology: A caring culture », Nature, vol. 504(7480):S4-S5, (PMID 24352362, DOI 10.1038/504S4a).
- ↑ « Impact des facteurs nutritionnels pendant et après cancer - Rapport - Ref : RAPNUT20 », sur e-cancer.fr (consulté le ).
- ↑ « Alimentation et cancer : que savons-nous ? », sur futura-sciences.com (consulté le ).
- ↑ Fondation ARC pour la recherche sur le cancern INCa (2012) Situations de travail et trajectoires professionnelles des actifs atteints de cancer Collection États des lieux et des connaissances, ouvrage collectif, ; rapport de l'institut national du cancer (INCa) et la fondation Arc, présenté au colloque « cancer et travail » du .
- ↑ (en) Jimmie C. Holland, « History of Psycho-Oncology: Overcoming Attitudinal and Conceptual Barriers », Psychosomatic medicine, 64e série, , p. 206-221 (lire en ligne, consulté le ).
- 1 2 Daniel Oppenheim et Sarah Dauchy, « La psycho‐oncologie et les tâches actuelles des psycho‐oncologues », Bulletin du Cancer, vol. 91, no 1, (ISSN 0007-4551, lire en ligne, consulté le ).
- ↑ (en) Anne E. Kazak et Robert B. Noll, « The integration of psychology in pediatric oncology research and practice: collaboration to improve care and outcomes for children and families », The American Psychologist, vol. 70, no 2, , p. 146–158 (ISSN 1935-990X, PMID 25730721, DOI 10.1037/a0035695, lire en ligne, consulté le ).
- ↑ Guy Laurent, Après le cancer : Suivi et interventions, Maloine, (ISBN 9782224034887), p. 5.
- ↑ Florence Rosier, « Une nouvelle stratégie nationale pour faire reculer le cancer en France », sur lemonde.fr, (consulté le ).
- ↑ Joséphine Lebard, « Quand le cancer bouleverse la vie des jeunes adultes », sur lemonde.fr, (consulté le ).
- ↑ Laurent 2017, p. 2.
- ↑ Laurent 2017, p. 86-88.
- ↑ Laurent 2017, p. 25.
- ↑ « Breakaway: The global burden of cancer—challenges and opportunities »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) ; Rapport rédigé par des experts en santé publique, sur le coût des cancers, et publié par le Economist Intelligence Unit du Journal The Economist 2010, (PDF, en anglais, 73 pages).
- ↑ (en) P. Boyle, « The Globalisation of Cancer », Lancet, vol. 368, p. 629-630 (2006).
- 1 2 (en) Boyle P, Levin B (eds.) World Cancer Report 2008, Lyon : International Agency for Research on Cancer, 2008.
- 1 2 3 4 colloque « Cancer, quels coûts pour la société », Assemblée Nationale, 2010/10/21 (Source EHESP, 2010).
- ↑ communiqué de presse intitulé Les chiffres 2010 du cancer disponibles sur le site de l'InVS.
- ↑ Institut national du cancer, Analyse économique des coûts du cancer en France, , page 36.
- ↑ Institut national du cancer, Analyse économique des coûts du cancer en France, , p. 28.
- ↑ Health and Environment Alliance (HEAL)
- ↑ Communiqué : Le MDRGF et le réseau européen HEAL dénoncent l'absence totale de prise en compte de l'environnement dans cette épidémie et lancent une nouvelle grande campagne sur ce sujet majeur.
- ↑ « Le « droit à l’oubli » concernera cinq types de cancer et l’hépatite C », Le Monde.fr, (ISSN 1950-6244, lire en ligne).
- ↑ « WHO Disease and injury country estimates », World Health Organization, (consulté le )
- ↑ Le cancer tue chaque année 8,8 millions de personnes, 24 heures,
- ↑ Le cancer a tué 7,6 millions personnes en 2008, swissinfo.ch, .
- ↑ « Le cancer en chiffres », sur fondation-arc.org,
- ↑ Les carcinomes basocellulaires, cancers les plus bénins car non métastatiques, ne sont pas pris en compte car ils sont rarement recensés par les registres généraux.
- ↑ « Les cancers en chiffres », sur frm.org,
- ↑ « Incidence, mortalité et survie pour tous cancers et par type de cancers », L’état de santé de la population en France Rapport 2017, p. 222
- ↑ Cancer, approche méthodologique du lien avec l'environnement, Éditeur : INSERM, expertise collective 2005, 92 p. (Communiqué, consulté 2008 10 04).
- ↑ Comparaison et évolution des incidences chez l'homme et la femme (tableau Inserm, 2008).
- ↑ (en) Belot A, Grosclaude P, Bossard N, Jougla E, Benhamou E. et al. « Cancer incidence and mortality in France over the period 1980-2005 » Revue d'Épidémiologie et de Santé Publique 2008;56:159-175.
- ↑ Estimation de l'incidence et de la mortalité par cancer en France de 1980 à 2005, sur le site de l'Institut de veille sanitaire.
- ↑ source: Le téléphone sonne, émission radiophonique de France Inter, .
- ↑ étude menée par l'Institut national du cancer , rapport d' Survie attendue des patients atteints de cancers en France.
- ↑ INCa Les données sur le cancer, en ligne, consulté le
- ↑ Rapport INCa 2011 sur Les cancers en France.
- ↑ 1er rapport de « l'Observatoire sociétal des cancers »
- ↑ Observatoire sociétal des cancers (2014° Rapport 2013, .
- ↑ Site du Comité éthique et cancer.
- ↑ Portail : Cancer-info.
- ↑ Portail de la Plate forme collaborative CancerContribution.fr
- 1 2 3 Institut de veille sanitaire (2015), rapport : Estimations de l’incidence départementale des cancers en France métropolitaine 2008-2010 ; Étude à partir des données des registres des cancers du réseau Francim et des bases de données médico-administratives (résumé) ; (ISSN 1956-6964).
- ↑ « Lutte contre le cancer : "Le stress est un complice" de la maladie », sur france24.com, .
- ↑ « Cancers : leur incidence a doublé en France depuis 1990 », Le Monde.fr, (lire en ligne, consulté le )
- ↑ Incidence et mortalité projetée en 2017 des cancers (tumeurs solides) selon la classe d'âge et le sexe par localisation
- ↑ (en) M Quaresma, MP. Coleman et B. Rachet, 40-year trends in an index of survival for all cancers combined and survival adjusted for age and sex for each cancer in England and Wales, 1971-2011 : a population-based study, The Lancet, (lire en ligne [PDF]).
- ↑ (en) « Actuarial Life Table », sur www.ssa.gov (consulté le )
- ↑ Cancer (vue d'ensemble) sur passeportsante.net.
- 1 2 3 (en) Roberta De Angelis et al. « Cancer survival in Europe 1999—2007 by country and age: results of EUROCARE-5—a population-based study » The Lancet Oncology, Early Online Publication, 5 December 2013 DOI 10.1016/S1470-2045(13)70546-1 résumé.
- ↑ Éric Favereau, Belle éclaircie sur le front du cancer, Libération, .
- ↑ « Cancer : la survie s'améliore en France », Le Figaro.fr, (lire en ligne).
- 1 2 Cancers — Pronostics à long terme de l'INSERM.
- 1 2 3 (en) Steliarova-Foucher E. et al. « Geographical patterns and time trends of cancer incidence and survival among children and adolescents in Europe since the 1970s (the ACCISproject): an epidemiological study » Lancet 2004, 11, 364(9451):2097-105.
- ↑ (en) Walker KM, Carozza S, Cooper S, Elgethun K. « Childhood cancer in Texas counties with moderate to intense agricultural activity » J Agric Saf Health. 2007 Jan;13(1):9-24. (Résumé).
- ↑ « Inserm »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- ↑ (en) J L Daniels, A F Olshan et D A Savitz « Pesticides and childhood cancers » Environ Health Perspect. 1997;105(10): 1068–1077. (Texte intégral)
- 1 2 3 4 5 6 7 8 9 10 (en) Shelia Hoar Zahm et Mary H. Ward ; « Pesticides and Childhood Cancer » Environmental Health Perspectives 1998;106 Supplément 3.
- ↑ (en) Simcox NJ, Fenske RA, Wolz SA, Lee IC, Kalman DA. « Pesticides in household dust and soil: exposure pathways for children of agricultural families » Environ Health Perspect. 1995;103:1126-1134.
- ↑ (en) Physicians for Social Responsibility. Pesticides and Children: What the Pediatric Practitioner Should Know. Washington: Physicians for Social Responsibility, 1995; 1-8.
- ↑ (en) National Research Council. Pesticides in the Diet of Infants and Children. Washington:National Academy Press, 1993.
- ↑ (en) Wiles R, Davies K, Campbell C. Overexposed: Organophosphate Insecticides in Children's Food. Washington:Environmental Working Group/The Tides Center, 1998.
- ↑ Wiles R, Davies K. Pesticides in Baby Food. Washington: Environmental Working Group, 1995.
- ↑ (en) Hill RH Jr, To T, Holler JS, Fast DM, Smith SJ, Needham LL, Binder S. « Residues of chlorinated phenols and phenoxy acid herbicides in the urine of Arkansas children » Arch Environ Contam Toxicol. 1989;18:469-474.
- ↑ (en) Leiss JK, Savitz DA. « Home pesticide use and childhood cancer: a case-control study » Am J Public Health. 1995;85:249-252.
- ↑ (en) Reeves JD. « Household insecticide-associated blood dyscrasias in children » Am J Hematol Oncol. 1982;4:438-439.
- ↑ (en) Jérémie Rudant et al. « Household Exposure to Pesticides and Risk of Childhood Hematopoietic Malignancies: The ESCALE Study (SFCE) »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) Environ Health Perspect. 2007;115(12):1787-1793. [PDF] DOI 10.1289/ehp.10596.
- ↑ « Registre National des Hémopathies malignes de l'Enfant »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- ↑ « La problématique AJA atteints d'un cancer en chiffres », GO-AJA (consulté le ).
- ↑ En 2013, des archéologues retrouvent des ossements vieux de 1 200 ans av. J.C. porteurs de lésions cancéreuses. Cf. (en) Michaela Binder, Charlotte Roberts, Neal Spencer, Daniel Antoine et Caroline Cartwright, « On the Antiquity of Cancer: Evidence for Metastatic Carcinoma in a Young Man from Ancient Nubia (c. 1200BC) », PLOS ONE, vol. 9, no 3, (DOI 10.1371/journal.pone.0090924)
- ↑ Maryse Delehedde, Que sait-on du cancer ?, EDP Sciences, , p. 12.
- ↑ Le cas numéro 45 traite notamment des tumeurs saillantes du sein, et donne un pronostic défavorable.
- ↑ Valérie Delavigne, Les cancers, Springer Science & Business Media, , p. 70.
- ↑ (en) John Laszlo, Understanding Cancer, Harper & Row, , p. 80.
- ↑ Jean-Charles Sournia Jacques Le Goff, Les maladies ont une histoire, Seuil, , p. 75.
- ↑ R. Virchow, La pathologie cellulaire basée sur l'étude pathologique et physiologique des tissus, J.-B. Baillière et fils, , p. 23—24.
- ↑ Patrice Pinell, Naissance d'un fléau : histoire de la lutte contre le cancer en France (1890-1940), Métailié, , p. 43.
- ↑ Jacques Rouesse, Une histoire du cancer du sein en Occident, Springer Science & Business Media, , p. 118.
- ↑ Anne Prigent, « Marie Curie à l'origine de la radiothérapie », Le Figaro.fr, (lire en ligne)
- ↑ http://www.lequotidiendumedecin.fr/1906-declaration-de-guerre-mondiale-contre-le-cancer.
- ↑ Jacques Rouesse, Une histoire du cancer du sein en Occident, Springer Science & Business Media, , p. 150.
- ↑ David S. Fischer, John C. Marsh et Marion E. Morra, Cancer Therapy, G.K. Hall Medical Publishers, , p. 251.
- ↑ (en) Denis R. Miller, « A Tribute to Sidney Farber — the Father of Modern Chemotherapy », British Journal of Haematology, no 134, , p. 20-26.
- ↑ (en) Emil Frei et al., « A Comparative Study of Two Regimens of Combination », Blood, no 13, , p. 1126–1148.
- ↑ Jean-François Morère, Frédérique Penault-Llorca, Matti S. Aapro et Rémy Salmon, Le cancer du sein, Springer Science & Business Media, , p. 167.
- ↑ Hervé Le Guyader, « Comment l'éléphant trompe le cancer », Pour la science, no 493, , p. 92-94.
- 1 2 3 (en) E. Gregory MacEwen « Spontaneous tumors in dogs and cats: Models for the study of cancer biology and treatment » Cancer and Metastasis Reviews Volume 9, Number 2, 125-136. DOI 10.1007/BF00046339 (Résumé).
- 1 2 Article de Romandie News relatif à une étude anglaise de publiée par l'assureur animalier SantéVet.
- ↑ (en) Thrusfield M. « Companion animal epidemiology: its contribution to human medicine » Acta Vet Scand Suppl. 1988;84:57-65.
- ↑ (en) Vail DM, MacEwen EG. « Spontaneously occurring tumors of companion animals as models for human cancer » Cancer Invest. 2000;18(8):781-92. .
- ↑ (en) Seper Ekhtiari, Kentaro Chiba, Snezana Popovic et Rhianne Crowther, « First case of osteosarcoma in a dinosaur: a multimodal diagnosis », The Lancet Oncology, vol. 21, no 8, , p. 1021–1022 (ISSN 1470-2045 et 1474-5488, PMID 32758461, DOI 10.1016/S1470-2045(20)30171-6, lire en ligne, consulté le )
- ↑ (en) Gyeongyun Go et Sang Hun Lee, « The Cellular Prion Protein: A Promising Therapeutic Target for Cancer »
- ↑ Manqiu Ding, Yongqiang Chen, Yue Lang et Li Cui, « The Role of Cellular Prion Protein in Cancer Biology: A Potential Therapeutic Target », Frontiers in Oncology, vol. 11, (ISSN 2234-943X, DOI 10.3389/fonc.2021.742949/full, lire en ligne, consulté le )
- ↑ (en-US) GEN Staff Writer, « Scientists Implicate Prion Protein in Aggressive Pancreatic Cancer », sur GEN - Genetic Engineering and Biotechnology News, (consulté le )
- ↑ (en) « Prion Protein Identified As Novel Early Pancreatic Cancer Biomarker », sur ScienceDaily (consulté le )
- ↑ (en) Zhenxing Gao, Min Peng, Liang Chen et Xiaowen Yang, « Prion Protein Protects Cancer Cells against Endoplasmic Reticulum Stress Induced Apoptosis », Virologica Sinica, vol. 34, no 2, , p. 222–234 (ISSN 1995-820X, PMID 31020572, PMCID PMC6513834, DOI 10.1007/s12250-019-00107-2, lire en ligne, consulté le )
- ↑ Seunghwa Cha, Mi-Ji Sin, Mo-Jong Kim et Hee-Jun Kim, « Involvement of Cellular Prion Protein in Invasion and Metastasis of Lung Cancer by Inducing Treg Cell Development », Biomolecules, vol. 11, no 2, , p. 285 (ISSN 2218-273X, PMID 33671884, PMCID 7918983, DOI 10.3390/biom11020285, lire en ligne, consulté le )
- ↑ (en) Sophie Mouillet-Richard,Alexandre Ghazi, et Pierre Laurent-Puig, « The Cellular Prion Protein and the Hallmarks of Cancer - PMC »
- ↑ (en) Minchan Gil, Yun Kye Kim, Kyung-Eun Kim et Wook Kim, « Cellular prion protein regulates invasion and migration of breast cancer cells through MMP-9 activity », Biochemical and Biophysical Research Communications, vol. 470, no 1, , p. 213–219 (ISSN 0006-291X, DOI 10.1016/j.bbrc.2016.01.038, lire en ligne, consulté le )
- ↑ ex : Alexander, A., Samlowski, W. E., Grossman, D., Bruggers, C. S., Harris, R. M., Zone, J. J.,… & Leachman, S. A. (2003). Metastatic melanoma in pregnancy: risk of transplacental metastases in the infant. Journal of clinical oncology, 21(11), 2179-2186.
- ↑ Beer, A. E., & Billingham, R. E. (1971). Immunobiology of mammalian reproduction. Advances in immunology, 14, 1-84|résumé.
- ↑ Potter J.F & Schoeneman M (1970). Metastasis of maternal cancer to the placenta and fetus. Cancer, 25(2), 380-388.
- ↑ (en) MP Little, WF Heidenreich et G. Li, « Parameter identifiability and redundancy in a general class of stochastic carcinogenesis models », PLoS One, vol. 4, no 12, , e8520 (PMID 20046831, PMCID PMC2797326, DOI 10.1371/journal.pone.0008520, lire en ligne).
- ↑ « Cancer : Une maladie des cellules souche? », sur eurostemcell.org, (consulté le ).
- ↑ E Melo F de Sousa, I Guessous, L Vermeulen et JP. Medema, « Cellules souches cancéreuses et futures modalités thérapeutiques du cancer [Cancer stem cells and future therapeutic implications] », Revue médicale suisse, vol. 7, no 289, , p. 774-777 (PMID 21568100, lire en ligne)La théorie des cellules souches cancéreuses repose sur l'observation d'un gradient de différenciation cellulaire au sein de certaines tumeurs.
- ↑ « Communiqué de presse : « Les cellules cancéreuses protégées par notre propre système immunitaire » », sur cnrs.fr, (consulté le ).
- ↑ (en) « IL15 interleukin 15 [Homo sapiens (human)] », sur National Center for Biotechnology Information (NCBI), (consulté le ).
- ↑ « Immunothérapie contre le cancer : la révolution attendue », sur L'Institut Curie (consulté le ).
- ↑ Damien Mascret, « L'immunothérapie prolonge la survie de patients atteints de mélanome », Le Figaro.fr, (lire en ligne).
- ↑ (en) Matthew J. Paszek, Nastaran Zahir, Kandice R. Johnson et Johnathon N. Lakins, « Tensional homeostasis and the malignant phenotype », Cancer Cell, vol. 8, no 3, , p. 241–254 (DOI 10.1016/j.ccr.2005.08.010, lire en ligne, consulté le ).
- ↑ (en) Fabien Montel, Morgan Delarue, Jens Elgeti et Laurent Malaquin, « Stress Clamp Experiments on Multicellular Tumor Spheroids », Physical Review Letters, vol. 107, no 18, , p. 188102 (DOI 10.1103/PhysRevLett.107.188102, lire en ligne, consulté le ).
- ↑ « Cancers : les chiffres clés - Qu'est-ce qu'un cancer ? », sur www.e-cancer.fr (consulté le )
- ↑ Bibliographie jeunesse, sur Sparadrap.org.
Voir aussi
Articles connexes
- Liste des cancers
- Liste de cancérogènes du groupe 1 du CIRC
- Cancer professionnel
- Recherche en cancérologie
- Aliments anticancer
- Paradoxe de Peto
- Atlas of Genetics and Cytogenetics in Oncology and Haematology
- « The hallmarks of cancer »
- Tomographie optique diffuse
- Socio-oncologie
Organismes
- Centre international de recherche sur le cancer
- Fonds mondial de recherche contre le cancer
- Institut Curie
- Gustave-Roussy
- Institut national du cancer (France)
Associations
- Ligue nationale contre le cancer
- Fondation ARC pour la recherche sur le cancer
- Association européenne contre le cancer du col de l'utérus
Liens externes
- Ressources relatives à la santé :
- Classification internationale des maladies oncologiques
- (en) Classification internationale des soins primaires
- (en) Diseases Ontology
- (en) DiseasesDB
- (en) ICD-10 Version:2016
- (en + es) MedlinePlus
- (en) NCI Thesaurus
- (no + nn + nb) Store medisinske leksikon
- Ressource relative à la recherche :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Cancer the Open Directory Project
- Fiches par cancer et par pays sur le site de l'Observatoire européen du cancer
- clinicaltrials.gov(traitements anticancéreux expérimentaux)(en)
- Dossier documentaire de la Société Française de Santé Publique