| Causes | Infection à Helicobacter pylori (d) ou anti-inflammatoire non stéroïdien |
|---|---|
| Symptômes | Épigastralgie, pyrosis, melæna et hématémèse |
| Médicament | Magaldrate (en), carbonate de calcium, oméprazole, hyoscyamine, calcium (glucoheptonate de) dihydraté (en), pantoprazole, propantheline (d), glycopyrronium (d), glycine, clidinium (en), hydroxyde de magnésium, dihydroxyaluminum sodium carbonate (d), aluminium carbonate (en), carbonate ion (d), ésoméprazole, lansoprazole, hexocyclium (en), glycopyrronium (d), diphemanil (d) et propantheline (d) |
|---|---|
| Spécialité | Gastro-entérologie |
| CISP-2 | D86 |
|---|---|
| CIM-10 | K25-K27 |
| CIM-9 | 531-534 |
| DiseasesDB | 9819 |
| MedlinePlus | 000206 |
| eMedicine |
181753 ped/2341 |
| MeSH | D010437 |
![]() Mise en garde médicale
Mise en garde médicale
L’ulcère gastroduodénal (UGD, parfois épellé gastro-duodénal), aussi appelé ulcère de l'estomac, est une maladie qui a longtemps été considérée comme chronique, définie anatomiquement par une perte de substance de la paroi de l’estomac ou du duodénum dépassant la muscularis mucosae[1].
L’ulcère implique le plus souvent une bactérie, l’Helicobacter pylori. Cette découverte fortuite[2] est due à J. Robin Warren et Barry J. Marshall et leur a valu le prix Nobel de médecine en 2005. Cependant, d’autres facteurs en facilitent la survenue comme le stress des patients de réanimation ou certains médicaments.
Causes ou facteurs de risque
Avant la compréhension du rôle d'une bactérie dans l’ulcère gastroduodénal, on l'interprétait classiquement comme résultant d’un déséquilibre entre des facteurs protecteurs de la muqueuse gastroduodénale (intégrité anatomique de la muqueuse, de la vascularisation pariétale, sécrétion de mucus par les cellules mucigènes, sécrétion de bicarbonate) et des facteurs d’agression (sécrétion chlorhydro-peptique majorée notamment par le stress), la prise de toxiques, dont l’alcoolisme, le tabagisme, le café, certains médicaments, dont l’aspirine (risque de 1⁄1000 d’avoir un ulcère) ou autres anti-inflammatoires non stéroïdiens, corticostéroïdes…
Cette conception classique a été remise en cause par la découverte du rôle prépondérant de l’infection par Helicobacter pylori.
Contrairement à une idée reçue, le « stress » (dans le sens courant d'« anxiété ») n'est pas un facteur de risque. Le terme d’« ulcère de stress » correspond à un stress physiologique lors de pathologie aiguë grave, notamment chez les patients en réanimation.
Les causes médicamenteuses sont indépendantes de la présence d’hélicobacter. Les ulcères sont causés dans ce cas par la suppression de la sécrétion de prostaglandines par l’estomac[3] qui est due à une inhibition de la cyclooxygénase 1 (COX-1). Les anti-inflammatoires de type anti COX-2 (appelé communément coxibs) provoquent beaucoup moins d’ulcères.
Dans certains cas, les ulcères peuvent être liés à une autre cause, comme dans le syndrome de Zollinger-Ellison.
Épidémiologie
C’est l’une des maladies gastroentérologiques les plus fréquentes : on estime que 5 à 10 % des habitants des États-Unis développeront un ulcère gastrique ou duodénal dans leur vie.
Les ulcères duodénaux sont les plus fréquents : on trouve un ulcère gastrique pour 10 ulcères duodénaux.
Les complications des ulcères diminuent en fréquence, avec l’utilisation de médicaments efficaces sur l’ulcère.
Symptômes
Les signes de l’ulcère gastrique ou de l’ulcère duodénal sont très variables et peu spécifiques. Il n’existe pas d’élément clinique permettant d’affirmer le diagnostic avec certitude. La découverte d’un ulcère gastroduodénal à l'endoscopie digestive haute est possible chez des patients ne se plaignant de rien.
Les symptômes les plus courants sont :
- l’épigastralgie qui est une douleur localisée à la partie haute de l’abdomen et qui présente des caractéristiques : par exemple, une apparition dans les 2 à 3 heures après les repas est soulagée par une prise alimentaire, surtout s’il s’agit d’aliments alcalins comme les produits laitiers. Elle se répète de façon quotidienne, donnant une impression de « faim douloureuse » ;
- le pyrosis (sensation de brûlure rétrosternale), une dyspepsie (sensation d’inconfort lors de la digestion), des nausées ou des vomissements, une anorexie (perte d’appétit) avec amaigrissement, la pâleur d’une anémie ferriprive ou un méléna (diarrhée noirâtre due à du sang digéré) sont des signes moins constants.
Les signes cliniques évoluent par périodes où le malade souffre quotidiennement, entrecoupées de périodes sans gêne particulière. Il existe un rythme saisonnier à ces périodes qui seraient plus fréquentes au printemps et en automne.
On peut aussi constater des signes cliniques plus bruyants pouvant témoigner d’une complication d’emblée, lors notamment d’une perforation de la paroi digestive ou d’une hémorragie digestive majeure. La symptomatologie décrite ci-dessus est alors couverte par celle de la péritonite (douleur abdominale intense, iléus, ventre de bois à la palpation…) et ceux de l’état de choc hémorragique (pâleur intense, tachycardie, hypotension, angoisse…).
Diagnostic
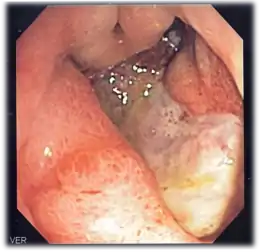
La fibroscopie œsogastroduodénale est l’examen de référence. Elle visualise l’ulcère, en détermine la localisation, s’il est isolé ou multiple. Des biopsies sont nécessaires en cas d’ulcère gastrique, pour vérifier l’absence de cancérisation. Les ulcères les plus fréquents sont situés sur la petite courbure de l’estomac et sur le bulbe du duodénum (partie postérieure). On recherchera également une colonisation par l’Helicobacter pylori, très souvent associé à l’ulcère gastroduodénal, et dont l’éradication permettra d’éviter des récidives.
Un transit œsogastroduodénal (radiographie de l’abdomen après avoir avalé un produit radio-opaque) peut être utile, si on ne peut avoir accès à une fibroscopie, ou si une symptomatologie évocatrice persiste, en l’absence de signe fibroscopique visible.
La radio d’abdomen sans préparation est en règle générale normale. On peut visualiser de l’air sous les coupoles diaphragmatiques en cas d’ulcère perforé : un scanner peut également être utile en cas de saignement, ou de suspicion de perforation.
Chez les personnes jeunes, on peut se contenter d’une simple recherche d’hélicobacter par une analyse des gaz respiratoires ou par la recherche d’antigènes spécifiques dans les selles, sans faire de fibroscopie[4].
Complications
Hémorragie
La complication la plus fréquente est l’hémorragie digestive haute (correspond à plus d'un tiers de ces dernières[5]) se manifestant soit par une hématémèse (vomissement de sang), soit par un méléna (diarrhée noirâtre faite de sang digéré), soit simplement par une anémie. Son incidence annuelle est comprise entre 19 et 57 cas pour 100 000 suivant les pays[6]. Il peut y avoir saignement abondant, par exemple sur érosion de l’artère gastroduodénale qui passe sur la face postérieure du premier duodénum.
La fibroscopie peut voir un saignement en cours, ou seulement la présence d'un caillot. Elle peut ne visualiser qu'un ulcère apparemment non compliqué.
La mortalité est autour de 5 % même si elle a tendance à baisser[7].
Plusieurs scores de risque ont été développés afin d'estimer le pronostic de l'hémorragie digestive haute. Ils sont basés sur la clinique, la biologie, et parfois les données endoscopiques. Parmi ces scores, on peut citer le « Rockall score »[8], le « Glasgow Blatchford score »[9] et l'AIMS65[10], seul ce dernier étant spécifique de l'hémorragie sur ulcère gastrique.
Perforation
L’ulcère peut se compliquer de perforation gastrique ou duodénale, avec constitution d’un pneumopéritoine ou d’une péritonite. Cette complication est cependant plus rare[11].
Autres
En chronique, l’ulcère peut se compliquer d’anémie ferriprive, de sténose pylorique et de cancer gastrique.
Un ulcère gastrique peut se « cancériser » et un cancer gastrique peut prendre la forme d'un ulcère : ceci explique que la recherche d'un cancer gastrique soit systématique devant tout ulcère gastrique. Ceci ne concerne pas les ulcères duodénaux.
Traitement et surveillance
Aujourd'hui, 90 % des malades guérissent et ne gardent pas de séquelles grâce à un traitement médicamenteux de quelques semaines à base d’antihistaminique H2 relayé depuis par les inhibiteurs de la pompe à protons, plus efficaces. La récidive est cependant possible.
Cependant ces traitements utilisant jusqu'à cinq types d'antibiotiques[12] peuvent avoir des effets secondaires assez importants [13],[14],[15].
Des pistes de recherches utilisant par exemple des nanoparticules[16]semblent néanmoins plus à même de cibler plus précisément le biofilm de l'ulcère[17] et de diminuer l'impact des traitements.
La cicatrisation de l’ulcère est obtenue par un traitement anti-acide et quelques mesures hygiéno-diététiques : arrêt du tabac, sevrage alcoolique, etc.
L’éradication d’Helicobacter pylori par un traitement antibiotique permet de réduire l’échec du traitement anti-acide ou la récidive de l’ulcère gastroduodénal. On utilise une triple antibiothérapie séquentielle à base de pénicilline, de macrolide et d'imidazolé durant dix jours associée à un inhibiteur de la pompe à protons.
Le traitement par anti-acide au long cours peut être proposé chez les patients toujours porteurs d’Helicobacter pylori ou à risque de récidive d’ulcère gastroduodénal.
Les pansements gastriques (sucralfate, sels de bismuth) sont des gels renforçant la muqueuse digestive et permettant une meilleure cicatrisation.
La consommation de probiotiques limite le développement de la bactérie Helicobacter pylori mais ne peut l'éradiquer. On espère que ces probiotiques pourraient avoir des effets bénéfiques sur les gastrites[18].
Un traitement impliquant la chronopharmacologie est aussi utilisé.
Traitement des complications
En cas de complication, le traitement peut être médicamenteux ou chirurgical :
- perforation d’ulcère :
- sur estomac vide, un traitement médicamenteux peut être mis en place : aspiration par sonde gastrique, perfusion avec inhibiteurs de la pompe à protons et antibiotiques, surveillance en milieu chirurgical,
- sur estomac plein, la constitution d’une péritonite est beaucoup plus rapide, et une intervention chirurgicale est nécessaire en urgence (toilette péritonéale et drainage, suture de l’ulcère) ;
- hémorragie : une fibroscopie, réalisée en urgence[19], permet de confirmer la cause gastrique du saignement et de mettre en route un traitement endoscopique adapté. En cas de visualisation d'un caillot adhérent, celui-ci doit être retiré afin de visualiser la lésion saignante et la traiter[20]. Plusieurs types de traitement peuvent être pratiqués : l'injection siloée d'adrénaline n'est plus conseillée[21]. l'injection de liquides dans la muqueuse proche de l'artère responsable permet de comprimer cette dernière et complète ainsi l'adrénaline. La pose d'un clip sur l'artère est une autre solution, équivalente à la thermocoagulation[22]. Ce traitement endoscopique permet de réduire le risque de récidive, le recours à la chirurgie et la mortalité[23]. L'intérêt d'un contrôle endoscopique quelques jours après la guérison d'un saignement est discutable[7]. Une perfusion d’inhibiteurs de la pompe à protons à forte dose est réalisée dans le même temps[24]. La dose nécessaire reste discutée, les fortes doses ne montrant pas de supériorité par rapport à des doses inférieures[25]. Si la visualisation de l’ulcère est impossible du fait des caillots, s’il y a récidive du saignement, ou si celui-ci est trop important, une intervention chirurgicale en urgence permet de contrôler l’hémorragie. Une embolisation de l'artère responsable peut être une solution alternative[26]. Le traitement par inhibiteurs de la pompe à protons sera continué après cette intervention, un contrôle de la bonne cicatrisation de l’ulcère sera nécessaire à six semaines en cas de localisation gastrique (avec biopsies pour éliminer une cancérisation).
Un contrôle endoscopique de la guérison de l’ulcère gastrique sera effectué pour confirmer l’éradication d’Helicobacter pylori, l’absence de gastrite atrophiante, de lésion cancéreuse et la disparition de l’ulcère.
Prévention
Il est conseillé de ne consommer l’alcool, le tabac, le café et les épices que de façon modérée.
Un traitement préventif par inhibiteur de la pompe à protons peut être prescrit dans les situations à risque (usage d’anti-inflammatoires non stéroïdiens ou d’aspirine).
Notes et références
- ↑ Ulcère gastroduodénal. Dictionnaire médical de l'Académie de Médecine
- ↑ Isabelle Catala (Dr), « L'ulcère vaincu par sérendipité », Le Quotidien du médecin, (lire en ligne)
- ↑ (en) Wallace JL, « Prostaglandins, NSAIDs, and gastric mucosal protection: why doesn’t the stomach digest itself? » Physiol Rev. 2008;88:1547-1565.
- ↑ (en) McColl KEL « Should non-invasive Helicobacter pylori testing replace endoscopy in investigation of dyspepsia? »] Helicobacter 2000;5:S11-S15.
- ↑ (en) Hearnshaw SA, Logan RF, Lowe D, Travis SP, Murphy MR, Palmer KR, « Acute upper gastrointestinal bleeding in the UK: patient characteristics, diagnoses and outcomes in the 2007 UK audit » Gut, 2011;60:1327-1335
- ↑ (en) Lau JY, Sung J, Hill C, Henderson C, Howden CW, Metz DC, « Systematic review of the epidemiology of complicated peptic ulcer disease: incidence, recurrence, risk factors and mortality » Digestion, 2011;84:102-113
- 1 2 (en) Lau JY, Barkun A, Fan DM, Kuipers EJ, Yang YS, Chan FK, « Challenges in the management of acute peptic ulcer bleeding » Lancet, 2013;381:2033-2043
- ↑ (en) Rockall TA, Logan RF, Devlin HB, Northfield TC, « Risk assessment after acute upper gastrointestinal hemorrhage » Gut, 1996;38:316-321
- ↑ (en) Blatchford O, Murray WR, Blatchford M, « A risk score to predict need for treatment for upper gastrointestinal hemorrhage » Lancet, 2000;356:1318-1321
- ↑ (en) Saltzman JR, Tabak YP, Hyett BH, Sun X, Travis AC, Johannes RS, « A simple risk score accurately predicts in-hospital mortality, length of stay, and cost in acute upper GI bleeding » Gastrointest Endosc, 2011;74:1215-1224
- ↑ (en) Malfertheiner P, Chan FK, McColl KE, « Peptic ulcer disease » Lancet 2009;374:1449-1461.
- ↑ "2017, Recommandations sur le traitement de l’infection Helicobacter pylori chez l’adulte"
- ↑ "Mars, 2013: Hélicobacter pylori, la bactérie qui combat obésité et diabète"
- ↑ "Nature, 2018:Helicobacter pylori infection and inflammatory bowel disease: a crosstalk between upper and lower digestive tract"
- ↑ "Nbci, Huin 2019:A Novel View of Human Helicobacter pylori Infections: Interplay between Microbiota and Beta-Defensins"
- ↑ "2012, Mucoadhesive and muco-penetrating delivery systems for eradication of Helicobacter pylori"
- ↑ "Nbci 2015:Microbial biofilms and gastrointestinal diseases"
- ↑ (en) Lesbros-Pantoflickova D, Corthésy-Theulaz I, Blum AL « Helicobacter pylori and Probiotics » J Nutr. 2007 Mar;137(3 Suppl 2):812S-8S
- ↑ (en) Spiegel BMR, Vakil NB, Ofman JJ, « Endoscopy for acute nonvariceal upper gastrointestinal tract hemorrhage: is sooner better? A systematic review » Arch Intern Med, 2001;161:1393-1404
- ↑ (en) Kahi CJ, Jensen DM, Sung JJ et al. « Endoscopic therapy versus medical therapy for bleeding peptic ulcer with adherent clot: a meta-analysis » Gastroenterology, 2005;129:855-862
- ↑ (en) Calvet X, Vergara M, Brullet E, Gisbert JP, Campo R, « Addition of a second endoscopic treatment following epinephrine injection improves outcome in high risk bleeding ulcers » Gastroenterology, 2004;126:441-450
- ↑ (en) Sung JJ, Tsoi KK, Lai LH, Wu JC, Lau JY, « Endoscopic clipping versus injection and thermo-coagulation in the treatment of non-variceal upper gastrointestinal bleeding: a meta-analysis » Gut, 2007;56:1364-1373
- ↑ (en) Cook DJ, Guyatt GH, Salena BJ, Laine LA, « Endoscopic therapy for acute nonvariceal upper gastrointestinal hemorrhage: a meta-analysis » Gastroenterology, 1992;102:139-148
- ↑ (en) Sreedharan A, Martin J, Leontiadis GI et al. « Proton pump inhibitor treatment initiated prior to endoscopic diagnosis in upper gastrointestinal bleeding » Cochrane Database Syst Rev, 2010; 7. CD005415
- ↑ (en) Wang CH, Ma MH, Chou HC et al. « High-dose vs. non-high-dose proton pump inhibitors after endoscopic treatment in patients with bleeding peptic ulcer: a systematic review and meta-analysis of randomized controlled trials » Arch Intern Med, 2010;170:751-758
- ↑ (en) Loffroy R, Guiu B, « Role of transcatheter arterial embolization for massive bleeding from gastroduodenal ulcers » World J Gastroenterol, 2009;21:5889-5897
Liens externes
- Notice dans un dictionnaire ou une encyclopédie généraliste :
- Ressources relatives à la santé :
- (en) Classification internationale des soins primaires
- (en) Diseases Ontology
- (en) DiseasesDB
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (en) NCI Thesaurus
- (no + nn + nb) Store medisinske leksikon
- ulcère gastroduodénal (UGD)