
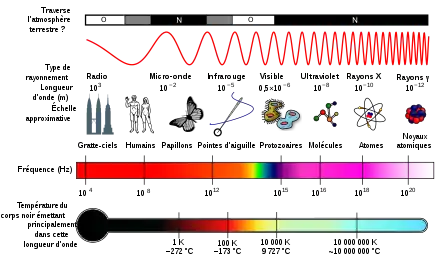
Le rayonnement ultraviolet (UV), également appelé « lumière noire » parce que généralement invisible à l’œil nu, est un rayonnement électromagnétique de longueur d'onde inférieure à celle de la lumière visible, mais supérieure à celle des rayons X. Les rayons UV ne peuvent être observés qu’indirectement, soit par la fluorescence, soit à l’aide de détecteurs spécialisés.
Le nom signifie « au-delà du violet » (du latin ultra : « au-delà de »), le violet étant la couleur de fréquence la plus élevée (et donc de longueur d'onde la plus courte) de la lumière visible.
Les ampoules ordinaires sont conçues pour émettre peu d'ultraviolets[1], à l'inverse des ampoules ultraviolettes et du soleil.
Les ultraviolets ont été découverts en 1801 par le physicien allemand Johann Wilhelm Ritter d'après leur action chimique sur le chlorure d'argent.
Les couleurs visibles vont de 623 à 740 nm pour le rouge et de 380 à 430 nm pour le violet. Au delà, les lumières invisibles du spectre ultraviolet peuvent être subdivisées selon leur longueur d'onde en :
- UV proches (380-200 nm), VUV (Vacuum ultraviolet, 200-120 nm) qui, comme leur nom l'indique, ne se propagent pas dans l'air, et ultraviolets extrêmes (120–5 nm), d'autres standards peuvent donner d'autres définitions (cf. ISO 21348, Definitions of Solar Irradiance Spectral Categories en section Bandes spectrales des radiations UV) ;
- UV-A1 : 340−400 nm ; UV-A2 : 315−340 nm ; UV-B : 280−315 nm ; UV-C : 100−280 nm. Ces trois bandes sont standardisées.
Les ultraviolets sont la cause du bronzage mais, à haute dose, sont nocifs pour la santé humaine, notamment à cause de leur effet mutagène ; ils peuvent provoquer des cancers cutanés tels que le mélanome, provoquer un vieillissement prématuré de la peau (rides), des brûlures (coup de soleil), des cataractes. Ils sont néanmoins nécessaires à petites doses régulières pour la synthèse de la vitamine D. Ils sont capables de « casser » de nombreux composés organiques en suspension dans l'air ou dans les eaux superficielles, et des agents tels que les virus à ARN, et participant à la destruction (photodégradation) de certains polluants ou de molécules odorantes (parfums des fleurs par exemple), mais aussi à la pollution photochimique (ozone troposphérique, NOx…).
Généralités
.jpg.webp)
Près de 5 % de l'énergie électromagnétique du Soleil est émise sous forme de rayonnement UV. Ces rayons UV sont classés dans trois catégories en fonction de leur longueur d'onde : les UV-A (400-315 nm), UV-B (315-280 nm) et UV-C (280-100 nm). Toutefois, en raison de l'absorption des UV par la couche d'ozone de l'atmosphère, 95 % de la lumière UV qui atteint la surface de la Terre appartient à la gamme des UV-A[3],[4].
Les UV traversent l'atmosphère même par temps froid ou nuageux. Ils n'ont rien à voir avec la sensation de chaleur procurée par le Soleil, qui est due aux infrarouges. L'intensité lumineuse des UV est plus importante à midi solaire et à haute altitude, car en traversant une plus courte distance dans l'atmosphère, ils ont moins de chances d'être interceptés par des molécules d'ozone. La quantité d'UV-B augmente d'environ 4 % chaque 300 mètres de dénivelé.
Les UV sont réfléchis par l'eau (5 % des UV réfléchis), le sable (20 % des UV réfléchis), l'herbe (5 % des UV réfléchis) et surtout la neige (85 % des UV réfléchis).
Le trou dans la couche d'ozone permet les passages de spectres ultraviolets que l'ozone arrête, ce qui est potentiellement dangereux en raison de la nocivité importante de ces ultraviolets. L'Antarctique est le seul continent touché par ce trou, les effets nocifs concernent donc un très petit nombre d'êtres vivants, tels que les manchots. L'Arctique est touché depuis peu, à la suite de l'hiver très froid entre 2010 et 2011.
Le soleil est le plus agressif au midi solaire en été, c'est-à-dire vers 14 h dans la plus grande partie de l'Europe, en fonction du fuseau horaire. C'est pourquoi il est déconseillé de s'exposer entre 12 h et 16 h, tout particulièrement à proximité de l'eau ou de la neige qui réverbèrent une partie des UV, ou en montagne où les taux d'UV sont plus importants.
Découverte
Les rayons ultraviolets ont été découverts en 1801 par le physicien allemand Johann Wilhelm Ritter : examinant l'action des différentes couleurs (ou longueurs d'onde) du spectre solaire décomposé par un prisme, sur un papier imbibé de chlorure d'argent, il s'aperçut que le papier brunissait plus rapidement au-delà du violet, donc de toute couleur visible. Il qualifia ce rayonnement invisible de « rayons oxydants », à la fois pour montrer leur réactivité chimique et les opposer aux « rayons thermiques » (c'est-à-dire infrarouges), que William Herschel avait découverts l'année précédente en deçà du rouge du spectre solaire. On adopta peu après l'expression plus simple de « rayons chimiques », qui demeura en usage jusqu'à la fin du XIXe siècle, en dépit des allégations de chercheurs qui y voyaient un rayonnement d'origine essentiellement non-lumineuse (notamment John William Draper, qui les baptisait pour cette raison « rayons tithoniques[5],[6] ») ; mais finalement les termes de « rayons chimiques » et de « rayons thermiques » le cédèrent aux termes de rayonnement « ultraviolet » et infrarouge, respectivement[7],[8].
En 1878, on découvrit l'action stérilisante des courtes longueurs d'onde lumineuses sur les bactéries[8], et, dès 1903, on reconnut que les longueurs d'onde les plus efficaces à cet égard se situaient autour de 250 nm. En 1960, l'action du rayonnement ultraviolet sur l'ADN fut établie[9].
La découverte des rayons ultraviolets d'une longueur d'onde inférieure à 200 nm, appelés « ultraviolets cosmiques » à cause de leur absorption par la couche d'ozone, est due au physicien allemand Victor Schumann[10] en 1893.
Prospective
Étant donné leur importance en termes d'écologie, de photochimie de l'atmosphère et de santé publique, il est utile de pouvoir prévoir les taux d'UV futur dans diverses parties du monde.
Ces projections dépendent notamment de la vitesse de cicatrisation des trous dans la couche d'ozone, de la qualité de la couche d'ozone dans le reste de l'atmosphère et donc des scénarios d'émission de gaz délétères pour l'ozone stratosphérique et d'émissions de gaz à effet de serre. De nombreux gaz qui ont contribué à la destruction de la couche d'ozone ont fait l'objet de mesures pour réduire ou arrêter leur production dans le cadre du protocole de Montréal, mais celui-ci ne prend pas en compte le protoxyde d'azote N20, qui contribue également à la dégradation de cette couche et dont les taux n'ont pas cessé de croitre depuis. Les gaz à effet de serre jouent également un rôle car ils modifient les températures à basse et haute altitude modifient aussi la physico-chimie de la couche d'ozone[11].
L'activité solaire varie dans le temps selon un cycle solaire (de onze ans, lié aux taches et éruptions solaires)[12], ce qui est une première source de modification naturelle du climat, mais aussi de variation de la quantité d'UV arrivant dans la stratosphère. En moyenne, environ 5 % de l'énergie reçue du soleil est portée par des UV, et principalement par les UV-C (de 10 à 200 nm). Ces derniers sont les plus dangereux pour le vivant, car les plus énergétiques, mais ils sont entièrement et rapidement absorbés par l’atmosphère qui protège la biosphère (au point que ces rayons UV-C ne sont donc observables que dans le vide sidéral ou au-dessus de l’atmosphère terrestre)[11].
Cette variabilité dépend également de plusieurs paramètres géophysiques :
- paramètres géométriques, tels que l'angle de pénétration du rayonnement UV dans l'atmosphère qui dépend du lieu, de l'heure et de la saison[11] ;
- chemin (direct ou « diffusif ») parcouru par le rayonnement UV dans l'atmosphère[11] ;
- constitution physicochimique de l’atmosphère au moment où le rayonnement UV s'y propage ; avec en particulier :
- la densité de la couche d'ozone sur le trajet de pénétration du rayonnement UV[13],
- la nébulosité, dont les effets sont ambigus et complexes ; en effet la nébulosité cause une variabilité spatiotemporelle importante, expliquant plus 20 % de la variabilité journalière de l’indice UV[14], avec une échelle de variation temporelle et spatiale parfois très courte. De plus, si certains nuages filtrent efficacement, jusqu'à 50 % voire 90 % pour un ciel couvert à plus de 80 % par des nuages denses[15] une partie du rayonnement UV[16], d'autres, les cirrus ou la brume dans 80 % des cas, en augmentent au contraire l’intensité. C'est le cas quand la couverture nuageuse est fractionnée tout particulièrement au-dessus d'étendues marines ou neigeuses[16],[17] : des mesures faites par Schafer et al. en 1996 ont montré des augmentations locales de 11 % des UV reçus au sol[18], et en 2011, Jégou et al. ont rapporté une augmentation de 10 % de l’indice UV pour un ciel à environ 65 % couvert de nuages[19]. Les aérosols naturels issus des embruns marins et des volcans, ou d'origine anthropiques — feux de forêt et de brousse, combustion de biomasse ou d'hydrocarbures fossiles —, peuvent selon les contextes absorber et/ou diffuser les UV en provenance du Soleil ou réverbérés par les neiges et surfaces en eau : ils peuvent diminuer le rayonnement UV reçu au sol de près de 30 %[20] ou réduire le forçage radiatif[21],[22] ;
- l'albédo, en réverbérant une partie des UV augmente leur présence dans l'air ambiant[11].
Selon les données disponibles au début du XXIe siècle, à scénario identique de changement climatique, les taux futurs de N2O semblent conditionner de manière déterminante les valeurs futures des taux d'ozone[15] et donc d’UV reçus au sol, surtout en zone tropicale[11]. La complexité des systèmes nuageux (notamment liée à leur variabilité spatiale et temporelle) en fait la source majeure d’incertitude dans les projections climatiques[23] et des taux d’UV reçus au sol[24].
Effets sur les écosystèmes
Beaucoup d'animaux (dont l'Homme) ont besoin d'un peu d'UV pour synthétiser la vitamine D ; beaucoup d'organismes annulent ou réduisent les dégâts induits par les UV par l'évitement comportemental, la photoprotection par des pigments ad hoc, et grâce à des processus de réparation photoenzymatique, mais les méta-analyses scientifiques ont confirmé des effets délétères des UV à tous les niveaux trophiques[25].
Les plantes (y compris cultivées) sont sensibles à un déficit comme à un excès d’UV-B ; et par suite les herbivores et carnivores (qui en dépendent) peuvent être indirectement aussi affectés par ces manques ou excès d'UV-B, rappellent Kakani et al. (2003)[26].
Les écosystèmes aquatiques, marins notamment, sont très sensibles aux UV :
- le phytoplancton, les bactéries, cyanophycées et archées vivant dans l'eau sont très sensibles aux variations d’UV[27], de même que les phages et autres virus très abondants dans les eaux, marines notamment[28] ;
- chez les algues, des modélisations de la photoinhibition de la production primaire par les UV dans certaines zones du Pacifique ont conclu que la composante UV de la lumière solaire entraîne une diminution de 20% du potentiel estimé de productivité primaire (tout en ayant des conséquences positifs en endommageant certains prédateurs, concurrents et agents pathogènes moins tolérants aux UV[25] ;
- Hader et ses collègues ont montré en 2007 que la photosynthèse phytoplanctonique océanique (source d'une grande partie de l'oxygène de l'air) dépend d'un équilibre subtil entre salinité, température et insolation par les UV-A et UV-B[29] ;
- agriculture intensive, précipitations accrues et fonte des glaciers et du pergélisol contribuent ensemble à l'augmentation de la turbidité — de l'eau — qui absorbe les UV près de la surface. Ceci atténue ou supprime un service écosystémique important: la capacité naturelle des UV à désinfecter l'eau[30],[25]. Cela affecte par ailleurs les animaux marins dont la vue est sensible à la lumière du spectre ultraviolet[31],[32] ;
- les UV détruisent certains polluants par photolyse ou atténuent leur toxicité (ex. : les UV-B transforment le méthylmercure (déméthylation, au moins provisoire) en mercure moins toxique), mais ils créent d'autres polluants, et aggravent la toxicité de certains pesticides et hydrocarbures aromatiques polycycliques. Ils augmentent la libération de micropolluants par les microplastiques et les nanoplastique[25].
Depuis quelques décennies, deux risques majeurs d'exposition accrue aux UV existent :
- le trou de la couche d'ozone, que le Protocole de Montréal a commencé à réparer, mais avec une amélioration qui s'est amoindrie depuis 2007 environ ;
- le réchauffement climatique : la diminution (voire disparition) de la durée et de l'épaisseur de l'enneigement et de la couverture de glace expose de nombreux organismes terrestres ou aquatiques aux UV. Le réchauffement peut aussi localement perturber le mélange des couches en maintenant des couches anoxiques en profondeur[25] ;
Notamment dans les eaux douces, saumâtres et salées, les modifications locales et globales de la couche d'ozone, du réchauffement, de la turbidité et de divers polluants combinent leurs effets, de manière parfois synergique ; ils sont encore incomplètement compris[25].
Les ultraviolets restent nuisibles pour les êtres vivants, qui utilisent deux stratégies pour se défendre : les réfléchir pour les empêcher de pénétrer dans l'organisme, ou les absorber dès qu'ils y entrent. Les réfléchir n'est pas facile car le matériel vivant est transparent aux UV et il ne dispose pas de métal. Il faut utiliser des structures photoniques, qui, selon l'arrangement, renvoient telle ou telle longueur d'onde. Une structure serrée renverra de petites longueurs d'onde, tandis qu'une large de grandes. Aux limites des ondes visibles, les humains perçoivent les iridescences des coléoptères ou des papillons, les Pieridae, le citron de Provence, résultat de la façon que ces insectes emploient pour se défendre contre les UV. Certaines fourmis, comme Cataglyphis bombycina, arrivent à une réflexion totale par la technique du prisme éclairé par un sommet : le rayon lumineux, arrivant sur la surface par un angle faible, est entièrement réfléchi. Absorber les rayons dès qu'ils entrent dans l'organisme est la technique employée par pratiquement tous les mammifères, plein d'autres animaux, et même les plantes et les champignons. Ils, elles, utilisent pour cela la mélanine, un pigment que l'organisme synthétise, qui va convertir la lumière en chaleur. C'est ce qui donne la coloration des peaux. C'est ce qui donne également certaine fluorescence : les Polistes brunetus protègent leurs larves en fermant les opercules de leur nid par de la soie fluorescente. -[33].
Effets sur la santé
Ils sont bons ou mauvais selon la dose et le type de peau. C'est pourquoi la protection de la couche d'ozone et la gestion de l'exposition de la peau aux UV sont deux enjeux conjoints de santé publique[34],[35].
Bénéfices pour la santé
L'exposition modérée aux UV-B permet à l'organisme de synthétiser la vitamine D, qui permet notamment l'absorption du calcium par l'intestin et contribue ainsi à la robustesse du squelette. Une carence sévère en vitamine D au cours de l'enfance conduit au rachitisme.
Outre le rachitisme, les UV-B permettent de traiter plusieurs maladies, comme le psoriasis et l'eczéma.
Les UV-A proches du violet, entre 360 et 400 nm de longueur d'onde, limitent le développement de la myopie chez des modèles animaux comme le poulet[36] et chez l'homme adulte fortement myope[37].
Danger à hautes doses
Des expositions intenses et/ou prolongées au soleil ou à des rayonnements artificiels (issus par exemple de lampes ou de dispositifs industriels type poste à souder) provoque un dessèchement de la peau, des brûlures (coup de soleil) et peut provoquer des tumeurs et cancers (phénomène dit de photocarcinogénèse cutanée)[38]. Les photons des rayonnements UV sont absorbés par les bases pyrimidines de l’ADN, principalement thymine mais aussi cytosine. L'irradiation provoque alors la dimérisation à partir de bases voisines avec rupture de la chaîne ADN de telle sorte que la réplication ultérieure est inhibée[39].
Le rayonnement solaire, en raison de sa charge en UV, a lui-même été classé agent cancérigène de classe 1 (cancérigènes certains) en 1992 par l'IARC[40],[41].
Pour l'OMS, 50 à 90 % des cancers de la peau sont imputables aux UV solaires[42], faisant des UV le premier facteur de risque pour les cancers de la peau[43] (mais pas pour les lymphomes malins qui au contraire seraient plutôt moins nombreux chez ceux qui se sont régulièrement mais modérément exposés au soleil ou qui ont séjourné en zone tropicale). Les UVB ont longtemps été accusés d'en être les principaux ou seuls responsables, mais une exposition chronique aux UVA a ensuite également été reconnue comme jouant un rôle dans la photocarcinogénèse cutanée (65 % de la cancérogenèse seraient dus aux UVB et 35 % aux UVA selon De Laat en 1997[44].
Les UV peuvent également être la cause :
- d'érythèmes actiniques (pouvant évoluer en cancers)[45] ;
- de cancers oculaires[45] ;
- de photo-kératites (ou ophtalmies des neiges en montagne), évoluant en mélanomes oculaires si l'exposition est chronique ;
- de photo-conjonctivites et/ou cataractes[45] ;
- de ptérygions pouvant conduire à une dégénérescence maculaire liée à l'âge[45] ;
- de hyperplasies épidermiques conduisant à un vieillissement prématuré de la peau[45] ;
- d'immunodépressions au niveau de la peau (qui seraient une des causes de la photocarcinogénèse selon Matsumura et Ananthaswamy 2004)[45].
Effets virucides
Les ultraviolets sont virucides[46] permettant des applications professionnelles de stérilisation par ultraviolets.
Indice UV
L'indice UV (ou index UV) est une échelle de mesure de l'intensité du rayonnement UV du Soleil, et du risque qu'il représente pour la santé.
L'indice UV se décline en cinq catégories, correspondant à un niveau de risque :
- 1 - 2 : faible : port de lunettes de soleil en cas de journées ensoleillées ;
- 3 - 5 : modéré : couvrez-vous, portez un chapeau et des lunettes de soleil. Appliquez un écran solaire de protection moyenne (indice de 15 à 29) surtout si vous êtes à l’extérieur pendant plus de 30 minutes. Cherchez l’ombre quand le soleil est au méridien ;
- 6 - 7 : élevé : réduisez l’exposition entre 12 h et 16 h. Appliquez un écran solaire de haute protection (indice de 30 à 50), portez un chapeau et des lunettes de soleil et placez-vous à l’ombre ;
- 8 - 10 : très élevé : sans protection, la peau sera endommagée et peut brûler. Évitez l’exposition au soleil entre 12 h et 16 h. Recherchez l’ombre, couvrez-vous, portez un chapeau et des lunettes de soleil, et appliquez un écran solaire de très haute protection (indice + 50) ;
- 11+ : extrême : la peau non protégée sera endommagée et peut brûler en quelques minutes. Évitez toute exposition au Soleil et, si ce n’est pas possible, couvrez-vous absolument, portez un chapeau et des lunettes de soleil et appliquez un écran solaire de très haute protection (indice + 50).
Interactions UV-atmosphère
- L'absorption : lors de leur traversée dans l'atmosphère, une partie des rayons UV est absorbée par les molécules de gaz (par les molécules d'oxygène par exemple). Ce phénomène crée de l'énergie capable de provoquer, par exemple, la dissociation de la molécule de gaz en deux autres molécules.
- La diffusion : les rayons ultraviolets peuvent aussi être diffusés par les molécules de gaz contenues dans l'atmosphère. Sachant que plus un rayon lumineux a une courte longueur d'onde, plus il est diffusé (cela explique que nous percevons le ciel en bleu qui est la couleur de la lumière visible avec la plus courte longueur d'onde), on en conclut que les rayons UV sont fortement diffusés par les gouttelettes d'eau des différentes couches nuageuses. Mais cela n’entraîne pas forcément une baisse de l'intensité lumineuse : les nuages hauts n’entraînent pratiquement pas de baisse de l'intensité tandis que les nuages bas diffusent une grande partie des rayons UV vers le haut.
- La réflexion : les rayons UV sont réfléchis par le sol en fonction de la nature du sol. On mesure cette réflexion par une fraction appelée l'albédo, comprise entre 0 et 1. La réflexion est particulièrement forte sur la neige (albédo de 0,9 ; 0,85 en UV).
Différence entre UV-A, UV-B et UV-C
Les trois types de rayonnements UV, A, B et C, sont classés en fonction de leur activité biologique et de leur pouvoir de pénétration de la peau. Ils correspondent à trois intervalles conventionnels de longueurs d'onde (voir ci-dessous). Plus la longueur d’onde du rayonnement UV est longue (plus il se rapproche de la lumière visible), moins il possède d'énergie et donc moins il est nocif mais plus il a un pouvoir de pénétration cutanée important. Inversement, plus la longueur d'onde du rayonnement UV est courte (plus il se rapproche des rayons X), plus il possède d'énergie et donc plus il est destructeur tout en ayant un moindre pouvoir de pénétration cutanée[47].
UV-A (400-315 nm)
Les UV-A, dont la longueur d’onde est relativement longue, représentent près de 95 % du rayonnement UV qui atteint la surface de la Terre. Ils peuvent pénétrer dans les couches profondes de la peau.
Ils sont responsables de l'effet de bronzage immédiat. En outre, ils favorisent également le vieillissement de la peau et l'apparition de rides, en perturbant l'équilibre des synthèses de protéines (en particulier la dégradation du collagène et augmentent la destruction de l'élastine) et dans les cellules ils sont à l'origine de la production de radicaux libres, très dommageables pour celles-ci. Pendant longtemps, on a pensé que les UV-A ne pouvaient être à l'origine de lésions durables. En réalité les UV-A semblent favoriser l'émergence de cancers de la peau par plusieurs mécanismes[48],[49], mais avec un effet bien moindre que les UV-B[50].
Les UVA excitent la molécule d'ADN et favorisent des liaisons entre certaines bases notamment quand l’ADN est sous forme de double-hélice, ce qui peut être source de mutations, voire de cancers[51]. Un autre mécanisme cancérigène semble exister par l'intermédiaire des dérivés réactifs de l'oxygène que les UV-A génèrent à l'intérieur des cellules, en quantité plus importante que les UV-B[52]. Il est aussi probable que les UV-A potentialisent la toxicité cellulaire des UV-B en pénétrant plus profondément dans la peau, en ayant une activité immunosuppressive[53] et en endommageant les systèmes de réparation de l'ADN[54].
Les UVA sont dangereux pour les yeux des enfants dont le cristallin ne joue que partiellement son rôle de filtre. 90 % des UV-A atteignent la rétine chez le nourrisson et encore 60 % avant l'âge de treize ans. Chez l'adulte de plus de vingt ans, le cristallin arrête (et subit) les UV-A presque à 100 %.
UV-B (315-280 nm)
Les UV-B, de longueur d’onde moyenne, ont une activité biologique importante, mais ne pénètrent pas au-delà des couches superficielles de la peau, ils sont relativement absorbés par la couche cornée de l'épiderme (mélanine). Une partie des UV-B solaires est filtrée par l’atmosphère.
Ils sont responsables du bronzage et des brûlures à retardement. Ils sont capables de produire de très fortes quantités de radicaux libres oxygénés dans les cellules de la peau, responsables à court terme des coups de soleil et de l'inflammation. Outre ces effets à court terme, ils favorisent le vieillissement de la peau (en abîmant les fibres de collagène) et l'apparition de cancers cutanés car même si les UV-B représentent une minorité de la lumière qui atteint la surface de la Terre, ils sont bien plus cancérigènes que les UV-A[50].
De fortes intensités d'UV-B sont dangereuses pour les yeux et peuvent causer le « flash du soudeur » ou photokératite, car ils ne sont arrêtés qu'à 80 % par le cristallin de l'adulte. Chez l'enfant, la moitié des UV-B atteignent la rétine des nourrissons et 75 % avant l'âge de dix ans.
En revanche, ils peuvent être bénéfiques pour certains types de pathologies de la peau tels que le psoriasis. Ils sont également importants pour la synthèse de vitamine D.
UV-C (280-100 nm)
Les UV-C, de courte longueur d’onde, sont les UV les plus énergétiques ainsi que les plus nocifs (l'énergie croît quand la longueur d'onde décroît), mais ils sont complètement filtrés par la couche d'ozone de l’atmosphère et n’atteignent donc théoriquement pas la surface de la Terre.
Toutefois, depuis plusieurs décennies des lampes UV-C (et plus récemment des diodes électroluminescentes [DEL/LED]) sont utilisées en laboratoire de biologie pour les effets germicides, afin de stériliser des pièces ou des appareils (hotte à flux laminaire, par exemple). Un nombre croissant de dispositifs, sources éventuelles accidentelles d'exposition des consommateurs aux UV-C sont depuis peu mis sur le marché (ex. : petites modules photovoltaïques destinés à potabiliser de l'eau dans les pays en développement explique une augmentation du nombre d'accidents (lésions oculaires et/ou dermatologiques), faisant que la Commission européenne a demandé un avis sur les risques associés à ces nouveaux dispositifs au SCHEER (Comité scientifique des risques sanitaires, environnementaux et émergents). Les experts ont estimé ne pas pouvoir évaluer ce risque, par manque d'études sur le degré d'exposition des humains et sur les effets d'une exposition chronique[55].
La bande spectrale des UV-C est constituée de trois sous-bandes :
- UV-C de 280 à 230 nm ;
- V-UV de 200 à 140 nm, c'est-à-dire les UV se propageant uniquement dans le vide (Vacuum ultraviolet) ;
- X-UV de 140 à 100 nm, longueurs d'onde qui s'approchent de celles des rayons X et qui sont les longueurs d'onde les plus énergétiques des ultraviolets. Selon les institutions[56], la lumière dont la longueur d'onde est située entre la fin des ultraviolets et le début des rayons X (124 à 10 nm) est parfois appelée rayonnement ultraviolet extrême, ou EUV. Elle est parfois comprise dans la catégorie UV-C, parfois distincte[57].
Protection
Pour se défendre contre la lumière UV, le corps, selon le type de peau, réagit aux expositions en libérant le pigment brun de mélanine. Ce pigment absorbe les UV, ce qui permet de bloquer leur pénétration et d'empêcher des dommages aux couches plus profondes et plus vulnérables de la peau. Des antioxydants (vitamines E et C, β-carotène…) peuvent neutraliser les radicaux libres formés par les UV.
Les crèmes solaires contiennent des filtres ultraviolets qui bloquent en partie les UV et aident à protéger la peau. Plus l’indice de protection est élevé, plus le degré de protection est grand[58]. L’indice de protection correspond en réalité au rapport entre le temps nécessaire pour attraper un coup de soleil avec et sans crème solaire.
Avec un indice de protection 50, il faudra par exemple cinquante fois plus de temps pour attraper un coup de soleil qu’en n’ayant aucune protection.
En 1957[59], les laboratoires RoC[60] inventent le premier écran solaire très haute protection (IP 50+).
Les vêtements et lunettes de soleil arrêtent une partie des UV. Il existe des lotions qui contiennent des filtres ultraviolets bloquant en partie les UV, néanmoins, la plupart des dermatologues recommandent de ne pas prendre de bain de soleil prolongé.
Astronomie
En astronomie, les objets très chauds émettent préférentiellement de la lumière UV (loi de Wien). Toutefois, la couche d'ozone, qui nous protège des UV intenses provenant du Soleil, cause des difficultés aux astronomes observant à partir de la Terre. C'est pourquoi la plupart des observations UV sont faites à partir de l'espace. Il existe toutefois des télescopes terrestres équipés de spectrographe échelle en lumière visible et ultraviolette comme le Très Grand Télescope (VLT).
Utilisation

Les lampes fluorescentes produisent de la lumière UV dans leur tube contenant un gaz à basse pression ; un enduit fluorescent sur l'intérieur des tubes absorbe les UV qui sont ensuite réémis sous forme de lumière visible.
Les lampes halogènes produisent également des UV et ne doivent pas être utilisées sans leur verre de protection.
Par longueur d'onde[61] :
- 13,5 nm : lithographie par ultraviolets extrêmes ;
- 230-365 nm : suivi de balises sur les produits, code-barres ;
- 230-400 nm : détecteurs optiques, instrumentation ;
- 240-280 nm : désinfection, assainissement d'eau et de surfaces (maximum d'absorbance par l'ADN à 254 nm), effaceur d'EPROM ;
- 200-400 nm : science forensique, dépistage de drogues ;
- 270-360 nm : analyse de protéines, séquençage de l'ADN, recherches pharmaceutiques ;
- 280-400 nm : imagerie médicale des cellules ;
- 300-320 nm : luminothérapie ;
- 300-365 nm : séchage de polymères d'encres ;
- 300-400 nm : éclairage à semi-conducteurs ;
- 350-370 nm : pièges à insectes (les mouches sont attirées le plus par la longueur 365 nm)[62].
Entre les deux guerres, l'actinothérapie a été expérimentée contre certaines maladies (rachitisme), mais aussi sur diverses substances, pour produire des « médicaments irradiés » aux nouvelles propriétés médicamenteuses (issues de l'action photochimique des ultraviolets sur le produit)[63].
Des lampes UV sont également utilisées pour analyser des minerais ou des gemmes ou pour identifier toute sorte de choses, par exemple des billets de banque (de nombreux objets peuvent paraître semblables sous la lumière visible et différents sous la lumière UV).
Des colorants fluorescents UV sont employés dans de nombreuses applications (par exemple en biochimie ou dans certains effets spéciaux).
Des lampes UV de longueur d'onde 253,7 nm (lampe à décharge à vapeur de mercure) sont utilisées pour stériliser des zones de travail et des outils utilisés dans des laboratoires de biologie et des équipements médicaux. Puisque les micro-organismes peuvent être protégés de la lumière UV par de petites fissures présentes dans le support, ces lampes sont utilisées seulement comme supplément à d'autres techniques de stérilisation.
La lumière UV est employée pour la photolithographie à très haute résolution, comme cela est nécessaire pour la fabrication des semi-conducteurs.
Les UV sont aussi utilisés pour le séchage des encres, la synthèse de polymère par photopolymérisation, le durcissement de certaines colles par photoréticulation et en spectroscopie ultraviolet-visible. On les utilise également pour provoquer certaines réactions photochimiques comme la photoisomérisation des groupements azobenzène, la dimérisation de la coumarine puis le cassage des dimers, la destruction des groupements nitrobenzène.
Il est recommandé d'employer des protections pour les yeux lorsqu'on travaille avec de la lumière UV, particulièrement pour les UV de courte longueur d'onde. Des lunettes de soleil ordinaires peuvent offrir une certaine protection, cependant elles sont souvent insuffisantes.
La vision des insectes, telle celle des abeilles, s'étend dans le spectre de l'ultraviolet proche (UV-A), et les fleurs ont souvent des marques visibles par de tels pollinisateurs. Certains pièges à insectes utilisent ce phénomène. Certains vertébrés voient aussi tout ou partie du spectre de l'ultraviolet[64], comme les poissons[65], ou certains planctonophages, qui l'utilisent pour mieux détecter leurs proies[66].
La photographie ultraviolette est un processus photographique d'enregistrement d'images en utilisant uniquement la lumière du spectre ultraviolet par réflexion ou fluorescence, utilisée entre autres en médecine légale et en restauration d'art [67].
Bandes spectrales des radiations UV
Les rayonnements UV sont des ondes électromagnétiques situées entre la lumière visible et les rayons X. Cette catégorie de rayonnement marque le début de la zone ionisante du spectre électromagnétique qui s'étend lui de 750 THz à 30 PHz.
Découpage historique de 1932
Lors du deuxième Congrès international sur la lumière à Copenhague en 1932, Coblentz introduit le concept de bandes spectrales UVA, UVB et UVC[68]. Ces régions ont été déterminées par les propriétés de transmission de trois filtres en verre communs :
- un filtre de baryum-silex définit les UVA (315-400 nm) ;
- un filtre de baryum-silex-pyrex l'UVB (280-315 nm) ;
- et un filtre pyrex définit l'UVC (longueurs d'onde plus courtes que 280 nm).
Donc la base de ces divisions a son fondement dans la physique, et non la biologie, bien que ces définitions aient été très utiles en biologie.
Découpage CIE de 1999
Plus récemment, les termes UVA-I (340-400nm) et UVA-II (315-340nm) sont entrés en usage en raison d'une meilleure compréhension des différences entre UVB et UVA. En réalité, les rayons UVA-II sont semblables à des rayons UVB, dans lequel la molécule cible (par exemple, ADN) est directement modifiée par l'absorption de l'énergie UV. En revanche, les rayons UVA-I ont tendance à causer des dommages indirects à des molécules cibles par des espèces réactives de l'oxygène (ROS) générés par l'absorption d'UV par d'autres molécules[68].
La CIE recommande dans le domaine de la photobiologie et de la photochimie le découpage du domaine ultraviolets en quatre domaines à la suite de la séparation du domaine des UVA en deux sous-domaines[69].
- UV-A1 : 340-400 nm
- UV-A2 : 315-340 nm
- UV-B : 280-315 nm
- UV-C : 100-280 nm
Découpage ISO
Voici la classification des UV qui est actuellement définie par la norme ISO 21348[70]:
| Nom | Abréviation | Intervalle de longueur d'onde (en nanomètres) |
Énergie du photon (en électronvolts) |
Notes / autres dénominations |
|---|---|---|---|---|
| Ultraviolet | UV | 100 – 400 | 3,10 – 12,4 | |
| Vacuum ultraviolet | VUV | 10 – 200 | 6,20 – 124 | |
| Ultraviolet extrême | EUV | 10 – 121 | 10,25 – 124 | Extreme ultraviolet |
| Hydrogen Lyman-alpha | H Lyman-α | 121 – 122 | 10,16 – 10,25 | |
| Ultraviolet lointain | FUV | 122 – 200 | 6,20 – 10,16 | Far ultraviolet |
| Ultraviolet C | UVC | 100 – 280 | 4,43 – 12,4 | Ultraviolet germicide (ex. : lampe germicide)[71] |
| Ultraviolet moyen | MUV | 200 – 300 | 4,13 – 6,20 | Middle ultraviolet |
| Ultraviolet B | UVB | 280 – 315 | 3,94 – 4,43 | |
| Ultraviolet proche | NUV | 300 – 400 | 3,10 – 4,13 | Near ultraviolet. Visible par les oiseaux, insectes et poissons |
| Ultraviolet A | UVA | 315 – 400 | 3,10 – 3,94 | lumière noire |
Notes et références
- ↑ « Spectre lumineux des lampes d’éclairage », sur energie-environnement.ch (consulté le ).
- ↑ Newsham, K. K. et Robinson, S. A. (2009), Responses of plants in polar regions to UVB exposure: a meta‐analysis, Global Change Biology, 15(11), 2574-2589.
- ↑ « Les UV-A Savoir », sur uv-damage.org (version du 21 octobre 2017 sur Internet Archive).
- ↑ Lire en ligne
- ↑ D’après J.W. Draper, « On a new Imponderable Substance and on a Class of Chemical Rays analogous to the rays of Dark Heat », The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, vol. LXXX, , p. 453-461
- ↑ D’après J.W. Draper, « Description of the Tithonometer », The Practical Mechanic and Engineer's Magazine, , p. 122-127.
- ↑ D’après (en) Steven Beeson et James W Mayer, Patterns of light : chasing the spectrum from Aristotle to LEDs, New York, Springer, , 196 p. (ISBN 978-0-387-75107-8, lire en ligne), « 12.2.2 Discoveries beyond the visible », p. 149
- 1 2 D’après Philip E. Hockberger, « A history of ultraviolet photobiology for humans, animals and microorganisms », Photochem. Photobiol., vol. 76, no 6, , p. 561–79 (PMID 12511035, DOI 10.1562/0031-8655(2002)0760561AHOUPF2.0.CO2)
- ↑ D’après James Bolton et Christine Colton, The Ultraviolet Disinfection Handbook, American Water Works Association, , 149 p. (ISBN 978-1-58321-584-5), p. 3-4.
- ↑ T. Lyman, « Victor Schumann », Astrophysical Journal, vol. 38, , p. 1–4 (DOI 10.1086/142050, Bibcode 1914ApJ....39....1L)
- 1 2 3 4 5 6 Kévin Lamy, Projection climatique du rayonnement ultraviolet au cours du 21e siècle : impact de différents scénarios climatiques, (lire en ligne), thèse de doctorat, université de La Réunion.
- ↑ (en) David H. Hathaway, « The Solar Cycle », Living Reviews in Solar Physics, vol. 12, no 1, , p. 4 (ISSN 2367-3648 et 1614-4961, PMID 27194958, PMCID PMC4841188, DOI 10.1007/lrsp-2015-4, lire en ligne, consulté le )
- ↑ (en) Michaela I. Hegglin et Theodore G. Shepherd, « Large climate-induced changes in ultraviolet index and stratosphere-to-troposphere ozone flux », Nature Geoscience, vol. 2, , p. 687–691 (DOI 10.1038/ngeo604, lire en ligne).
- ↑ (en) J. R. Ziemke, J. R. Herman, J. L. Stanford et P. K. Bhartia, « Total ozone/UVB monitoring and forecasting: Impact of clouds and the horizontal resolution of satellite retrievals », Journal of Geophysical Research : Atmospheres, no 103, , p. 3865–3871 (DOI 10.1029/97JD03324, lire en ligne).
- 1 2 (en) A. F. Bais, K. Tourpali, A. Kazantzidis, H. Akiyoshi, S. Bekki, P. Braesicke, M. P. Chipperfield, M. Dameris, V. Eyring, H. Garny et al., « Projections of UV radiation changes in the 21st century: impact of ozone recovery and cloud effects », Atmospheric Chemistry and Physics, vol. 11, , p. 7533–7545 (DOI 10.5194/acp-11-7533-2011).
- 1 2 (en) R. L. McKenzie, W. A. Matthews et P. V. Johnston, « The relationship between erythemal UV and ozone, derived from spectral irradiance measurements », Geophysical Research Letters, no 18, , p. 2269–2272 (DOI 10.1029/91GL02786, lire en ligne).
- ↑ (en) J. Sabburg et J. Wong, « The effect of clouds on enhancing UVB irradiance at the Earth’s surface: A one year study », Geophysical Research Letters, vol. 27, , p. 3337–3340 (DOI 10.1029/2000GL011683, lire en ligne).
- ↑ (en) J. S. Schafer, V. K. Saxena, B. N. Wenny, W. Barnard et J. J. De Luisi, « Observed influence of clouds on ultraviolet-B radiation », Geophysical Research Letters, vol. 23, , p. 2625–2628 (DOI 10.1029/96GL01984, lire en ligne).
- ↑ (en) F. Jégou, S. Godin-Beekmann, M. Corrêa, C. Brogniez, F. Auriol, V. Peuch, M. Haeffelin, A. Pazmino, P. Saiag, F. Goutail et al., « Validity of satellite measurements used for the monitoring of UV radiation risk on health », Atmospheric Chemistry and Physics, vol. 11, , p. 13377–13394.
- ↑ (en) Kévin Lamy et al., « Ultraviolet radiation modelling from ground-based and satellite measurements on Reunion Island, southern tropics », Atmospheric Chemistry and Physics, vol. 18, , p. 227–246 (DOI 10.5194/ acp-18-227-2018, lire en ligne).
- ↑ (en) Janusz W. Krzyścin et Sylwester Puchalski, « Aerosol impact on the surface UV radiation from the ground-based measurements taken at Belsk, Poland, 1980–1996 », Journal of Geophysical Research : Atmospheres, vol. 103, , p. 16175–16181 (DOI 10.1029/98JD00899, lire en ligne).
- ↑ (en) Mde P. Corrêa et al., « Projected changes in clear-sky erythemal and vitamin D effective UV doses for Europe over the period 2006 to 2100 », Photochem. Photobiol. Sci., vol. 12, , p. 1053–1064 (DOI 10.1039/c3pp50024a, lire en ligne).
- ↑ (en) O. Boucher et al., Climate Change 2013 – The Physical Science Basis : Working Group I Contribution to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change, Cambridge University Press, , 571–658 p. (DOI 10.1017/CBO9781107415324.016, lire en ligne), « Chapitre 7 - Clouds and Aerosols ».
- ↑ (en) A F. Bais, R. L. McKenzie, G. Bernhard, P. J. Aucamp, M. Ilyas, S. Madronich et K. Tourpali, « Ozone depletion and climate change: impacts on UV radiation », Photochem. Photobiol. Sci., vol. 14, , p. 19–52 (DOI 10.1039/C4PP90032D, lire en ligne).
- 1 2 3 4 5 6 Williamson et al. (2019), The interactive effects of stratospheric ozone depletion, UV radiation, and climate change on aquatic ecosystems, Photochemical & Photobiological Sciences, 18(3), 717-746.
- ↑ (en) V. Kakani, K. Reddy, D. Zhao et K. Sailaja, « Field crop responses to ultraviolet-B radiation: a review », Agricultural and Forest Meteorology, vol. 120, , p. 191–218 (DOI 10.1016/j.agrformet.2003.08.015, lire en ligne).
- ↑ (en) M. Vernet, E. A. Brody, O. Holm-Hansen et B. G. Mitchell, « The Response of Antarctic Phytoplankton to Ultraviolet Radiation: Absorption, Photosynthesis, and Taxonomic Composition », American Geophysical Union, , p. 143–158 (DOI 10.1029/AR062p0143, lire en ligne).
- ↑ (en) R. T. Noble et J. A. Fuhrman, « Virus decay and its causes in coastal waters », Applied and Environmental Microbiology, vol. 63, no 1, , p. 77–83 (ISSN 0099-2240 et 1098-5336, PMID 16535501, résumé)
- ↑ (en) D.-P. Häder, H. D. Kumar, R. C. Smith et R. C. Worrest, « Effects of solar UV radiation on aquatic ecosystems and interactions with climate change », Photochem. Photobiol. Sci., vol. 6, , p. 267–285 (DOI 10.1039/B700020K, lire en ligne).
- ↑ C. E. Williamson, S. Madronich, A. Lal, R. E. Zepp, R. M. Lucas, E. P. Overholt, K. C. Rose, G. Schladow et J. Lee-Taylor (2017), Climate change-induced increases in precipitation are reducing the potential for solar ultraviolet radiation to inactivate pathogens in surface waters, Sci. Rep., 7, 13033.
- ↑ I. N. Flamarique (2016), Diminished foraging performance of a mutant zebrafish with reduced population of ultraviolet cones, Proc. R. Soc., 283, 20160058.
- ↑ D. M. Leech et S. Johnsen (2006), Ultraviolet vision and forging in juvenile bluegill (Lepomis macrochirus), Can. J. Fish. Aquat. Sci., 63, 2183–2190
- ↑ Serge Berthier et Bernd Schöllhorn, « Des nids de guêpes d'une intense fluorescence », sur www.larecherche.fr (consulté le )
- ↑ Rhainds M et De Guire L (1998), Rayonnement ultraviolet : perspective de santé publique ; Levallois, P. et P. Lajoie (rédacteurs), Pollution astmosphérique et champs électromagnétiques, Sainte-Foy, Les Presses de l'université Laval, 237-266.
- ↑ De Guire L et Drouin L, « Les rayons ultraviolets et la santé », Travail et Santé, no 8(2), , p. 29-33
- ↑ Torii, H., Violet Light Exposure Can Be a Preventive Strategy Against Myopia Progression, EBioMedicine, 15, 210-219.
- ↑ Torii, H., Ohnuma, K., Kurihara, T., Tsubota, K. et Negishi, K. (2017), Violet Light Transmission is Related to Myopia Progression in Adult High Myopia [PDF], Scientific Reports, 7(1)
- ↑ Césarini JP (2007), Rayonnement ultraviolet et santé, Radioprotection, 42(03), 379-392 (résumé).
- ↑ Perrot J.-Y., Désinfection des eaux destinées à la potabilisation par UV, Roissy, Wedeco ITT Industrie, , 54 p.
- ↑ IARC (2008), World Cancer Report
- ↑ Armstrong B (2004), How sun exposure causes skin cancer: an epidemiological perspective. Dans Prevention of skin cancer, de Elwood J., English D. et Hill D., p. 89-116.
- ↑ OMS (1999), Aide-mémoire (305)
- ↑ Smedby, K. E., Hjalgrim, H., Melbye, M., Torrång, A., Rostgaard, K., Munksgaard, L. … et Adami, H. O. (2005), Ultraviolet radiation exposure and risk of malignant lymphomas, Journal of the National Cancer Institute, 97(3), 199-209 (résumé)
- ↑ De Laat, A., Van der Leun, J. et De Grujl, F. (1997), Carcinogenesis induced by UVA (365- nm) radiation: the dose–time dependence of tumor in hairles mice, Carcinogenesis, 18 (5), p. 1013-1020
- 1 2 3 4 5 6 Bonneau J (2010), Utilisation des outils d'estimation de l’exposition au rayonnement ultraviolet solaire pour améliorer la prévention : une interface santé au travail et santé publique (Cas des agriculteurs de Suisse romande), mémoire de diplôme d'ingénieur, 11 octobre 2010, EHESP
- ↑ Fiorenza Gracci, « Les UV du soleil tuent bien le coronavirus, montrent deux études italiennes », science-et-vie.com, (lire en ligne, consulté le ).
- ↑ Organisation mondiale de la santé, « Rayonnement UV » (consulté le ).
- ↑ « Soleil et cancer : UVA, les risques démasqués », CNRS, (version du 26 juillet 2009 sur Internet Archive)
- ↑ « Understanding UVA and UVB - SkinCancer.org », sur skincancer.org (consulté le )
- 1 2 F. R. de Gruijl, « Photocarcinogenesis: UVA vs UVB », Methods in Enzymology, vol. 319, , p. 359-366 (ISSN 0076-6879, PMID 10907526, lire en ligne, consulté le )
- ↑ Pour la science, Actualité, no 403, mars 2011
- ↑ Frank R. de Gruijl, « Photocarcinogenesis: UVA vs. UVB radiation », Skin Pharmacology and Applied Skin Physiology, vol. 15, 2002 sep-oct, p. 316-320 (ISSN 1422-2868, PMID 12239425, DOI 10.1159/000064535, lire en ligne, consulté le )
- ↑ Gary M. Halliday, Diona L. Damian, Sabita Rana et Scott N. Byrne, « The suppressive effects of ultraviolet radiation on immunity in the skin and internal organs: implications for autoimmunity », Journal of Dermatological Science, vol. 66, , p. 176-182 (ISSN 1873-569X, PMID 22277701, DOI 10.1016/j.jdermsci.2011.12.009, lire en ligne, consulté le )
- ↑ F. R. de Gruijl, H. J. van Kranen et L. H. Mullenders, « UV-induced DNA damage, repair, mutations and oncogenic pathways in skin cancer », Journal of Photochemistry and Photobiology. B, Biology, vol. 63, , p. 19-27 (ISSN 1011-1344, PMID 11684448, lire en ligne, consulté le )
- ↑ Commission européenne, d'après avis du SCHEER, « Lampes à UV-C : un appareil qui tue les bactéries et les virus pourrait-il être mauvais pour votre santé? », (consulté le )
- ↑ « The National Institutes of Health (NIH) Consensus Development Program: Sunlight, Ultraviolet Radiation, and the Skin », sur consensus.nih.gov (consulté le )
- ↑ (en) « Environnement spatial (naturel et artificiel) — Procédé de détermination des irradiances solaires », International Standard, no ISO 21348, , p. 5 (lire en ligne).
- ↑ « Comment choisir un indice de protection solaire ? », sur Biafine (consulté le ).
- ↑ « RoC : l'expert en cosmétiques » (version du 22 février 2011 sur Internet Archive).
- ↑ http://www.live2times.com/1954-roc-invente-la-creme-solaire-ecran-total-e--7576/
- ↑ « Applications », sur s-et.com (version du 6 octobre 2008 sur Internet Archive).
- ↑ (en) « Ultraviolet Light, UV Rays, What is Ultraviolet, UV Light Bulbs, Fly Trap », Pestproducts.com (consulté le )
- ↑ Raynal C (2011) Médicaments irradiés, sources de santé. Revue d'histoire de la pharmacie, 59(369), 53-70.(résumé)
- ↑ Jacobs, G. H. (1992). Ultraviolet vision in vertebrates. American Zoologist, 32(4), 544-554.
- ↑ Losey, G. S., Cronin, T. W., Goldsmith, T. H., Hyde, D., Marshall, N. J. et McFarland, W. N. (1999), The UV visual world of fishes: a review, Journal of Fish Biology, 54(5), 921-943.
- ↑ Novales-Flamarique, H. et Hawryshyn, C. (1994), Ultraviolet photoreception contributes to prey search behaviour in two species of zooplanktivorous fishes, Journal of Experimental Biology, 186(1), 187-198.
- ↑ Voir les références sur la page Photographie UV
- 1 2 (en) Commission européenne Santé publique, « Bancs solaires et rayonnement UV » (version du 8 avril 2009 sur Internet Archive).
- ↑ (en) CIE, « 134/1 TC 6-26 report: Standardization of the Terms UV-A1, UV-A2 and UV-B » (version du 31 mars 2016 sur Internet Archive).
- ↑ (en) « ISO 21348-2007 Environnement spatial (naturel et artificiel) — Procédé de détermination des irradiances solaires » (version du 16 juillet 2011 sur Internet Archive).
- ↑ (en) Karl G. Linden et Jeannie L. Darby, « Estimating Effective Germicidal Dose from Medium Pressure UV Lamps », sur Journal of Environmental Engineering, (ISSN 0733-9372, DOI 10.1061/(ASCE)0733-9372(1997)123:11(1142), consulté le ), p. 1142–1149
Voir aussi
Articles connexes
- Lumière noire
- Lampe de Wood
- Compteuse de billets
- Cancer de la peau
- Mélatonine
- Vitamine D
- Photodégradation
- Photochimie, pollution photochimique
- Ozone troposphérique
- Rayonnement solaire
- Nucléation de la vapeur d'eau atmosphérique :
Bibliographie
- Pierre Bessemoulin et Jean Oliviéri (2000), Le rayonnement solaire et sa composante ultraviolette.
- Pol Dyèvre et Paul Méreau, Effets sur la santé de l'exposition professionnelle aux rayonnements ultraviolets.
- Justine Bonneau, « Utilisation des outils d’estimation de l’exposition au rayonnement ultraviolet solaire pour améliorer la prévention : une interface santé au travail et santé publique (Cas des agriculteurs de Suisse romande) » (version du 4 mars 2016 sur Internet Archive), mémoire de diplôme d'ingénieur, , EHESP.
- Niankan Kouassi (2016), Potentiel d'entreposage à long terme de la carotte après une introduction de résistance naturelle aux maladies par la lumière UV-C (résumé).
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Ressources relatives à la santé :
- (en) Medical Subject Headings
- (cs + sk) WikiSkripta
- Connaître l'index UV en France, La Sécurité Solaire
- Évaluation des risques associés aux bancs solaires et à l'exposition aux UV (résumé par GreenFacts du rapport du SCCP de la Commission européenne)
- Le rayonnement ultraviolet, Organisation mondiale de la santé
- (en) J. L. Lean et E. O. Hulburt, « Comment on Validating the solar EUV proxy, E10.7 » (version du 15 février 2005 sur Internet Archive) (article, Journal of Geophysical Research, vol. 107, n° A2, 1027, DOI 10.1029/2001JA000137, 2002, par W. K. Tobiska), à propos du forçage radiatif des UV solaires.