_(14782023652).jpg.webp)
| Médicament | Calcitriol et ergocalciférol |
|---|---|
| Spécialité | Endocrinologie |
| CIM-10 | E55 |
|---|---|
| CIM-9 | 268 |
| OMIM | 277440, 600081 et 600785 264700, 277440, 600081 et 600785 |
| DiseasesDB | 9351 |
| MedlinePlus | 000344 |
| eMedicine | 985510 |
| MeSH | D012279 |
| MeSH | D012279 |
| Patient UK | Vitamin-d-deficiency-including-osteomalacia-and-rickets |
![]() Mise en garde médicale
Mise en garde médicale
Le rachitisme est une maladie de la croissance et de l'ossification observée chez le nourrisson et le jeune enfant. Elle se caractérise par une insuffisance de calcification des os et des cartilages et elle est due à une carence en vitamine D et en calcium.
Cette carence est principalement liée à un défaut d'exposition solaire (rayonnement ultra-violet), plus accessoirement à des carences alimentaires. Le rachitisme est une maladie socio-géographique, dépendant de la latitude, du climat, de la couleur de la peau, mais aussi de l'alimentation, de l'habillement, et d'un milieu urbain défavorisé (vie à l'intérieur ou en pollution atmosphérique).
Le rachitisme se présente comme un ensemble de déformations osseuses pouvant avoir des conséquences graves : troubles respiratoires et infections pulmonaires, ou encore, chez la fille, un bassin osseux étroit et rétréci, futur obstacle à un accouchement.
La gravité de ces conséquences contraste avec la simplicité de la prévention (supplémentation en vitamine D). Cependant, si le rachitisme carentiel a presque disparu des pays développés, le déficit en vitamine D reste un problème d'actualité, à l'échelon local comme au niveau mondial.
Histoire
Préhistoire
Le rachitisme est très rare durant la préhistoire et la Haute Antiquité, probablement à cause de l'exposition solaire des chasseurs-cueilleurs, et des premiers agriculteurs[1]. Presque tous les cas observés sur les restes osseux, de la préhistoire au Moyen Âge, proviennent d'Europe septentrionale et de la Sibérie[2]. En 1998, on ne connaissait que deux ou trois cas de momies égyptiennes avec rachitisme probable, dont celle d'un babouin en captivité[1],[3].
Le diagnostic paléopathologique de rachitisme nécessite des critères précis et techniques, faute de quoi il peut s'agir d'un artefact de « pseudopathologie ». Selon le type de sol (acide et mal drainé), les os enterrés peuvent se décalcifier, et le crâne ou les os longs se déformer sous la pression du terrain, ce qui a pu donner lieu à des diagnostics erronés de rachitisme[4].
Un autre type célèbre de faux diagnostic de rachitisme fut celui de l'anatomo-pathologiste Rudolf Virchow qui, en 1872, au vu du crâne de l'Homme de Néanderthal, diagnostiqua un cas d'homme moderne atteint de rachitisme dans son enfance[5].
Antiquité et Moyen-Âge
Rare dans l'Antiquité, le rachitisme aurait été décrit en médecine chinoise probablement dès le IIIe siècle av. J.-C., et plus sûrement à partir du VIIe siècle apr. J.-C.[6]. Toutefois, les médecins chinois ont pensé chaque déformation comme une manifestation unique et séparée, en l'attribuant au froid, sans en reconnaitre le tableau d'ensemble complet[7].
La maladie est ignorée chez les Egyptiens et les Grecs. Selon Mirko Grmek, la rareté du rachitisme en Grèce classique est attestée par l'absence totale, dans les traités gynécologiques hippocratiques, des déformations pelviennes (partie inférieure du bassin), cause mécanique principale des accouchements difficiles. Les données ostéo-archéologiques confirment la rareté de ces déformations et la largeur relative du bassin féminin grec antique[2].
Aux yeux des médecins, le rachitisme serait devenu apparent sous l'Empire romain, lié à la concentration urbaine, aux changements des habitudes alimentaires, et à la paupérisation de certaines couches de la population[2].
Au IIe siècle après J.-C., Soranos d'Éphèse mentionne les déformations des jambes et de la colonne vertébrale des jeunes enfants. Il note que la maladie est plus fréquente dans la ville de Rome que dans les cités grecques. Galien décrit plus précisément les genoux cagneux (genu valgum), les jambes arquées, et les déformations du thorax[6].
Ces troubles ne sont plus guère mentionnés, ou de façon peu claire, jusqu'au XVIIe siècle. C'est alors que deux médecins anglais en donnent les premières descriptions modernes (tableau synthétique).
Études cliniques (XVIIe siècle - XIXe siècle)
Le terme anglais Rickets apparait en 1634 dans le Registre de décès de la ville de Londres (en). L'origine du terme est très discutée : de rucket « souffle court » (dialecte du Dorset), de rucken « secouer ou tituber », de wricken « tordre » (moyen anglais), de rick « entassé ou courbé » (vieil anglais), de riquets « bossu » (normand)[6].

En 1645, Daniel Whistler (en) publie, à Londres, une thèse médicale intitulée De Morbo puerili Anglorum, quem patrio idiomate indigenæ vocant The Rickets « De la maladie des enfants anglais populairement appelée the Rickets ».
En 1650, Francis Glisson en donne une description clinique complète[8], considérée comme un classique du genre, en lui donnant le nom de rachitis (dérivé du terme grec pour épine dorsale ou colonne vertébrale) dans Rachitide sive Morbo Puerili, qui vulgo The Rickets dicitur.
Le terme savant rachitisme sera adopté en français, alors que le terme vulgaire rickets reste communément utilisé en anglais.
Whistler et Glisson voient cette maladie comme d'apparition récente, provenant de Dieu, des étoiles ou de la nature elle-même[9]. Glisson décrit une plus grande fréquence de rachitisme chez les enfants des grandes villes. Il note que la maladie frappe aussi aux « berceaux des riches ».
En effet, le climat moins ensoleillé de l'Europe du Nord, les nouvelles conditions démographiques et socio-économiques (développement urbain) peuvent avoir augmenté les cas de rachitisme. De même, la pratique d'emmailloter les nourrissons et de les sevrer à la bouillie de céréales a pu contribuer à une carence ou un déficit en vitamine D[6].
Au XVIIIe siècle, la maladie devient endémique dans toutes les villes d'Europe du Nord. À Paris, Nicolas Andry créé le terme « orthopédie » en publiant L'Orthopédie, ou l'Art de prévenir et de corriger dans les enfants les difformités du corps, notamment celles liées au rachitisme. Thomas Percival (1740-1804) est le premier à mentionner l'huile de foie de morue dans le traitement du rachitisme[10]. En 1825, Bretonneau et Trousseau introduisent ce traitement en France[11].
À la fin du XIXe siècle, les origines du rachitisme restent obscures. Les uns l'attribuent à une mauvaise alimentation, d'autres au manque de lumière solaire, au manque d'exercice ou à l'air pollué, d'autres encore à une maladie par dégénérescence en rapprochant le rachitisme de la syphilis congénitale (quelques signes osseux pouvant être similaires)[12].
Études biochimiques
Il faut attendre le XXe siècle pour véritablement comprendre la nature biochimique et environnementale de la maladie. En 1908, Leonard Findlay (1878-1947) reproduit la maladie chez les chiots en les maintenant confinés dans des endroits sombres. En 1917, Hess et Unger montrent qu'ils peuvent prévenir le rachitisme, non seulement par l'huile de foie de morue, mais aussi par exposition au rayonnement ultra-violet[6].
À partir de 1919, plusieurs chercheurs, dont Edward Mellanby et Elmer McCollum, parviennent à isoler les différentes vitamines D à partir de l'huile de foie de morue. Leurs premières formules chimiques sont établies en 1935 par Adolf Windaus (déjà Prix Nobel de Chimie 1928 pour ses travaux sur les stérols) qui réalise aussi la synthèse d'un précurseur, la provitamine D3[11].
Dans les années 1960-1970, le métabolisme des vitamines D est précisé grâce aux méthodes par traceur isotopique[6],[11].
Pathogénie
Voir les sources, le métabolisme et le rôle osseux de la vitamine D
Le rachitisme est une carence en vitamine D entrainant un trouble de minéralisation du squelette en croissance, de la naissance à l'adolescence. Chez l'adulte et les personnes âgées, cette carence participe à l'apparition de troubles osseux analogues appelés ostéomalacie et ostéoporose.
Causes de la carence

La cause principale est la réduction de l'exposition solaire qui ne permet plus de produire de vitamine D3 naturelle (cholécalciférol) au niveau de la peau (source essentielle principale). Cette carence peut être aggravée par des apports alimentaires insuffisants (dénutrition, malnutrition, manque de calcium…) ou encore des maladies digestives par malabsorption. L'apport alimentaire et le lait maternel, non supplémentés, sont une source très faible de vitamine D. Le lait maternel ne contient que 1,5 à 3 % du taux plasmatique maternel, soit environ 20 à 60 UI par litre de lait, quantité insuffisante pour couvrir les besoins quotidiens du nourrisson[13],[14].
Les autres causes sont beaucoup plus rares : maladies génétiques du métabolisme de la vitamine D, maladies génétiques du métabolisme des phosphates, maladies rénales ou hépatiques.
La réduction de l'exposition solaire est liée à un ensemble de facteurs socio-géographiques. Les facteurs naturels et climatiques sont la latitude, la saison, l'altitude, l'atmosphère (brumes, brouillard…) La géographie du rachitisme peut être modifiée par le régime alimentaire (les peuples les plus proches des pôles dépendent de la mer pour leur survie).
Il en est de même pour les modifications liées à l'activité humaine et aux facteurs culturels au cours de l'histoire : urbanisation (rues étroites et sombres, pollution de l'air par poussières et fumées - chauffage domestique au charbon), allaitement maternel prolongé suivi d'un sevrage aux féculents (régime carencé), confinement saisonnier ou permanent des enfants, habitudes vestimentaires, travail des enfants et des jeunes mères (en milieu agricole ou en milieu industriel)[15]…
Certains régimes alimentaires (non supplémentés) peuvent favoriser le rachitisme comme ceux constitués presque uniquement de pain traditionnel comme le chapati ou le pita, ou de céréales (riz, maïs) et féculents. Ce type de régime trop riche en fibres, en phytates et en lignines diminue l'absorption de calcium. S'il est exclusif et prolongé, il peut conduire à des situations de rachitisme, même en exposition solaire adéquate[16].
Conséquences
L'ensemble du squelette est concerné (jusqu'au nanisme dans les cas extrêmes[1]), mais les lésions les plus spécifiques s'observent au niveau des os longs, au cartilage de croissance des métaphyses[13]. Ces os longs se déforment et se courbent sous le poids du corps, d'abord aux membres inférieurs, puis aux supérieurs dans les formes sévères[1].

Les épiphyses sont l'objet d'un remodelage (le tissu osseux non minéralisé s'accumule de façon anarchique) aboutissant à un élargissement des extrémités des os : bourrelets ou nodosités osseuses visibles ou palpables notamment au niveau des côtes, des poignets ou des chevilles.
Au niveau des os plats, le défaut de minéralisation provoque des zones de ramollissement avec des zones d'épaississement. Les déformations du crâne donnent un aspect de « grosse tête carrée »[1].
Ce même défaut retentit sur la dentition (retard d'éruption, dents fragiles, caries précoces) et le système musculaire (faiblesse et perte de tonus, hernies fréquente, retard à tenir la tête, à la position assise, debout, à la marche).
Le rachitisme à lui seul (sans autre maladie associée) menace rarement la vie de façon immédiate et directe, mais il constitue un handicap compromettant la qualité de vie. Il peut indirectement causer à moyen ou long terme des problèmes graves. Chez les filles, les déformations du bassin entrainaient à l'âge adulte des accouchements difficiles voire impossibles par voie naturelle. Dans les deux sexes, les déformations thoraciques entrainaient des difficultés respiratoires avec infections fréquentes (« poumon rachitique »)[13],[17].
Chez l'animal

La plupart des vertébrés (des poissons osseux aux primates) dépendent de l'exposition solaire pour leurs besoins en vitamine D[18]. Le foie des téléostéens marins est bien connu pour sa richesse en vitamine D (utilisation traditionnelle de l'huile de foie de morue)[19].
Le rachitisme peut les affecter en phase de croissance osseuse. Il s'agit alors d'un rachitisme expérimental (reproduction en laboratoire) ou en situation de confinement à l'abri de la lumière (animaux nés en captivité).
Chez les oiseaux, l'ablation de la glande uropygienne (située au niveau du croupion) entraine un rachitisme, même en situation d'exposition solaire. Cette glande sécrète, entre autres, une provitamine D qui se dépose sur les plumes pour être convertie en vitamine D à la lumière solaire[19].
Une question reste problématique, celle de l'absence de rachitisme chez des animaux nocturnes, frugivores ou insectivores, comme certaines espèces de chauves-souris. L'hypothèse proposée est que ces animaux se nourriraient aussi de fruits ou autres végétaux (champignons) qui ont été séchés au soleil durant la journée. Processus au cours duquel se ferait une conversion de l'ergostérol végétal en vitamine D2, susceptible d'avoir une activité anti-rachitique[20].
Épidémiologie
Données historiques
Historiquement, le rachitisme prend de l'importance lors de l'urbanisation de l'Europe centrale et du nord à la fin du Moyen Âge. Cet accroissement est maximum au début de l'ère industrielle dans les mêmes régions, lié au climat, à la pollution urbaine et aux conditions de vie. Au tout début du XXe siècle, des auteurs signalent que plus de 80 % des enfants de moins de 4 ans des grandes villes d'Europe du Nord présentent des signes cliniques de rachitisme, avec des variations saisonnières[16].

Aux États-Unis, le rachitisme apparait dans les grandes villes (New York, Boston, La Nouvelle-Orléans) vers la fin du XIXe siècle, en étant plus fréquent chez les Noirs que chez les Blancs, notamment lors de la migration des familles noires du sud agricole vers le nord industriel. On considérait alors comme presque normal, un rachitisme modéré des jeunes enfants noirs en zone urbaine.
En général, le rachitisme se voit principalement dans les pays faiblement ensoleillés, dans les pays où les enfants sortent peu, dans les zones urbaines défavorisées (pollution, manque de lumière) et plus souvent chez les individus à peau foncée. En 1967 et 1970, W. F Loomis propose une théorie[21] selon laquelle la peau claire des populations vivant loin de l'équateur, dans les régions de faible ensoleillement, serait le résultat d'une évolution naturelle ayant pour résultat d'éviter le rachitisme (la peau foncée filtrant davantage les UV, ce qui limite les cancers de la peau mais limite aussi la synthèse de vitamine D)[15],[16].
Si cette théorie est généralement acceptée en ce qui concerne la couleur de la peau humaine, la vitamine D, et les cancers de la peau, elle parait moins pertinente pour la répartition du rachitisme. En effet cette répartition en sus de la latitude, dépend aussi du climat, de l'altitude, de l'alimentation et de facteurs socio-économiques. De plus le diagnostic de rachitisme peut varier selon les critères utilisés : sur la seule clinique, on ne distingue que les cas avérés les plus sévères, sur des critères biochimiques, on peut ajouter tous les cas potentiels, à risque plus élevé (déficience et non carence en vitamine D)[16].
Données modernes
Le rachitisme est devenu rare dans les pays développés grâce au dépistage précoce et surtout au traitement prophylactique. Il persiste toutefois un risque de déficience en vitamine D chez les adolescents selon leur mode de vie en hiver, ou encore chez les migrants asiatiques en Grande-Bretagne. Enfin, il existe aussi un rachitisme lié à la maltraitance de l'enfant, ou du moins à une négligence éducative.
Dans les pays ensoleillés, le rachitisme peut exister en Méditerranée orientale, Éthiopie et Moyen-Orient, Inde du nord… surtout dans les villes, selon des facteurs culturels (habillement, alimentation, confinement des petits enfants ou des jeunes femmes…)[15]. Il est rare en Afrique tropicale, et ne survient que dans des circonstances particulières (nourrissons trop vêtus, reclus dans un endroit sombre) par crainte superstitieuse[16],[22].
Le rachitisme est aussi répandu chez les enfants migrants ou transplantés, d'une région subtropicale à un pays froid ou tempéré[22].
Description clinique
La forme clinique classique est celle du nourrisson et du petit enfant, le plus souvent en rapport avec une carence maternelle en vitamine D durant la grossesse.
Le rachitisme néonatal est rare, survenant seulement chez les nouveau-nés de mère avec carence très sévère (mère déjà carencée pour elle-même, avec retentissement sur son propre squelette).
Forme débutante
Le plus souvent, le rachitisme se distingue cliniquement à partir de l'âge de 3 mois par la persistance prolongée de la mollesse des os du crâne (le pariétal et l'occipital sont normalement mous pendant les 3 premiers mois). Cette mollesse qui persiste au-delà est appelée « craniotabès ». Il s'agit d'une zone de ramollissement de taille variable, de la consistance analogue au celluloid. Elle siège en plein os à distance des sutures, elles-mêmes ramollies.
Ce craniotabès tardif peut s'accompagner d'une ébauche de bourrelet osseux aux poignets, aux chevilles, et au niveau des côtes. Appelés « nouures épiphysaires » et « chapelet costal », ce sont les deux signes cliniques majeurs pour le diagnostic[13].
Non prévenu ou non traité, le rachitisme évolue vers une forme complète du petit enfant. Les signes osseux restent les signes principaux, ils sont indolores, symétriques et diffus (une déformation isolée exclut le rachitisme).
Forme complète
Le craniotabès persiste avec élargissement ramolli des sutures crâniennes, retard à la fermeture des fontanelles, retard de l'éruption dentaire, caries précoces, voûte du palais en ogive.
Le crâne subit des déformations : plagiocéphalie symétrique (aplatissements latéraux, aspect de tête carrée), front olympien (saillie des bosses frontales), crâne natiforme (saillie des bosses pariétales).

Les atteintes des membres sont les plus caractéristiques. Les bourrelets ou renflements osseux sont d'abord palpables au poignet, bord externe du radius (précoce), et à la cheville (au-dessus de la pointe de la malléole externe), puis visibles.
Les déformations osseuses prédominent aux membres inférieurs (aggravées par la station debout et la marche), en restant plus discrètes aux membres supérieurs. L'aspect le plus fréquent est le genu varum (jambes arquées en parenthèses) ; plus rare est la déformation inverse ou genu valgum (jambes arquées en X). La crête du tibia peut faire saillie « en lame de sabre ». Ces déformations indiquent un rachitisme sévère. Plus tardivement, une coxa vara (déplacement de la tête du fémur) peut apparaitre avec une « démarche en canard ».
Ces déformations retentissent sur le bassin osseux qui s'aplatit ou se rétrécit. Chez les filles, c'est une future source éventuelle de dystocie osseuse (accouchement difficile par bassin étroit), cause historique importante de décès maternel lors de l'accouchement.
Au niveau du thorax, le chapelet costal est très évocateur. Il s'agit de nodosités saillantes et symétriques de la jonction entre les côtes osseuses et le cartilage costo-sternal (côtes et sternum). Elles sont alignées selon une ligne oblique en bas et en dehors, à partir de la ligne mamelonnaire (axe vertical passant par le mamelon). À ne pas confondre avec la saillie normale de l'extrémité antérieure des côtes, en dos d'âne asymétrique.
Les autres déformations thoraciques sont l'aplatissement antéro-postérieur, l'élargissement à la base, la projection du sternum en avant (thorax « en carène » ou « en bréchet de poulet » ou pectus carinatum), ou au contraire sternum enfoncé (pectus excavatum).
Une seule déformation, unique et isolée, exclut le rachitisme, en relevant d'autres causes. Le rachitisme se distingue par son caractère diffus et multiple.
Il existe enfin une perte de tonus musculaire, nette et constante, avec retards de développement (de la tenue de la tête à la marche). Cette hypotonie retentit sur la colonne vertébrale, entrainant une cyphose d'attitude facilement réductible (souple, non raide et non bloquée). Dans les cas sévères, le ventre est gros, flasque et étalé avec hernies fréquentes.
Signes radiologiques et biologiques
Radiologie
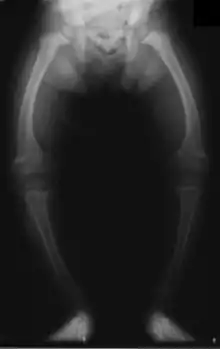
La radiologie confirme le diagnostic, et il est inutile de les multiplier. Le défaut de minéralisation des os longs s'observe particulièrement sur les radiographies de face d'un poignet et des genoux : retard ou irrégularités des points d'ossifications attendus pour l'âge (maturation squelettique), lignes métaphysaires irrégulières donnant un aspect « en toit de pagode », la corticale de la diaphyse est amincie, la densité osseuse est diminuée donnant un aspect vermoulu. Les os longs s'incurvent.
Au niveau du thorax, le chapelet costal clinique donne un aspect radiologique, surtout visible de profil, « en bouchon de champagne » des jonctions chondro-osseuses. En sus des déformations osseuses, on peut observer des atteintes pulmonaires par troubles de la ventilation.
Biologie
Les signes sanguins les plus constants sont l'abaissement des phosphates et l'augmentation des phosphatases alcalines, qui traduisent les réactions et perturbations de la construction osseuse en situation de carence en vitamine D et calcium.
La baisse de calcium dans le sang (hypocalcémie) n'existe que dans la moitié des cas.
Le dosage de la vitamine D sous sa forme hydroxylée 25-(OH)D (forme de réserve hépatique) peut être utile pour adapter le traitement. Le dosage simultané de la forme précédente avec la forme 1,25-(OH)2D (forme active rénale) permet de distinguer différents rachitismes autres que le rachitisme carentiel[23].
Il existe de nombreuses autres anomalies biologiques qui ont de la valeur pour la recherche, mais de peu d'intérêt en pratique courante[13].
Évolution et complications
Sous traitement curatif, l'amélioration est rapide. L'hypocalcémie se corrige en quelques jours, les autres signes biologiques comme le tonus musculaire en quelques semaines, la minéralisation osseuse en un à trois mois. Les déformations des os longs se corrigent lentement en plusieurs années[13]. La normalisation est d'autant plus lente que le rachitisme est traité tard.
Non traitée, l'évolution peut être spontanément favorable quand la croissance se ralentit (vers l'âge de 2 ans), et le rachitisme guérit (n'évolue plus) vers l'âge de 3 à 4 ans. Cela se fait au prix de séquelles permanentes : déformations thoraciques et de la colonne vertébrale. Les déformations des membres peuvent s'estomper avec l'âge.
Les complications sont celles de l'hypocalcémie (qui peut être révélatrice, apparaître en premier) : convulsions, tétanie. Les troubles cardiaques par hypocalcémie sont rares, mais graves (pronostic vital)[13].
Les autres complications sont infectieuses et respiratoires, ou liées à la faiblesse de la musculature (hernies), ou encore des épisodes anémiques ou digestifs. Les plus graves sont les complications pulmonaires (pneumonies) qui engagent aussi le pronostic vital dans les pays dépourvus d'infrastructures sanitaires.
 Enfants d'une même famille souffrant de rachitisme, Paris, vers 1912.
Enfants d'une même famille souffrant de rachitisme, Paris, vers 1912. Femme souffrant de nanisme et de rachitisme, vers 1912.
Femme souffrant de nanisme et de rachitisme, vers 1912.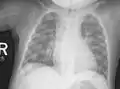 Radiographie du thorax.
Radiographie du thorax.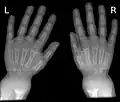 Radiographie de mains et poignets.
Radiographie de mains et poignets.
Formes cliniques
Rachitismes carentiels
Le rachitisme carentiel peut s'associer avec d'autres maladies infectieuses et métaboliques, en particulier le scorbut (carence en vitamine C).
Un rachitisme avec fractures multiples à la radio doit faire penser à un syndrome de Silverman, dans le cadre d'une maltraitance sur mineur.
Le rachitisme des prématurés et néonatal (dès la naissance) se distinguent souvent par une hypocalcémie précoce. Ils sont prévenus par l'administration de vitamine D aux femmes enceintes (dernier trimestre de grossesse) et au nouveau-né.
Le rachitisme carentiel peut se manifester chez le grand enfant et l'adolescent, à mode de vie particulier (vie recluse, longs vêtements), avec carence alimentaire en calcium. Il se caractérise alors par son caractère douloureux (douleurs osseuses) et une fatigabilité à la marche, parfois avec crises de tétanie.
Autres rachitismes
Les rachitismes dit vitamino-résistants (non améliorés par vitaminé D) sont rares, le plus souvent d'origine génétique.
Ce sont le rachitisme hypophosphatémique, lié au chromosome X (transmission dominante liée à l'X), et les rachitismes pseudo-carentiels de transmission autosomique récessive : type 1 par déficit en α-hydroxylase (rachitisme, douleurs osseuses et myasthénie) et type 2 par résistance périphérique au calcitriol (rachitisme et alopécie)[23].
Des maladies digestives, hépatiques, rénales, prises médicamenteuses peuvent interférer avec le métabolisme de la vitamine D et favoriser le risque de rachitisme.
Traitement
Préventif
.jpg.webp)
Sa prévention est simple, elle consiste en l'administration régulière de vitamine D aux femmes enceintes au cours du dernier trimestre de grossesse ; puis au nouveau-né de la naissance jusqu'à l'âge de 18 mois ; au-delà de 18 mois, selon les cas et les situations à risques, cette prévention peut être répétée au cours des hivers jusqu'à la fin de la croissance.
Cette supplémentation, autrefois effectuée par de l'huile de foie de morue, est actuellement administrée via des préparations pharmaceutiques de cholécalciférol.
Les besoins varient d'un enfant à un autre en fonction du poids à la naissance et d'une éventuelle prématurité, de l'ensoleillement (lieu de vie, saison) et de l'âge (les besoins sont maximaux jusqu'à 18 mois).
En France, chez l'enfant jusqu'à l'âge de 2 à 3 ans, un apport systématique de 1000 à 1200 UI/j est préconisé, ou réduit à 600-800 UI/j en cas d'utilisation de lait enrichi. Toujours en France, l'enrichissement en vitamine D du lait, des produits laitiers et des huiles est autorisé. C'est particulièrement le cas depuis 1992 des laits pour nourrissons et des préparations pour nourrissons[23].
L'allaitement maternel exclusif représente un risque de carence, car le lait maternel contient très peu de vitamine D (moins de 60 UI par litre, représentant moins de 3 % du taux sanguin maternel)[14].
Curatif
Les doses de vitamine D sont plus importantes. L'administration se fait par voie orale, soit de façon quotidienne 5 000 UI/j pendant un mois, soit en une seule dose de charge de 100 000 à 200 000 UI, renouvelée un mois plus tard.
Un traitement d'entretien (à visée préventive) prend ensuite le relais du traitement curatif[13].
En cas d'hypocalcémie, un apport de calcium est nécessaire selon le régime alimentaire du nourrisson et de l'enfant.
.JPG.webp)
Cas historiques et artistiques
Une étude de paléopathologie a montré qu'un enfant de la famille des Médicis, un fils de François Ier de Médicis, identifié comme étant Filippo (1577-1582), était atteint de rachitisme sévère. Les auteurs de l'étude attribuent ce rachitisme à un allaitement prolongé (à l'époque, il pouvait dépasser les deux ans), suivi d'un régime alimentaire inapproprié, les enfants fragiles restant confinés à l'intérieur des habitations[10].
Des peintres ont apparemment remarqué le rachitisme avant les médecins (Whistler 1645 et Glisson 1650). C'est le cas de Hans Burgkmair avec sa Vierge à l'enfant (1509) et du Caravage avec son Amour endormi (1608)[10].
En littérature, un personnage de Charles Dickens, l'enfant Tiny Tim, dans A Christmas Carol, a été analysé comme étant atteint de tuberculose et de rachitisme[17],[24].
Références
- 1 2 3 4 5 (en) Artur C. Aufderheide, The Cambridge Encyclopedia of Human Paleopathology, Cambridge, Cambridge University Press, , 478 p. (ISBN 0-521-55203-6), p. 305-310.
- 1 2 3 Mirko D. Grmek, Les maladies à l'aube de la civilisation occidentale, Paris, Payot, coll. « Médecine et Sociétés », , 527 p. (ISBN 2-228-55030-2), p. 118-120.
- ↑ Les squelettes étudiés de l'antiquité égyptienne se comptent au moins en plusieurs dizaines de milliers. Le professeur Grafton Elliot-Smith, anatomiste au Caire, examina jusqu'à sa mort (1937) près de 30 000 squelettes, des périodes pré-dynastiques au début de l'ère chrétienne, soit plus de 4 000 ans (Pierre L. Thillaud 1996, op. cit., p. 15 (note 17).
- ↑ (en) Calvin Wells, Pseudopathology, Charles C. Thomas, , p. 6.dans Diseases in Antiquity, Don Brothwell et A.T. Sandison (dir.)
- ↑ Pierre L. Thillaud, Paléopathologie humaine, Sceaux, Kronos B.Y. Editions, , 238 p. (ISBN 2-910652-03-3), p. 14 (note 10).
- 1 2 3 4 5 6 (en) R. Ted Steinbock, Rickets and Osteomalacia, Cambridge, Cambridge University Press, , 1176 p. (ISBN 0-521-33286-9), p. 978.dans The cambridge World History of Human Disease, K.F. Kiple (dir.)
- ↑ (en) T'AO LEE, Historical Notes on Some Vitamin Deficiency Diseases in China, Charles C. Thomas, , p. 421-422.dans Diseases in Antiquity, Don Brothwell et A.T. Sandison (dir.)
- ↑ Nouvelle édition avec George Bate et Assuerus Regemorter, De rachitide sive morbo puerili tractarus, opera primo ac potissimum Francisci Glissonii, conscriptus, adscitis in operis societatem Georgio Bate et Ahasuero Regemortero, (1671).
- ↑ (en) Andrew Wear, Early Modern Europe, 1500-1700, Cambridge (GB), Cambridge University Press, , 556 p. (ISBN 0-521-38135-5), p. 219.dans The Western Medical Tradition, 800 BC to AD 1800, The Wellcome Institute for the History of Medicine, London.
- 1 2 3 Mingyong Zhang, Fan Shen, Anna Petryk et Jingfeng Tang, « "English Disease": Historical Notes on Rickets, the Bone-Lung Link and Child Neglect Issues », Nutrients, vol. 8, no 11, (ISSN 2072-6643, PMID 27854286, PMCID PMC5133108, DOI 10.3390/nu8110722, lire en ligne, consulté le ).
- 1 2 3 Y. Guidicelli, « Vitamine D », La Revue de Médecine, , p. 365-371.
- ↑ (en) Elizabeth Lomax, Diseases of Infancy and Early Childhood, Cambridge, Cambridge University Press, , 1176 p. (ISBN 0-521-33286-9), p. 153.dans The Cambridge World History of Human Disease, K.F. Kiple (dir.)
- 1 2 3 4 5 6 7 8 Alain Fouilhoux, « Rachitisme », La Revue du Praticien, vol. 49, , p. 1679-1684.
- 1 2 Thao Bui, « Vitamine D et grossesse », La Revue du Praticien - médecine générale, vol. 26, no 880, , p. 338-339.
- 1 2 3 Glenville Jones 2000, op. cit., p. 766-768.
- 1 2 3 4 5 R. Ted Steinbock 1993, op. cit. p. 979-980.
- 1 2 (en) Glenville Jones, Vitamine D, Cambridge University Press, (ISBN 0-521-40214-X), p. 763-764.dans The Cambridge World History of food, vol. 1, K.F. Kiple (dir.)
- ↑ Michael F. Holick et Tai C. Chen, « Vitamin D deficiency: a worldwide problem with health consequences », The American Journal of Clinical Nutrition, vol. 87, no 4, , p. 1080S–6S (ISSN 1938-3207, PMID 18400738, lire en ligne, consulté le ).
- 1 2 Sherwood (trad. de l'anglais), Physiologie animale, Louvain-la-Neuve (Belgique)/Paris, De Boeck, , 61 p. (ISBN 978-2-8073-0286-0, lire en ligne), p. 329.
- ↑ Glenville Jones 2000, op. cit., p. 765.
- ↑ W. F. Loomis, 1967, Skin-pigment regulation of vitamin D biosynthesis in man, Science, 157 : 501-6. W.F. Loomis, 1970, Rickets, Scientific American, 223 : 77-91.
- 1 2 Marc Gentilini, Médecine tropicale, Paris, Flammarion, , 928 p. (ISBN 2-257-14394-9), p. 582.
- 1 2 3 Jean-Claude Guilland, « Vitamine D », La Revue du Praticien, vol. 63, no 8, , p. 1097-1104.
- ↑ Russell W. Chesney, « Environmental factors in Tiny Tim's near-fatal illness », Archives of Pediatrics & Adolescent Medicine, vol. 166, no 3, , p. 271–275 (ISSN 1538-3628, PMID 22393183, DOI 10.1001/archpediatrics.2011.852, lire en ligne, consulté le ).