الأنيبيبات الدقيقة ( Microtubule) أكبر مكونات الهيكل الخلوي توجد في سيتوبلازم الخلايا حقيقية النوى وفي بعض أنواع البكتيريا، هذه البوليمرات الأنبوبية المكونة من بروتين التيوبيولين (tubulin) تستطيع أن تنمو حتى 50 ميكروميتر، بالإضافة لكونها تتمتع بديناميكية عالية. القطرالخارجي للإنيبيبات تقربيا 24 نانوميتر أما الداخلي حوالي 12 نانوميتر[1]، تتشكل عن طريق بلمرة دايمر (مركب ينتج عن ارتباط جزيئتين متشابهتين) (dimer) من اثنين من البروتينات الكروية ألفا وبيتا تيوبيولين.[2]
الأنيبيبات الدقيقة ضرورية لمجموعة من واسعة من الوظائف الخلوية، فهي تشارك في الحفاظ على بنية الخلية جنبا إلى جنب مع الخيوط الدقيقة والخيوط المتوسطة التي تشكل معاً الهيكل الخلوي.
كما أنها تشكل البنية الداخلية للأهداب والأسواط، وتوفر منابر للنقل داخل الخلايا وتشارك في مجموعة متنوعة من العمليات الخلوية بما في ذلك حركة الحويصلات الإفرزاية، والعضيات، وتجميع الجزيئات داخل الخلايا.[3] كما تلعب دورا في فصل الكروموسومات ( الإنقسام المتساوي والمنصف)، وهي أيضا المكون الرئيسي للخيوط المغزلية لسحب كروموسومات الخلايا حقيقية النوى.
الأنيبيبات الدقيقة تحتوي على أنوية، تنظم من خلال مراكز نتظيم الأنيبيبات الدقيقة (MTOCs) مثل السنتروسوم الذي يوجد في مركز العديد من الخلايا الحيوانية أو الأجسام القاعدية التي توجد في الأسواط والأهداب.[4]
هنالك العديد من البروتينات التي ترتبط بالأنيبيبات الدقيقية بما في ذلك البروتينات المحركة كينيسين ( Kinesin) وداينين (Dynein) وبروتينات القطع مثل (katanin) وغيرها من البروتينات المهمة لديناميكية الأنيبيبات الدقيقة.[5]
التركيب
المعلومات التي نمتلكها اليوم عن تركيب الأنيبيبات الدقيقة معظمها آت من المجهر الإلكتروني[2]، في الخلايا حقيقية النوى هي عبارة عن تراكيب أسطوانية طويلة جوفاء مصنوعة من ألفا α وبيتا β تيوبيولين دايمر،[6] وحدات ألفا وبيتا تحتويان تقربيا على 50% من الأحماض الأمينية المتماثلة، وكلا منهما لديها 50 KDa وزن جزيئي.[7]
ألفا وبيتا تيوبيولين دايمر تتبلمر إلى خيوط أولية (بدئِية) (protofilaments) خطية التي ترتبط أفقيا لكي تشكل أنيبيب واحد، والتي يمكن أن تُمدد عن طريق إضافة المزيد من ألفا وبيتا تيوبيولين دايمر، عادة يتم تشكيل الأنيبيبات الدقيقة عن طريق تجميع ثلاثة عشر خيوط أولية متوازية، وعلى الرغم من ذلك لوحظ في المختبر أنها قد تحتوي عدد أكثر أو أقل من الخيوط الأولية.[8]
الأنيبيبات الدقيقة لديها قطبية مميزة التي تعتبر ضرورية لتمكينها من القيام بوظائفها البيولوجية. التيوبيولين يتبلمر من أقصاه إلى أقصاه وحدة بيتا الفرعية من أحد التيوبيولين دايمر ترتبط مع وحدة ألفا الفرعية من الدايمر المجاور، ولذلك في خيط اولي (بدئي) سوف نجد نهاية واحدة تحتوي على وحدات ألفا الفرعية مكشوفة بينما في النهاية سوف نجد وحدات بيتا الفرعية مكشوفة. هذه النهايت تمثل (-) و (+) على التوالي، حزمة الخيوط الأولية ذات القطبية المتشابهة تكون موازية لبعضها البعض لذلك نجد في أنيبيب دقيق نجد نهاية واحد (+) تحتوي فقط على β بيتا تيوبيولين مكشوفة بينما النهاية الأخرى (-) تحتوي فقط على α ألفا تيوبيولين مكشوفة، في حين أن استطالة الأنيبيب يمكن أن تحدث في كل من النهايتان (+)و(-) إلا أن الاستطالة تكون أسرع إلى حد كبيرعلى النهاية (+).[9]
التَجَمُع الجانبي للخيوط الأولية( البدئية) يولد هيكل شبه حلزوني، كل دورة حلزونية تحتوي على ثلاثة عشر تيوبيولين دايمر كلا من خيط أولي مختلف. هنالك نوعان مختلفان من التفاعلات التي تحدث بين الوحدات الفرعية للخيوط الأولية الجانبية داخل الأنيبيب تسمى تشابكات نوع أ ( A-type) وتشابكات نوع ب (B-type). في تشابكات نوع أ، التَجمِيع الجانبي للخيوط الأولية يحدث بين وحدات ألفا وبيتا الفرعية المجاورة ( أي أن الوحدات الفرعية ألفا α تيوبيولين من خيط أولي تتفاعل مع الوحدات الفرعية β بيتا تيوبيولين من خيط أولي مجاور. في تشابكات النوع ب، الوحدات الفرعية ألفاα وبيتاβ تيوبيولين من خيط أولي واحد تتفاعل مع الوحدات الفرعية ألفاα وبيتاβ تيوبيولين في خيط أولي مجاور، على التوالي.[10]
بعض أنواع البكتيريا (Prosthecobacter) تحتوي على الأنيبيبات الدقيقة، تركيب هذه الأنيبيبات الدقيقة مماثل لتركيب الأنيبيبات الدقيقة في الخلايا حقيقية النوى، ويتكون من أنبوب مجوف من الخيوط الأولية يتم تجميعها من دايمرات متخالفة من تيوبيولين البكتيريا أ (BtubA) و تيوبيولين البكتيريا ب (BtubB)، كلا من تيوبيولن البكتيريا أ وتيوبيولين البكتيريا ب يتشاركان ببعض السمات مع ألفا وبيتا تيوبيولين.[11]
تنظيم الخلايا
تعتبر الأنيبيبات الدقيقة جزء من الشبكة الهيكلية (الهيكل الخلوي) داخل سيتوبلازم الخلية. تضم أدوار أنيبيبات الهيكل الخلوي الدقيقة الدعم الميكانيكي، وتنظيم السيتوبلازم، والنقل، والحركة، وفصل الكروموسومات. الأنيبيب الدقيق قادر على النمو والتقلص من أجل توليد القوة، وهنالك البروتينات المحركة التي تسمح للعضيات والمكونات الخلوية الأخرى أن تُحمل على الأنيبيبات الدقيقة.هذا المزيج من الأدوار يجعل الأنيبيبات الدقيقة مهمة لتنظيم وتحريك المكزنات داخل الخلايا.[12]
تنظيم الأنيبيبات الدقيقة في الخلية يختلف حسب نوعها، في (epithelia) الظهارة النسيج الذي يبطن التجاويف النهاية(-) لبوليمر الأنيبيب الدقيق مثبتة بالقرب من مواقع اتصال الخلية بالخلايا الأخرى ومنظمة على طول المحور القمي القاعدي. . بعد التَّنَوِّي يتم إطلاق سراح النهاية (-) وينم أعادة تثبيتها بواسطة عوامل عدة.[13] بهذه الطريقة يمكن تسهيل نقل البروتينات، الحويصلات والعضيات على طول محور القمي القاعدي للخلية. في الخلايا الليفية وغيرها من أنواع الخلايا الوسيطة ترتكز الأنيبيبات الدقيقة في الجسيم المركزي وتشع منها النهاية (+) إلى الخارج باتجاه محيط الخلية في هذه الخلايا الأنيبيبات الدقيقة تلعب أدوارا هامة في هجرة الخلية. وعلاوة على ذلك، فإنها تنظم العديد من مكونات الخلية، بما في ذلك الشبكة الإندوبلازمية وجهاز جولجي.[14]
بلمرة الأنيبيبات الدقيقة
التَّنَوِّي
التنوي هو الحدث الذي يبدأ تشكيل الأنيبيبات الدقيقة من جديد، هذه الشعيرات من الهيكل الخلوي تشكل عادة عن طريق بلمرة دايمر ألفا وبيتا تيوبيولين، الوحدات الأساسية لبناء الأنيبيبات الدقيقة التي تتفاعل بداية لتشكل نواة البذرة التي سوف تسطيل منها الخيوط.
الأنيبيات الدقيقة عي عادة منوية ويتم تنظيمها من قبل عضيات متخصصة تسمى مراكز تنظيم الأنيبيب الدقيق (MTOCs) تحتوي هذه المراكز على نوع آخر من التيوبيولين وهو ɣ تيوبيولين، والتي تختلف عن الوحدات الفرعية ألفا وبيتا تيوبيولين لللأنيبيبات الدقيقة نفسها.وɣ تيوبيولين يجمع العديد من البروتينات الأخرى المرتبطة بها لتشكيل هيكل مثل الغسالة معروف باسم " ɣ-tubulin ring complex" (ɣ-TuRC) . هذا المركب يتصرف كنموذج ل ألفا وبيتا تيوبيولين دايمر لبدأ البلمرة، فهو هي بمثابة غطاء للنهاية (-) بينما يستمر نمو الأنيبيب بعيدا عن MTOC في اتجاه (+).[15]
الجسيم المركزي هو مركز تنظيم الأنيبيبات الدقيقة الأولي في معظم الخلايا.وعلى الرغم من ذلك يمكن أن تنوى الأنيبيبات الدقيقة من مواقع أخرى كذلك. على سبيل المثال، الأسواط والأهداب تمتلك مراكز تنظيم الأنيبيب في قاعدتها وتسمى الأجسام القاعدية. بالإضافة إلى ذلك، العمل من مجموعة Kaverina في الفاندربيلت، فضلا عن غيرهم، تشير إلى أن جهاز جولجي يمكن أن تكون بمثابة منصة هامة ل التنوي الأنيبيبات الدقيقة .[16]
في بعض أنواع الخلايا مثل الخلايا النباتية، لا تحتوي على مراكز محددة لتنظيم الأنيبيبات، في هذه الخلايا الأنيبيبات الدقيقة تنوى من مواقع منفصلة في السيتوبلازم[17]، في أنواع أخرى مثل الطفيليات المثقبية تحتوي على مراكز تنظيم أنيبيبات دقيقة، لكنها موجدة بشكل دائم في قاعدة السوط، هنا تنوي الأنيبيات الدقيقة للقيام بأدوار هيكلية وتوليد الخيوط المغزلية للانقسام ليست مقبولة كمراكز تنظيم الأنيبيبات الدقيقة في المريكز.
البلمرة
بعد أن تتم عملية التنوية
الأولية، يجب إضافة مونوميرات التيوبيولين إلى البوليمر النامي، عملية إضافة أو إزالة المونوميرات تعتمد على تركيز دايمرات ألفا وبيتا تيوبيولين في المحلول والتي تتعلق بالتركيز الحرج، وهو تركيز الدايمرات في الحالة المستقرة حيث أنه لم يعد يوجد تجميع صافي أو تفكيك في في نهاية الأنيبيب، إذا كان تركيز الدايمر أكبر من التركيز الحرج فإن الأنيبيب تتبلمر وتنمو، أما إذا كان تركيز الدايمر أقل من التركيز الحرج فإن طول الأنايبيب سوف يتناقص.[18]
ديناميكا الأنيبيبات الدقيقة
عدم الإستقرار الديناميكي
يشير عدم الإستقرار الديناميكي إلى حصول التفكيك والتجميع في نهاية الأنيبيبات في الوقت نفسه، الأنيبيب الدقيق يسطتيع أن بحيوية أن يبدل بين حالة التمدد والانكماش في هذه المنطقة.[19] دايمرات التيوبيولين تسطتيع ربط جزيئين من GTP واحدة منها يمكن أن تتحلل لاحقا في التجميع. خلال البلمرة، دايمرات التيوبيولين تكون في حالة الربط ب GTP . 7 الGTP المرتبط بألفا تيوبيولين مستقر وفي هذه الحالة يلعب وظيفة هيكلية. ومع ذلك، فإن الGTP المرتبط ب بيتا تيوبيولين يمكن أن يتحلل إلى GDP بعد وقت قصير من التجميع. خصائص تجميع ال GDP تيوبيولين تختلف عن خصائص GTP تيوبيولين، ال GDP تيوبيولين أكثر عرضة للتحلل.[20] الوحدة الفرعية GDP تيوبيولين في طرف الأنيبيب تميل إلى أن تسقط على الرغم من أن GDP تيوبيولين في وسط الأنيبيب لا يمكن أن تظهر تلقائيا من البوليمر. عندما يضاف التيوبيولين إلى نهاية الأنيبيب الذي يرتبط ب GTP تنشأ قبعة من GTP المرتبط بالتيوبيولين على طرف الأنيبيب الدقيق لحمايته من التفكك، عندما يصل التحلل طرف الأنيبيب الدقيق فإنه يبدأ في التحلل السريع والأنكماش. ويسمى هذ التحول من النمو إلى التقلص كارثة catastroph. GTP تيوبيولين يبدأ الأضافة إلى طرف الأنيبيب الدقيق مجددا موفرا بذلك غطاء جديد وبذلك يشكل حماية للأنيبيب الدقيق من الانكماش، وهذا ما يمسى بالإنقاذ ( rescue ).[21]
نموذج " البحث والقبض
في عام 1986، اقرح مارك كرشنير وتيم ميتشيسون أن الأنبيبات الدقيق تستخدم خصائصها الديناميكية من النمو والانكماش هل النهاية (+) لتحقق الشكل الثلاثي الأبعاد للخلية في الفضاء. النهايات (+) التي تقابل kinetochores أو مواقع القطبية يتم القبض عليها (تصبح مستولى عليها) و لا مزيد من النمو أو الانكماش يحدث، وعلى النقيض من الأنيبيبات الدقيقة الحيوية العادية، التي تمتلك عمر نصف من 5-10 دقائق، الأنيبيبات المستولى عليها يمكن أن تدوم لساعات. هذه الفكرة معرفة ب نموذج "البحث والقبض"[22] . في الواقع العديد العمل منذ ذلك الحين إلى حد كبير أيد صحة هذه النظرية. في الحيز الحركي وجد العديد من المركبات المتنوعة لالتقاط النهايات (+) الإنيبيبات الدقيقة.[23]
تنظيم ديناميكا الأنيبيبات الدقيقة
التعديلات
على الرغم من أن معظم الأنابيب الدقيقة لها عمر نصف من 5-10 دقائق إلا أنه يمكن لبعضها أن تبقى مستقرة لعدة ساعات.23الأنابيب الدقيقة المستقرة تراكم التعديلات post على الوحدات الفرعية للتيوبيولين عن طريق عمل إنزيمات مرتبطة بالأنانبيب الدقيقة[24][25] . ومع ذلكن بمجرد أن تزال البلمرة معظم التعديلات يتم عكسها عن طريق الإنزيمات قابلة للذوبان. معظم تفاعلات التعديل بطيئة بينما تفاعلاتها العكسية سريعة، تم الكشف عن التيوبيولين المعدل فقط في الأنابيب الدقيقة المستقرة طويلة العمر.معظم هذه التعديلات تحدث على C-terminal في ال ألفا تيوبيولين. هذه المنطقة وهي غنية بالغلوتامات سالبة الشحنة، تشكل ذيول غير منظمة نسبيا التي التي تخرج من الأنيبيب الدقيق وتشكل اتصالات مع المحركات. وهكذا، فإنه يعتقد أن تعديلات التويولين تنظم تتفاعل المحركات مع الأنيبيب. عادة ما تكون هذه الأنابيب الدقيقة المعدلة المستقرة موجهة نحو موقع قطبية الخلية في الخلايا البينية، هذه المجموعة الفرعية المعدلة من الانابيب الدقيقة توفر طريق متخصص تساعد في إيصال الحويصلات إلى مناطق الإستقطاب . هذه التعديلات تشمل :
- Detyrosination: إزالة C-terminal tyrosine من ألفا تيوبيولين هذا التفاعل يكشف الغلوتومات على C-terminal الجديدة. كنتيجة غالبا ما يشار الأنابيب الدقيقة التي تراكم هذا التعديل عليها أنه حمض الغلوتاميك-الأنابيب الدقيقة، على الرغم من أن كربوكسي ببتيداز تويولين لم يتم بعد تحديدها، إلا أن tubulin—tyrosine ligase )) (TTL) معروف.[26]
- Delta2: إزالة بقايا اخر اثنين من C-terminus من ألفا تيوبيولين.[27] على عكس detyrosination يعتقد أن هذا التفاعل لا رجعة فيه، وقد وثقت فقط في الخلايا العصبية.
- Acetylation أستلة: إضافة مجموعة الاسيتيل ليسين 40 ألفا تويولين. يحدث هذا التعديل على lysine التي يمكن الوصول إليها إلا من داخل الأنيبيب، ويبقى من غير الواضح كيفية وصول الانزيمات بقايا lysine. طبيعة أسيتيل تويولين لا تزال موضع جدل. ومع ذلك، ومن المعروف أن رد الفعل العكسي لأن يحفزه HDAC6.[28]
- Polyglutamylation: إضافة بوليمر الغلوتامات إلى مجموعة ال جاما كربوكسيل إلى أي واحدة من خمسة غلوتامات الموجدوة قرب نهاية ألفا تيوبيولين [29]
- Polyglycylation: إضافة بوليمر الجلايسين إلى مجموعة جاما الكربوكسيل من أي واحد من الغلوتومات عثر عليها قرب نهاية بيتا تويولين. TTL3 و8 إضافة الجلايسين المتفرعة الأولي، في حين TTL10 يطيل سلسلة polyglycine.
العقاقير التي ترتيط بالتيوبيلين وأثارها الكيميائية
مجموعة واسعة من الأدوية قادرة على الربط بالتيوبيولين، وتعديل خصائص تجميعها. هذه الأدوية يمكن أن يكون لها تأثير أقل بكثير على التراكيز داخل الخلايا من التيوبيولين. هذا التدخل مع ديناميكا الأنابيب الدقيقة يمكن أن يكون له تأثير على وقف دورة الخلية أو موت الخلية المبرمج ومع ذلك، هناك بيانات تشير إلى أن تدخل ديناميكات الأنيبيب غير كافية لمنع الخلايا التي تمر بالانقسام.[30] وقد أثبتت هذه الدراسات أن قمع الدينامكيات يحتاج لتراكيزأقل من تلك اللازمة لمنع الانقسام[31]
العقاقير التي يمكن أن تغير ديناميكات الأنابيب الدقيقة تضم:
- فئة عقاقير التاكسن المكاغحة للسرطان (paclitaxel (taxol) and docetaxel) تمنع عدم الاستقرار الديناميكي عن طريق تثبيت GDP مرتبط بالتيوبيولين في الأنيبيب الدقيق، وهكذا حتى عندما التحلل من GTP يصل إلى طرف الأنيبي الدقيق، لايوجد عدم بلمرة والأنيبيب لا يتقلص مرة أخرى.
- The epothilones, e.g. Ixabepilone، تعمل بطريقة مشابهة لسابقتها.
- Nocodazole, vincristine, and colchicine، تعطي تأثير عكسي تمنع بلمرة التيوبيولين إلى أنيبيب.
- Eribulin يربط النهاية (+) النامية الأنابيب الدقيقة،Eribulin تمارس الآثار المضادة للسرطان من خلال إحداث موت الخلايا المبرمج للخلايا السرطانية التالية لفترات طويلة ولايمكن عكسه للخلايا الت يتمت محاصرتها.
بوليمرات الانابيب الدقيقة حساسة للغاية للعوامل البيئية المختلفة، انخفاض متوى أيونات الكالسيوم الحر وتعمل على زعزعة استقرار الأنابيب الدقيقة، وهذا منع الباحثبن من دراسة البوليمر مبكرا في المختبرات. 7 كما تسبب درجات الحرارة الباردة التحلل السريع للأنابيب الدقيقة. في المقابل، الماء الثقيل يعزز الاستقرار أنيبيب البوليمر.[32]
البروتينات التي تتفاعل مع الأنابيب الدقيقة
البروتينات المرتبطة بالأنيبيب (MAPs)
لقد تبين أن MAPs تلعب دورا حاسما في تنظيم ديناميكات الأنابيب في جسم الكائن الحي. معدلات البلمرة، والتحلل، والكارثة تختلف تبعا لأي نوع من البروتينات المرتطية بالأنيبيب موجودة. ويمكن تصنيف MAPs التي تم تحديدها أصلا في أنسجة المخ إلى نوعين بناء على الوزن الجزيئي. الفئة الأولى تشمل MAPs ذات الوزن الجزيئي أقل من 55-62 KDa، وتسمى بروتينات تاو وقد ثبت في المختبر أنها ترتبط مباشرة في الأنابيب الدقيقة، وتحث عملية ة التنوي، وتمنع التفكك، وتحث على تشكيل صفوف متوازية.36 بالإضافة إلى ذلك، أظهرت بروتينات تاو تحقيق الاستقرا في النابيب الدقيقة في المحاور وأيضا تورطها في مرض ألزهايمر.37 الفئة الثانية تضم MAPs ذات الوزن الجزيئي 200-1000 KDa ، والت ييوجود منها أربعة أنواع معروفة : MAP-1،MAP-2 MAP-3 MAP-4، بروتينات MAP-1 تتكون من ممجوعة من ثلاث بروتينات مختلفة A وBوC، وبروتين C يلعب دورا كبيرا في النقل الرجعي للحويصلات ويسمى أيضا ب دايني السيتوبلازم. يقع MAP-2 في التشعبات وفي جسم الخلايا العصبية حيث يرتبط مع خيوط الهيكل الخلوي الأخرى. توجد بروتينات ال MAP-4 في معظم الخلايا والأنابيب الدقيقة المستقرة. بالإضافة يمكن أن يكون MAPs تأثير على استقرار هيكل الأنيبيب، بحيث تزعزع استقرارها عن طريق تفسيخها أو عن طريق تحفيز التحلل للأنيبيبات الدقيقة.[33]
البروتينات المتتبعة ل النهاية (+) (+TIPs)
البروتينات المتتبعة لنهاية (+) هي عبارة عن بروتينات مرتبطة بالأنابيب (MAPs) حيث ترتيط ب أطراف الأنابيب النامية، وتلعب دورا مهما في تنظيم ديناميكات الأنابيب. على سيبل المثال (TIPs) لوحظ أنها تشارك في تفاعلات الأنيبيبات الدقيقة مع الكروموسومات خلال عملية الانقسام.
البروتينات المحركة
يمكن للأنابيب الدقيقة أن تشكل ركائز للبروتينات المحركة التي تشارك في الوظائف الخلوية الهامة مثل حركة الحويصلات وانقسام الخلايا. على عكس البروتينات المرتبطة بالأنابيب الأخرى البروتينات المحركة تستخدم الطاقة من الناتجة عن التحليل المائي ATP لتوليد شغل ميكانيكي لتحريك البروتين على طول الركيزة، البروتينات المحركات الرئيسية التي تتفاعل مع الأنابيب الدقيقة هي كينيسين والذي يتحرك باتجاه النهاية (+) والداينين الذي يتحرك باتجاه النهاية (-) في الأنيييب.
الوظائف
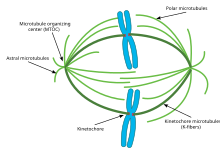
الانقسام
هيكل ملحوظ يتكون بشكل كبير من الأنابيب الدقيقة هو المغزل الانقسامي mitotic spindl[34] e، يستخدم من قبل الخلايا حقيقية النوى لفصل الكرموسومات خلال انقسام الخلية. المغزل الانقسامي يضم الأنابيب الدقيقة المغزلية، والبروتينات المرتطبة بالأنابيب الدقيقة، ومراكز تنظيم الأنابيب الدقيقة. الأنابيب الدقيقة تنشأمن مراكز تنظيم الأنابيب الدقيقة، وتخرج منها باتجاه باتجاه الخلية وكل خلية تحتوي على اثنان من مراكز تنظيم الأنابيب الدقيقة.
عملية الانقسام تسهل من قبل ثلاث مجموعات فرعية من الأنابيب الدقيقة، والمعروفة باسم النجمي، والقطبي، الحيز الحركي، والأنيبيب النجمي ينشأ من مراكز تنظيم الأنابيب الدقيقة ولايرتبط بالكروموسوم، بدلا من ذلك فإنه يرتبط بالهيكل الخلوي بالقرب من الغشاء الخلوي ويعمل بالتنسيق مع محركات الداينين المتخصصة، محركات الداينين تسحب مراكز تنظيم الأنابيب نحو غشاء الخلية وبالتالي المساعدة في التموضع الصحيح وتوجيه الجهازبأكمله.
أنيبيب الحيز الحركي، يرتبط بالكرموسومات في ال kinetochores، كل كرموسوم لديه اثنان من الكرومتيد وكل كرومتيد لديه واحد kinetochores، ال kinetochores الاثنين المتربطان بمنطقة من الكرموسوم تسمى السنترومير، الأنابيب الدقيقة القطبية من مراكز تنظيم النابيب الدقيقة واحد تتشابك مع الأنابيب الدقيقة من مراكز أخرى البروتينات الحركية تجعلها تدفع عكس بعضها البعض مما يساعد على فصل الكرموسومات إلى خلايا ابنة اثنتين .
انقسام الخلايا في حقيقيات النوى النموذجية، ينتهي بتكوين جزء سايتوبلازمي بين الخلايا الابنة تسمى أوساط الجذع. تم بناء الهيكل الخلوي من الأنابيب الدقيقة التي كانت أصلا جزء من المغزل الانقسامي
الأهداب والأسواط
الأنابيب الدقيقة تلعب أدوارا هيكلية رئيسية في أهداب الخلايا حقيقية النوى والأسواط. والأسواط تمتد من مراكز تنظيم الأنابيب الدقيقة وفي هذه الحالة تسمى الأجسام القاعدية. حركة بروتينات الداينين على مختلف الأنابيب الدقيقة، يسمح العضية لثني وتوليد القوة للسباحة، ونقل المواد خارج الخلية، وأدوار أخرى. بدائيات النوى تمتلك البروتينات مثل تويولين بما في ذلك FtsZ. ومع ذلك، سياط بدائية مختلفة تماما في هيكل من سياط حقيقية النواة ولا تحتوي على هياكل القائم على أنيبيب.[35]
تنظيم الجينات
الهيكل الخلوي هو نظام ديناميكي يعمل على عدة مستويات مختلفة: بالإضافة إلى إعطاء الخلية شكل معين ودعم النقل من الحويصلات والعضيات، كما يمكن أن تؤثر على التعبير الجيني. ومع ذلك، يتم فهم آليات نقل الإشارة المشاركة في هذه الاتصالات قليلا. بالرغم من ذلك، وقد وصفت العلاقة بين التحلل بوساطة المخدرات من الأنابيب الدقيقة وتعبيرا محددا من عوامل النسخ، التي وفرت معلومات عن التعبير التفاضلية من الجينات يتوقف على وجود هذه العوامل وهذا التواصل بين يرتبط الهيكل الخلوي وتنظيم الاستجابة الي أيضا إلى العمل من عوامل النمو: على سبيل المثال، وجود هذه العلاقة لالضام عامل نمو الأنسجة
مصادر
- Pilhofer, Martin; Ladinsky, Mark S.; McDowall, Alasdair W.; Petroni, Giulio; Jensen, Grant J. (2011-12-01). "Microtubules in bacteria: Ancient tubulins build a five-protofilament homolog of the eukaryotic cytoskeleton". PLoS biology 9 (12): e1001213.doi:10.1371/journal.pbio.1001213. ISSN 1545-7885. PMC 3232192.PMID 22162949.
- Mandelkow E, Mandelkow E-M: Microtubule structure. Curr Opin Struct Biol 1994, 4:171-179.
- Vale RD (Feb 2003). "The molecular motor toolbox for intracellular transport.". Cell 112(4): 467–80.
- Joshi HC: Microtubule organizing centers and y-tubulin. Curt Opin Cell Biol 1994, 6:55-62.
- Howard J; Hyman AA; (Feb 2007). "Microtubule polymerases and depolymerases.". Curr Opin Cell Biol 19 (1): 31–5.
- Weisenberg RC (1972). "Microtubule formation in vitro in solutions containing low calcium concentrations". Science 177: 1104–5.
- Desai A. and Mitchison TJ; (1997). "Microtubule polymerization dynamics.". Annu Rev Cell Dev Biol 13: 83–117
- Chrétien D, Metoz F, Verde F, Karsenti E, Wade RH. Lattice defects in microtubules: protofilament numbers vary within individual microtubules J Cell Biol. 1992 Jun;117(5):1031-40.
- Walker RA, O'Brien ET, Pryer NK, Soboeiro MF, Voter WA, et al. (1988). "Dynamic instability of individual microtubules analysed by video light microscopy: rate constants and transition frequencies". J. Cell Biol 107: 1437–48
- Nogales E (2000). "Structural Insights into Microtubule Function". Annual Review of Biochemistry 69: 277–302.
- Schlieper, Daniel; Oliva, María A.; Andreu, José M.; Löwe, Jan (2005-06-28). "Structure of bacterial tubulin BtubA/B: Evidence for horizontal gene transfer". Proceedings of the National Academy of Sciences of the United States of America 102 (26): 9170–9175.
- Walker R, Sbeetz MP: Cytoplasmic microtubule-associated motors. Annu Rev Biochem 1993, 62:429-451.
- Bartolini, F; Gundersen, G. G. (2006). "Generation of noncentrosomal microtubule arrays". Journal of Cell Science 119 (Pt 20): 4155–63.
- Guenette S, Solomon F: Microtubule assembly: pathways, dynamics, and regulators. Curr Opin Struct Bio1199 3, 3:198-20].
- Desai A.; and Mitchison TJ; (1997). "Microtubule polymerization dynamics.". Annu Rev Cell Dev Biol 13: 83–117.
- Vinogradova, T; Miller, P. M.; Kaverina, I (2009). "Microtubule network asymmetry in motile cells: Role of Golgi-derived array". Cell cycle (Georgetown, Tex.) 8 (14): 2168–74.PMC 3163838. PMID 19556895.
- Yuan M, Shaw PI, Warn RM, Lloyd CW: Dynamic reorientation of cortical microtubules, from transverse to longitudinal, in living plant-cells. Proc Natl Acad Sci USA 1994, 91:6050-6053.
- Alberts B, Johnson A, Lewis J, et al. Molecular Biology of the Cell. 4th edition. New York: Garland Science; 2002. The Self-Assembly and Dynamic Structure of Cytoskeletal Filaments. Available from: http://www.ncbi.nlm.nih.gov/books/NBK26862/
- Karp, Gerald (2005). Cell and Molecular Biology: Concepts and Experiments. USA: John Wiley & Sons. p. 355.
- Weisenberg RC, Deery WJ, Dickinson PJ (September 1976). "Tubulin-nucleotide interactions during the polymerization and depolymerization of microtubules". Biochemistry15 (19): 4248–54. doi:10.1021/bi00664a018. PMID 963034.
- Mitchison T, Kirschner M (1984). "Dynamic instability of microtubule growth". Nature 312(5991): 237–42. doi:10.1038/312237a0. PMID 6504138.
- Kirschner M, Mitchison T (May 1986). "Beyond self-assembly: from microtubules to morphogenesis". Cell 45 (3): 329–42.
- Cheeseman IM, Desai A (January 2008). "Molecular architecture of the kinetochore-microtubule interface". Nature Reviews Molecular Cell Biology 9 (1): 33–46.
- Janke C, Bulinski JC (December 2011). "Post-translational regulation of the microtubule cytoskeleton: mechanisms and functions". Nature Reviews Molecular Cell Biology 12 (12): 773–86.
- Garnham CP, Roll-Mecak A (July 2012). "The chemical complexity of cellular microtubules: tubulin post-translational modification enzymes and their roles in tuning microtubule functions". Cytoskeleton 69 (7): 442–63.
- Ersfeld K, Wehland J, Plessmann U, Dodemont H, Gerke V, Weber K (February 1993)."Characterization of the tubulin-tyrosine ligase". The Journal of Cell Biology 120 (3): 725–32.
- Paturle-Lafanechère L, Eddé B, Denoulet P, et al. (October 1991). "Characterization of a major brain tubulin variant which cannot be tyrosinated". Biochemistry 30 (43): 10523–8.
- Hubbert C, Guardiola A, Shao R, et al. (May 2002). "HDAC6 is a microtubule-associated deacetylase". Nature 417 (6887): 455–8.
- Audebert S, Desbruyères E, Gruszczynski C, et al. (June 1993). "Reversible polyglutamylation of alpha- and beta-tubulin and microtubule dynamics in mouse brain neurons". Molecular Biology of the Cell 4 (6): 615–26.
- Ganguly, A; Yang, H; Cabral, F (2010). "Paclitaxel-dependent cell lines reveal a novel drug activity". Molecular cancer therapeutics 9 (11): 2914–23.
- Yang, Hailing; Ganguly, Anutosh; Cabral, Fernando (2010). "Inhibition of Cell Migration and Cell Division Correlates with Distinct Effects of Microtubule Inhibiting Drugs". The Journal of Biological Chemistry 285 (42): 32242–50. doi:
- Burgess, J; Northcote, DH (1969). "Action of colchicine and heavy water on the polymerization of microtubules in wheat root meristem.". J Cell Sci 5 (2): 433–451.
- Langkopf A, Hammarback J, Muller R, Vallee R, Garner C: Microtubule-associated proteins 1A and LC2: two proteins encoded in one messenger RNA. J Biol Chem 1992, 267:16561 16566.
- Rosette C, Karin M (March 1995). "Cytoskeletal control of gene expression: depolymerization of microtubules activates NF-kappa B". The Journal of Cell Biology 128(6): 1111–9.
- Sanders MA, Salisbury JL: Centrin plays an essential role in mi- crotubule severing during flagellar excision in Chlamydomonas reinhardtii. J Biol Chem 1994, 124:795-805.