غاز الخردل (أو مايعرف بـ "كبريتيد الخردل") هو مركب كيميائي ينتمي لصنف من المركبات العضوية التي تدعى الثيولات، وهو سائل يصدر بخارًا خطرًا، ويسبب حروقًا وتقرحًا في الجلد المعرض. يؤذي غاز الخردل الجهاز التنفسي عند تنشقه، ويسبب التقيؤ والإسهال عند ابتلاعه، ويلحق أضرارًا بالأعين والأغشية المخاطية، والرئتين والجلد والأعضاء التي يتولد فيها الدم. أخطر التأثيرات الطويلة الأجل تحصل بسبب كون غاز الخردل مسببا للسرطان والتغييرات الوراثية، ولا يوجد حاليًا أي علاج له.
| غاز الخردل | |
|---|---|
| الاسم النظامي (IUPAC) | |
كبريتيد بيس 2-كلور الإيثيل |
|
| أسماء أخرى | |
غاز الخردل |
|
| المعرفات | |
| رقم CAS | 505-60-2 |
| بوب كيم | 10461 |
| الخواص | |
| الصيغة الجزيئية | C4H8Cl2S |
| الكتلة المولية | 159.07 غ/مول |
| المظهر | سائل عديم اللون إن كان نقيا |
| الكثافة | 1.27 غ/سم3 |
| نقطة الانصهار | 14.4 °س |
| نقطة الغليان | 217 °س يتفكك |
| الذوبانية في الماء | ضئيلة |
| المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| نقطة الوميض | 105 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التركيب و التفاعلات
كبريتيد الخردل هو مركب عضوي بصيغة . في طريقة ديرتز ، يتم تصنيع خردل الكبريت من خلال مفاعلة ثنائي كلوريد الكبريت بالإثيلين :
و في Levinstein process ، يتم استخدام ثنائي كلوريد الكبريت الثنائي بدلاً من ذلك :[2][3]
في طريقة ماير ، يتم إنتاج ثيولات الغليكول من الكلوروإيثانول و كبريتيد البوتاسيوم و الكلور مع ثلاثي كلوريد الفوسفور: [4]
في طريقة ماير كلارك ، يتم استخدام حمض الهيدروكلوريك المركز (HCl) بدلاً من PCl3 كعامل الكلورة:
كما و يستخدم كلوريد ثيونيل و الفوسجين أيضاً كعامل اختناق ، كعوامل معالجة بالكلور ، مع إمكانية إضافة عاملين لإنتاج آليات سمية إضافية إذا ظلت شائبة في المنتج النهائي.
كبريتيد الخردل هو سائل لزج في درجات الحرارة العادية . المركب النقي له نقطة انصهار 14 °م (57 °ف) ويتحلل قبل الغليان في 218 °م (424 °ف) .
تفاعلات كبريتيد الخردل مع إيثوكسيد الصوديوم يُعطي divinyl sulfide :
آلية التسمم الخلوي
يزيل المركب بسهولة أيون الكلوريد عن طريق الاستبدال النووي الجزيئي لتكوين أيون السلفونيوم الدوري. يميل هذا الوسيط التفاعلي إلى التسبب في ألكلة دائمة من نوكليوتيد الغوانين في خيوط الحمض النووي ، مما يمنع الانقسام الخلوي ويؤدي بشكل عام مباشرة إلى موت الخلية المبرمج ، [5] و في حال إذا لم تمت الخلية فورأً ، فقد يؤدي الحمض النووي التالف إلى تطور السرطان. [5] سيكون الإجهاد التأكسدي علم أمراض آخر يشارك في سمية كبريتيد الخردل . لا يعتبر كبريتيد الخردل قابلاً للذوبان في الماء ولكنه قابل للذوبان في الدهون ، مما يساهم في امتصاصه السريع في البشرة.[5]
بالمعنى الأوسع ،المركبات مع العنصر الهيكلي BCH2CH2X ، حيث X هي أي مجموعة مغادرة ، و B هي قاعدة لويس المعروفة باسم الخردل. ويمكن أن تشكل هذه المركبات أيونات حلقية (أيونزيوم) (سولفونيوم و أمونيوم و ما إلى ذلك) ، وهي عوامل جيدة للتكيُّف. ومن الأمثلة على ذلك bis(2-chloroethyl) ، و (2-haloethyl) amines (nnedrogen) ، و sesquimustard الكبريت ، التي تحتوي على مجموعتي α-chloroethyl thioether (ClH2CCH2S−) متصلة بواسطة مجموعة ethylene (−CH2CH2−). هذه المركبات لها قدرة مشابهة على ألكلة الحمض النووي ، ولكن خصائصها الفيزيائية ، على سبيل المثال نقاط الانصهار ، قد تختلف.
أصناف عناصر كبريتيد الخردل
القائمة الكاملة لعوامل كبريتيد الخردل الفعالة التي يتم تخزينها بشكل شائع و هي كما يلي:
| Chemical | Code | Trivial name | CAS number | PubChem | Structure |
|---|---|---|---|---|---|
| Bis(2-chloroethyl)sulfide | H/HD | Mustard | 505-60-2 | بوبكيم 10461 | 
|
| 1,2-Bis-(2-chloroethylthio)-ethane | Q | Sesquimustard | 3563-36-8 | بوبكيم 19092 | 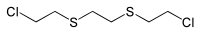
|
| Bis-(2-chloroethylthioethyl)-ether | T | O-mustard | 63918-89-8 | بوبكيم 45452 | 
|
| 2-Chloroethyl chloromethyl sulfide | 2625-76-5 | 
| |||
| Bis-(2-chloroethylthio)-methane | HK | 63869-13-6 | 
| ||
| Bis-1,3-(2-chloroethylthio)-n-propane | 63905-10-2 | 
| |||
| Bis-1,4-(2-chloroethylthio)-n-butane | 142868-93-7 | 
| |||
| Bis-1,5-(2-chloroethylthio)-n-pentane | 142868-94-8 | 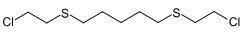
| |||
| Bis-(2-chloroethylthiomethyl)-ether | 63918-90-1 | 
|
تاريخ
التطوير
من الممكن إن تطوير عامل الخردل في وقت مبكر من عام 1822 من قبل سيزار مانسويت ديسمريز(1798-1863). [6] وصف ديسبيرتز تفاعل ثنائي كلوريد الكبريت و الإثيلين ولكن لم يذكر من أي الخصائص المزعجة لمنتج التفاعل . في عام 1854 ، كرر كيميائي فرنسي آخر ، ألفريد رييش (1829-1908) ، هذا الإجراء ، أيضاً دون وصف أي خصائص فسيولوجية سلبية. في عام 1860 ، قام العالم البريطاني فريدريك غوثري بتصنيع وتمييز مركب عامل الخردل و لاحظ خصائصه المهيجة ، خاصة في تذوقه. [7] أيضاً في عام 1860 ، كرر الكيميائي ألبرت نيمان ، المعروف بإسم رائد في كيميائية الكوكايين ، مكرراً التفاعل ، و مسجل خصائص تكوين فقاعة . في عام 1886 ، نشر فكتور ماير ورقة تصف توليفة أنتجت عوائد جيدة. قام بدمج 2chloroethanol مع كبريتيد البوتاسيوم المائي ، ثم قام بمعالجة ثيوديغليكول الناتج مع ثلاثي كلوريد الفوسفور. كان نقاء هذا المركب أعلى بكثير ، وبالتالي كانت الآثار الصحية الضارة عند التعرض أكثر حدة. هذه الأعراض ظهرت نفسهاعلى مساعده ، ومن أجل استبعاد احتمال أن يكون مساعده يعاني من مرض عقلي (أعراض نفسية جسدية) ، اختبر ماير هذا المركب على الأرانب المختبرية ، التي مات معظمها. في عام 1913 ، قام الكيميائي الإنجليزي هانز تاشار كلارك (المعروف بتفاعل إيشفايلر كلارك) باستبدال ثلاثي كلوريد الفوسفور بحمض الهيدروكلوريك في صيغة ماير أثناء عمله مع هيرمان إميل فيشر في برلين . كلارك قد دخل المستشفى لمدة شهرين بسبب الحروق بعد أن انفصلت إحدى قواريره . وفقاً لماير ، أرسل تقرير فيشر في هذا الحادث إلى الجمعية الكيميائية الألمانية و التي وضعت القيصرية الألمانية على الطريق إلى الأسلحة الكيميائية. [8]
يمكن لعامل الخردل أن يكون له تأثير في تحويل ألوان جلد المريض إلى لون مختلف ، بما في ذلك الألوان الحمراء والبرتقالية والوردية ، وفي حالات غير معتادة ، زرقاء. اعتمدت القيصرية الألمانية خلال الحرب العالمية الأولى على طريقة ماير كلارك لأن 2chloroethanol كانت متاحة بسهولة من صناعة الصبغة الألمانية في ذلك الوقت .
استعمال

تم استخدام عامل الخردل لأول مرة بفعالية في الحرب العالمية الأولى من قبل الجيش الألماني ضد الجنود البريطانيين والكنديين بالقرب من أيبرس ، بلجيكا ، في عام 1917 ، ثم ضد الجيش الثاني الفرنسي أيضاً. اسم أيبريت يأتي من استخدامه من قبل الجيش الألماني بالقرب من بلدة أيبرس . و لم يستخدم الحلفاء عامل الخردل حتى نوفمبر 1917 في كامبريه ، فرنسا ، بعد أن استولت الجيوش على مخزون من قذائف الخردل الألمانية . استغرق الأمر أكثر من عام في بريطانيا لتطوير سلاح عامل الخردل الخاص بهم ، مع إنتاج المواد الكيميائية المتمركزة على أحواض أفونماوث في بريستول . [9][10] (كان الخيار الوحيد المتاح للبريطانيين هو عملية "Despretz – Niemann-Guthrie"). تم استخدام هذا لأول مرة في سبتمبر 1918 أثناء كسر خط هيندنبيرغ.
تطوير أول دواء للعلاج الكيميائي
الكشف في السوائل البيولوجية
انظر أيضاً
مراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/10461 — تاريخ الاطلاع: 19 نوفمبر 2016 — العنوان : Mustard gas — الرخصة: محتوى حر
- Stewart, Charles D. (2006). Weapons of mass casualties and terrorism response handbook. Boston: Jones and Bartlett. صفحة 47. . مؤرشف من الأصل في 24 يناير 2020.
- "Chemical Weapons Production and Storage". Federation of American Scientists. مؤرشف من الأصل في 11 أغسطس 2014.
- Institute of Medicine (1993). Chapter 5: Chemistry of Sulfur Mustard and Lewisite. Veterans at Risk: The Health Effects of Mustard Gas and Lewisite. The National Academies Press. . مؤرشف من الأصل في 10 ديسمبر 2019.
- Mustard agents: description, physical and chemical properties, mechanism of action, symptoms, antidotes and methods of treatment. Organisation for the Prohibition of Chemical Weapons. Accessed June 8, 2010. نسخة محفوظة 24 أغسطس 2018 على موقع واي باك مشين.
- By Any Other Name: Origins of Mustard Gas - تصفح: نسخة محفوظة 2014-02-01 على موقع واي باك مشين.. Itech.dickinson.edu (2008-04-25). Retrieved on 2011-05-29.
- F. Guthrie (1860). "XIII.—On some derivatives from the olefines". Q. J. Chem. Soc. 12 (1): 109–126. doi:10.1039/QJ8601200109.
- Duchovic, Ronald J.; Vilensky, Joel A. (2007). "Mustard Gas: Its Pre-World War I History". J. Chem. Educ. 84 (6): 944. doi:10.1021/ed084p944. مؤرشف من الأصل في 12 مارس 2009.
- Edited by David Large. The Port of Bristol, 1848-1884.
- "Photographic Archive of Avonmouth Bristol BS11". BristolPast.co.uk. مؤرشف من الأصل في 29 نوفمبر 201712 مايو 2014.
وصلات خارجية
- غاز الخردل
- العثور على غاز الخردل في العراق.
- Textbook of Military Medicine - Intensive overview of mustard gas Includes many references to scientific literature
- Detailed information on physical effects and suggested treatments
- Iyriboz Y (2004). "A recent exposure to mustard gas in the United States: clinical findings of a cohort (n=247) 6 years after exposure". MedGenMed. 6 (4): 4. PMC . PMID 15775831. Shows Photos taken in 1996 showing people with mustard gas burns.
- An overview of the sulfur and nitrogen mustard agents (Caution: contains graphic images)
- Questions and Answers for Mustard Gas
- UMDNJ-Rutgers University CounterACT Research Center of Excellence A research center studying sulfur mustard, includes searchable reference library with many early references on sulfur mustard.
- Nightmare in bari









