كلوريد القصدير الثنائي (أو كلوريد القصديروز) مركب كيميائي له الصيغة SnCl2، ويكون على شكل بلورات بيضاء.
| كلوريد القصدير الثنائي | |
|---|---|
| الاسم النظامي (IUPAC) | |
كلوريد القصدير الثنائي |
|
| أسماء أخرى | |
ثنائي كلوريد القصدير |
|
| المعرفات | |
| رقم CAS | 7772-99-8 10025-69-1 (ثنائي هيدرات) |
| بوب كيم | 24479 |
| الخواص | |
| الصيغة الجزيئية | SnCl2 |
| الكتلة المولية | 189.61 غ/مول |
| المظهر | بلورات بيضاء |
| الكثافة | 3.95 غ/سم3 (لا مائي) 2.71 غ/سم3 (ثنائي هيدرات) |
| نقطة الانصهار | 247 °س |
| نقطة الغليان | 623 °س |
| الذوبانية في الماء | 84 غ/100 مل ماء عند 0 °س |
| الذوبانية | ينحل في الإيثانول والأسيتون والإيثر |
| المخاطر | |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التحضير
يحضر كلوريد القصدير الثنائي اللامائي من أثر كلوريد الهيدروجين على فلز القصدير. أما الشكل المائي (ثنائي هيدرات) فيحصل عليه بشكل مشابه وذلك من أثر حمض الهيدروكلوريك كما في المعادلة:
Sn (s) + 2 HCl (aq) → SnCl2 (aq) + H2 (g)
يلي ذلك إجراء عملية تبلور للحصول على بلورات من ثنائي الهيدرات، والتي يمكن نزع جزيئات الماء منها باستخدام بلاماء حمض الخليك.
الخواص
ينحل كلوريد القصدير الثنائي بشكل جيد في الماء، كما أنه ينحل في الإيثانول والأسيتون وثنائي إيثيل الإيثر. يوجد منه نمط مائي على شكل ثنائي هيدرات ثابت، لكنه يمكن أن تخضع محاليله لحلمهة عند تسخينها، حيث يتشكل ملح قاعدي غير منحل:
- SnCl2 (aq) + H2O (l) ⇌ Sn(OH)Cl (s) + HCl (aq)
لذلك فللحصول على محاليل رائقة من كلوريد القصدير الثنائي يحل في حمض الهيدروكلوريك وذلك من أجل إزاحة التوازن حسب مبدأ لو شاتيليه إلى الجهة اليسرى.
كما تخضع محاليل كلوريد القصدير الثنائي للأكسدة بأكسجين الهواء حسب المعادلة:
- 6 SnCl2 (aq) + O2 (g) + 2 H2O (l) → 2 SnCl4 (aq) + 4 Sn(OH)Cl (s)
ويمكن التخفيف من هذا الأثر بتخزين المحاليل فوق قطع من فلز القصدير.[3]
- يتميز كلوريد القصدير الثنائي بخواصه الاختزالية، حيث يختزل أملاح الذهب والفضة إلى الفلزات، كما يختزلالحديد الثلاثي إلى الحديد الثنائي:
- SnCl2 (aq) + 2 FeCl3 (aq) → SnCl4 (aq) + 2 FeCl2 (aq)
تعد محاليل كلوريد القصدير الثنائي مصدراً لأيونات +2Sn والتي تشكل المركبات الأخرى للقصدير الثنائي عن طريق حدوث تفاعل ترسيب. فعلى سبيل المثال يتفاعل كلوريد القصدير الثنائي مع كبريتيد الصوديوم ليشكل كبريتيد القصدير الثنائي ذا اللون البني المسود.
في حال إضافة قلوي إلى محلول كلوريد القصدير الثنائي يتشكل راسب أبيض من أكسيد القصدير الثنائي المائي، والذي بدوره ينحل في حال إضافة فائض من القلوي بسبب تشكل أنيون القصديريت كما في المعادلات:
- SnCl2(aq) + 2 NaOH (aq) → SnO·H2O (s) + 2 NaCl (aq)
- SnO·H2O (s) + NaOH (aq) → NaSn(OH)3 (aq)
يعد كلوريد القصدير الثنائي من أحماض لويس حيث يشكل معقدات مع ربيطات مثل الكلوريد كما في المعادلة:
- SnCl2 (aq) + CsCl (aq) → CsSnCl3 (aq)
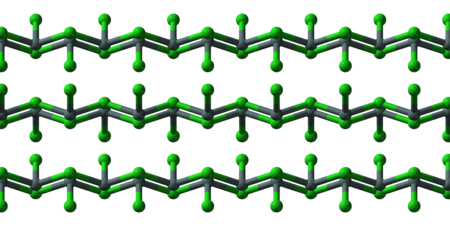
البنية
لمركب كلوريد القصدير الثنائي زوج وحيد من الإلكترونات، لذلك يكون الجزيء منحنياً (غير خطي) في الحالة الغازية. أما في الحالة الصلبة فإن كلوريد القصدير الثنائي يشكل سلاسل متصلة ببعضها البعض عن طريق جسور كلورية. أما الشكل المائي من ثنائي الهيدرات فإنه يكون أيضاً على شكل رباعي وجوه، وتكون ذرة الأكسجين من إحدى جزيئتي الماء مرتبطة مباشرة مع ذرة القصدير، أما الأخرى فترتبط بالأولى.
الاستخدامات
- تستخدم محاليل ثنائي كلوريد القصدير في حمض الهيدروليك ككهرل في عملية الطلي الكهربائي بالقصدير، حيث يطبق فرق جهد ويترسب القصدير على المهبط من خلال عملية تحليل كهربائي.
- يستخدم كلوريد القصدير الثنائي كمرسخ لوني لبعض الأصبغة في مجال الصباغة مثل صباغ كارمين، والذي يعطي
معه ألوان أنصع.
- يستخدم كحفاز في إنتاج عديد حمض اللبنيك.
- له تطبيقات مخبرية في الكيمياء التحليلية وذلك لخواصه الاختزالية، حيث كان يستخدم للكشف عن وجود أيونات الزئبق. ففي حال إضافة كلوريد القصدير الثنائي بالقطارة على محلول من كلوريد الزئبق الثنائي يتشكل لدينا راسب أبيض من كلوريد الزئبق الأحادي، والذي ينقلب بدوره حال إضافة المزيد من كلوريد القصدير الثنائي إلى اللون الأسود، مما يدل على تشكل الزئبق الفلزي. وفي تطبيق آخر بنقلب لون كلوريد القصدير الثنائي إلى اللون الأرجواني عند وجود مركبات الذهب.
- في الكيمياء العضوية يستخدم كلوريد القصدير الثنائي في اختزال ستيفن، حيث يختزل النتريل إلى إيمين والذي يتحلمه بسهولة إلى ألدهيد.[5]
لكن هذا التفاعل قل استخدامه حالياً، بسبب استعمال هيدريد ثنائي إيزوبوتيل ألومنيوم كبديل.
يستعمل كلوريد القصدير الثنائي في اختزال الكينون إلى هيدروكينون كما يستعمل لاختزال مركبات النترو العطرية إلى مركبات أنيلين.[6]
- يستعمل كلوريد القصدير الثنائي كمضاف غذائي له رقم الإي E512 إلى بعض الأغذية والأطعمة المحفوظة في معلبات حيث تسهم كعامل للمحافظة على اللون وكمضاد تأكسد.
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/24479 — تاريخ الاطلاع: 19 نوفمبر 2016 — العنوان : Tin dichloride — الرخصة: محتوى حر
- صفحة البيانات الكيميائية من Alfa - تصفح: نسخة محفوظة 14 أبريل 2020 على موقع واي باك مشين.
- H. Nechamkin (1968). The Chemistry of the Elements. New York: McGraw-Hill.
- J. M. Leger, J. Haines, A. Atouf (1996). "The high pressure behaviour of the cotunnite and post-cotunnite phases of PbCl2 and SnCl2". Journal of Physics and Chemistry of Solids. 57 (1): 7–16. doi:10.1016/0022-3697(95)00060-7.
- Williams, J. W (1955). OrgSynth. 3: 626.
- F. D. Bellamy and K. Ou (1984). "Selective reduction of aromatic nitro compounds with stannous chloride in non acidic and non aqueous medium". Tetrahedron Letters. 25 (8): 839–842. doi:10.1016/S0040-4039(01)80041-1.




