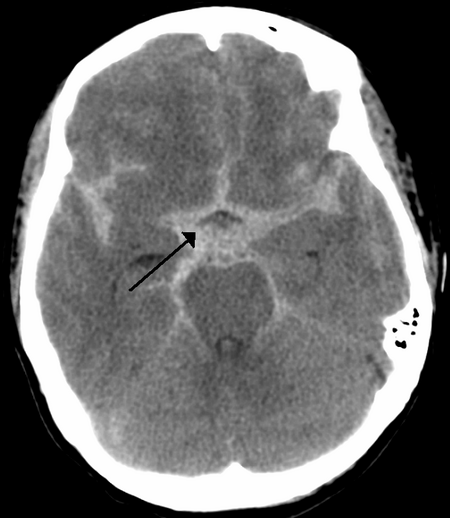
نزف تحت العنكبوتية (Subarachnoid hemorrhage) هو نزف في الحيز تحت العنكبوتية – المنطقة الواقعة بين الغشاء العنكبوتي والأم الحنون في الطبقة المحيطة بالدماغ-. هذا النزف يمكن أن يحدث بشكل عفوي نتيجة لفتق حدث في شريان محتقن داخل الدماغ، أو يمكن أن يحصل نتيجة إصابة للدماغ.
تشمل أعراض نزف تحت العنكبوتية ألمًا حادًّا في الرأس يوصف بـ "الصداع الرعدي"، وتشمل أيضًا التقيؤ، الارتباك أو درجة متدنيّة من الوعي، وفي بعض الأحيان التشنُّجات.[1] بشكل عام يتم تأكيد التشخيص بنزف تحت العنكبوتية عبر صورة تصوير مقطعي محوسب للرأس وأحيانا يتم التشخيص عبر إجراء طبي يدعى البَزْل القَطَنِي.
العلاج يكون عبر التدخل الجراحي الفوري بعملية جراحة عصبية أو عبر إجراءات علاجية محتكمة إلى أساس إشعاعي إضافة إلى الأدوية والعلاجات الأخرى لتساعد على منع تكرار حدوث النزيف ومضاعفاته. بدأ إجراء العمليات الجراحية لتمدد الأوعية الدموية في الثلاثينيات 1930، ولكن منذ 1990التسعينات يتم التعامل مع العديد من حالات تمدد الأوعية الدموية عن طريق إجراء عمليات جراحية أقل جورا تسمى بـ "اللف"، التي تقوم بها الأجهزة من خلال الأوعية الدموية الكبيرة.[1]
يعد نزف تحت العنكبوتية شكل من أشكال السكتات الدماغية ويشكل ما نسبته 1-7 بالمئة من مجموع السكتات الدماغية.[2] يُعدّ نزف تحت العنكبوتية حالة صحية طارئة ويمكن أن يؤدي إلى الوفاة أو إلى إعاقات شديدة – حتى وإن تم اكتشافه وعلاجه في مراحله المبكرة.
أكثر من نصف حالات نزف العنكبوتية هي حالات مميتة ويموت ما نسبته 10-15 بالمئة من المصابين قبل الوصول إلى المشفى،[1] أما النسبة الناجية فعادة ما تنجو باعتلالات عصبية أو قصور فكري.[3]
| نزف تحت العنكبوتية | |
|---|---|
تصوير أشعة مقطعية يظهر نزف تحت العنكبوتية كمنطقة بيضاء في الوسط وتمتد إلى الأتلام في كلا الجانبين (انظر السهم)
| |
| معلومات عامة | |
| الاختصاص | طب الطوارئ |
| من أنواع | نزف داخل القحف، واعتلال دماغي |
| الإدارة | |
| أدوية | |
العلامات والأعراض
العرض الرئيسي لنزيف تحت العنكبوتية هو صُداع قصف الرعد (صداع يوصف بـأنه مثل تلقي "ركلة في الرأس"[4] أو "الأسوأ على الإطلاق" النامي من ثواني إلى دقائق). هذا الصداع غالبًا ما يبدأ من الجزء الخلفي من الرأس.[5] بصرف النظر عن الصداع المميز لهذه الحالة حوالي ثلث من الناس ليس لديهم أي أعراض، وواحد من كل عشرة أشخاص يعانون من هذا العرض ويبحث عن الرعاية الطبية يتم تشخيصه فيما بعد بنزف تحت العنكبوتية.[1] ومن الممكن أن يعاني المصاب من التقيؤ، ويعاني 1 من 14 أشخاص من نوبات.[1] وقد يعاني المصابون كذلك من الارتباك، أو انخفاض مستوى الوعي أو الغيبوبة أيضاً، بالإضافة إلى تصلب الرقبة وغيرها من العلامات السحائية.[1] عادة ما يحدث تصلب الرقية بعد ستة ساعات من ظهور النزيف.[6] توسع بؤبؤ العين دون أعراض أخرى وفقدان منعكس الحدقة قد يشير إلى فتق الدماغ نتيجة ارتفاع الضغط داخل القحف (الضغط داخل الجمجمة).[1] النزيف في باطن العين العين (نزيف في مقلة العين) قد يحدث استجابة لارتفاع الضغط: النزيف تحت الزجاجية (نزيف تحت الغشاء الذي يغلف الجسم الزجاجي للعين) ونزيف الجسم الزجاجي قد يكونا مرئيان عند إجراء تنظير لقاع العين. هذا معروف باسم متلازمة تيرسون Terson Syndrome التي تحدث في 3-13% من الحالات وتكون شائعة أكثر في حالات النزيف تحت العنكبوتية الأكثر شدة.[7] شذوذ العصب المحرك للعين (العين المصابة تنظر للأسفل والخارج ويتدلى الجفن على نفس الجانب) أو الشلل (فقدان الحركة) قد يشير إلى نزيف من الشريان المخي الموصل الخلفي.[1][5] تكون النوبات أكثر شيوعاً إذا كان النزيف ناتجا عن تمدد الأوعية الدموية، وإلا فإنه من الصعب التنبؤ بمصدر النزيف من خلال الأعراض.[1] إذا كان الشخص مصابا بالنزف تحت العنكبوتية ولديه نوبات غالباً ما يكون التشخيص هو تشوه شرياني وريدي.[5] الجمع بين النزيف داخل الدماغ وارتفاع الضغط داخل الجمجمة (إذا كان موجودا) يؤدي إلى "تدفق ودي (سمبثاوي)" أي بمعنى الإفراط في تفعيل الجهاز العصبي الودي. ويعتقد أن هذا يحدث من خلال آليتين: التأثير المباشر على النخاع الذي يؤدي إلى تنشيط الجهاز العصبي الودي الهابط والنشر المحلي للمواد الوسيطة للالتهابات التي تنتشر في الدورة الدموية الطرفية حيث تفعل الجهاز الودي. ونتيجة لارتفاع التدفق الودي هناك زيادة مفاجئة في ضغط الدم تحدث بواسطة زيادة انقباض البطين وزيادة تضيّق الأوعية الذي يؤدي إلى زيادة المقاومة الوعائية الجهازية. النتائج المترتبة على هذه الزيادة السمبثاوية يمكن أن تكون مفاجئة، حادة وكثيراً ما تكون مهددة للحياة. تركيزات البلازما العالية من الأدرينالين أيضاً قد تسبب عدم الانتظام في ضربات القلب (اضطرابات في معدل ضربات القلب والإيقاع)، وقد تسبب أيضا في تغيرات في تخطيط كهربيَة القلب في 27% من الحالات[8] والسكتة القلبية (في 3% من الحالات) قد تحدث بسرعة بعد ظهور النزيف.[1][9] ونتيجة أخرى لهذه العملية هي الوذمة الرئوية العصبية[10] حيث تتسبب عملية زيادة الضغط داخل الدورة الدموية الرئوية بتسرب السوائل من الشعيرات الدموية الرؤية إلى الفراغات الهوائية والحويصلات الهوائية والرئة. نزيف تحت العنكبوتية قد يحدث أيضاً للأشخاص الذين لديهم إصابة في الرأس. الأعراض قد تشمل الصداع، انخفاض مستوى الوعي وشلل شقّي (ضعف في جانب واحد من الجسم). النزيف تحت العنكبوتية ظاهرة متكررة في إصابات الدماغ الرضية، ويؤدي إلى سوء التشخيص إذا ترافق ذلك مع تدهور في مستوى الوعي.[11]
الأسباب
معظم حالات النزيف سببها الصدمات.[12] في 85% من حالات النزيف العفوية السبب هو تمزق ناتج عن تمدد الأوعية الدموية الدماغية -ضعف في جدار أحد الشرايين في الدماغ التي تتوسع، وإنها تميل إلى أن تكون موجودة في دائرة ويليس وفروعها. في حين أن معظم حالات النزيف يسببها النزيف من تمدد الأوعية الدموية الصغيرة، الأوعية الكبيرة (التي هي أقل شيوعا) هي أكثر عرضة للتمزق.[1] في 15-20% من حالات النزيف تحت العنكبوتية العفوية، لا يتم الكشف عن تمدد الأوعية الدموية الوعائية عن خلال تصوير الأوعية الأولي.[13] تعزى حوالي نصف هذه الحالات إلى نزيف حول الدماغ الأوسط ولا ترتبط بتمدد الاوعية الدموية. حيث أن الدم في هذه الحالات يتواجد فقط في المساحات ما تحت العنكبوتية في جميع أنحاء الدماغ المتوسط، وإن مصدر الدم فيها غير مؤكد.[1] أما باقي الحالات تكون بسبب الاضطرابات الأخرى التي تؤثر على الأوعية الدموية (مثل تشوهات الشرايين الوريدية) واضطرابات الأوعية الدموية في الحبل الشوكي ونزيف في مختلف الأورام.[1] تعاطي الكوكايين وفقر الدم المنجلي (عادةً عند الأطفال) والعلاج المضاد للتخثر نادرًا والمشاكل في تخثر الدم والسكتة النخامية من الممكن أن يؤدوا أيضًا إلى النزف تحت العنكبوتية.[6][13] تسلخ الشريان الفقري عادةً ما يكون بسبب الصدمات ومن الممكن أن يؤدي إلى النزيف تحت العنكبوتية إذا كان التسلخ يتضمن جزءا من الوعاء الدموي في الجمجمة.[14] يمكن الكشف عن الدم تحت العنكبوتية من خلال الفحص بالأشعة المقطعية فيما يصل إلى 60% من الأشخاص الذين يعانون من إصابات في الدماغ.[15] صدمة النزيف تحت العنكبوتية تحدث عادة بالقرب من موقع كسر في الجمجمة أو كدمة داخل المخ.[13] وعادة ما تحدث في أشكال أخرى من إصابات في الدماغ وترتبط بتوقعات سيئة لسير المرض، لكنه من غير الواضح إن كان ذلك نتيجة مباشرة للنزيف تحت العنكبوتية أو إذا كان وجود الدم تحت العنكبوتية هو مجرد مؤشر على شدة الإصابة في الرأس ويعتمد سير المرض على آليات أخرى مرتبطة بالإصابة.[15]
التشخيص
فقط 10% من الذين يدخلون إلى قسم الطوارئ ويعانون من الصُّداع الرَّعدي هم مُصابون فعليا بنزيف تحت العنكبوتية، عادةً ما يُؤخذ في عين الاعتبار عدد الأسباب المُحتملة الأخرى في الوقت ذاته، مثل التهاب السحايا والصداع النصفي وخثار الجيب الوريدي الدماغي.[4] النزيف داخل الدماغ شائع بمقدار الضعف بالمقارنة مع النزيف تحت العنكبوتية وغالباً ما يشخص خطأً على أنه الأخير.[16] إنه ليس من غير المألوف أن يشخص النزيف تحت العنكبوتية خطأ في بأنه صداع نصفي أو صداع التوتر، مما قد يؤدي إلى التأخير في الحصول على الأشعة المقطعية. حدث هذا في 12% من جميع الحالات في دراسة أجريت عام 2004، وكان أكثر احتمالاً في الناس الذين كان لديهم نزيف أصغر ولم يتواجد هنالك ضعف في حالتهم العقلية، حيث أن التأخر في التشخيص أدى إلى نتائج أسوأ.[17] عند بعض الناس يمكن للصداع أن يشفى من تلقاء نفسه دون وجود أية أعراض أخرى، حيث يشار إلى هذا النوع من الصداع باسم "الصداع الخفير"، لأنه من المفترض أن ينجم عن تسرب صغير ("تسرب التحذير") من تمدد الأوعية الدموية. "الصداع الخفير" أيضا يتطلب التحقيقات عبر الأشعة المقطعية والبزل القطني لأنه من الممكن أن يحدث المزيد من النزيف في الأسابيع الثلاثة اللاحقة.[3]
التصوير
الخطوات الأولى لتقييم الشخص المحتمل اصابته بنزيف تحت العنكبوتية هي الحصول على السيرة المرضية وأداء الفحص البدني، حيث تهدف في تحديد ما إذا كانت الأعراض سببها النزيف تحت العنكبوتية أو سببا آخر. التشخيص لا يمكن أن يتم من خلال الخلفية السريرة وحدها، لذلك التصوير الطبي مطلوب بشكل عام لتأكيد أو استبعاد النزيف. طريقة الاختبار تتم من خلال التصوير المقطعي المحوسب دون اجراءات التصوير النقيض للدماغ، هذا لديه حساسية عالية حيث تحدد أكثر من 95% من الحالات بشكل صحيح وخاصة في اليوم الأول بعد بدء النزيف. التصوير بالرنين المغناطيسي قد يكون أكثر حساسية من التصوير الطبقي المحوري بعد عدة أيام.[1] أفادت دراسة أنه خلال ستة ساعات من ظهور الأعراض تكون نتيجة التصوير المقطعي المحوسب حساسة بنسبة 100%.[18]
البزل القطني
عند إزالة السائل النخاعي بإبرة من الكيس القطني تظهر أدلة على نزيف في 3% من المرضى الذين كانت نتيجة التصوير الطبقي المحوري لديهم طبيعية، لذلك يعتبر البزل القطني إلزاميا للناس المشتبه وجود نزيف تحت العنكبوتية لديهم إذا كانت نتيجة التصوير سلبية.[1] يتم جمع ثلاثة أنابيب من السائل الدماغي النخاعي على الأقل.[6] إذا وجد ارتفاع في معدل خلايا الدم الحمراء في جميع الأنابيب بشكل متساوي فهذا يشير إلى وجود نزيف تحت العنكبوتية، وإذا قلّت عدد الخلايا في كل زجاجة فمن المرجّح أن ذلك بسبب الأضرار التي لحقت بالأوعية الدموية الصغيرة أثناء الإجراء وهذا معروف باسم "traumatic tap" "صدمة الصنبور".[3] وبينما لا يوجد قطع رسمي لخلايا الدم الحمراء في السائل الدماغي النخاعي ليس هنالك حالات موثقة تقل عن بضعة مئات من الخلايا لكل حقل على مستوى عالي القوة.[19]
يتم فحص عينة السائل الدماغي النخاعي أيضًا "للاصفرار" (مظهر السائل الأصفر الناتج من جهاز الطرد المركزي)، فهذا يمكن تحديده عن طريق قياس الضوء الطيفي (قياس امتصاص موجات معينة من الضوء) أو عن طريق الفحص البصري. من غير الواضح أي طريقة هي الأجدر.[20] ما زال فحص الاصفرار طريقة موثوقة للكشف عن النزف تحت العنكبوتية بعد عدة أيام من ظهور الصداع.[21] يجب مرور فاصل زمني بمدة 12 ساعة ما بين بدء حدوث الصداع وإجراء عملية البزل القطني على الأقل، وذلك لان الهيموغلوبينمن في خلايا الدم الحمراء يستغرق عدة ساعات ليؤيض إلى البيليروبين.[1][21]
تصوير الأوعية الدموية
بعد التأكد من وجود نزيف تحت العنكبوتية، يجب تحديد مصدره. إذا كان النزيف من المرجح أنه قد نشأ من تمدد الأوعية الدموية (كما تبينه نتيجة التصوير المقطعي المحوسب)، فالخيار يكمن بين تصوير الأوعية الدماغية (حقن مواد مظللة -مواد عتيمة للأشعة - من خلال قسطرة لشرايين الدماغ) والتصوير الطبقي المحوري للأوعية (تصوير الأوعية الدموية مع مادة مظللة عن طرق التصوير المقطعي المحوسب) لتحديد تمدد الأوعية الدموية. كما تقدم قسطرة الأوعية إمكانية لف الأوعية الدموية المتمددة. (انظر للأسفل) .[1][3]
مخطط القلب الكهربائي
التغيرات في مخطط القلب الكهربائي شائعة نسبياً في نزيف تحت العنكبوتية وتحدث في 40-70% من الحالات. ويمكن أن تشمل إطالة فترة كيو تي، وموجات Q، الاضطرابات القلبية وارتفاع ST الذي يشبه نوبة قلبية.[22]
التصنيف
هناك عدة جداول تحتوي على مقاييس لدرجات النزف تحت العنكبوتية. يتم استخدام مقياس غلاسكو للغيبوبة لتقييم الوعي. وتستخدم ثلاثة مقاييس متخصصة لتقييم النزف تحت العنكبوتية، حيث كلما كانت الدرجة أعلى فهذا يعني نتائج أسوأ.[23] قد استمدت هذه المقاييس عن طريق مطابقة رجعية لسمات المرضى الذين يعانون من النزف ونتائجهم. وقد وصف أول مقياس من قبل "هانت وهيس" عام 1968.[24]
| الدرجة | العلامات والأعراض | نسبة النجاة |
|---|---|---|
| 1 | دون أعراض أو صداع خفيف وتصلب بسيط للرقبة. | 70% |
| 2 | صداع معتدل إلى شديد؛ تصلب الرقبة؛ لا يوجد عجز عصبي سوى الشلل العصبي القحفي. | 60% |
| 3 | الشعور بالنعس؛ الحد الأدنى من العجز العصبي. | 50% |
| 4 | الذهول؛ شلل نصفي معتدل إلى شديد؛ من المحتمل وجود صمل فصل الدماغ المبكر واضطرابات خمولبة. | 20% |
| 5 | غيبوبة؛ عميقة صمل فصل الدماغ؛ احتضار. | 10% |
مقياس "فيشر " يصنف ظهور نزيف تحت العنكبوتية على التصوير الطبقي المحوري.[25]
| الدرجة | ظهور النزف |
|---|---|
| 1 | لا شيء واضح. |
| 2 | أقل من 1 مم. |
| 3 | أكبر من 1 مم. |
| 4 | منتشر أو لا شيء مع النزف داخل البطين أو تمديد متني. |
تم تعديل هذا المقياس من قبل "كلاسن" وزملاءه في العمل، ويعكس المخاطر المضافة بسبب حجم النزيف التحت العنكبوتي والنزف داخل البطين المصاحب. (0 - لا شيء؛ 1 - الحد الأدنى من النزيف تحت العنكبوتية دون النزيف البطيني الداخلي؛ 2 - الحد الأدنى من النزيف تحت العنكبوتية مع النزيف البطيني الداخلي؛ 3 - نزيف تحت العنكبوتية كثيف دون النزيف البطيني الداخلي؛ 4 - نزيف تحت العنكبوتية كثيف مع النزيف البطيني الداخلي).[26] تصنيف الاتحاد العالمي لجراحي الأعصاب (WFNS) يستخدم مقياس غلاسكو للغيبوبة (GCS) والعجز العصبي البؤري لقياس شدة الأعصاب.[27]
| الدرجة | درجة غلاسكو للغيبوبة | العجز العصبي المحوري |
|---|---|---|
| 1 | 15 | معدوم |
| 2 | 13–14 | معدوم |
| 3 | 13–14 | موجود |
| 4 | 7–12 | معدوم أو موجود |
| 5 | <7 | معدوم أو موجود |
وقد اقترح نظام تصنيف شامل من قبل جلفي وكارتر للتنبؤ بالنتائج وقياس العلاج.[28] يتكون النظام من خمس درجات ويقوم بتعيين نقطة واحدة لوجود أوعدم وجود واحدة من خمسة عوامل هي: سن أكبرمن 50؛ درجة هنت وهس 4 أو 5؛ مقياس فيشر 3 أو 4؛ تمدد للأوعية الدموية أكبر من 10 ملم؛ وتمدد أوعية الدورة الدموية الخلفية بمقدار 25 ملم أو أكثر.[28]
الفحص والوقاية
الكشف عن تمدد الأوعية الدموية لا يتم تنفيذه على مستوى السكان لأنه نادر نسبيًّا، فإنه لن يكون فعالا من حيث التكلفة. إذا كان لدى شخص ما اثنين أو أكثر من أقارب الدرجة الأولى سبق لهم الإصابة بنزيف تحت العنكبوتية الأمدمي فإن الفحص قد يكون مجديًا.[1][29] ومن المعروف أن داء الكلى المتعددة الكيسات السائد، وهو داء كلى وراثي، يترافق مع تمدد الأوعية الدموية الدماغية في 8٪ من الحالات، ولكن معظم هذه الأوعية صغيرة وبالتالي من غير المرجح أن تتمزق. نتيجة لذلك إن الفحص للمرض ينصح به فقط في حالة العائلات المصابة ب ADPKD التي أصيب فرد منها بتمزق الأوعية الدموية المتمددة.[30] قد يتم الكشف عن تمدد الأوعية الدموية بالمصادفة عبر تصوير الدماغ وهذا يمثل معضلة لأن جميع أدوية علاج تمدد الأوعية الدموية الدماغية تحتمل وجود بعض المضاعفات. قدمت الدراسة الدولية لتمدد الأوعية الدموية الغير ممزقة داخل الجمجمة (ISUIA) بيانات تنبؤية لللأشخاص الذين سبق لهم الإصابة بنزيف تحت العنكبوتية والأشخاص الذين كان لديهم تمدد في الأوعية الدموية التي تم الكشف عنها خلال وسائل أخرى. أولئك الذين أصيبوا بنزف تحت العنكبوتية كانوا معرضين أكثر للنزف نتيجة تمدد أوعية دموية اخرى. في المقابل، فإن أولئك الذين لم يصابوا بنزيف وكان لديهم تمدد في الأوعية الدموية الصغيرة ( أقل من 10 ملم) فتوجد احتمالية قليلة جدا لأن يصابوا بنزف تحت العنكبوتية، ومن المحتمل أكثر أن يصابوا بضرر نتيجة المحاولات لإصلاح تمدد الأوعية الدموية.[31] تبعا لأساسيات الدراسة الدولية لتمدد الأوعية الدموية غير الممزقة داخل الجمجمة (ISUIA) وغيرها من الدراسات، فإنه من المستحسن أن يلجأ الناس إلى العلاج الوقائي فقط إذا كان مأمول عمرهم معقولا أو إذا كان لديهم تمدد في الأوعية الدموية التي من المحتمل جداً أن تتمزق.[29] وفي الوقت نفسه هنالك أدلة محدودة فقط أن العلاج الداخلي لتمدد الأوعية الدموية الغير ممزقة مفيد فعلاً.[32]
المعالجة
يتضمن التدبير العلاجي للمرض إجراءات عامة لتحقيق الاستقرار في المريض عبر استخدام تحقيقات وعلاجات محددة. وتشمل الوقاية من عودة النزيف عن طريق طمس مصدر النزيف ومنع ظاهرة تعرف باسم بالتشنج الوعائي، والوقاية من أو علاج المضاعفات.[1] استقرار المريض هو الأولوية الأولى. أولئك الذين لديهم مستوى وعي متدني قد يحتاجون إلى تنبيب وتهوية ميكانيكية. يتم مراقبة ضغط الدم والنبض ومعدل التنفس ومقياس غلاسكو للغيبوبة بشكل متكرر. بمجرد تأكيد التشخيص، فمن الأفضل أن يتم إدخال المريض إلى العناية المركزة، خاصة أن 15% من المرضى قد يعانون من النزيف بعد وقت قصير من دخول العناية المركزة. التغذية هي إحدى الأولويات المبكرة، وتكون إما عن طريق الفم أو عبر أنبوب أنفي معدي، وهذه أفضل من طرق الحقن. بشكل عام، إن تسكين الألم (السيطرة على الألم) يقتصر على مسكنات قليلة التخدير مثل الكوديين، لأن التخدير قد يؤثر على الحالة العقلية، وبالتالي تتداخل مع القدرة على مراقبة مستوى الوعي. يتم منع التجلط الوريدي العميق من خلال جوارب الضغط أو الضغط الهوائي المتقطع على عضلة بطة الساق، أو كليهما.[1] عادة ما يتم إدخال قسطرة المثانة لمراقبة توازن السوائل. من الممكن إعطاء البنزوديازيبينات للمساعدة في تخفيف الالم.[6] وينبغي إعطاء الأدوية المضادة للقيء للمرضى اليقظين.[5] من المؤشرات لإجراء استنزاف البطين الخارجي من قبل جراح الأعصاب: المرضى الذين لديهم مستوى سريري متدني عند دخولهم، أو التدهور العصبي الحاد، أو التوسع البطيني التدريجي في التصوير المحوري الطبقي،. يمكن إدخال مصرف البطين الخارجي إما عن طريق غرفة العمليات أو في سرير المريض. في كلا الحالتين يجب الحفاظ على تقنية التعقيم الصارمة أثناء الإدراج. في المرضى الذين يعانون من النزف تحت العنكبوتية الأمدمي فإن تصريف البطين الخارجي يستخدم لإزالة سوائل النخاع الشوكي والدم ومنتجات الدم الثانوية التي تزيد من مستوى الضغط داخل الجمجمة ومن الممكن أن تزيد من خطر الإصابة بالتشنج الدماغي.[33]
منع إعادة النزيف
الأشخاص الذين يظهر لديهم ورم دموي كبير في الأشعة المقطعية أو تدني في مستوى الوعي أو أعراض عصبية بؤرية قد يستفيدون من الاستئصال الجراحي العاجل للدم أو إسداد موقع النزيف. أما البقية فيتم الحفاظ على استقرارهم على نحو واسع ويخضعون لتصوير الأوعية عبر الشريان الفخذي (transfemoral) ولتصوير طبقي محوري للأوعية الدموية فيما بعد. من الصعب معرفة من سيحدث له النزيف مرة أخرى، وقد يحدث ذلك في أي وقت ويؤدي إلى توقعات سيئة. بعد مرور الـ 24 ساعة الأولى، يبقى خطر عودة النزف حوالي 40 في المئة على مدى أربعة أسابيع لاحقة، مما يشير إلى أن التدخلات ينبغي أن تهدف إلى الحد من هذا الخطر في أقرب وقت ممكن.[1] إذا تم التعرف على تمدد للأوعية الدموية الدماغية من خلال تصوير الأوعية الدموية، فهنالك تدبيران متاحان للحد من خطر أي نزيف آخر من نفس الأوعية الدموية المتمددة: القص[34] واللف[35] القص يتطلب حج القحف (فتح الجمجمة) لتحديد موقع تمدد الأوعية الدموية، يليها وضع ملاقط حول عنق أم الدم. يتم تنفيذ اللف من خلال الأوعية الدموية الكبيرة (داخل الاوعية الدموية): يتم إدخال قسطرة في الشريان الفخذي في الفخذ وتُمد من خلال الشريان الأبهر إلى الشرايين التي تغذي الدماغ (كلا الشرايين السباتية وكلا الشرايين الفقرية). عندما يتم تحديد موقع تمدد الأوعية الدموية، يتم نشر لفائف البلاتين التي تسبب تجلط الدم في منطقة تمدد الأوعية الدموية وتطمس أم الدم. عادة ما يتم اتخاذ القرار بشأن طريقة العلاج الذي سيستخدم من قبل فريق متعدد التخصصات يتكون من أخصائي الاعصاب وأخصائي الاشعة العصبية وفي كثير من الأحيان المهنيين الصحيين الآخرين.[1] بشكل عام، يتم اتخاذ القرار بين القص واللف اعتمادا على مكان تمدد الأوعية الدموية وحجمها وحالة المريض. تمدد الأوعية الدموية في الشريان الدماغي الأوسط والأوعية التابعة له يصعب الوصول إليها عبر التصوير الوعائي وتميل إلى أن تكون قابلة للقص. أما الشرايين مثل الشريان القاعدي والشريان الدماغي الخلفي فمن الصعب الوصول إليها جراحيا لكن الوصول إليها يكون أكثر سهولة عبر باطنة الوعاء.[36] تستند هذه المناهج على التجربة العامة، وأجريت التجربة الوحيدة العشوائية التي تقارن مباشرة بين الأساليب المختلفة على مرضى ذوو حالة صحية جيدة نسبيًا ولديهم تمدد صغير في الأوعية الدموية (أقل من 10 ملم) في الشريان المخي الأمامي وشريان التواصل الامامي ( يشكلان معا "الدورة الدموية الأمامية" )، ويشكلون حوالي 20٪ من جميع المرضى الذين يعانون من تمدد في الأوعية الدموية في حالة نزف تحت العنكبوتية.[36][37] و هذه التجربة، التجربة الدولية لتمدد الاوعية الدموية تحت العنكبوتية (ISAT) أظهرت أن احتمالية الوفاة أو الاعتماد على الاّخرين في النشاطات اليومية تنخفض (7.4% للحد من الخطر المطلق، 23.5% الحد من المخاطر النسبية) إذا تم استخدام اللف داخل الأوعية الدموية بدلا من الجراحة.[36] العائق الرئيسي من اللف هو أن احتمال تمدد الأوعية الدموية سوف يتكرر؛ هذا الاحتمال ضئيل للغاية في النهج الجراحية. في التجربة الدولية لتمدد الاوعية الدموية في حالة النزف تحت العنكبوتية 8.3% يحتاجون إلى تلقي المزيد من العلاج على المدى الطويل. و بالتالي عادة ما يتم متابعة الأشخاص الذين خضعوا للف الأوعية الدموية لسنوات عديدة مع تصوير للأوعية الدموية أو عن خلال طرق أخرى لضمان تحديد تمدد الأوعية الدموية مبكرًا.[38] وقد وجدت التجارب الأخرى أيضا ارتفاع معدل التكرار الذي يستدعي المزيد من العلاجات.[39][40]
التشنج الوعائي
التشنج الوعائي، حيث تنقبض الأوعية الدموية وبالتالي تحد من تدفق الدم، وهو من المضاعفات الخطيرة للنزف تحت العنكبوتية. ويمكن أن يتسبب بنقص التروية في حالات إصابة الدماغ (المسمية بـ "نقص التروية المتأخرة") وتلف دائم في الدماغ بسبب نقص الأكسجين في أجزاء من الدماغ. ويمكن أن يكون قاتلاً إذا كان شديدًا. يتميز نقص التروية المتأخر بظهور أعراض عصبية جديدة، ويمكن التأكد منه عن خلال دوبلر عبر الجمجمة أو تصوير الأوعية الدماغية. ما يعادل ثلثا من الأشخاص المصابين بالنزيف تحت العنكبوتية سيحدث لديهم نقص تروية متأخر، ولنصف هؤلاء ضرر دائم نتيجة لذلك.[41] من الممكن إجراء فحص لتطور التشنج الوعائي إضافة إلى دوبلر عبر الجمجمة كل 24-48 ساعة. إذا بلغت سرعة تدفق الدم أكثر من 120 سم في الثانية الواحدة فإنها تدل على التشنج الوعائي.[3]
لقد اقترح استخدام مثبطات قنوات الكالسيوم، التي يعتقد بأنها قادرة على منع تشنج الأوعية الدموية عن طريق منع الكالسيوم من دخول خلايا العضلات الملساء، لمنع التشنج الوعائي.[15] النيموديبين (أحد مثبطات قنوات الكالسيوم) يحسن النتيجة إذا تم إعطاؤه بين اليوم الرابع والحادي والعشرين بعد النزيف، حتى إن كان ذلك لا يقلل بشكل كبير من كمية التشنج الوعائي الذي يتم الكشف عنه بتصوير الأوعية الدموية.[42] في حالات النزف تحت العنكبوتية نتيجة للصدمات، لن يؤثر دواء النيمودين على النتائج طويلة الأمد، ولا يوصى به في هذه الحالات.[43] و قد تم دراسة مثبطات أخرى لقنوات الكالسيوم بالإضافة إلى سلفات المغنيسيوم، ولا ينصح بهم في الوقت الحاضر؛ ولا يوجد هنالك أي دليل يؤكد فائدة إعطاء النيمودين عن طريق الوريد.[41]
وقد اقترحت بعض الدراسات القديمة أن تناول الستاتين قد يقلل من التشنج الوعائي، ولكن التحليل اللاحق الذي تضمن ثلاثة قضايا اخرى لم يظهر أية أدلة تؤكد فائدة استخدام الستاتين في حالات التشنج الوعائي أو النتائج السريرية.[44] كثيرا ً ما يستخدم بروتوكول يشار اليه باسم" H الثلاثي" وكثيرا ما يستخدم كمقياس لعلاج التشنج الوعائي عندما يؤدي إلى ظهور الأعراض. وهو استخدام السوائل الوريدية لتحقيق حالة من ارتفاع ضغط الدم وفرط حجم الدم (السوائل الزائدة في الدورة الدموية) وتخفيف الدم (تخفيف خفيف للدم).[45] النتائج لهذا البروتوكول غير حاسمة؛ لم تنفذ تجارب عشوائية منظمة لإثبات فوائده.[46] إن كانت أعراض نقص التروية المتأخر لم تتحسن مع العلاج الطبي، فمن الممكن أن تتم محاولة تصوير الأوعية لتحديد مواقع التشنج الوعائي وإعطاء الدواء الموسع للأوعية (الأدوية التي تؤدي إلى إرخاء جدار الوعاء الدموي) مباشرة في الشريان. كما يمكن إجراء القسطرة (فتح منطقة ضيقة مع بالون).[3]
مضاعفات اخرى
استسقاء الرأس (إعاقة تدفق السائل النخاعي) قد يحدث كإحدى المضاعفات للنزيف تحت العنكبوتية في كل من الأمد القصير أو الطويل. ويتم الكشف عنه من خلال الفحص الطبقي المحوري، حيث يلاحظ وجود زيادة في حجم البطينات الجانبية. إذا تدنى مستوى الوعي، يتم تصريف السوائل الزائدة عن طريق البزل القطني العلاجي، والتصريف خارج البطين (عبر جهاز مؤقت يتم إدراجه في واحدة من البطينين) أو في بعض الأحيان يتم عمل تحويلة دائمة.[1][3] الإغاثة في حالات استسقاء الرأس يمكن أن تؤدي إلى تحسن هائل في حالة الشخص.[1] اضطرابات ضغط الدم واضطرابات الكهارل والالتهاب الرئوي والمعاوضة القلبية من الممكن أن تحدث في حوالي نصف الأشخاص المصابين بنزف تحت العنكبوتية في المستشفى وربما تؤدي إلى تفاقم التشخيص سوءا.[3] تحدث النوبات أثناء الإقامة في المستشفى في حوالي ثلث الحالات.[3] ويعتقد الكثيرون أن الأدوية المضادة للصرع تساعد على الوقاية من النوبات.[3] وعلى الرغم من أن هذا يمارس على نطاق واسع،[47] فإنه أمر مثير للجدل ولا يستند على أدلة قوية.[48][49] في بعض الدراسات، ارتبط استخدام هذه العقاقير مع التشخيص السيء؛ على الرغم من أنه ليس واضحا ما إذا كان هذا بسبب الأدوية نفسها التي تسبب ضررا في الواقع، أو لأنها تستخدم في أكثر الأحيان في الحالات التي تعاني من التشخيص السيئ.[50][51] هنالك احتمال وجود نزيف في المعدة بسبب القرح الناتجة عن التوتر.[52]
توقعات سير المرض
النتائج قصيرة الأمد
نزف تحت العنكبوتية يرتبط عادة بالنتائج السيئة.[2][16] معدل الوفيات يتراوح ما بين 40 و 50 في المئة،[16] ولكن إحصائيات النجاة آخذة في التحسن.[1] ومن بين هؤلاء الذين ينجون بعد الإدخال إلى المستشفى، فإن أكثر من ربعهم يصبح لديهم قيود كبيرة في نمط حياتهم وأقل من خمس لا يكون لديهم أي أعراض متبقية.[36] التأخر في تشخيص النزف تحت العنكبونية الثانوي (حيث يُظن خطأً أن الصداع الرعدي هو مجرد صداع نصفي وهذه إحدى حالات سوء الفهم) يساهم في سوء النتائج.[17] من العوامل التي تتم ملاحظتها في المرضى عند دخولهم للمشفى وترتبط بنتائج سيئة: الدرجة العصبية؛ ارتفاع ضغط الدم الانقباضي؛ التشخيص السابق بنوبة قلبية أو النزف تحت العنكبوتية؛ مرض الكبد؛ حجما أكبر من الدم وتمدد أكبر في الأوعية الدموية عند التصوير الطبقي المحوري الأولي، وجود أم الدم في الدورة الدموية الخلفية؛ والسن الكبير.[50] وتشمل العوامل المصاحبة لنتائج أسوء أثناء الإقامة في المشفى حدوث نقص التروية المتأخر الناجم عن التشنج الوعائي وتطور ورم دموي داخل المخ أو النزف داخل البطين (نزيف في بطينات الدماغ) ووجود الحمى في اليوم الثامن من الدخول.[50]
ما يسمى ب "الصورة الوعائية السلبية للنزيف تحت العنكبوتية"، وهي أن يتواجد نزف ما تحت العنكبوية دون أن يظهر تمدد في الأوعية الدموية عند تصوير أربعة أوعية دموية في التصوير الوعائي، في هذه الحالة يكون التشخيص أفضل من إذا كان النزف مرافقا تمدد الأوعية الدموية. ومع ذلك، لا يزال يترافق مع خطر نقص التروية أو عودة النزف أو استسقاء الرأس.[13] لكن النزيف حول الدماغ المتوسط تصاحبه نسبة منخفضة جدا من معاودة النزف أو نقص التروية المتأخر، وتشخيص هذا النوع الفرعي ممتاز.[53] يعتقد أن نتيجة سير المرض الناتج عن صدمات الرأس يتأثر جزئيا بموقع وكمية النزف تحت العنكبوتية[15] ومن الصعب عزل آثار نزف تحت العنكبوتية عن اّثار العوامل الأخرى التي تصاحب إصابات الدماغ الناتجة عن الصدمة؛ ومن غير المعروف ما إذا كان وجود الدم تحت العنكبوتية يؤدي إلى تفاقم التشخيص أو أنه مجرد إشارة إلى حدوث صدمة كبيرة.[15] اللأفراد المصابون بإصابات الدماغ الحادة أو المعتدلة نتيجة الصدمة بالإضافة إلى نزيف تحت العنكبوتية معرضون لخطر الموت بمقدار الضعف مقارنة مع الاّخرين الذين لم يصابوا بنزيف.[15] وهم معرضون أيضاً للإصابة بالعجز الشديد أو حالة الغيبوبة المستمرة، ويرتبط النزيف تحت العنكبوتية الناتج عن الصدمة مع علامات أخرى ترتبط بسوء النتائج، مثل الصرع التابع للصدمات واستسقاء الراس والإقامة المطولة في وحدة العناية المركزة.[15] مع ذلك، فإن أكثر من 90 في المئة من الأشخاص الذين يعانون من نزيف تحت العنكبوتية نتيجة لصدمة ويحصلون على درجة تفوق 12 على مقياس غلاسكو للغيبوبة يحققون نتائج جيدة.[15] وهناك أيضا أدلة متواضعة تبين أن العوامل الوراثية تؤثر على نتائج النزيف تحت العنكبوتية. على سبيل المثال، وجود نسختين من4) ApoE نسخة مغايرة من الجين الرامز إلى صميم البروتين الشحمي E الذي يلعب دورا في مرض الزهايمر) يبدو أنه يزيد من مخاطر حدوث نقص التروية المتأخرة وحدوث النتائج السيئة للنزيف.[54] حدوث ارتفاع السكر في الدم بعد إحدى حلقات نزف تحت العنكبوتية يزيد احتمالية حدوث العواقب السيئة للنزيف.[55]
النتائج طويلة الأمد
الأعراض العصبية المعرفية مثل التعب واضطرابات المزاج والأعراض الأخرى ذات الصلة هي عقابيل شائعة. حتى في أولئك الذين يبينون تعافيا عصبيا جيدا يبقى القلق والاكتئاب واضطراب ما بعد الصدمة وضعف الإدراك أعراضا شائعة عندهم؛ 46 في المئة من الأفراد الذين أصيبوا بنزيف تحت العنكبوتية لديهم اعتلال إدراكي يؤثر على نوعية حياتهم.[3] وأكثر من 60% من اللأشخاص يشكون من حدوث الصداع المتكرر.[56] قد يؤدي نزيف تحت العنكبوتية الأمدمي إلى تلف منطقة ما تحت المهاد والغدة النخامية، وهما منطقتان في الدماغ تلعبان دورا محوريا في التنظيم والإنتاج الهرموني. أكثر من ربع الأشخاص الذين عانوا من نزيف تحت العنكبوتية سابقا قد يصابون بقصور النخامية (قصور في هرمون واحد أو أكثر من هرمونات تحت المهاد-الغدة النخامية مثل هرمون النمو، هرمون ملوتن أو الهرمون المنبه للجريب).[57]
الوبائيات

وفقا ً لمراجعة أجريت ل 51 دراسة من 21 دولة، متوسط حدوث نزيف تحت العنكبوتية هو9.1 لكل 100,000 سنويا. دراسات من اليابان وفنلندا تظهر معدلات أعلى في تلك البلدان (22.7 و 19.7 على التوالي)، وذلك لأسباب غير مفهومة تماما. في جنوب ووسط أمريكا، في المقابل، المعدل هو 4.2 لكل 100,000 في المتوسط.[58] على الرغم من أن المجموعة من الأشخاص المعرضين لخطر حدوث نزيف تحت العنكبوتية هي أصغر سنا من المجموعة السكانية المتضررة عادة بالسكتة الدماغية [2] فإن الخطر يستمر بالتزايد مع التقدم في السن. إن احتمالية إصابة الشباب بنزيف تحت العنكبوتية أقل من الناس في منتصف العمر (نسبة الخطر 0.1 أو 10%).[58] يستمر خطر الإصابة بالتزايد مع زيادة العمر ويبلغ نسبة 60% عند كبار السن (أكبر من 85 سنة) مقارنة مع الذين تتراوح أعمارهم ما بين 45 و55 سنة.[58] خطر الإصابة بنزيف تحت العنكبوتية أعلى بحوالي 25% لدى النساء في عمر 55 مقارنة مع الرجال في نفس الفئة العمرية، وربما يعكس هذا التغيرات الهرمونية التي تنتج عن انقطاع الطمث مثل انخفاض مستويات هرمون الاستروجين.[58] قد يكون للوراثيات دور في احتمالية إصابة الشخص بنزيف تحت العنكبوتية؛ يزداد الخطر بمقدار ثلاثة إلى خمسة أضعاف عند أقارب الدرجة الأولى لأشخاص سبق وعانوا من النزيف تحت العنكبوتية.[4] مع ذلك، إن العوامل الخاصة بأسلوب الحياة هي الأكثر أهمية في تحديد خطر الإصابة بشكل عام.[2] وهذه العوامل تشمل التدخين وارتفاع ضغط الدم والإفراط في استهلاك الكحول.[16] إذا كان الشخص مدخنا فيما مضى فإن ذلك يضاعف خطر إصابته بالنزيف مقارنة مع أولئك الذين لم يدخنوا من قبل قط.[2] تُمنح بعض الحماية الضئيلة للأفراد ذوي العرق القوقازي ومن قبل العلاج بالهرمونات البديلة وداء السكري.[2] من المحتمل وجود علاقة عكسية بين نسبة الكولسترول الكلي في الدم وخطر الإصابة بالنزيف تحت العنكبوتية الذي لم يحدث نتيجة للصدمة، لكن تأكيد هذا الارتباط يعوقه عدم وجود دراسات كافية.[59] حوالي 4% من حالات النزيف الأمدمي تحدث بعد الجماع و 10% من المصابين بالنزيف تظهر لديهم الأعراض عند الانحناء أو رفع الأشياء الثقيلة.[5] عموما، حوالي 1٪ من جميع الناس لديهم أم دم واحدة أو في الأوعية الدموية الدماغية. ولكن معظمها صغيرة ومن غير المرجح أن تتمزق.[31]
تاريخيا
في حين أن الصورة السريرية لنزيف تحت العنكبوتية قد تم التعرف عليها من قبل أبقراط، فإن حقيقة وجود تمدد للأوعية الدموية الدماغية وأنه من الممكن تمزقهم لم تُعرف حتى القرن الـ 18.[60] وقد وصفت الأعراض المرتبطة بشكل أكثر تفصيلا في 1886 من قبل الطبيب بايروم برامويل من إدنبره.[61] في عام 1924، أعطى السيد الدكتور شارلز سيموندس أخصائي الأعصاب في لندن (1890-1978) سردا كاملا لجميع الأعراض الرئيسية لنزيف تحت العنكبوتية، وصاغ مصطلح "نزيف تحت العنكبوتية العفوي".[60][62][63] وصف سيموندس أيضا استخدام البزل القطني والاصفرار في التشخيص.[64] تم إجراء أول تدخل جراحي من قبل السيد نورمان دوت، الذي كان تلميذ للدكتور هارفي كوشينغ الذي كان يعمل في ادنبره في ذلك الوقت. وقدّم عملية لف أم الدم في الثلاثينيات، وكان رائدا مبكرا في استخدام الصور الوعائية.[63] جراح الأعصاب الأمريكي الدكتور والتر داندي الذي كان يعمل في بالتيمور كان أول من قدّم الملاقط في عام 1938.[34] تم تطبيق الجراحة الدقيقة لعلاج تمدد الأوعية الدموية في عام 1972 من أجل زيادة تحسين النتائج.[65] شهدت الثمانينات بدء إدخال علاج H الثلاثي[45] كعلاج لنقص التروية المتأخرة بسبب بالتشنج والتجارب مع النيموديبين.[42][66] في محاولة لمنع هذه المضاعفة في عام 1983، ذكر جراح الأعصاب الروسي زوبكوف وزملاؤه أول استخدام لبالون القسطرة اللمعي في حالات التشنج الوعائي ما بعد النزف تحت العنكبوتية الأمدمي.[67][68] قدم جراح الأعصاب الإيطالي الدكتور غيدو غوليلمي علاج اللف في باطن الأوعية الدموية عام 1991.[35][69]
المراجع
- van Gijn J, Kerr RS, Rinkel GJ (2007). "Subarachnoid haemorrhage". Lancet. 369 (9558): 306–18. doi:10.1016/S0140-6736(07)60153-6. PMID 17258671.
- Feigin VL, Rinkel GJ, Lawes CM, et al. (2005). "Risk factors for subarachnoid hemorrhage: an updated systematic review of epidemiological studies". Stroke. 36 (12): 2773–80. doi:10.1161/01.STR.0000190838.02954.e8. PMID 16282541. مؤرشف من الأصل في 6 يونيو 2011.
- Suarez JI, Tarr RW, Selman WR (January 2006). "Aneurysmal subarachnoid hemorrhage". New England Journal of Medicine. 354 (4): 387–96. doi:10.1056/NEJMra052732. PMID 16436770.
- Longmore, Murray; Ian Wilkinson; Tom Turmezei; Chee Kay Cheung (2007). Oxford Handbook of Clinical Medicine, 7th edition. Oxford University Press. صفحة 841. .
- Ramrakha, Punit; Kevin Moore (2007). Oxford Handbook of Acute Medicine, 2nd edition. Oxford University Press. صفحات 466–470. .
- Warrell, David A; Timothy M. Cox; et al. (2003). Oxford Textbook of Medicine, Fourth Edition, Volume 3. Oxford. صفحات 1032–34. .
- McCarron MO, Alberts MJ, McCarron P (2004). "A systematic review of Terson's syndrome: frequency and prognosis after subarachnoid haemorrhage". Journal of Neurology, Neurosurgery, and Psychiatry. 75 (3): 491–93. doi:10.1136/jnnp.2003.016816. PMC . PMID 14966173. مؤرشف من الأصل في 30 يناير 2008.
- Allman, Keith G.; Iain H. Wilson (2006). Oxford Handbook of Anaesthesia, 2nd edition. Oxford University Press. صفحات 408–409. .
- Banki NM, Kopelnik A, Dae MW, et al. (2005). "Acute neurocardiogenic injury after subarachnoid hemorrhage". Circulation. 112 (21): 3314–19. doi:10.1161/CIRCULATIONAHA.105.558239. PMID 16286583. مؤرشف من الأصل في 8 يونيو 2011.
- O'Leary, R.; McKinlay, J. (2011). "Neurogenic pulmonary oedema". Continuing Education in Anaesthesia, Critical Care & Pain. 11 (3): 87–92. doi:10.1093/bjaceaccp/mkr006.
- Servadei F, Murray GD, Teasdale GM, et al. (February 2002). "Traumatic subarachnoid hemorrhage: demographic and clinical study of 750 patients from the European brain injury consortium survey of head injuries". Neurosurgery. 50 (2): 261–67, discussion 267–69. doi:10.1097/00006123-200202000-00006. PMID 11844260.
- Parrillo, Joseph (2013). Critical care medicine : principles of diagnosis and management in the adult (الطبعة 4th). Philadelphia, PA: Elsevier/Saunders. صفحة 1154. . مؤرشف من الأصل في 2 أبريل 2015.
- Rinkel GJ, van Gijn J, Wijdicks EF (1 September 1993). "Subarachnoid hemorrhage without detectable aneurysm. A review of the causes". Stroke. 24 (9): 1403–9. doi:10.1161/01.STR.24.9.1403. PMID 8362440. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 13 فبراير 2010.
- Santos-Franco JA, Zenteno M, Lee A (April 2008). "Dissecting aneurysms of the vertebrobasilar system. A comprehensive review on natural history and treatment options". Neurosurg Rev. 31 (2): 131–40, discussion 140. doi:10.1007/s10143-008-0124-x. PMID 18309525.
- Armin SS, Colohan AR, Zhang JH (June 2006). "Traumatic subarachnoid hemorrhage: Our current understanding and its evolution over the past half century". Neurological Research. 28 (4): 445–52. doi:10.1179/016164106X115053. PMID 16759448.
- Teunissen LL, Rinkel GJ, Algra A, van Gijn J (1 March 1996). "Risk factors for subarachnoid hemorrhage: a systematic review". Stroke. 27 (3): 544–49. doi:10.1161/01.STR.27.3.544. PMID 8610327. مؤرشف من الأصل في 16 يناير 2010.
- Kowalski RG, Claassen J, Kreiter KT, et al. (February 2004). "Initial misdiagnosis and outcome after subarachnoid hemorrhage". Journal of the American Medical Association. 291 (7): 866–69. doi:10.1001/jama.291.7.866. PMID 14970066. مؤرشف من الأصل في 16 يناير 2010.
- Perry JJ, Stiell IG, Sivilotti ML, Bullard MJ, Emond M, Symington C, Sutherland J, Worster A, Hohl C, Lee JS, Eisenhauer MA, Mortensen M, Mackey D, Pauls M, Lesiuk H, Wells GA (18 July 2011). "Sensitivity of computed tomography performed within six hours of onset of headache for diagnosis of subarachnoid haemorrhage: prospective cohort study". BMJ (Clinical research ed.). 343: d4277. doi:10.1136/bmj.d4277. PMC . PMID 21768192.
- Thomas, L; et al. (July 2009). "Evidence-Based Approach To Diagnosis And Management Of Aneurysmal Subarachnoid Hemorrhage In The Emergency Department". Emergency Medicine Practice. 11 (7). مؤرشف من الأصل في 11 يوليو 2018.
- Chu, K; Hann, A; Greenslade, J; Williams, J; Brown, A (Mar 10, 2014). "Spectrophotometry or Visual Inspection to Most Reliably Detect Xanthochromia in Subarachnoid Hemorrhage: Systematic Review". Annals of Emergency Medicine. 64: 256–264.e5. doi:10.1016/j.annemergmed.2014.01.023. PMID 24635988.
- Cruickshank A, Auld P, Beetham R, et al. (May 2008). "Revised national guidelines for analysis of cerebrospinal fluid for bilirubin in suspected subarachnoid haemorrhage". Annals of Clinical Biochemistry. 45 (Pt 3): 238–44. doi:10.1258/acb.2008.007257. PMID 18482910. مؤرشف من الأصل في 17 يوليو 2011.
- Nguyen H, Zaroff JG (November 2009). "Neurogenic stunned myocardium". Curr Neurol Neurosci Rep. 9 (6): 486–91. doi:10.1007/s11910-009-0071-0. PMID 19818236.
- Rosen D, Macdonald R (2005). "Subarachnoid hemorrhage grading scales: A systematic review". Neurocritical Care. 2 (2): 110–18. doi:10.1385/NCC:2:2:110. PMID 16159052.
- Hunt W, Hess R (1968). "Surgical risk as related to time of intervention in the repair of intracranial aneurysms". Journal of Neurosurgery. 28 (1): 14–20. doi:10.3171/jns.1968.28.1.0014. PMID 5635959.
- Fisher C, Kistler J, Davis J (1980). "Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computerized tomographic scanning". Neurosurgery. 6 (1): 1–9. doi:10.1097/00006123-198001000-00001. PMID 7354892.
- Claassen J, Bernardini GL, Kreiter K, et al. (September 2001). "Effect of cisternal and ventricular blood on risk of delayed cerebral ischemia after subarachnoid hemorrhage: the Fisher scale revisited". Stroke. 32 (9): 2012–20. doi:10.1161/hs0901.095677. PMID 11546890. مؤرشف من الأصل في 6 يونيو 2011.
- Teasdale G, Drake C, Hunt W, Kassell N, Sano K, Pertuiset B, De Villiers J (1988). "A universal subarachnoid hemorrhage scale: report of a committee of the World Federation of Neurosurgical Societies". Journal of Neurology, Neurosurgery, and Psychiatry. 51 (11): 1457. doi:10.1136/jnnp.51.11.1457. PMC . PMID 3236024.
- Ogilvy CS, Carter BS (May 1998). "A proposed comprehensive grading system to predict outcome for surgical management of intracranial aneurysms". Neurosurgery. 42 (5): 959–68, discussion 968–70. doi:10.1097/00006123-199805000-00001. PMID 9588539.
- White PM, Wardlaw JM (December 2003). "Unruptured intracranial aneurysms". Journal of Neuroradiology. 30 (5): 336–50. PMID 14752379. مؤرشف من الأصل في 13 أغسطس 2018.
- Gibbs GF, Huston J, Qian Q, et al. (May 2004). "Follow-up of intracranial aneurysms in autosomal-dominant polycystic kidney disease". Kidney International. 65 (5): 1621–27. doi:10.1111/j.1523-1755.2004.00572.x. PMID 15086900.
- International Study of Unruptured Intracranial Aneurysms Investigators (December 1998). "Unruptured intracranial aneurysms—risk of rupture and risks of surgical intervention". New England Journal of Medicine. 339 (24): 1725–33. doi:10.1056/NEJM199812103392401. PMID 9867550. مؤرشف من الأصل في 15 ديسمبر 2008.
- Naggara ON, White PM, Guilbert F, Roy D, Weill A, Raymond J (September 2010). "Endovascular treatment of intracranial unruptured aneurysms: systematic review and meta-analysis of the literature on safety and efficacy". Radiology. 256 (3): 887–97. doi:10.1148/radiol.10091982. PMID 20634431.
- "Care of the Patient with Anuerysmal Subarachnoid Hemorrhage". AANN Clinical Practice Guidelines. American Association of Neuroscience Nurses. مؤرشف من الأصل في 14 نوفمبر 201514 يونيو 2013.
- Dandy WE (1938). "INTRACRANIAL ANEURYSM OF THE INTERNAL CAROTID ARTERY: CURED BY OPERATION". Annals of Surgery. 107 (5): 654–59. doi:10.1097/00000658-193805000-00003. PMC . PMID 17857170.
- Guglielmi G, Viñuela F, Dion J, Duckwiler G (1991). "Electrothrombosis of saccular aneurysms via endovascular approach. Part 2: Preliminary clinical experience". Journal of Neurosurgery. 75 (1): 8–14. doi:10.3171/jns.1991.75.1.0008. PMID 2045924.
- Molyneux AJ, Kerr RS, Yu LM, et al. (2005). "International subarachnoid aneurysm trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: A randomised comparison of effects on survival, dependency, seizures, rebleeding, subgroups, and aneurysm occlusion". Lancet. 366 (9488): 809–17. doi:10.1016/S0140-6736(05)67214-5. PMID 16139655.
- van der Schaaf I, Algra A, Wermer M, et al. (2005). Rinkel GJ (المحرر). "Endovascular coiling versus neurosurgical clipping for patients with aneurysmal subarachnoid haemorrhage". Cochrane Database of Systematic Reviews (Online) (4): CD003085. doi:10.1002/14651858.CD003085.pub2. PMID 16235314. مؤرشف من الأصل في 28 مارس 2020.
- Campi A, Ramzi N, Molyneux AJ, et al. (2007). "Retreatment of ruptured cerebral aneurysms in patients randomized by coiling or clipping in the International Subarachnoid Aneurysm Trial (ISAT)". Stroke. 38 (5): 1538–44. doi:10.1161/STROKEAHA.106.466987. PMID 17395870. مؤرشف من الأصل في 7 يناير 2010.
- Piotin M, Spelle L, Mounayer C, et al. (2007). "Intracranial aneurysms: Treatment with bare platinum coils—aneurysm packing, complex coils, and angiographic recurrence". Radiology. 243 (2): 500–8. doi:10.1148/radiol.2431060006. PMID 17293572. مؤرشف من الأصل في 7 أكتوبر 2008.
- Raymond J, Guilbert F, Weill A, et al. (2003). "Long-term angiographic recurrences after selective endovascular treatment of aneurysms with detachable coils". Stroke. 34 (6): 1398–403. doi:10.1161/01.STR.0000073841.88563.E9. PMID 12775880. مؤرشف من الأصل في 9 يونيو 2010.
- Dorhout Mees S, Rinkel G, Feigin V, et al. (2007). Rinkel GJ (المحرر). "Calcium antagonists for aneurysmal subarachnoid haemorrhage". Cochrane Database of Systematic Reviews (Online) (3): CD000277. doi:10.1002/14651858.CD000277.pub3. PMID 17636626.
- Allen GS, Ahn HS, Preziosi TJ, et al. (1983). "Cerebral arterial spasm: A controlled trial of nimodipine in patients with subarachnoid hemorrhage". New England Journal of Medicine. 308 (11): 619–24. doi:10.1056/NEJM198303173081103. PMID 6338383.
- Vergouwen MD, Vermeulen M, Roos YB (December 2006). "Effect of nimodipine on outcome in patients with traumatic subarachnoid haemorrhage: A systematic review". Lancet Neurology. 5 (12): 1029–32. doi:10.1016/S1474-4422(06)70582-8. PMID 17110283.
- Vergouwen MD, de Haan, RJ, Vermeulen, M, Roos, YB (January 2010). "Effect of statin treatment on vasospasm, delayed cerebral ischemia, and functional outcome in patients with aneurysmal subarachnoid hemorrhage: a systematic review and meta-analysis update". Stroke. 41 (1): e47–52. doi:10.1161/STROKEAHA.109.556332. PMID 19875741. مؤرشف من الأصل في 10 مارس 2010.
- Kassell NF, Peerless SJ, Durward QJ, Beck DW, Drake CG, Adams HP (September 1982). "Treatment of ischemic deficits from vasospasm with intravascular volume expansion and induced arterial hypertension". Neurosurgery. 11 (3): 337–43. doi:10.1097/00006123-198209000-00001. PMID 7133349.
- Sen J, Belli A, Albon H, Morgan L, Petzold A, Kitchen N (October 2003). "Triple-H therapy in the management of aneurysmal subarachnoid haemorrhage". Lancet Neurology. 2 (10): 614–21. doi:10.1016/S1474-4422(03)00531-3. PMID 14505583.
- Rosengart AJ, Huo JD, Tolentino J, et al. (August 2007). "Outcome in patients with subarachnoid hemorrhage treated with antiepileptic drugs". Journal of Neurosurgery. 107 (2): 253–60. doi:10.3171/JNS-07/08/0253. PMID 17695377.
- Naval NS, Stevens RD, Mirski MA, Bhardwaj A (February 2006). "Controversies in the management of aneurysmal subarachnoid hemorrhage". Critical Care Medicine. 34 (2): 511–24. doi:10.1097/01.CCM.0000198331.45998.85. PMID 16424735.
- Liu KC, Bhardwaj A (2007). "Use of prophylactic anticonvulsants in neurologic critical care: a critical appraisal". Neurocritical Care. 7 (2): 175–84. doi:10.1007/s12028-007-0061-5. PMID 17763834.
- Rosengart AJ, Schultheiss KE, Tolentino J, Macdonald RL (August 2007). "Prognostic factors for outcome in patients with aneurysmal subarachnoid hemorrhage". Stroke. 38 (8): 2315–21. doi:10.1161/STROKEAHA.107.484360. PMID 17569871. مؤرشف من الأصل في 24 يوليو 2008.
- Naidech AM, Kreiter KT, Janjua N, et al. (March 2005). "Phenytoin exposure is associated with functional and cognitive disability after subarachnoid hemorrhage". Stroke. 36 (3): 583–87. doi:10.1161/01.STR.0000141936.36596.1e. PMID 15662039. مؤرشف من الأصل في 6 يونيو 2011.
- Lindsay, Kenneth W; Ian Bone; Robin Callander (1993). Neurology and Neurosurgery Illustrated. United States: Churchill Livingstone. .
- Greebe P, Rinkel GJ (April 2007). "Life expectancy after perimesencephalic subarachnoid hemorrhage". Stroke. 38 (4): 1222–24. doi:10.1161/01.STR.0000260093.49693.7a. PMID 17332451. مؤرشف من الأصل في 26 نوفمبر 2010.
- Lanterna LA, Ruigrok Y, Alexander S, et al. (August 2007). "Meta-analysis of APOE genotype and subarachnoid hemorrhage: clinical outcome and delayed ischemia". Neurology. 69 (8): 766–75. doi:10.1212/01.wnl.0000267640.03300.6b. PMID 17709709.
- Kruyt ND, Biessels GJ, de Haan RJ, et al. (June 2009). "Hyperglycemia and clinical outcome in aneurysmal subarachnoid hemorrhage: a meta-analysis". Stroke. 40 (6): e424–30. doi:10.1161/STROKEAHA.108.529974. PMID 19390078.
- Powell J, Kitchen N, Heslin J, Greenwood R (June 2002). "Psychosocial outcomes at three and nine months after good neurological recovery from aneurysmal subarachnoid haemorrhage: predictors and prognosis". Journal of Neurology, Neurosurgery, and Psychiatry. 72 (6): 772–81. doi:10.1136/jnnp.72.6.772. PMC . PMID 12023423. مؤرشف من الأصل في 14 يوليو 2007.
- Schneider HJ, Kreitschmann-Andermahr I, Ghigo E, Stalla GK, Agha A (September 2007). "Hypothalamopituitary dysfunction following traumatic brain injury and aneurysmal subarachnoid hemorrhage: a systematic review". Journal of the American Medical Association. 298 (12): 1429–38. doi:10.1001/jama.298.12.1429. PMID 17895459. مؤرشف من الأصل في 25 يناير 2010.
- de Rooij NK, Linn FH, van der Plas JA, Algra A, Rinkel GJ (December 2007). "Incidence of subarachnoid haemorrhage: a systematic review with emphasis on region, age, gender and time trends". Journal of Neurology, Neurosurgery, and Psychiatry. 78 (12): 1365–72. doi:10.1136/jnnp.2007.117655. PMC . PMID 17470467.
- Wang X, Dong Y, Qi X, Huang C, Hou L (23 May 2013). "Cholesterol levels and risk of hemorrhagic stroke: a systematic review and meta-analysis". Stroke. 44 (7): 1833–39. doi:10.1161/STROKEAHA.113.001326. PMID 23704101. مؤرشف من الأصل في 16 أغسطس 2013.
- Longstreth WT, Koepsell TD, Yerby MS, van Belle G (1985). "Risk factors for subarachnoid hemorrhage" ( كتاب إلكتروني PDF ). Stroke. 16 (3): 377–85. doi:10.1161/01.STR.16.3.377. PMID 3890278. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 26 مارس 2009.
- Bramwell B (1886). "Spontaneous meningeal haemorrhage". Edinburgh Medical Journal. 32: 101.
- Symonds CP (1924). "Spontaneous subarachnoid hemorrhage". Quarterly Journal of Medicine. 18 (69): 93–122. doi:10.1093/qjmed/os-118.69.93.
- Todd NV, Howie JE, Miller JD (June 1990). "Norman Dott's contribution to aneurysm surgery". Journal of Neurology, Neurosurgery, and Psychiatry. 53 (6): 455–58. doi:10.1136/jnnp.53.6.455. PMC . PMID 2199609.
- Symonds CP (1924). "Spontaneous Sub-arachnoid Hæmorrhage". Proceedings of the Royal Society of Medicine. 17 (Neurol Sect): 39–52. PMC . PMID 19983808.
- Krayenbühl HA, Yaşargil MG, Flamm ES, Tew JM (December 1972). "Microsurgical treatment of intracranial saccular aneurysms". Journal of Neurosurgery. 37 (6): 678–86. doi:10.3171/jns.1972.37.6.0678. PMID 4654697.
- Pickard JD, Murray GD, Illingworth R, et al. (March 1989). "Effect of oral nimodipine on cerebral infarction and outcome after subarachnoid haemorrhage: British aneurysm nimodipine trial". BMJ (Clinical research ed.). 298 (6674): 636–42. doi:10.1136/bmj.298.6674.636. PMC . PMID 2496789.
- Zubkov IuN, Nikiforov BM, Shustin VA (Sep–Oct 1983). "1st attempt at dilating spastic cerebral arteries in the acute stage of rupture of arterial aneurysms". Zh Vopr Neirokhir Im N N Burdenko. 5 (5): 17–23. PMID 6228084.
- Zubkov YN, Nikiforov BM, Shustin VA (Sep–Oct 1984). "Balloon catheter technique for dilatation of constricted cerebral arteries after aneurysmal SAH". Acta Neurochir (Wien). 70 (1–2): 65–79. doi:10.1007/BF01406044. PMID 6234754.
- Strother CM (1 May 2001). "Historical perspective. Electrothrombosis of saccular aneurysms via endovascular approach: part 1 and part 2". AJNR. American Journal of Neuroradiology. 22 (5): 1010–12. PMID 11337350. مؤرشف من الأصل في 27 سبتمبر 2011.